El Pacífico Tropical Oriental (PTO) es una región biogeográfica marina relativamente aislada, cuyo endemismo de peces supera el 70% (Zapata & Robertson, 2007). Esta región se extiende desde el Golfo de California hasta Perú, incluyendo las islas océanicas Clipperton, Revillagilledo, Isla del Coco, Malpelo e islas Galápagos. De acuerdo con Robertson y Cramer (2009), el PTO se subdivide en tres provincias según la distribución de peces: Cortez, Panámica y Oceánica. El PTO posee dos mayores agrupaciones de islas continentales, una en el golfo de California y otra a lo largo de Panamá y Costa Rica (Mora & Robertson, 2005a). Dichas islas, al encontrarse un poco más alejadas de la costa, generan condiciones óptimas para el desarrollo de arrecifes. La riqueza de peces más alta se encuentra en el centro de la provincia Panámica, entre Costa Rica y Panamá (Robertson & Cramer, 2009), lo cual podría representar un centro de especiación o de acumulación de especies (Mora & Robertson, 2005b). Por lo tanto, las islas continentales ubicadas en esta zona podrían jugar un papel importante en mantener la diversidad y abundancia de peces de la región, y además, representar sitios clave para la conservación marina.
La Isla del Caño se localiza a 15km de la costa Pacífico Sur de Costa Rica. En ella se ha establecido un área marina protegida de 3km de radio, que forma parte de la Reserva Biológica Isla del Caño (RBIC). Allí se presentan los arrecifes coralinos más desarrollados de la costa Pacífico continental de Costa Rica (Cortés & Jiménez, 2003). La mayoría de las investigaciones han sido enfocadas en arrecifes coralinos, donde se han descrito las especies de coral, la distribución de los arrecifes y los factores que los amenazan (i.e. Guzmán, 1986; Guzmán, Cortés, Richmond & Glynn, 1987; Guzmán, 1988; Guzmán & Cortés, 1989; Guzmán & Cortés, 2001). Otros estudios incluyen aspectos de la ecología de algunos peces asociados, por ejemplo se describe la densidad del pez coralívoro Arothron meleagris y su rol en el arrecife (Guzmán & Robertson, 1989), y el importante papel ecológico de Sufflamen verres y Pseudobalistes naufragium en la dispersión de fragmentos de Porites lobata (Guzmán, 1988; Cortés & Jiménez, 2003).
Actualmente se carece para la isla de una descripción de la estructura de las comunidades de peces de arrecife, donde se describan las especies principales y sus relaciones con el hábitat. Además, se necesita actualizar los registros de ictiofauna marina de la RBIC, que incluya peces de arrecife y otros peces marinos que la habitan. Aunque existe una lista de peces arrecifales (Cortés et al., 2009), y una lista general de peces costeros hasta 100m de profundidad (Robertson & Allen, 2008), es necesario unificarlas y complementar el record con especies que fueron registradas durante nuestro periodo de estudio.
Los arrecifes y comunidades coralinas de la RBIC son un importante objeto de conservación para el país, y además son una fuente de ingresos económicos para las comunidades aledañas que dependen del turismo. Es común encontrar más de 25 embarcaciones por día durante la época seca, realizando tours de snorkel y buceo (Montero-Cordero, obs. pers), las cuales representan principales actividades turísticas realizadas en la isla. Por esta razón y por el vacío de conocimiento actual, es imprescindible tener una visión más precisa del estado de los peces de arrecife en el área y el valor de la biodiversidad ictiológica, para contar con una línea base que permita tomar decisiones certeras en cuanto al manejo y conservación de este sitio.
Los objetivos de este estudio son 1) Analizar la estructura de la comunidad de peces de arrecife de la Isla del Caño, incluyendo su abundancia, distribución por grupo trófico y relación con la estructura del hábitat y 2) Recopilar y actualizar la lista de peces costeros registrados hasta el día de hoy, y comparar la riqueza de peces de la RBIC con la de otras regiones del PTO
Materiales y métodos
Área de estudio
La Isla del Caño (8°43’ N - 85°52’ W) se ubica en la plataforma continental del Pacífico de Costa Rica, aproximadamente a 15km de la costa, frente a Bahía Drake, Península de Osa. Posee cinco plataformas coralinas o bajos arrecifales con extensiones que van desde 0.8 hasta 4.2ha: dos al norte, una al este y dos pequeñas al sur. Se caracterizan por poseer principalmente corales pocilopóridos y porítidos, así como algunos microatolones de P. lobata (Guzmán & Cortés, 1989; Quesada-Alpízar & Cortés, 2006). El sector sur, más expuesto a la acción de las olas, presenta extensos campos de octocorales. Además, alrededor de toda la isla se pueden encontrar arrecifes rocosos y pináculos submarinos (Guzmán & Cortés, 1989), entre ellos Bajo del Diablo y Bajo Paraíso. Bajo del Diablo es un pináculo rocoso localizado a unos 2km al oeste de la Isla, con numerosos octocorales y corales aislados (Cortés & Jiménez, 2003), mientras que Bajo Paraíso se encuentra a aproximadamente unos 5km al NE de la isla, fuera del área marina protegida. Este último es un bajo arenoso con promontorios rocosos de poca altura, algunos de ellos cubiertos por el coral suave Carijoa sp. y corales aislados (Cortés & Jiménez, 2003).
Estructura de la comunidad de peces
Con el fin de estudiar la composición y abundancia de peces, y su relación con el hábitat, se realizaron censos estacionarios en 10 sitios alrededor de la Isla (Fig. 1). Los sitios fueron visitados al menos una vez entre enero y mayo del 2008, y en cada visita se realizaron al menos dos censos por sitio. El estudio se concentró en la época seca para disminuir los efectos estacionales, tales como baja visibilidad y fuerte oleaje en época lluviosa que dificultan el muestreo. Los censos estacionarios y la estimación de las variables ambientales siguieron el método de Bohnsack & Bannerot (1986). Dicha técnica delimita un área mediante un cilindro imaginario de 7.5m de radio en donde se estima la cobertura relativa del sustrato y luego se documentan todas las especies de peces observadas dentro del cilindro en un lapso de 5min. Después de dicho periodo se registra además, el número de individuos de cada especie. Esta técnica es muy apropiada en arrecifes coralinos o rocosos distribuidos en parche, tal y como se encuentran en la Isla del Caño.
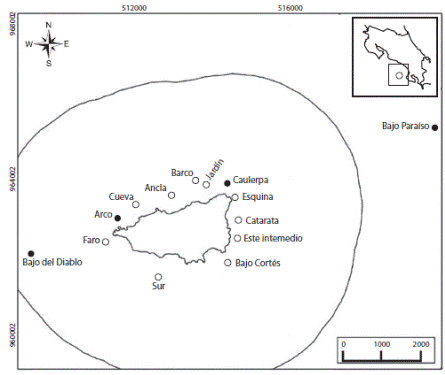
Fig. 1 Sitios de muestreo. Círculos vacíos: sitios donde se realizaron los censos de cilindro. Círculos rellenos: sitios que fueron visitados durante este estudio y otras giras de la Fundación Keto, con el fin de enriquecer el registro de especies. La línea representa el límite del área protegida. La escala se representa en metros.
Al inicio de cada censo se registraron las siguientes variables ambientales: profundidad, porcentaje aproximado de cobertura del substrato (coral, roca, arena) y la rugosidad. Los porcentajes de cobertura se estimaron dentro de cada cilindro imaginario, tal como se describe en la metodología de Bohnsack y Bannerot (1986). Adicionalmente se midió el índice de Rugosidad (IR) (Luckhurst & Luckhurst, 1978), utilizando dos radios del cilindro, separados entre ellos por un ángulo de 90º, para los cuales la dirección estuvo determinada de manera azarosa. En cada radio se colocó una cadena de 2.5m de largo en la parte externa e interna del cilindro, con lo cual se obtuvieron cuatro medidas para cada punto censado. Una vez que la cadena fue colocada sobre el sustrato, se midió con una cinta métrica la longitud total de los extremos de la cadena. La relación entre la longitud de la cadena sobre el sustrato y la longitud real de la cadena predice la irregularidad del arrecife, con valores entre 0 y 1.
Las especies de peces fueron clasificadas en grupos tróficos de acuerdo a una adaptación de Ferreira, Floeter, Gasparini, Joyeux y Ferreira (2004) y Dominici-Arosemena y Wolff (2006) en siete categorías: 1) carnívoros (representado con las iniciales “CAR”, se alimentan de organismos móviles bentónicos y peces); 2) consumidores de invertebrados (“INV”, se alimentan principalmente de cangrejos, moluscos y otros invertebrados móviles o sésiles); 3) omnívoros (“OMN”, se alimentan de una variedad de organismos, incluyendo animales y material vegetal); 4) piscívoros (“PIS”, se alimentan de peces vivos); 5) planctívoros (“PLA”, consumen principalmente macro y micro zooplancton); 6) herbívoros ramoneadores (“HRA”, se alimentan ramoneando algas y detritus, por ejemplo, loros y cirujanos); y 7) herbívoros territoriales (HTER, se alimentan de algas que crecen en sus territorios, por ejemplo las damiselas).
Para determinar las similitudes entre los sitios de muestreo de acuerdo a la composición de especies, se utilizaron únicamente las especies más frecuentes, es decir aquellas especies observadas en siete o más sitios. Esto con el fin de eliminar el sesgo por diferencias en el esfuerzo de muestreo entre sitios, lo cual adjudica especies raras a aquellos sitios que tuvieron mayor cantidad de visitas, por lo que la similitud entre ellos se vería afectada. La densidad (ind/100m2) de las especies fue transformada a Log10(x+1). Posteriormente, se generó una matriz de similitud de Bray Curtis, graficada mediante un análisis de escalamiento multidimensional no paramétrico (nMDS). Los sitios fueron agrupados según su similitud mediante una prueba SIMPROF y sus diferencias fueron analizadas mediante la prueba SIMPER de manera tal que se pudieran identificar las especies que caracterizaban y discriminaban los sitios. Todas las pruebas anteriores se realizaron con el programa Primer 6.1 (Clarke & Gorley, 2006).
Para evaluar la relación entre la distribución de peces y las variables ambientales se realizó un Análisis de Correspondencia Canónica (ACC), utilizando el programa MVSP 3.2 (Kovach, 2005). Este método evalúa la preferencia de las especies al ambiente mediante un diagrama de ordenación (Ter Braak & Verdonschot, 1995). El análisis fue realizado con respecto a la abundancia por grupo trófico (transformado a Log10(x+1), y con respecto a las siguientes variables ambientales (estandarizadas de 0 a 1): profundidad, cobertura de coral, cobertura de roca y rugosidad de los sustratos presentes.
Lista de especies de la RBIC
Con el fin de complementar el registro de la riqueza de especies de la zona, se realizaron censos estacionarios con cilindro (detalles en sección anterior) y censos de buzo errante (CBE). Estos últimos tuvieron como objetivo principal registrar la mayor cantidad de especies posible, buscando en la columna de agua, entre cuevas, lugares profundos o en mar abierto, un poco más alejados de la isla (<6km de la isla). Los CBE se realizaron en 14 sitios, incluyendo los 10 sitios utilizados en los censos estacionarios entre enero y mayo del 2008. Lo anterior se complementó con observaciones hechas en visitas adicionales en los años 2009 y 2010 (Fig. 1).
La lista se realizó con los registros de nuestras giras de campo, la lista de especies de la Isla del Caño publicada por Cortés et al. (2009), y los registros de peces marinos observados o colectados allí anteriormente (a profundidades <100m), según la base de datos de peces costeros del Pacífico Oriental Tropical (Robertson & Allen, 2008). En dicha base de datos existe una plataforma de investigación, la cual fue utilizada para generar una lista de especies confirmadas para la Isla del Caño (las “especies esperadas”, fueron excluidas del análisis). Los registros de esta base de datos provienen de colecciones de museo y expediciones del Instituto Smithsonian (Robertson & Allen, 2008).
Resultados
Composición de la comunidad de peces
Se realizaron 50 censos de cilindro en 10 lugares alrededor de la Isla del Caño, en los cuales se contabilizaron 11 027 individuos. En total se encontraron 79 especies, pertenecientes a 32 familias. La familias más abundantes fueron, respectivamente, Pomacentridae, Sphyraenidae y Haemulidae (Fig. 2); mientras que las especies con mayor densidad en la Isla fueron Chromis atrilobata, Sphyraena spp. (posiblemente S. ensis), Haemulon maculicauda, Thalassoma lucasanum y Lutjanus viridis, respectivamente (Fig. 3). Con respecto a la frecuencia de avistamiento, las especies Sufflamen verres, C. atrilobata, Stegastes flavilatus y T. lucasanum se observaron en más del 90% de los censos. Las especies Bodianus diplotaenia, Holacanthus passer y Scarus rubroviolaceous se observaron en más del 80%, mientras que Caranx melampygus, Canthigaster punctatisima, Paranthias colonus, Cirrithichthys oxycephalus, Epinephelus labriformis, Arothron meleagris, Cephalopholis panamensis, Halichoeres dispilus, Plagiotremus azaleus, Abudefduf troschelli y L. viridis se observaron aproximadamente en el 50% de los censos.
Durante los censos se registraron valores similares de rugosidad del substrato, siendo El Sur el menos rugoso. La Esquina y El Este presentaron los mayores porcentajes de cobertura de coral vivo, mientras que El Barco y El Sur fueron predominantemente rocosos. Los censos realizados en sitios como el Ancla y Cortés presentaron una estructura con parches de coral y roca mezclados con arena. Todos los censos se mantuvieron en profundidades entre 6 y 12m. Un resumen de las características ambientales por sitio se encuentra en el Cuadro 1.
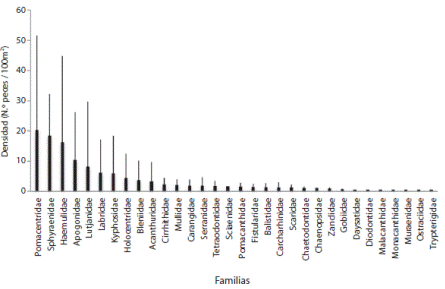
Fig. 2 Families found during stationary surveys conducted in 10 sites around Caño Island, according to their relative abundance.
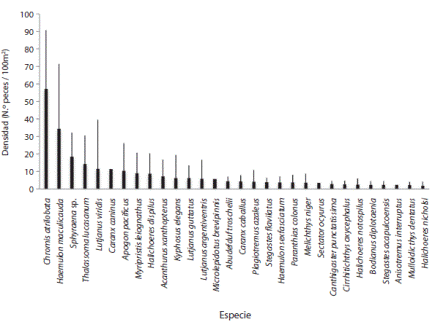
Fig 3 Density of the thirty most abundant species in Caño Island. The lines above the bars represent the standard deviation.
Cuadro 1 Características de las variables ambientales por sitio. Todos los valores son promedios por sitio. Los valores de coral vivo, roca y arena son promedios de porcentaje de cobertura. El índice de rugosidad (IR) varía de cero a uno, siendo uno el más rugoso
| Sitio | Roca (%) | Arena (%) | Coral (%) | Rugosidad (IR) | Profundidad (m) |
| Ancla | 51.87±11.32 | 49.37±13.74 | 10.62±7.24 | 0.41±0.13 | 14.25±2.26 |
| Cortés | 55±7.07 | 45±7.07 | 24.5±35.35 | 0.44±0.04 | 11.43±0.46 |
| Barco | 90±0 | 10±0 | 1±1.41 | 0.48±0.02 | 12.19±4.31 |
| Catarata | 62±26.26 | 24±17.91 | 31.6±18.91 | 0.40±0.10 | 9.39±0.94 |
| Cueva | 85±17.32 | 17.5±17.53 | 26.42±26.84 | 0.50±0.05 | 9.26±0.15 |
| Esquina | 45±7.07 | 35±21.21 | 55±21.21 | 0.45±0.02 | 5.4±0 |
| E. Intermedio | 65±35.35 | 10±0 | 51.5±14.84 | 0.54±0.07 | 12.04±4.10 |
| Faro | 71.25±19.31 | 28.75±19.31 | 10±14.14 | 0.29±0.17 | 12.19±0 |
| Jardin | 63±19.84 | 36±20.52 | 33±11.95 | 0.37±0.11 | 7.04±1.92 |
| Sur | 90±7.07 | 10±7.07 | 5± 7.07 | 0.16±0.05 | 9.14±3.84 |
En cuanto a grupos tróficos, el más representativo según su densidad fueron los planctívoros, tal como las damiselas cola de tijera (Chromis atrilobata), seguido de especies “carnívoras” que se alimentan de invertebrados y peces, tales como los pargos Lutjanus argentiventris, L. viridis, L. guttatus, los roncadores Haemulon maculicauda, H. sexfasciatum y las cabrillas Cephalopholis panamensis y Epinephelus labriformis, entre otros (Fig. 4). Según el diagrama de ordenamiento realizado por el ACC (Fig. 5), los ejes 1 y 2 juntos explican el 51% de la variación de los datos. Varios grupos tróficos se localizaron en el centro del diagrama, lo que quiere decir que no tuvieron una relación fuerte con ninguna de las variables consideradas. De acuerdo a las longitudes relativas de los vectores en el diagrama, la rugosidad del substrato fue la variable ambiental más importante con respecto a la distribución de los grupos tróficos, y actúa en la misma dirección que la profundidad. La posición de los grupos tróficos en relación a los vectores indican su preferencia ambiental, lo que significa que los herbívoros ramoneadores (HRAM) poseen una asociación con sitios de alta cobertura de coral, y los carnívoros (CAR) parecen estar asociados a una mayor cobertura rocosa, mayor profundidad y mayor rugosidad del substrato.
El análisis MDS mostró una clara separación de cuatro grupos según la composición de especies: A) Ancla, Cortés, Faro y Sur; B) Catarata y Cueva; C) Esquina, Jardín y Este Intermedio; y D) Barco (Fig. 6). Por otro lado, el análisis SIMPER identificó que dos especies de pargos, Lutjanus argentiventris (Fig. 7A) y L. viridis (Fig. 7B) actúan como las dos variables de mayor importancia para explicar las diferencias de los 4 grupos, al contribuir con más del 47% de la disimilitud. El grupo A (Ancla, Cortés, Faro y Sur), se caracteriza por altas densidades del pargo Lutjanus viridis en comparación con el grupo B y C, cuyas densidades fueron menores; lo anterior lo separa del resto de grupos (Fig. 7B). El grupo B (Catarata y Cueva) se caracteriza por altas densidades de especies pequeñas características de arrecifes coralinos tales como Abudefduf troschelii, Halichoeres notospilus y Plagiotremus azaleus. Por otro lado, en los sitios del grupo C (Esquina, Jardín y Este Intermedio) se observaron mayores densidades de Acanthurus xanthopterus y Acanthurus nigricans. El grupo D (El Barco), aislado del resto de los sitios, presentó una composición de especies particular, debido a que en este sitio se observaron mayores densidades de pargos Lutjanus argentiventris y L. viridis en comparación con el resto de los sitios, incluso el grupo A (Fig.7A, 7B ).
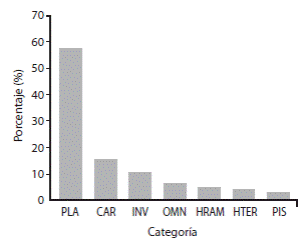
Fig. 4 Composición de los grupos tróficos de la Isla del Caño. PLA=planctívoro, CAR=carnívoro que se alimenta de invertebrados y peces, INV=se alimenta principalmente de invertebrados, OMN=omnívoro, HRAM=herbívoro ramoneador, HTER=herbívoro territorial, PIS=piscívoro. Fig. 4. Composition of trophic groups in Caño Island. PLA=Planktivores, CAR=Carnivores that feed on invertebrates and fish, INV=Fish that feed mainly on invertebrates, OMN=Omnivores, HRAM=Roving Herbivores, HTER=Territorial Herbivores, PIS=Piscivores.
Lista de especies de la RBIC
Tomando en cuenta el registro de datos de este estudio, la recopilación de otros estudios y análisis de bases de datos externas, la riqueza de peces marinos reportados para la Isla del Caño es de 212 especies (Cuadro 2), lo cual representa un 20.17% de los peces marinos reportados para la costa pacífica de Costa Rica, y un 16.81% de los peces marinos (<100m) de todo el PTO (Cuadro 3). El presente estudio agregó 35 especies reportadas por primera vez en una publicación científica para la Isla del Caño (Cuadro 2).
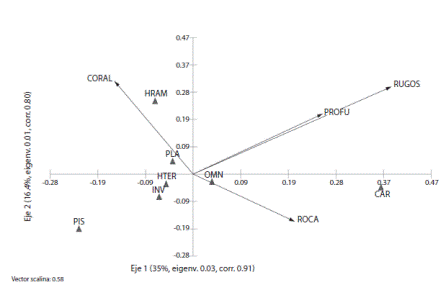
Fig. 5 Canonical correspondence analysis (CCA) ordination diagram showing trophic groups and their relationship to environmental variables in 10 sampling sites around Caño Island. The length and direction of the arrows indicate the relative importance and direction of change of environmental variables: coral coverage (CORAL), rock coverage (ROCA), depth (PROFU) and roughness (RUGOS). The environmental preference of each trophic group is indicated by their initials: PLA=Planktivores, CAR=Carnivores that feed on invertebrates and fish, INV=Fish that feed mainly on invertebrates, OMN=Omnivores, HRAM=Roving Herbivores, HTER=Territorial Herbivores, PIS=Piscivores. The title of each axis shows the cumulative percentage of variance explained (%), the eigenvalue (eigen) and trophic group correlations with environment (corr).
Si comparamos el número de especies reportadas para Isla del Caño con otras islas continentales presentes en la gran provincia Panámica del Pacífico Oriental Tropical (Robertson & Cramer, 2009), encontramos que es la cuarta más diversa (de un total de seis estudiadas, Cuadro 4). Si estandarizamos por el área de isla (asumiendo que el área terrestre es una aproximación del área marina aledaña), encontramos que la Isla del Caño es la segunda más diversa, después de la Isla Iguana (Panamá), que tiene mucho más especies de peces a pesar de su pequeña área. Si comparamos la Isla del Caño con las islas oceánicas y las continentales (de un total de 11 estudiadas), es la octava más diversa (Cuadro 4), y la tercera más diversa si se estandariza por el área de isla.
Discusión
Composición de la comunidad de peces
El presente estudio encontró 79 especies utilizando censos estacionarios de cilindro en 10 lugares. Comparando exclusivamente con censos visuales (estacionarios o transectos) en otros lugares de la provincia Panámica, este número es similar a la cantidad encontrada por Dominici-Arosemena, Brugnoli-Olivera, Cortés-Núñez, Molina-Ureña y Quesada-Alpizar (2005), n=75, en Bahía Culebra, Golfo de Papagayo, pero mayor que en las Islas Catalinas (n=46, Espinoza & Salas, 2005), el Parque Marino Ballena (n=54, Salas & Alvarado, 2008) y Manuel Antonio (n=39, Phillips & Pérez-Cruet, 1984). Sin embargo, es mucho menor a lo reportado para Bahía Honda en Panamá (n=126, Dominici-Arosemena & Wolff, 2006). Las diferencias se deben principalmente al esfuerzo de muestreo y las metodologías de censo visual (transecto vs. censo estacionario); por lo anterior, debe tenerse precaución al realizar comparaciones. Este tipo de estudios representan líneas de base necesarias, sin embargo no están homogenizados entre sí con respecto a las metodologías.
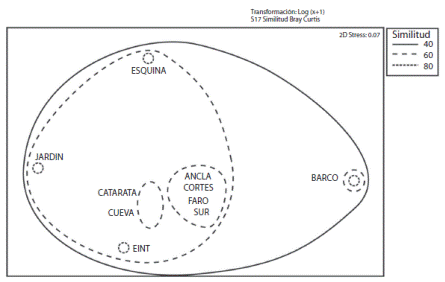
Fig. 6 Similarities of the study sites based on the composition and density (ind/100 m2) of the most common fish species grouped as follows: A) Anchor, Cortés, Faro and Sur, B) Catarata and Cueva; C) Esquina, Jardín and Este Intermedio (EINT) and D) Barco.
Chromis atrilobata fue una de las especies con mayor abundancia, lo cual coincide con otros sitios del PTO, tal como el Pacífico Norte en Costa Rica y Bahía Honda en Panamá (Dominici-Arosemena et al., 2005; Espinoza & Salas, 2005; Dominici-Arosemena & Wolff, 2006). También es común observar entre los más abundantes a Thalassoma lucasanum (Salas & Alvarado, 2008; Friedlander et al., 2012), que en conjunto con C. atrilobata se colocan como las dos especies planctívoras dominantes en la Isla del Caño. Según Dominici-Arosemena & Wolff, (2006), la predominancia de los planctívoros C. atrilobata y T. lucasanum parece ser un patrón común en todo el PTO, pero la proporción puede variar entre regiones. Por otro lado, los herbívoros han sido reportados en bajas cantidades dentro del PTO (Zapata & Morales, 1997; AburtoOropeza & Balart, 2001; Dominici-Arosemena et al., 2005; Dominici-Arosemena & Wolff, 2006), cuyo patrón es similar a los resultados del presente estudio.
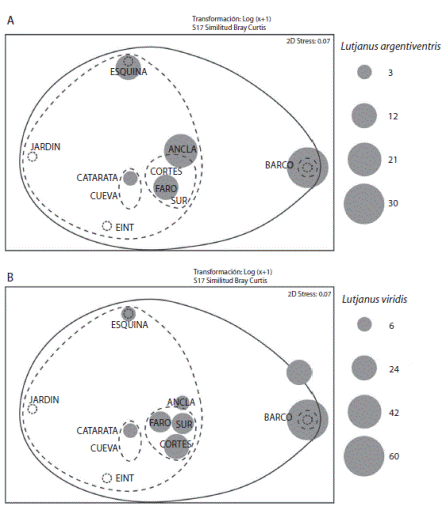
Fig. 7 Abundance and distribution of fish species that mainly influence the dissimilarity between sampling sites, A) L. argentiventris and B) L. viridis. Nota: EINT= Este Intermedio”
Los resultados del ACC sugieren una asociación entre los peces herbívoros móviles (HRAM) como los loros y los cirujanos (Scaridae y Acanthuridae) con sitios en donde la cobertura de coral es mayor. Nuestros resultados se dan principalmente por la frecuente aparición de cardúmenes del cirujano Acanthurus xanthopterus en el sitio “Este Intermedio”, un sitio de alta cobertura coralina. Su presencia no necesariamente está relacionada con el coral, sino que ambos organismos tienen preferencia por este mismo tipo de ambiente. A. xanthopterus es un pez de amplia distribución geográfica que prefiere bahías protegidas (Myers, 1991) y arrecifes alejados de la costa (Myers, 1991; Letourneur, Kulbicki & Labrosse, 1998), además su abundancia y biomasa están correlacionados con características de sitios alejados de la costa (Letourneur et al., 1998). Su presencia allí puede deberse a que el Este Intermedio reúne ambas características, es un lugar protegido del oleaje y la Isla del Caño se encuentra alejada de la costa. DominiciArosemena y Wolff (2006) no encontraron una gran influencia de la cobertura de coral per se en la riqueza y abundancia de especies; esto es de esperarse ya que las especies del Pacífico Oriental están adaptadas a vivir predominantemente en arrecifes rocosos. Sin embargo, se recomienda explorar en el futuro con mayor detalle este patrón encontrado.
Cuadro 2 Lista actualizada de especies encontradas en la Reserva Biológica Isla del Caño
| Familia | Especie | Referencia | |
|---|---|---|---|
| Acanthuridae | Acanthurus nigricans (Linnaeus, 1758) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Acanthurus triostegus (Linnaeus, 1758) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Acanthurus xanthopterus Valenciennes, 1835 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Prionurus laticlavius (Valenciennes, 1846) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Antennariidae | Antennarius sanguineus (Gill, 1863) | Robertson & Allen, 2008. | |
| - | Antennatus strigatus (Gill, 1863) | Robertson & Allen, 2008. | |
| Apogonidae | Apogon dovii Günther, 1862 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Apogon pacificus (Herre, 1935) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Atherinopsidae | Atherinella eriarcha Jordan & Gilbert, 1882 | Robertson & Allen, 2008. | |
| - | Atherinella starksi (Meek & Hildebrand, 1923) | Robertson & Allen, 2008. | |
| - | Melanorhinus cyanellus (Meek & Hildebrand, 1923) | Robertson & Allen, 2008. | |
| Balistidae | Balistes polylepis Steindachner, 1876 | Presente estudio. | |
| - | Canthidermis maculata (Bloch, 1786) | Presente estudio. | |
| - | Melichthys niger (Bloch, 1786) | Presente estudio; Cortés et al., 2009. | |
| - | Pseudobalistes naufragium (Jordan & Starks, 1895) | Presente estudio; Cortés et al., 2009. | |
| - | Sufflamen verres (Gilbert & Starks, 1904) | Presente estudio; Robertson & Allen, 2008. | |
| - | Xanthichthys mento (Jordan & Gilbert, 1882) | Cortés et al., 2009. | |
| Batrachoididae | Daector schmitti Collette, 1968 | Robertson & Allen, 2008. | |
| Belonidae | Belonidae spp. | Presente estudio; Cortés et al., 2009. | |
| Bleniidae | Acanthemblemaria hancocki Myers & Reid, 1936 | Presente estudio; Robertson & Allen, 2008. | |
| - | Entomacrodus chiostictus (Jordan & Gilbert, 1882) | Robertson & Allen, 2008. | |
| - | Hypsoblennius brevipinnis (Günther, 1861) | Robertson & Allen, 2008. | |
| - | Ophioblennius steindachneri Jordan & Evermann, 1898 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Plagiotremus azaleus (Jordan & Bollman, 1890) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Bothidae | Bothus spp. | Presente estudio. | |
| - | Engyophrys sanctilaurentii Jordan & Bollman, 1890 | Robertson & Allen, 2008. | |
| Bregmacerotidae | Bregmaceros bathymaster Jordan & Bollman, 1890 | Robertson & Allen, 2008. | |
| Bythidae | Gunterichthys bussingi Møller &, Schwarzhans & Nielsen 2004 | Robertson & Allen, 2008. | |
| - | Ogilbia jewettae Møller &, Schwarzhans & Nielsen 2005Robertson & Allen, 2008. Ogilbia robertsoni Møller &, Schwarzhans & Nielsen 2005 Robertson & Allen, 2008. Ogilbia sedorae Møller &, Schwarzhans & Nielsen 2005 Robertson & Allen, 2008. | ||
| Callionymidae | Synchiropus atrilabiatus (Garman, 1899)Robertson & Allen, 2008. | ||
| Carangidae | Alectis ciliaris (Bloch, 1787) Presente estudio. Caranx caballus Günther, 1868 Presente estudio; Cortés et al., 2009. Caranx caninus Günther, 1867 Presente estudio. Caranx lugubris Poey, 1860Robertson & Allen, 2008. | ||
| Familia | Especie | Referencia | |
| - | Caranx melampygus Cuvier, 1833 | Presente estudio; Cortés et al. 2009; Robertson & Allen, 2008. | |
| - | Caranx sexfasciatus Quoy & Gaimard, 1825 | Presente estudio; Cortés et al., 2009. | |
| - | Elagatis bipinnulata (Quoy & Gaimard, 1825) | Presente estudio; Cortés et al., 2009. | |
| - | Gnathanodon speciosus (Forsskål, 1775) | Presente estudio. | |
| - | Seriola rivoliana Valenciennes, 1833 | Presente estudio; Cortés et al., 2009. | |
| - | Trachinotus rhodopus Gill, 1863 | Presente estudio. | |
| Carcharhinidae | Triaenodon obesus (Rüppell, 1837) | Presente estudio; Cortés et al., 2009. | |
| Chaenopsidae | Acanthemblemaria exilispinus Stephens, 1963 | Robertson & Allen, 2008. | |
| - | Acathemblennaria hancocki Myers & Reid, 1936 | Cortés et al., 2009. | |
| - | Chaenopsis deltarrhis Böhlke, 1957 | Robertson & Allen, 2008. | |
| - | Coralliozetus boehlkei Stephens, 1963 | Robertson & Allen, 2008. | |
| - | Coralliozetus springeri Stephens & Johnson, 1966 | Robertson & Allen, 2008. | |
| - | Ekemblemaria myersi Stephens, 1963 | Robertson & Allen, 2008. | |
| - | Emblemaria piratica Ginsburg, 1942 | Robertson & Allen, 2008. | |
| - | Mccoskerichthys sandae Rosenblatt & Stephens, 1978 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Stathmonotus culebrai Seale, 1940 | Robertson & Allen, 2008. | |
| Chaetodontidae | Chaetodon humeralis Günther, 1860 | Presente estudio; Cortés et al., 2009. | |
| - | Johnrandallia nigrirostris (Gill, 1862) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Chanidae | Chanos chanos (Forsskal, 1775) | Presente estudio. | |
| Cirrhitidae | Cirrhitichthys oxycephalus (Bleeker, 1855) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Cirrhitus rivulatus Valenciennes, 1846 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Oxycirrhites typus Bleeker, 1857 | Presente estudio; Cortés et al., 2009. | |
| Clupeidae | Harengula thrissina (Jordan & Gilbert, 1882) | Robertson & Allen, 2008. | |
| Congridae | Heteroconger pellegrini Castle, 1999 | Robertson & Allen, 2008. | |
| Coryphaenidae | Coryphaena hippurus Linnaeus, 1758 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Dactyloscopidae | Dactyloscopus byersi Dawson, 1969 | Robertson & Allen, 2008. | |
| - | Dactyloscopus lunaticus Gilbert, 1890 | Robertson & Allen, 2008. | |
| - | Dactyloscopus minutus Dawson, 1975 | Robertson & Allen, 2008. | |
| - | Dactyloscopus pectoralis Gill, 1861 | Robertson & Allen, 2008. | |
| - | Gillellus searcheri Dawson, 1977 | Robertson & Allen, 2008. | |
| - | Gillellus semicinctus Gilbert, 1890 | Robertson & Allen, 2008. | |
| - | Heteristius cinctus (Osburn & Nichols, 1916) | Robertson & Allen, 2008. | |
| - | Platygillellus altivelis Dawson, 1974 | Robertson & Allen, 2008. | |
| - | Platygillellus bussingi Dawson, 1974 | Robertson & Allen, 2008. | |
| Dasyatidae | Dasyatis dipterura (Jordan & Gilbert, 1880) | Presente estudio. | |
| - | Daysatis longus (Garman, 1880) | Presente estudio. | |
| Diodontidae | Diodon holacanthus Linnaeus, 1758 | Presente estudio. | |
| - | Diodon hystrix Linnaeus, 1758 | Presente estudio; Cortés et al., 2009. | |
| Elopidae | Elops affinis Regan, 1909 | Cortés et al., 2009; Robertson & Allen, 2008. | |
| Engraulidae | Anchoa eigenmannia (Meek & Hildebrand, 1923) | Robertson & Allen, 2008. | |
| Exocoetidae | Cypselurus callopterus (Günther, 1866) | Presente estudio. | |
| Fistularidae | Fistularia commersonii Rüppell, 1838 | Presente estudio; Cortés et al., 2009. | |
| Familia | Especie | Referencia | |
| Ginglymostomatidae | Ginglymostoma cirratum (Bonnaterre, 1788) | Presente estudio. | |
| Gobiesocidae | Arcos rhodospilus (Günther, 1864) | Robertson & Allen, 2008. | |
| - | Gobiesox daedaleus Briggs, 1951 | Robertson & Allen, 2008. | |
| - | Tomicodon petersii (Garman, 1875) | Robertson & Allen, 2008. | |
| Gobiidae | Bathygobius ramosus Ginsburg, 1947 | Robertson & Allen, 2008. | |
| - | Bollmannia umbrosa Ginsburg, 1939 | Robertson & Allen, 2008. | |
| - | Chriolepis cuneata Bussing, 1990 | Robertson & Allen, 2008. | |
| - | Coryphopterus urospilus Ginsburg, 1947 | Presente estudio; Robertson & Allen, 2008. | |
| - | Elacatinus inornatus Bussing, 1990 | Robertson & Allen, 2008. | |
| - | Elacatinus janssi Bussing, 1981 | Robertson & Allen, 2008. | |
| - | Elacatinus puncticulatus (Ginsburg, 1938) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Gobulus crescentalis (Gilbert, 1892) | Robertson & Allen, 2008. | |
| - | Gobulus hancocki Ginsburg, 1938 | Robertson & Allen, 2008. | |
| - | Gymneleotris seminuda (Günther, 1864) | Robertson & Allen, 2008. | |
| - | Lythrypnus rhizophora (Heller & Snodgrass, 1903) | Robertson & Allen, 2008. | |
| Haemulidae | Anisotremus caesius (Jordan & Gilbert, 1882) | Cortés et al., 2009. | |
| - | Anisotremus interruptus (Gill, 1862) | Presente estudio. | |
| - | Anisotremus taeniatus Gill, 1861 | Presente estudio; Cortés et al., 2009. | |
| - | Haemulon flaviguttatum Gill, 1862 | Presente estudio. | |
| - | Haemulon maculicauda (Gill, 1862) | Presente estudio; Cortés et al., 2009. | |
| - | Haemulon sexfasciatum Gill, 1862 | Presente estudio; Cortés et al., 2009. | |
| - | Haemulon steindachneri (Jordan & Gilbert, 1882) | Presente estudio; Cortés et al., 2009; -Robertson & Allen, 2008. | |
| - | Microlepidotus brevipinnis (Steindachner, 1869) | Presente estudio; Cortés et al., 2009. | |
| Holocentridae | Myripristis berndti Jordan & Evermann, 1903 | Presente estudio; Cortés et al., 2009. | |
| - | Myripristis leiognathus Valenciennes, 1846 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Sargocentron suborbitalis (Gill, 1863) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Istiophoridae | Istiophorus platypterus (Shaw, 1792) | Presente estudio. | |
| Kuhliidae | Kuhlia mugil (Forster, 1801) | Robertson & Allen, 2008. | |
| Kyphosidae | Kyphosus analogus (Gill, 1862) | Presente estudio; Cortés et al., 2009. | |
| - | Kyphosus elegans (Peters, 1869) | Presente estudio. | |
| - | Sectator ocyurus (Jordan & Gilbert, 1882) | Presente estudio; Cortés et al., 2009. | |
| Labridae | Bodianus diplotaenia (Gill, 1862) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Halichoeres chierchiae Di Caporiacco, 1948 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Halichoeres dispilus (Günther, 1864) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Halichoeres melanotis (Gilbert, 1890) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Halichoeres nicholsi (Jordan & Gilbert, 1882) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Halichoeres notospilus (Günther, 1864) | Presente estudio; Robertson & Allen, 2008. | |
| - | Iniistius pavo (Valenciennes, 1840) | Presente estudio. | |
| - | Novaculichthys taeniourus (Lacepède, 1801) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Familia | Especie | Referencia | |
| Scaridae | Scarus compressus (Osburn & Nichols, 1916) | Presente estudio. | |
| - | Scarus ghobban Forsskål, 1775 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Scarus perrico Jordan & Gilbert, 1882 | Presente estudio; Robertson & Allen, 2008. | |
| - | Scarus rubroviolaceus Bleeker, 1847 | Presente estudio; Cortés et al., 2009. | |
| - | Stethojulis bandanensis (Bleeker, 1851) | Presente estudio. | |
| - | Thalassoma grammaticum Gilbert, 1890 | Presente estudio; Cortés et al., 2009. | |
| - | Thalassoma lucasanum (Gill, 1862) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Labrisomidae | Malacoctenus ebisui Springer, 1959 | Robertson & Allen, 2008. | |
| - | Malacoctenus margaritae (Fowler, 1944) | Robertson & Allen, 2008. | |
| - | Malacoctenus tetranemus (Cope, 1877) | Robertson & Allen, 2008. | |
| - | Malacoctenus sudensis Springer, 1959 | Presente estudio; Robertson & Allen, 2008. | |
| - | Paraclinus mexicanus (Gilbert, 1904) | Robertson & Allen, 2008. | |
| - | Starksia fulva Rosenblatt & Taylor, 1971 | Robertson & Allen, 2008. | |
| - | Starksia posthon Rosenblatt & Taylor, 1971 | Robertson & Allen, 2008. | |
| Lobotidae | Lobotes spp. | Presente estudio, | |
| Lophiidae | Lophiodes caulinaris (Garman, 1899) | Robertson & Allen, 2008. | |
| Lutjanidae | Hoplopagrus guentheri Gill, 1862 | Presente estudio; Cortés et al., 2009, | |
| - | Lutjanus aratus (Günther, 1864) | Presente estudio. | |
| - | Lutjanus argentiventris (Peters, 1869) | Presente estudio, Cortés et al. 2009. | |
| - | Lutjanus guttatus (Steindachner, 1869) | Presente estudio | |
| - | Lutjanus inermis (Peters, 1869) | Presente estudio; Cortés et al. 2009, | |
| - | Lutjanus novemfasciatus Gill, 1862 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Lutjanus viridis (Valenciennes, 1846) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Malacanthidae | Malacanthus brevirostris Guichenot, 1848 | Presente estudio. | |
| Microdesmidae | Microdesmus suttkusi Gilbert, 1966 | Robertson & Allen, 2008. | |
| Mobulidae | Mobula tarapacana (Philippi, 1892) | Presente estudio. | |
| Monacanthidae | Aluterus scriptus (Osbeck, 1765) | Presente estudio. | |
| Mugilidae | Agonostomus monticola* (Bancroft, 1834) | Robertson & Allen, 2008. | |
| - | Chaenomugil proboscideus (Günther, 1861) | Robertson & Allen, 2008. | |
| Mullidae | Mulloidicthys dentatus (Gill, 1862) | Presente estudio; Cortés et al., 2009. | |
| Muraenidae | Anarchias galapagensis (Seale, 1940) | Robertson & Allen 2008. | |
| - | Echidna nebulosa (Ahl, 1789) | Presente estudio. | |
| - | Gymnomuraena zebra (Shaw, 1797) | Presente estudio; Robertson & Allen, 2008, | |
| - | Gymnothorax castaneus (Jordan & Gilbert, 1883) | Presente estudio; Cortés et al., 2009. | |
| - | Gymnothorax dovii (Günther, 1870) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Gymnothorax flavimarginatus (Rüppell, 1830) | Presente estudio; Robertson & Allen, 2008. | |
| - | Gymnothorax panamensis (Steindachner, 1876) | Robertson & Allen, 2008. | |
| - | Muraena clepsydra Gilbert, 1898 | Presente estudio. | |
| - | Muraena lentiginosa Jenyns, 1842 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Ogcocephalidae | Zalieutes elater (Jordan & Gilbert, 1882) | Robertson & Allen, 2008. | |
| Ophichthidae | Ichthyapus selachops (Jordan & Gilbert, 1882) | Robertson & Allen, 2008. | |
| - | Letharchus rosenblatti McCosker, 1974 | Robertson & Allen, 2008. | |
| Familia | Especie | Referencia | |
| - | Myrichthys tigrinus Girard, 1859 | Presente estudio; Robertson & Allen, 2008. | |
| - | Ophichthus longipenis McCosker & Rosenblatt, 1998 | Robertson & Allen, 2008. | |
| - | Paraletharchus pacificus (Osburn & Nichols, 1916) | Robertson & Allen, 2008. | |
| Ophidiidae | Lepophidium pardale (Gilbert, 1890) | Robertson & Allen, 2008. | |
| Opistognathidae | Opistognathus brochus Bussing & Lavenberg, 2003 | Robertson & Allen, 2008. | |
| - | Opistognathus galapagensis Allen & Robertson, 1991 | Robertson & Allen, 2008. | |
| - | Opistognathus smithvanizi Bussing & Lavenberg, 2003 | Robertson & Allen, 2008. | |
| Ostraciidae | Ostracion meleagris Shaw, 1796 | Presente estudio; Cortés et al., 2009. | |
| Paralychthyidae | Citharichthys gilberti Jenkins & Evermann, 1889 | Robertson & Allen, 2008. | |
| - | Citharichthys platophrys Gilbert, 1891 | Robertson & Allen, 2008. | |
| - | Enchelycore octaviana (Myers & Wade, 1941) | Robertson & Allen, 2008. | |
| Pomacanthidae | Holacanthus passer Valenciennes, 1846 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Pomacanthus zonipectus (Gill, 1862) | Presente estudio; Cortés et al., 2009. | |
| - | Abudefduf declivifrons (Gill, 1862) | Robertson & Allen, 2008. | |
| - | Abudefduf troschelii (Gill, 1862) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Chromis atrilobata Gill, 1862 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Microspathodon bairdii (Gill, 1862) | Robertson & Allen, 2008. | |
| - | Microspathodon dorsalis (Gill, 1862) | Presente estudio, Cortés et al., 2009, Robertson & Allen, 2008. | |
| - | Stegastes acapulcoensis (Fowler, 1944) | Presente estudio, Cortés et al., 2009, Robertson & Allen, 2008. | |
| - | Stegastes flavilatus (Gill, 1862) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Priacanthidae | Heteropriacanthus cruentatus (Lacepède, 1801) | Robertson & Allen, 2008. | |
| Rhincodontidae | Rhincodon typus Smith, 1828 | Presente estudio. | |
| Sciaenidae | Odontoscion xanthops Gilbert, 1898 | Presente estudio. | |
| Scombridae | Acanthocibium solandri (Cuvier, 1832) | Cortés et al., 2009. | |
| - | Scomberomorus sierra Jordan & Starks, 1895 | Cortés et al., 2009. | |
| - | Scorpaena histrio Jenyns, 1840 | Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Scorpaena plumieri mystes Jordan & Starks, 1895 | Presente estudio. | |
| - | Scorpaena russula Jordan & Bollman, 1890 | Robertson & Allen, 2008. | |
| - | Scorpaenodes xyris (Jordan & Gilbert, 1882) | Robertson & Allen, 2008. | |
| Serranidae | Alphestes immaculatus Breder, 1936 | Presente estudio. | |
| - | Cephalopholis panamensis (Steindachner, 1876) | Presente estudio; Cortés et al., 2009. | |
| - | Dermatolepis dermatolepis (Boulenger, 1895) | Presente estudio; Cortés et al., 2009. | |
| - | Epinephelus analogus Gill, 1863 | Cortés et al., 2009. | |
| - | Epinephelus labriformis (Jenyns, 1840) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Mycteroperca xenarcha Jordan, 1888 | Cortés et al., 2009. | |
| - | Paranthias colonus (Valenciennes, 1846) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Pronotogrammus eos Gilbert, 1890 | Robertson & Allen, 2008. | |
| - | Pseudogramma thaumasium (Gilbert, 1900) | Robertson & Allen, 2008. | |
| - | Rypticus bicolor Valenciennes, 1846 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Familia | Especie | Referencia | |
| - | Serranus psittacinus Valenciennes, 1846 | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| Sphyraenidae | Sphyraena spp. | Presente estudio. | |
| Syngnathidae | Bryx veleronis Herald, 1940 | Robertson & Allen, 2008. | |
| - | Doryrhamphus excisus Kaup, 1856 | Robertson & Allen, 2008. | |
| Synodontidae | Synodus lacertinus Gilbert, 1890 | Presente estudio; Robertson & Allen, 2008. | |
| - | Synodus sechurae Hildebrand, 1946 | Robertson & Allen, 2008. | |
| Tetraodontidae | Arothron hispidus (Linnaeus, 1758) | Presente estudio. | |
| - | Arothron meleagris (Lacepède, 1798) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Canthigaster punctatissima (Günther, 1870) | Presente estudio; Cortés et al., 2009; Robertson & Allen, 2008. | |
| - | Sphoeroides lobatus (Steindachner, 1870) | Presente estudio. | |
| Tripterygiidae | Lepidonectes clarkhubbsi Bussing, 1991 | Robertson & Allen, 2008. | |
| - | Axoclinus lucillae Fowler, 1944 | Robertson & Allen, 2008. | |
| - | Enneanectes carminalis (Jordan & Gilbert, 1882) | Robertson & Allen ,2008, | |
| Zanclidae | Zanclus cornutus (Linnaeus, 1758) | Presente estudio; Cortés et al., 2009. | |
* Catadromo. Vive en ríos pero desova en mar.
Cuadro 3 Comparaciones entre el número de especies encontradas en la Isla del Caño (n=212) y las especies reportadas* en otras partes de Costa Rica y el Pacífico Oriental Tropical
| Región | Especies confirmadas | Porcentaje presente en la Isla del Caño |
|---|---|---|
| Provincia Panámica1 | 9462 | 22.41% |
| Costa Rica-Costa Pacífico continental e I. del Coco (<100m profundidad) | 7193 | 29.48% |
| Total de peces marinos de Costa Rica (Pacífico, I. del Coco, Caribe, <100m) | 10513 | 20.17% |
| Pacífico Oriental Tropical (PTO) | 12612 | 16.81% |
1. Existen varias versiones sobre los límites de la Provincia Panámica, en este estudio se utilizó la clasificación según Robertson y Cramer (2009), en la cual la provincia panámica incluye toda la costa continental del PTO excepto el Golfo de California y Baja California Sur. 2. Robertson y Cramer (2009). 3. Bussing y López (2009).
Cuadro 4 Especies confirmadas y esperadas para varias Islas del Pacífico Oriental Tropical
| Provincia 1 | Isla | Confirmadas | Esperadas 2 | Área terrestre (km 2 ) |
|---|---|---|---|---|
| Gran Panámica (946)1 | I. Coiba, Panamá I. Perlas, Panamá | 3872 2762 | 759 669 | 2 700 331 |
| I. Gorgona, Colombia | 3561 | 594 | 26 | |
| I. Plata, Ecuador | 852 | 548 | 5 | |
| I. Caño, Costa Rica | 212 | 677 | 3.2 | |
| I. Iguana, Panamá | 1172 | 701 | 0.58 | |
| Oceánica (578)1 | I. Galápagos, Ecuador I. Revillagilledo, México | 4191 2591 | 479 306 | 7 880 157.81 |
| I. Coco, Costa Rica | 3232,3 | 339 | 23.85 | |
| I. Clipperton, Francia | 1561 | 172 | 8.9 | |
| I. Malpelo, Colombia | 2981 | 287 | 0.35 |
1. Provincias y su número de especies por Robertson y Cramer (2009). 2. Número de especies confirmadas según Robertson y Allen (2008); también todas las especies esperadas son según estos autores. 3. Cortés (2012) reporta más especies de peces (óseos y cartilaginosos) para la Isla del Coco (n=389), sin embargo se ha excluido este número porque incluye algunas especies de profundidades mayores de 100m, lo cual sesgaría la comparación con los otros sitios donde no se tiene este dato.
Los resultados de este trabajo muestran una tendencia a la asociación del grupo de las especies carnívoras, como pargos y roncadores (e.g. Lutjanidae y Haemulidae) con sustratos rocosos rugosos, relativamente profundos. Esto coincide con Allen (1995), tomando en cuenta que los adultos encuentran en rocas sus presas comunes como peces e invertebrados, principalmente crustáceos. En cuanto a la composición de especies por sitio, destaca la abundancia de Lutjanus viridis y Lutjanus argentiventris encontrada en El Barco. Allí se encontró la más alta cobertura rocosa (90%, el mismo valor tuvo El Sur, Cuadro 1) y el tercer índice de rugosidad más alto (0.48, Cuadro 1), lo cual puede explicar la relación encontrada de carnívoros en sitios rugosos y rocosos. Posiblemente la heterogeneidad del sustrato favorece la alimentación carnívora de los adultos para estas especies. Los guías locales de buceo turístico reportan que el Barco es también sitio de agregación del pargo de la mancha (Lutjanus guttatus), los cuales se reclutan en el área y se mantienen asociados a ese arrecife, pero esta especie no fue observada en este sitio durante nuestras visitas. Se debe estudiar más en detalle la relación de este sitio con la presencia de estas especies de importancia comercial, por lo que se recomienda que futuros estudios analicen el reclutamiento y residencia de esta especie. Adicionalmente, se considera importante implementar monitoreos constantes del sitio El Barco, ya que los presentes resultados demuestran que es lugar en donde especies de interés comercial son frecuentes y abundantes.
Se recomienda que futuros estudios cubran en su muestreo tanto la época seca como la lluviosa para tener una variable más que aporte a este análisis. Adicionalmente, los resultados aquí presentados podrían enriquecerse al coordinar los muestreos de todos los sitios de manera simultánea.
Lista de especies de la RBIC
Si bien el área terrestre de la Isla del Caño es bastante pequeña, su riqueza marina es sobresaliente, con un ~17% de peces costeros de toda la región del PTO y el ~30% de toda la costa Pacífico de Costa Rica. La RBIC se encuentra en la provincia Panámica, la más diversa del PTO, y precisamente la máxima riqueza de esta provincia se encuentra entre Panamá y Costa Rica (Robertson & Cramer, 2009). La Isla del Caño no posee peces marinos endémicos, estos son más comunes en las islas oceánicas, tal como la Isla del Coco, debido a su aislamiento geográfico. Sin embargo, la Isla del Caño posee especies de rangos limitados, tales como el blenio de tubo Mccoskerichtys sandae, el cual se distribuye únicamente desde el sur de Costa Rica hasta la costa noroeste del Pacífico panameño (Robertson & Allen, 2008), y el gobio Elacatinus inornatus, que solamente se encuentra desde Costa Rica hasta Colombia (Robertson & Allen, 2008).
Es interesante destacar, tomando en cuenta las diferencias en esfuerzo de muestreo, que las islas Panameñas Perlas y Coiba poseen una menor riqueza por área que la Isla del Caño, a pesar de su posición geográfica y desarrollo arrecifal elevado (Maté, 2003), y que la ictiofauna de la isla Gorgona posee un menor número de especies por área que la Isla del Caño. Es necesario aumentar los estudios de diversidad de especies en estas zonas, de manera que se puedan realizar comparaciones más certeras entre ellas.
Durante los censos de buzo errante realizados para complementar el registro de especies, se visitaron dos sitios que consideramos importante mencionar. Uno de estos es Bajo del Diablo, en donde abundan cardúmenes de especies de interés comercial como el pargo amarillo (Lutjanus argentiventris) y el jurel ojón (Caranx sexfasciatus). Frecuentemente se observan tiburones punta blanca (Triaenodon obesus) y pargos de gran tamaño (e.g. Lutjanus novemfasciatus), así como una gran variedad de peces de arrecife. El otro sitio es Bajo Paraíso, en este abundan especies de importancia comercial y deportiva, tales como el pargo dientón (Hoplopagrus guentherii), el hojarán (Seriola rivoliana), y grandes cardúmenes de pargos (e.g. Lutjanus viridis) y roncadores. Las agregaciones encontradas en estos sitios son masivas, por lo que estos sitios merecen atención para la conservación, y son además sitios clave para el buceo.
La Reserva Biológica Isla del Caño se ha convertido en una zona críticamente importante para el país, en varios sentidos. Desde el punto de vista turístico, tiene gran demanda para actividades relacionadas con el arrecife, como el snorkel y buceo beneficiadas directamente con observación de densos cardúmenes de pargos, roncadores y jureles, además de una población residente de tiburones; e indirectamente de la observación de cetáceos, atraídos por los cardúmenes antes mencionados (Montero-Cordero, 2007). Por otro lado, la Isla del Caño actúa como refugio para especies de valor comercial y social (pargos, roncadores, etc.) y podría favorecer la recuperación de estas poblaciones para que puedan ser sujetas a un uso sostenible en las afueras de la RBIC, por comunidades aledañas que dependen de las mismas. Finalmente, desde la perspectiva biológica, la Isla del Caño es sin duda un lugar importante para la conservación marina, sumando al día de hoy 212 especies de peces, algunas residentes y otras pelágicas visitantes. Estos números podrían cambiar si se descuida la continuidad de las medidas de conservación y manejo en esta área. Por lo anterior, se recomienda implementar prácticas turísticas sostenibles en esta área protegida y el cumplimiento general de las regulaciones de uso. Adicionalmente debe ser prioritario el mantener el monitoreo a largo plazo, para poder captar tendencias anuales de las especies. Las medidas anteriores contribuirían con la integridad ecológica y la conectividad con otros lugares del PTO.












 uBio
uBio 

