Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 suppl.4 San José Dec. 2010
Capítulo 1
Introducción a los grupos de macroinvertebrados acuáticos
Paul Hanson1*, Monika Springer1,2* & Alonso Ramirez3*
*Dirección de correspondencia:
Cada ambiente requiere adaptaciones particulares y por lo tanto alberga distintos grupos de organismos. El agua dulce es un medio distinto del agua salada y de la tierra firme. Muy pocas especies son capaces de vivir en ambientes de agua dulce y marinas, sobre todo por las diferencias en salinidad. Asimismo, no hay muchos organismos capaces de vivir en agua dulce y en tierra firme, aunque muchos animales tienen etapas juveniles que habitan en ambientes de agua dulce mientras que los adultos son terrestres. En este caso se notan adaptaciones diferentes durante las distintas etapas del ciclo de vida, por ejemplo los renacuajos tienen branquias mientras que las ranas tienen pulmones.
Tradicionalmente, los animales se dividen en invertebrados y vertebrados, aunque los primeros incluyen todos los filos de animales mientras que los últimos abarcan un solo subfilo del Filo Chordata. En otras palabras, la gran mayoría de los animales son invertebrados y en los ambientes dulceacuícolas son el grupo más abundante y diverso. En comparación con el ambiente marino, los ambientes de agua dulce albergan menos filos de animales, puesto que existen varios filos exclusivamente marinos. Otros filos contienen principalmente especies marinas, con algunas pocas dulceacuícolas.
Los macroinvertebrados dulceacuícolas son el grupo focal de este manual. En términos generales, definimos los macroinvertebrados como aquellos invertebrados que se pueden ver a simple vista o bien que son retenidos por una red de malla de aproximadamente 125µm. Esta distinción es relativa y a veces arbitraria, por lo que podemos ser un poco más precisos definiendo los macroinvertebrados con base en la taxonomía. Este grupo tiene representantes en muchos filos de animales, entre ellos: Arthropoda, Mollusca, Annelida, Platyhelminthes, Nematoda y Nematomorpha. Sin embargo, hay que aclarar que varios miembros de estos filos son microscópicos por lo que se les considera parte de la meiofauna (microcrustáceos y micromoluscos, muchos anélidos y nemátodos, entre otros).
A continuación presentamos un breve resumen de la biología e importancia de los macroinvertebrados dulceacuícolas, con énfasis en los insectos, que es el grupo más abundante y diverso. Para obtener más información sobre estos temas recomendamos consultar otras obras más especializadas, como Resh & Rosenberg (1984), Roldán-Perez (1988), Ward (1992), Smith (2001), Thorp & Covich (2001), Merritt et al. (2008) y Domínguez & Fernández (2009), entre otros. Además, cada uno de los capítulos de esta serie de suplementos incluye información más específica sobre la biología y ecología de cada grupo, incluyendo aspectos de su comportamiento, reproducción, ciclo de vida, alimentación, hábitat e importancia.
Ambientes dulceacuícolas
En términos muy generales se distingue entre las aguas con corriente (ambientes lóticos) versus las aguas sin corriente (ambientes lénticos). La primera categoría incluye ríos y quebradas mientras que la segunda incluye lagos, lagunas, pantanos y el agua que se acumula en varios tipos de recipientes, desde una bromelia hasta una lata vacía. Se debe notar que puede haber sitios sin corrientes (pozas) en los ríos y por otro lado un lago puede tener olas generadas por el viento. También se distingue entre cuerpos de agua oligotróficos, con pocos nutrientes y baja productividad primaria, versus eutróficos, con muchos nutrientes y una alta productividad primaria (mucho crecimiento de algas) que a menudo genera niveles bajos de oxígeno durante la noche.
Los organismos que viven en aguas con corriente se llaman reofílicos. En cuanto a estos ambientes podemos distinguir entre ríos y quebradas permanentes, versus intermitentes que se secan parcial- o completamente durante una parte del año. Dentro de un río existen zonas erosionales donde la corriente se lleva las partículas y zonas deposicionales donde la corriente deposita las partículas. Debajo y a los lados del fondo, en la zona hiporreica, las aguas del río se pueden mezclar con las subterráneas en los espacios intersticiales. A veces hay sitios donde el agua fluye en una lámina delgada sobre rocas empinadas, denominada la zona madícola o higropétrica. Donde hay cascadas o cataratas hay una zona de salpicadura en las rocas expuestas que se mantiene permanentemente mojada, con una comunidad de organismos especialmente adaptados a este tipo de hábitat. En términos generales, los ambientes lóticos, especialmente los ríos de aguas limpias y bien oxigenadas, son los ecosistemas de agua dulce que albergan la mayor diversidad de macroinvertebrados.
Los ambientes lénticos poseen en general menos diversidad de microhábitats que los ambientes lóticos. La orilla de una laguna, la zona litoral, tiene aguas someras con plantas creciendo en el fondo y a menudo ésta es la única zona que existe en un pantano. Por lo general, la zona litoral contiene el mayor número de especies de macroinvertebrados en los ambientes lénticos. En el área de aguas abiertas podemos distinguir entre las aguas superficiales, donde penetran la luz (zona limnética), versus aguas profundas, donde no penetra la luz (zona profundal).
Un ambiente dulceacuícola especialmente común en los bosques tropicales es el de las aguas contenidas en plantas terrestres (fitotelmata). Este ambiente incluye los huecos de árboles, las axilas de hojas (p. ej. bromelias), las brácteas florales (p. ej. Heliconia), los frutos caídos y otras partes vegetales caídas en el suelo. La diversidad en ambientes de fitotelmata es alta y las comunidades son complejas (Kitching 2000); se han registrado al menos 70 familias de insectos repartidas en 11 órdenes, la mayoría en Diptera, Coleoptera y Odonata (Greeney 2001); además de anélidos y crustáceos. Sin embargo, estos registros incluyen no solamente insectos acuáticos, sino también semi-acuáticos y a veces terrestres. Algunos insectos acuáticos son restringidos a fitotelmata, como por ejemplo la familia Pseudostigmatidae (Odonata).
Las aguas subterráneas (acuíferos y cavernas) contienen más volumen de agua dulce que cualquier otro cuerpo de agua, con la excepción de glaciares. Existen varios organismos (llamados stigobiontes) que están restringidos a este ambiente, por ejemplo ciertas especies de anélidos, nemátodos, ácaros, anfípodos, copépodos y otros micro-crustáceos (Gibert & Culver 2009). A nivel local puede haber relativamente pocas especies en estos ambientes pero a nivel regional existe una alta diversidad debido a la fragmentación de los hábitats y la limitada dispersión entre ellos (o sea, un alto nivel de endemismo). Donde las aguas subterráneas emergen en la superficie de la tierra se forman manantiales, los cuales representan un ambiente más para los macroinvertebrados. Por ejemplo, en Costa Rica, un estudio realizado por Goldschmidt (2004) ha revelado que un alto porcentaje de las especies de ácaros dulceacuícolas están restringidos a estos ambientes en particular.
Finalmente, las aguas subterráneas asociadas con actividad geotermal crean manantiales de agua caliente que albergan invertebrados muy particulares. Al parecer, ningún insecto puede vivir en temperaturas mayores de 50°C y muy pocos aguantan temperaturas mayores de 40°C. En diferentes partes del mundo se han encontrado en aguas termales ciertas especies de Odonata (Coenagrionidae), Hemiptera, Coleoptera (Dytiscidae e Hydrophilidae) y Diptera (Chironomidae, Stratiomyidae y Ephydridae) (Pritchard 1991). Sin embargo, la información sobre estos ambientes en áreas neotropicales es sumamente limitada.
Biología de los macroinvertebrados dulceacuícolas
Los grupos de macroinvertebrados que habitan en agua dulce muestran una gran variedad de adaptaciones, incluyendo importantes diferencias en sus ciclos de vida. Algunos grupos pasan todo, o casi todo, su ciclo de vida en el agua. Ejemplos incluyen chinches (Hemiptera), la mayoría de los escarabajos (Coleoptera; aunque la pupa es generalmente terrestre), crustáceos, moluscos, sanguijuelas y planarias. Por otro lado, los órdenes de insectos Ephemeroptera, Odonata, Plecoptera, Megaloptera, Trichoptera, Lepidoptera y Diptera tienen adultos terrestres. En muy pocos grupos, como Dryopidae (Coleoptera) y Nematomorpha, solo los adultos son acuáticos. El tiempo de desarrollo es altamente variable, dependiendo de la especie y de factores ambientales, como la temperatura del agua y la disponibilidad de alimento, y puede variar desde pocas semanas hasta varios años. En los ambientes tropicales, los ciclos de vida son por lo general “multivoltinos”, lo que quiere decir que se dan varias generaciones al año, las cuales se traslapan (Vásquez et al. 2009). Aquí usualmente no hay una estacionalidad muy marcada en la emergencia de los adultos, como se da en zonas templadas, donde prevalecen los ciclos “univoltinos” o “semivoltinos”, con una o dos generaciones al año. A pesar de ello, existen ejemplos de poblaciones de insectos acuáticos en Costa Rica con ciclos de vida semivoltinos, como Euthyplocia hecuba (Ephemeroptera) (Sweeney et al. 1995) y univoltinos, como Cora marina (Odonata) (Pritchard 1996). Finalmente, algunos grupos realizan migraciones a lo largo de los ríos, e incluso entre los ambientes de agua dulce y de mar. Por ejemplo, algunas especies de crustáceos decápodos necesitan del ambiente marino para el desarrollo del estadio larval y migran nuevamente hacia los ríos como juveniles. Como se mencionó anteriormente, cada capítulo contiene detalles de la biología de los diferentes grupos de macroinvertebrados.
Hábitat y locomoción
Los animales de agua dulce se pueden clasificar basándose en donde se encuentran en el cuerpo de agua y su manera de moverse. Algunos viven en la superficie del agua (neuston) mientras que otros permanecen suspendidos en la columna del agua (plancton) o bien nadan activamente (necton). Estos grupos generalmente no habitan en aguas con corriente y pueden ser muy abundantes y diversos en lagos y lagunas. La mayoría de los animales dulceacuícolas viven sobre algún tipo de sustrato, ya sea en el fondo (bentos) o en los tallos de plantas acuáticas, madera, rocas, etc.
Neuston (pleuston). Se denomina epineuston a los organismos que viven en la fase aérea sobre la película de agua. Algunas familias de chinches (p. ej. Gerridae, veliidae) son patinadores en la superficie del agua (Fig. 17) y otros artrópodos también viven en la superficie, pero se mueven brincando (Collembola) o caminando (Hemiptera-Hydrometridae y algunas arañas). Aunque son semiacuáticos, estos artrópodos muestran adaptaciones para moverse en la superficie del agua (Bush & Hu 2006), por lo que a menudo se incluyen en los estudios acuáticos. Los adultos de los coleópteros Gyrinidae viven principalmente en la superficie pero también son capaces de bucear y nadar. Se denomina hiponeuston a los que viven justo debajo la superficie, por ejemplo las larvas de zancudos (Culicidae), que permanecen muy cerca de la superficie debido a su modo de respiración (ver abajo).
Plancton. El zooplancton de agua dulce es dominado por dos grupos de crustáceos: los cladóceros y los copépodos (Figs. 56, 57). Ellos requieren una amplia superficie corporal para mantenerse en la columna de agua y aún así utilizan los apéndices para actuar en contra de la tendencia a hundirse. Los Chaoboridae (Diptera) son quizás el único grupo de insectos planctónicos.
Buceadores (“divers”). Varios chinches y algunos escarabajos adultos (Dytiscidae e Hydrophilidae) obtienen su oxígeno en la superficie del agua, pero bucean y nadan para alimentarse; a menudo pasan tiempo agarrándose de objetos sumergidos. Todos estos insectos tienen un cuerpo hidrodinámico y patas traseras en forma de remo con pelos natatorios.
Nadadores (“swimmers”). Algunos insectos que viven permanentemente sumergidos son capaces de nadar con movimientos como los de un pez. Entre los arranques breves de natación, pasan su tiempo agarrados de rocas, tallos de plantas acuáticas u otros objetos sumergidos. Entre ellos, los Baetidae, Isonychiidae y algunos Leptophlebiidae (Ephemeroptera) tienen un cuerpo hidrodinámico y un abdomen aplanado para impulsarse y nadar. Otros nadadores incluyen muchos ácaros Hydrachnidiae, que tienen pelos natatorios en las patas.
Agarradores (“clingers”). En áreas de corriente fuerte, los macroinvertebrados a menudo muestran adaptaciones para agarrarse o sujetarse al sustrato. Algunos macroinvertebrados tienen un cuerpo que funciona como una gran ventosa (larvas de Psephenidae, Fig. 10; Heptageniidae), uñas largas y fuertes (adultos de Elmidae y Dryopidae), ganchos en la punta del abdomen (Megaloptera y algunos Trichoptera) o una combinación de ganchos y sedas en la punta del abdomen (Simuliidae).Algunas larvas poseen ventosas en la parte ventral de su cuerpo, como los dípteros Blephariceridae y Psychodidae, para pegarse fuertemente a la superficie de las rocas. Los Trichoptera, Lepidoptera y Chironomidae utilizan seda para construir casitas y refugios y pegarlas al sustrato, la cual también es empleada como un “hilo de seguridad”, para evitar que la larva sea arrastrada por la corriente. Muchos Ephemeroptera y Plecoptera que viven en corrientes fuertes tienen el cuerpo aplanado y las patas proyectadas lateralmente, lo que ayuda a minimizar la resistencia a la corriente del agua.
Reptadores (“sprawlers”). Muchos Ephemeroptera, Odonata (p. ej. Libellulidae), Plecoptera y Trichoptera que viven en hábitats o micro-hábitats con menos corriente, se arrastran en la superficie del sustrato, ya sea encima de las rocas (incluso la superficie inferior), sedimentos, hojarasca o madera.
Trepadores (“climbers”). Varios macroinvertebrados viven en las partes sumergidas de las plantas acuáticas, aunque muchos de éstos no se alimentan de la planta. Algunos de ellos son depredadores, como las ninfas de diversas familias de libélulas (Odonata) y algunos hemípteros acuáticos (p. ej. Belostomatidae).
Excavadores (“burrowers”). Varios macroinvertebrados excavan y se entierren en los sedimentos blandos. A menudo tienen muchas setas en la parte dorsal del cuerpo, la cabeza aplanada y patas anteriores adaptadas para excavar. Por ejemplo, Ephemeridae y Polymitarcyidae (Ephemeroptera) construyen túneles en forma de u, mientras que Gomphidae (Odonata) simplemente se entierran. Otros excavadores incluyen algunos Chironomidae y otros Diptera, cangrejos y la mayoría de las almejas. Algunas especies no excavadoras se entierran en etapas jóvenes o como respuesta a condiciones de sequía. Muchos invertebrados pequeños no son excavadores activos, pero su pequeño tamaño (<1mm) les permite vivir entre los granos de arena y en el fango (espacios intersticiales) del fondo; esta comunidad de invertebrados se llama meiofauna.
Alimentación
El alimento de los animales de agua dulce se puede originar dentro del ecosistema acuático (autóctono) o venir del terrestre (alóctono). Los herbívoros y carnívoros se alimentan de organismos vivos, mientras que los detritívoros se alimentan de materia orgánica en descomposición (detritus). Dentro de cada una de estas categorías se puede distinguir varios grupos funcionales, basados en su comportamiento alimenticio. Es importante anotar que el comportamiento alimenticio puede cambiar a través del ciclo de vida del animal y que algunos animales ingieren diversos tipos de alimento (son omnívoros).
Los herbívoros se alimentan de plantas vasculares acuáticas o de algas filamentosas. Generalmente toman pedazos grandes (>1mm) de tejido vegetal y son llamados fragmentadores (desmenuzadores). Pueden alimentarse externamente o internamente como minadores de tallos u hojas (algunos Chironomidae), o pueden alimentarse de raíces enterradas en los sedimentos (Coleoptera: Curculionidae). Hay muy pocos herbívoros que no son fragmentadores: una especie de Chironomidae que induce agallas en Podostemaceae y algunos homópteros (Hemiptera) semiacuáticos que succionan savia. Otros herbívoros se alimentan de algas microscópicas, son menos especializados y por lo general seleccionan su alimento con base a su tamaño y disponibilidad. Algunos son filtradores de partículas en suspensión, que son recolectadas a través de cepillos bucales o redes de seda. Otros son raspadores que se alimentan de algas (perifiton) y microbios adheridos a las rocas u otros sustratos; ejemplos incluyen: Heptageniidae (Ephemeroptera), Glossosomatidae (Trichoptera, Fig. 14) y caracoles.
Los carnívoros se alimentan de otros animales e incluyen tres categorías: los depredadores, los parasitoides y los parásitos. Entre los macroinvertebrados carnívoros más comunes de agua dulce están los depredadores. La mayoría mastican la presa pero algunos le inyectan enzimas y succionan su contenido (chinches; larvas de los coleópteros Gyrinidae y Dytiscidae; ninfas y adultos de ácaros). A menudo los depredadores poseen adaptaciones morfológicas para capturar la presa, por ejemplo las patas raptoriales en chinches y el labio extensible en Odonata (Fig. 16). Algunos filtradores son depredadores cuando se alimentan de animales planctónicos (zooplancton).
Los parasitoides son organismos que viven en una asociación íntima con un hospedero y a diferencia de un parásito, siempre lo matan. En contraste con un depredador, la larva de un parasitoide consume un solo individuo. Comparado con los ecosistemas terrestres, este grupo es muy escaso en los ecosistemas acuáticos. Incluye algunas pocas especies de avispitas (Hymenoptera) que entran al agua para poner su huevo en un insecto acuático o en sus huevos, donde se alimenta y se desarrolla su larva. Este grupo también incluye las larvas de algunos Sciomyzidae (Diptera) que son parasitoides de caracoles.
Igual que el grupo anterior, los parásitos son organismos que viven en una asociación íntima con un hospedero, pero generalmente no lo matan (a veces pueden matarlo si la población de parásitos es muy alta). Ejemplos incluyen Sisyridae (Neuroptera) que son parásitos de esponjas (Porifera), Branchiura y algunos Copepoda (Crustacea) en peces, Bopyridae (Isopoda) en las branquias de camarones, las larvas de ácaros en los adultos de insectos acuáticos y las larvas de algunas almejas (unionida) en branquias de peces.
Los detritívoros se alimentan de detritus (materia orgánica muerta) e incluyen los siguientes grupos funcionales. Los fragmentadores (desmenuzadores) se alimentan de pedazos (>1mm) de hojas en descomposición (Fig. 15) o fragmentos de madera, una dieta que incluye muchos microorganismos (bacterías y hongos), lo cual aumenta el valor nutricional de las hojas. Ellos convierten estos fragmentos en partículas más finas de materia orgánica. Los filtradores incluyen los animales que utilizan estructuras especializadas del cuerpo (cepillos bucales como en Simuliidae, patas con brochas de setas en algunas Ephemeroptera y Trichoptera, branquias ciliadas en almejas, etc.) o redes de seda (algunos Trichoptera y Chironomidae) que funcionan como filtros para remover partículas finas (<1mm) del agua (Fig. 12). Ellos comúnmente aprovechan sitios de corriente fuerte que llevan una mayor cantidad de alimento. Muchos filtradores son más bien omnívoros porque se alimentan tanto de materia viva (fitoplancton y zooplancton) como de materia muerta. Los recogedores (recolectores) son animales que recogen partículas finas (<1mm) depositadas en el agua.
Respiración
Los ambientes acuáticos tienen menos oxígeno que los ambientes terrestres y la difusión de oxígeno por el agua es mucho más lenta que en el aire. La cantidad de oxígeno disuelto en el agua disminuye conforme aumenta la temperatura y disminuye la corriente. En agua fría pueden haber 15ppm (partes por millón) de oxígeno mientras que en el aire es 200 000ppm. Por ello, los macroinvertebrados tienen una diversidad de adaptaciones para obtener oxígeno del agua en los ambientes acuáticos.
En los insectos el sistema respiratorio consiste en una serie de aberturas (espiráculos) en el cuerpo, donde el aire entra directamente en un sistema de tubos (traqueolos) que se ramifican por todo el cuerpo. Muchos ácaros también tienen un sistema traqueal, pero este evolucionó de forma independiente al sistema de los insectos. En los insectos los espiráculos pueden estar abiertos para utilizar aire (directamente o indirectamente) o bien pueden estar cerrados y efectuar el intercambio de gases por la cutícula. Entre los que tienen los espiráculos abiertos, podemos clasificar cuarto grupos según su estrategia para obtener oxígeno: los que utilizan aire atmosférico, los que utilizan tanto el aire como el oxígeno disuelto en el agua y dos grupos que utilizan solamente el oxígeno disuelto en el agua.
En el primer grupo, el insecto mantiene contacto con la superficie del agua o se pone en contacto periódicamente, para obtener oxígeno directamente de la atmósfera (Figs. 6-9). Esto ocurre por ejemplo en las larvas y pupas de zancudos (Culicidae) y varias otras moscas, y en las larvas y adultos de algunos escarabajos (Dytiscidae e Hydrophilidae).
En el segundo grupo, el insecto lleva un suministro de aire en su cuerpo cuando está sumergido. Este aire no es simplemente un tanque de oxígeno, sino también una branquia física que permite la difusión de oxígeno desde el agua hacia el aire atrapado en el cuerpo. Sin embargo, esta carga de aire eventualmente desaparece y el insecto tiene que regresar a la superficie para renovar su suministro . Varios chinches y adultos de escarabajos (Fig. 6) muestran este tipo de respiración. El tiempo que pueden mantenerse sumergidos depende de la cantidad de oxígeno en el agua y disminuye conforme aumenta el tamaño del insecto. Cuando aumenta la temperatura no solamente disminuye la cantidad de oxígeno en el agua, sino también aumenta el metabolismo del insecto y por lo tanto su demanda de oxígeno. Bajo estas condiciones los insectos pequeños tienen una ventaja.
El tercer grupo consiste de insectos que llevan una película permanente de aire (un plastrón) encima de su cuerpo. Esta película de aire se forma gracias a pelos cortos que repelen el agua. Esta película de aire sirve como una branquia física que extrae oxígeno del agua. En contraste con el grupo anterior, el aire no desaparece con el paso de tiempo y por lo tanto estos insectos pueden quedarse sumergidos indefinidamente si el agua contiene bastante oxígeno (y si el insecto no tiene una demanda alta de oxígeno). Este grupo incluye los chinches del género Cryphocricos (Naucoridae) y los adultos de Dryopidae y Elmidae (Coleoptera).
El cuarto grupo tiene extensiones de cutícula alrededor de los espiráculos (branquias espiraculares) y el aire atrapado sirve como una branquia física al igual que en el grupo anterior. Estas estructuras también sirven para la respiración en el ambiente terrestre y por lo tanto los insectos con branquias espiraculares (p. ej. pupas de Simuliidae) pueden vivir en quebradas donde el nivel del agua fluctúa.
Dentro de los insectos acuáticos que mantienen los espiráculos cerrados (apneústicos) y no funcionales, la mayoría puede absorber oxígeno directamente del agua. El intercambio de gases ocurre a través de las partes de la cutícula que son permeables y que tienen una red densa de traqueolos cerca de la superficie (respiración cutánea). Este sistema funciona mejor cuando el animal tiene mucha superficie en comparación con su volumen, o sea en insectos pequeños y alargados como las larvas de los dípteros Chironomidae y Ceratopogonidae, y en las etapas jóvenes de muchos insectos y ácaros.
Muchos insectos acuáticos complementan la respiración cutánea con extensiones de la pared corporal que tienen numerosos traqueolos. Estas branquias traqueales están presentes en los estadios inmaduros de al menos algunas especies de todos los órdenes acuáticos principales, con la excepción de Hemiptera. Las branquias traqueales pueden tener la forma de placas o de filamentos ramificados y son especialmente diversos en Ephemeroptera. En Odonata, los Zygoptera tienen tres branquias en la punta del abdomen, mientras que los Anisoptera tienen cámaras branquiales dentro del abdomen, conectadas con el recto. Las branquias traqueales son especialmente importantes en aguas más cálidas y con menos oxígeno. El insecto a menudo mueve el cuerpo para aumentar el flujo de agua que pasa por las branquias (ventilación). Por ejemplo, los movimientos rítmicos de branquias en Ephemeroptera, las ondulaciones del abdomen de Trichoptera y Chironomidae dentro de sus casitas, y el movimiento del agua adentro y fuera de la cámara rectal de Anisoptera. Algunos insectos complementan la respiración cutánea con pigmentos respiratorios, lo que les ayuda a colonizar sitios donde el agua tiene niveles bajos de oxígeno. Algunas larvas de Chironomidae (tribu Chironomini) maximizan la captura de oxígeno usando hemoglobina, la cual les da un color rojo brillante cuando están vivos (Fig. 5). El pigmento representa una ventaja al colonizar ambientes contaminados, y en algunos casos estas larvas pueden llegar a ser sumamente abundantes. Otros insectos dependen en gran parte de las corrientes de agua para la ventilación de sus branquias.
Muchos otros invertebrados dulceacuícolas utilizan la respiración cutánea y branqueal, pero en vez de traqueolos tienen vasos sanguíneos que llevan el oxígeno a los tejidos. Los caracoles pulmonados han perdido las branquias y en su lugar la cavidad del manto se ha convertido en un pulmón, una adaptación para la respiración terrestre. Los Lymnaeidae y Physidae dependen en gran parte del aire que consiguen en la superficie del agua, y generalmente no pueden vivir a mucha profundidad. Sin embargo, los Planorbidae han evolucionado una branquia secundaria y además tienen hemoglobina, y por lo tanto pueden vivir en aguas con poco oxígeno. Al parecer, los caracoles pulmonados están mejor adaptados al agua con poco oxígeno (p. ej. en charcos o aguas muy contaminadas) que otros caracoles de agua dulce, generalmente restringidos a las quebradas (McMahon 1983).
Osmoregulación
La osmoregulación consiste en el mantenimiento de concentraciones específicas de sales o iones dentro del cuerpo. Los animales de agua dulce viven en un medio hipotónico, o sea, el agua tiende a entrar a su cuerpo porque las concentraciones de sales son mayores en su cuerpo que en el medio. Una manera de reducir la entrada de agua es poseer un tegumento impermeable: cutícula con cera en insectos o cutícula con carbonato de calcio en crustáceos. Sin embargo, la respiración cutánea y la respiración branqueal (branquias traqueales en el caso de insectos) requieren de superficies permeables y por las que entra un exceso de agua al cuerpo. Los animales dulceacuícolas eliminan este exceso de agua por medio de una orina muy diluida. Por ejemplo, en el caso de numerosos insectos la orina se forma en los túbulos de Malpighi (que conectan con el intestino) y muchos de los solutos esenciales son reabsorbidos en el recto, antes de salir del cuerpo. En los crustáceos decápodos estos procesos ocurren en un par de glándulas ubicadas en la base del segundo par de antenas (estas glándulas son más grandes en los decápodos dulceacuícolas que en los marinos). A pesar de la recuperación de solutos (sales o iones), el animal siempre pierde una fracción en la orina y a través de la superficie branqueal. Los solutos son reemplazados por la acción de células especializadas para la absorción de sales. Por ejemplo, Ephemeroptera y Plecoptera tienen células de cloruro en las branquias y el abdomen, mientras que estas células se encuentran en varias partes del cuerpo de chinches. Otros insectos tienen epitelio de cloruro localizado en el abdomen (Trichoptera) o dentro de la cámara rectal (Odonata: ambos subórdenes). Muchos Trichoptera y Diptera tienen extensiones (papilas), generalmente en la parte posterior del cuerpo (papilas anales, Fig. 13), las cuales no deben confundirse con branquias. Las larvas de Dytiscidae (Coleoptera) absorben iones en su intestino, y por lo tanto tienen que tomar agua y excretar mucha orina diluida. Los decápodos reemplazan las sales por absorción a través de las branquias.
El problema osmótico es más extremo en las almejas debido a la amplia superficie permeable que poseen en sus branquias y manto. En parte, ellas resuelven este problema por tener la sangre más diluida (con menos concentración de solutos) que cualquier otro animal. Además, las almejas producen una gran cantidad de orina diluida y absorben sales a través de las branquias.
Se debe notar que los problemas de osmoregulación que enfrentan los animales de agua dulce son opuestos a los enfrentados por los animales marinos. Los últimos requieren diferentes tipos de adaptaciones y por esta razón los animales dulceacuícolas usualmente no pueden tolerar un aumento en la salinidad del agua. Una discusión más detallada de osmoregulación se puede encontrar en Bradley (2009).
Importancia de los macroinvertebrados dulceacuícolas
Importancia ecológica
Los macroinvertebrados dulceacuícolas juegan papeles importantes dentro de básicamente todos los procesos ecológicos de los sistemas acuáticos. Energéticamente, las cadenas alimentarias acuáticas se basan en material autóctono producido por las algas o bien material alóctono que entra al sistema acuático desde afuera. Los macroinvertebrados son un enlace importante para poder mover esta energía a diversos niveles tróficos de las cadenas alimentarias acuáticas.
Los macroinvertebrados controlan la productividad primaria de los ecosistemas acuáticos. Ellos consumen gran cantidad de algas y otros microorganismos asociados con el perifiton en ríos o bien con el plancton en lagos. Muchas veces, este consumo aumenta la productividad primaria, ya que se elimina tejido poco productivo y se mineralizan los nutrientes (Wallace & Webster 1996, Allan & Castillo 2007). En sistemas basados en material alóctono como la hojarasca, los macroinvertebrados fragmentadores son vitales para mover esta energía a otros niveles tróficos. Los fragmentadores utilizan partículas de gran tamaño, como las hojas de árboles que caen al río y las degradan. En el proceso, generan fragmentos pequeños de materia orgánica que son accesibles a otros organismos, como los recolectores y filtradores. Al mismo tiempo, los macroinvertebrados filtradores, como las larvas de Simuliidae (los mismos que son tan fastidiosos como adultos), remueven partículas finas (seston) del agua y las convierten en partículas fecales más densas que se hunden y proveen alimento para otros invertebrados acuáticos. Estos procesos garantizan que los nutrientes presentes en las partículas no sean exportados del ecosistema y llevados por la corriente al mar (Malmqvist et al. 2004, Wotton & Malmqvist. 2001).
La deriva, o movimiento río abajo de los macroinvertebrados bénticos en la columna de agua, es un proceso sumamente común e importante en los ecosistemas lóticos (Waters 1972). Se ha encontrado que los macroinvertebrados entran en deriva por razones de comportamiento (para escapar de depredadores), dispersión (buscar nuevos sitios de alimentación) o como resultado de disturbios (crecidas del río o cambio de la calidad del agua). La cantidad de organismos en deriva puede ser alta y en sitios donde abundan los peces depredadores presentan una periodicidad fuertemente nocturna (Ramírez & Pringle 2001). Aparentemente, los insectos acuáticos compensan este movimiento con uno predominantemente opuesto, río arriba, en el estadio adulto (Hershey et al. 1993). Además, algunos estudios indican que las larvas también caminan río arriba y compensan la deriva (Humphries & Ruxton 2002). La deriva y el vuelo de los insectos adultos son importantes mecanismos en la recuperación o recolonización de los ecosistemas de ríos luego de disturbios naturales y antropogénicos.
Muchos macroinvertebrados dulceacuícolas sirven como alimento para los animales terrestres, como arañas, aves y murciélagos. Por ejemplo, la correa (Aramus guarauna) y el elanio caracolero (Rostrhamus sociabilis) dependen de ciertas especies de caracoles (Ampullariidae) en pantanos (Collett 1977). El mirlo acuático (Cinclus mexicanus) se alimenta casi exclusivamente de insectos acuáticos (Harvey & Marti 1993). En algunos sitios los adultos terrestres de los insectos acuáticos representan una proporción significativa de la biomasa de artrópodos de la zona ribereña. Estos insectos son componentes importantes en la dieta de aves y murciélagos e incluso pueden afectar su distribución (Jackson & Resh 1989, Iwata et al. 2003). Asimismo, una diversidad de artrópodos terrestres depredan los adultos de insectos acuáticos cuando salen del agua y de hecho pueden tener un efecto apreciable en las poblaciones de los mismos (Paetzold & Tockner 2005).
Importancia Económica
Algunos macroinvertebrados de agua dulce, principalmente Diptera, pueden ser plagas. Las larvas de Culicidae, Simuliidae y algunos Tabanidae viven en agua dulce, pero los adultos son terrestres y las hembras chupan la sangre de vertebrados (Fig. 76). La mayoría de estos casos solo resultan en una molestia para los seres humanos, pero el ganado a veces pierde peso cuando no puede pastar con tranquilidad por culpa de estas moscas fastidiosas.
Desde el punto de vista humano, las especies más problemáticas son las que transmiten enfermedades y sin duda el grupo que tiene mayor importancia médica es el de los zancudos o mosquitos (Culicidae). Por ejemplo, Aedes aegypti, una especie introducida a las Américas desde África hace varios siglos, es el vector principal del dengue y la fiebre amarilla (ambos son virus). Sus larvas se encuentran principalmente en aguas efímeras (latas vacías, llantas, canoas, etc.). Anopheles albimanus, una especie nativa, es el vector principal del paludismo o malaria (un protozoario) y sus larvas se encuentran en los márgenes de ríos o pantanos, donde el agua es soleada y crecen las algas verdes filamentosas. En Guatemala, Simulium ochraceum (Simuliidae) transmite un nemátodo introducido de África (Onchocerca volvulus) que causa oncocercosis (ceguera de río o enfermedad de Robles). Los simúlidos (bocones) también son vectores de protozoarios que infectan muchas especies de aves silvestres.
Varios cangrejos de la familia Pseudothelphusidae son hospederos secundarios de trematodos de pulmones, Paragonimus caliensis y P. mexicanus (Platyhelminthes: Troglotrematidae) (Blair et al. 1999). Cuando se alimentan de cangrejos crudos, el gusano puede pasar a los mamíferos; luego pasa a ciertos caracoles y finalmente a los cangrejos otra vez.
Algunas pocas especies de insectos acuáticos pueden alcanzar poblaciones tan altas (miles por metro cuadrado en el agua) que una emergencia masiva de adultos representa una molestia para los seres humanos, aunque no chupen sangre, ni muerdan. El mejor ejemplo son los “chayules” (algunos Chironomidae) que de vez en cuando salen del Río San Juan en números casi astronómicos e inundan el área con nubes de mosquitos.
Muy pocos invertebrados dulceacuícolas son plagas de cultivos puesto que hay muy pocos cultivos acuáticos. El ejemplo principal es el arroz inundado y aún en este caso la mayoría de las plagas son insectos terrestres que atacan las partes aéreas de la planta. Sin embargo, gorgojos (Curculionidae) del género Lissorhoptrus son acuáticos. Los adultos tienen setas natatorias en las tibias medias (aunque no son buenos nadadores) y se alimentan principalmente de las hojas flotando en la superficie del agua. Las larvas se alimentan de las raíces y tienen espiráculos adaptados para accesar el oxígeno dentro las raíces sumergidas. En cultivos de peces y camarones, algunos macroinvertebrados acuáticos pueden causar problemas, ya sea por competencia o por depredación, especialmente en los estanques con larvas o estadios jóvenes (p. ej. Belostomatidae de Hemiptera y varias familias de Odonata).
Por otro lado, algunos macroinvertebrados tienen una importancia económica positiva. Por ejemplo, algunas especies de camarones dulceacuícolas se cultivan para proveer alimento a los seres humanos (New & Valenti 2000). En México se utilizan los hemípteros de la familia Corixidae y en la India los Belostomatidae, como alimento. Además, varios macroinvertebrados de agua dulce se utilizan como suplemento alimenticio de mascotas (peces, tortugas y aves).
Finalmente, hay que señalar la gran importancia que tienen los macroinvertebrados acuáticos en los estudios de calidad de agua, evaluación ambiental y en el biomonitoreo acuático. Por su amplia aplicación en todo el mundo y su gran utilidad, tratamos este tema en un capítulo aparte.
Amenazas y conservación
La importancia del agua dulce como fuente de agua potable, para irrigación, recreación, etc. no requiere discusión, pero hay que destacar la importancia de los diversos organismos y procesos biogeoquímicos en mantener la cantidad y calidad de estas aguas. Por lo tanto, la conservación de estos ecosistemas es para nuestro propio bienestar. Sin embargo, la degradación continua de los ecosistemas dulceacuícolas sugiere que existe poca apreciación de los servicios ambientales proveídos por los organismos acuáticos (Arthington et al. 2010).
Las amenazas sobre los sistemas dulceacuícolas y los macroinvertebrados acuáticos han sido revisadas y resumidas por diversos estudios previos. Aspectos sobre la conservación de los ecosistemas de ríos ha sido revisada recientemente para la zonas tropicales (Moulton & Wantzen 2006, Ramírez et al. 2008) y para América Latina y el Caribe (Pringle et al. 2000). A nivel global existe una diversidad de amenazas para los macroinvertebrados acuáticos, las más importantes relacionadas con la contaminación del cuerpo de agua, la perdida y alteración de hábitat y la introducción de especies exóticas (Dudgeon et al. 2006). En Costa Rica, al igual que en el resto de Centro América, hay una gran cantidad de factores que amenazan la integridad ecológica de los ríos. Este es un problema sumamente serio que requiere una mejor cobertura de la que podamos incluir aquí. Por ello, aquí resaltamos solo algunos aspectos de la conservación de los ríos en Costa Rica.
La pérdida de diversidad es generalmente una de las principales consecuencias de los impactos antropogénicos. Relativo a ecosistemas terrestres, la perdida de la biodiversidad es más alta en los ecosistemas dulceacuícolas. un ejemplo son los caracoles, ya que aunque solo el 5% de las especies de caracoles son de agua dulce, este grupo ha sufrido el 20% de las extinciones de todos moluscos (Strong et al. 2008). En el caso de los caracoles, las causas son principalmente sobre-explotación, contaminación y destrucción del hábitat, y la invasión de especies exóticas. Es importante resaltar que no se conoce esta información para la mayoría de los macroinvertebrados acuáticos. Dentro de los insectos acuáticos, los Odonata han sido mejor evaluados por las agencias que monitorean el estado de conservación de la flora y fauna. A nivel mundial la lista roja de la UICN contiene 2 377 especies de Odonata, de las cuales 2 están extintas y 118 en la categoría más alta de peligro de extinción. Es de suponer que estos cambios en la biodiversidad acuática pueden resultar en alteraciones de los procesos ecológicos en los que estos organismos participan en los ríos (Wallace & Webster 1996).
En Costa Rica y en muchas zonas tropicales, las represas hidroeléctricas representan un problema de conservación importante. Las represas alteran la conectividad longitudinal de los ríos interfiriendo con el ciclo de vida de especies acuáticas que realizan migraciones periódicas. Muchas especies de camarones y algunas de peces son diádromas, lo que significa que al menos una de las etapas del ciclo de vida necesita de ambientes marinos. Las poblaciones de estas especies pueden extinguirse totalmente en tramos ubicados río arriba de las represas (Holmquist et al. 1998). Además de ser barreras migratorias, las represas hidroeléctricas pueden tener otros impactos negativos sobre la fauna de agua dulce. Por un lado, la liberación de los sedimentos que se acumulan en los embalses puede tener efectos adversos sobre los macroinvertebrados, tales como una menor visibilidad para los depredadores, dificultades en la respiración y obstrucción de las estructuras filtradoras, entre otros. Por otro lado, la reducción del caudal y la eliminación de sus fluctuaciones naturales perjudican las especies que habitan en el tramo río-abajo de la represa. En Costa Rica y en muchos otros países de la región hay un aumento significativo de represas hidroeléctricas en los ríos y los efectos han sido señalados por varios autores (Anderson et al. 2006).
La introducción de especies exóticas (especies no nativas) de invertebrados dulceacuícolas es otro problema importante de conservación (Gherardi 2007, Strayer 2010). Las especies exóticas pueden tener consecuencias dramáticas en los ecosistemas acuáticos. A pesar de ello, este problema ha pasado casi desapercibido y la mayoría de las personas no están conscientes de su importancia. Por ejemplo, las cigalas o langostas de agua dulce (Crustacea: Decapoda) son nativas de las zona templadas del hemisferio norte y sur, y algunas especies introducidas están causando problemas en muchas partes del mundo. Una de éstas es Procambarus clarkii (Cambaridae), que es nativa del sureste de los Estados unidos y del noreste de México. Es el famoso “crawfish” en la gastronomía “Cajun” de Louisiana y tiene un gran valor económico en la acuicultura. Por esta razón P. clarkii ha sido introducida en muchas partes del mundo, incluida Costa Rica. En algunos países está causando serios problemas; por ejemplo en España y México está desplazando especies nativas de cigalas. Su comportamiento excavador también se asocia con daños en las riberas de los ríos y en plantaciones de arroz inundado. Además, sus hábitos alimentarios (es muy omnívoro) pueden alterar los ecosistemas nativos. Otro ejemplo es el caracol de Asia, Melanoides tuberculatus (Thiaridae), el cual ha sido introducido en Costa Rica. Existe la posibilidad que esta especie exótica desplace algunas especies nativas de caracoles (p. ej. Hemisinus), como ha hecho en otras regiones.
Principales grupos de macroinvertebrados dulceacuícolas
A continuación presentamos una lista taxonómica con los principales grupos de invertebrados que incluyen especies de agua dulce (Figs. 1-3). La lista no incluye algunos grupos (Tardigrada, Gastrotricha, Rotifera, etc.), que por su tamaño microscópico o hábitat no aparecen habitualmente en las muestras de macroinvertebrados acuáticos. Es importante mencionar que en éstas muestras frecuentemente se encuentran individuos de grupos terrestres o de grupos que viven asociados a las orillas de los ambientes acuáticos. En ciertos hábitats (p. ej. en la orilla o en ambientes con abundante vegetación acuática emergente) y con determinados tipos de muestreo (p. ej. red de deriva) se capturan más organismos terrestres.
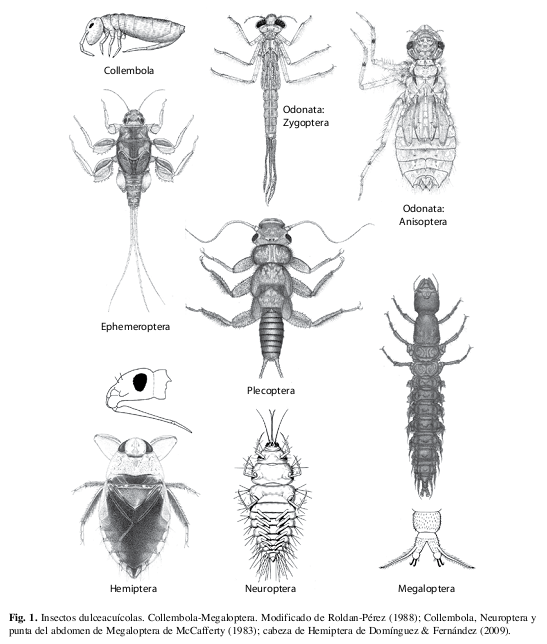
Filo Arthropoda: Subfilo Hexapoda
(Figs. 1, 2)
Aunque los insectos representan el grupo más abundante y diverso de macroinvertebrados dulceacuícolas, es un grupo principalmente terrestre; menos del 5% de todas las especies se pueden considerar acuáticas. En contraste con los crustáceos y moluscos, existen muy pocas especies de insectos que se pueden considerar marinas (Springer 2009). En la mayoría de insectos dulceacuícolas, únicamente los estadios inmaduros son acuáticos, con la excepción de Collembola, Hemiptera y Coleoptera donde, en su mayoría, los adultos también son acuáticos. El estado del conocimiento de los insectos acuáticos de Costa Rica fue revisado recientemente por Springer (2008).
Actualmente, en el filo Hexapoda hay cuatro clases de insectos: Collembola, Protura, Diplura e Insecta, de las cuales solamente la primera y última contienen organismos acuáticos. En la clase Insecta, 12 de los 28 órdenes tienen representantes acuáticos, sin incluir Orthoptera, que tiene algunas pocas especies semi-acuáticas (Amédégnato & Devriese 2008). Hay cinco órdenes en los cuales prácticamente la totalidad de las especies son acuáticas (Ephemeroptera, Odonata, Plecoptera, Megaloptera y Trichoptera), mientras que en los demás únicamente algunas familias se encuentran asociadas al ambiente acuático, ya que la mayoría de sus especies son terrestres. Los órdenes de la clase Insecta incluyen tanto insectos hemimetábolos (de desarrollo directo, con metamorfosis incompleta, pasando por los estadios de huevo, ninfa y adulto), como holometábolos (de desarrollo indirecto, con metamorfosis completa, pasando por huevo, larva, pupa y adulto).
Clase Collembola
Ametábolos (sin metamorfosis). La gran mayoría de los colémbolos son terrestres pero existen algunas especies con adaptaciones para vivir en la superficie del agua (Figs. 60, 61). Al parecer, ninguna especie está adaptada para vivir dentro del agua, aunque algunas pueden sobrevivir sumergidos por más de un día. Los colémbolos son de tamaño pequeño (usualmente <5mm) y poseen a menudo una estructura al final del abdomen (“fúrcula”) que sirve para brincar. El alimento de las especies acuáticas es poco conocido, pero es probable que se alimenten de materia vegetal muerta y sus microbios asociados.
Clase Insecta: Orden Ephemeroptera
Hemimetábolos. Todos son acuáticos en sus etapas inmaduras, en Costa Rica hay 10 familias y se reconocen por tener tres (a veces dos) filamentos terminales y branquias abdominales (Figs. 24, 25). Se encuentran en casi todos los ambientes de agua dulce, pero son más abundantes y diversos en los fondos rocosos de los ríos. Muchas especies son recolectoras y se alimentan de una variedad de algas unicelulares y detritus; algunas especies son excavadoras en el fondo.
Clase Insecta: Orden Odonata
Hemimetábolos. Todos son acuáticos en sus etapas inmaduras y en Costa Rica hay 14 familias. Las ninfas (Figs. 27-30) son depredadores y se reconocen por tener un labio altamente modificado para atrapar presas, el cual es fácil de observar debajo de la cabeza (Fig. 28); este labio permanece doblado en reposo pero se extiende rápidamente hacia delante cuando la ninfa tiene una presa en frente. La mayoría vive sobre el fondo o la vegetación sumergida.
Clase Insecta: Orden Plecoptera
Hemimetábolos. Todos son acuáticos en sus etapas inmaduras, en Costa Rica y Centroamérica hay una sola familia (Perlidae), aunque existen 16 familias a nivel mundial. Se reconocen por tener dos cercos terminales y branquias torácicas (Fig. 26). En Costa Rica se encuentran casi exclusivamente en aguas con corriente, donde son depredadores, por lo menos en las últimas etapas ninfales.
Clase Insecta: Orden Blattaria
Hemimetábolos. Aunque las cucarachas son terrestres, hay al menos una especie en Costa Rica y la región neotropical (Fig. 31), que se encuentra frecuentemente asociada a materia orgánica en descomposición (hojarasca) en zonas de corriente en ríos y quebradas de aguas limpias. También hay muchas especies de cucarachas (semiacuáticas o terrestres) que viven asociadas con ambientes de fitotelmata, especialmente los tanques de bromelias.
Clase Insecta: Orden Hemiptera
Hemimetábolos. Este orden incluye los chinches (suborden Heteroptera) y los homópteros (subórdenes Auchenorrhyncha y Sternorrhyncha). Los homópteros incluyen algunas pocas especies facultativamente acuáticas o semiacuáticas, mientras que los chinches (Figs. 32, 33) incluyen 7 familias acuáticas y 8 familias semiacuáticas (incluyendo los patinadores), de las casi 60 familias presentes en Costa Rica. Los hemípteros se reconocen por las piezas bucales en forma de proboscis (“pico”), siendo la gran mayoría de las especies acuáticas depredadores y muchas de ellas capaces de picar muy doloroso.
Clase Insecta: Orden Megaloptera
Holometábolos. Todos son acuáticos en sus etapas larvales, las cuales son similares a ciertas larvas de Coleoptera (ver la clave y Fig. 1). Es un orden pequeño con solo dos familias. Los Corydalidae (Fig. 41) son grandes y viven principalmente en aguas con corriente mientras que los Sialidae (una familia menos común) son más pequeños y habitan en varios tipos de agua con sedimentos blandos. Las larvas de ambas familias son depredadoras y las pupas son terrestres.
Clase Insecta: Orden Neuroptera
Holometábolos. Es un orden principalmente terrestre y de las 10 familias presentes en Costa Rica, solamente Sisyridae es acuática. Las larvas de esta familia se alimentan exclusivamente de esponjas (y posiblemente Bryozoa) de agua dulce (Fig. 62). La pupa y el adulto son terrestres.
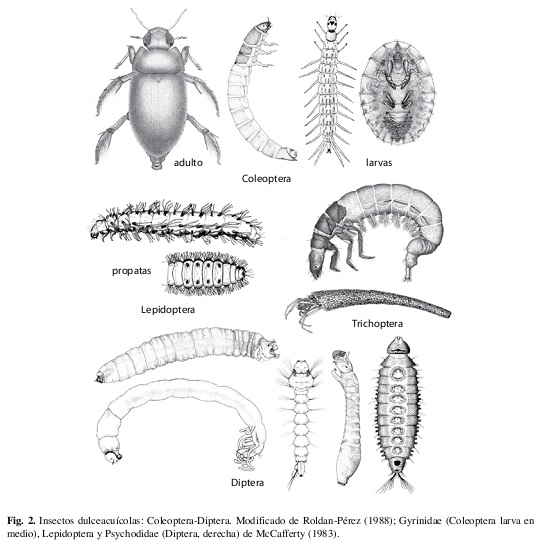
Clase Insecta: Orden Coleoptera
Holometábolos. Hay más de 100 familias de escarabajos en Costa Rica y alrededor de 15 de éstas son principalmente acuáticas, aunque Hydrophilidae (Fig. 35) y Ptilodactylidae tienen también muchas especies terrestres. Algunas otras familias, principalmente terrestres, tienen muy pocas especies acuáticas (p. ej. Curculionidae y Chrysomelidae) o tienen algunas especies semiacuáticas (p. ej. Staphylinidae, Fig. 36). En la mayoría de los casos tanto las larvas como los adultos son acuáticos, pero en Psephenidae y Ptilodactylidae solo las larvas son acuáticas (Figs. 37, 38), mientras que en Dryopidae solo los adultos son acuáticos. Las pupas generalmente son terrestres (excepto en Noteridae). Los escarabajos acuáticos habitan en casi todos tipos de agua dulce, su biología es muy diversa y las larvas son muy variables en su morfología (Figs. 37-40).
Clase Insecta: Orden Hymenoptera
Holometábolos. Casi todos los himenópteros son terrestres pero algunas pocas avispitas (en al menos 7 familias) son parasitoides de insectos acuáticos, por ejemplo, de huevos de libélulas o chinches, o de pupas de escarabajos o moscas (Psychodidae). En algunos casos la hembra entra al agua para poner su huevo en el hospedero. Estas avispas son muy escasas en las muestras acuáticas y la mejor manera de recolectarlas es criando los hospederos.
Clase Insecta: Orden Trichoptera
Holometábolos. Todos son acuáticos en sus etapas inmaduras (larva y pupa) y en Costa Rica hay 15 familias. Este orden es el grupo hermano de Lepidoptera y las larvas son similares (Figs. 43, 44), pero en vez de propatas a lo largo del abdomen, los tricópteros tienen un solo par de propatas al final del abdomen (con una sola uña). Viven en muchos tipos de agua dulce y su biología es diversa. Muchas larvas usan seda para armar casitas de piedras (Figs. 14, 46), material vegetal (Fig. 45) y hasta de conchas de caracoles; otros construyen una red de seda para filtrar el agua (Fig. 12) y algunos no construyen ni casita ni red.
Clase Insecta: Orden Lepidoptera
Holometábolos. Casi todos los lepidópteros son terrestres y las únicas especies con larvas y pupas acuáticas son los miembros de la subfamilia Nymphulinae (Crambidae). Las larvas de esta subfamilia (Fig. 42) viven en casitas en plantas acuáticas o sobre rocas en áreas de corriente, donde construyen túneles de tela (Fig. 11) y se alimentan de algas; algunas respiran del aire y otras tienen branquias.
Clase Insecta: Orden Diptera
Holometábolos. Aunque es principalmente terrestre, este orden contiene más especies dulceacuícolas que cualquier otro grupo de macroinvertebrados (sobre todo en la familia Chironomidae). Hay alrededor de 100 familias de moscas en Costa Rica, de las cuales aproximadamente 20 tienen especies acuáticas; más o menos la mitad de estas familias contienen exclusivamente (o casi exclusivamente) especies acuáticas mientras que la otra mitad incluyen especies acuáticas y terrestres. Las larvas y a menudo las pupas también son estadios acuáticos. Los dípteros acuáticos habitan en más tipos de agua que cualquier otro grupo de insectos, su biología es sumamente diversa y las larvas son muy variables en su morfología, aunque nunca poseen patas verdaderas (articuladas) en el tórax (Figs. 47-50).
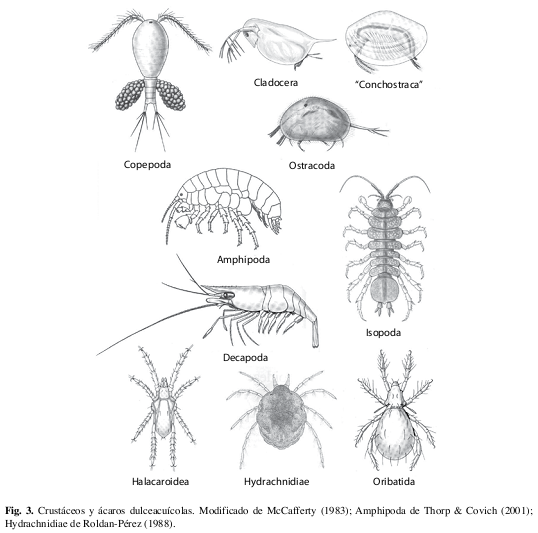
Filo Arthropoda: Subfilo Crustacea (Fig. 3)
Los crustáceos son principalmente marinos (más del 90% de las especies), pero existen varias especies dulceacuícolas y muy pocas terrestres; de las seis clases, cuatro se presentan en agua dulce (las otras dos son pequeñas y exclusivamente marinas). En contraste con los insectos, los crustáceos tienen un número variable de patas (dependiendo del grupo) y tienen dos pares de antenas, aunque un par puede ser muy reducido. A continuación presentamos los principales grupos que se encuentran en agua dulce; hay algunos otros que son menos comunes (p. ej. Mysida).
Clase Branchiopoda
Casi todos los miembros de este grupo son restringidos a las aguas continentales y por conveniencia se dividen en dos grupos ecológicos: los “branquiópodos grandes” (Brendonck et al. 2008) y los Cladocera (Forró et al. 2008). Miembros del primer grupo viven principalmente en charcos efímeros e incluye tres grupos: los Anostraca, que generalmente miden de 7 a 20mm (a veces más) y se parecen a un camarón alargado; los Notostraca, que miden de 10 a 50mm y tienen el cuerpo aplanado dorsalventralmente, con la parte anterior cubierta por un caparazón en forma de escudo; y los “camarones almejas” (antes clasificados en “Conchostraca”) que se pueden confundir con Ostracoda o almejas pequeñas (ver la clave y Fig. 3). Los Cladocera usualmente miden de 0.2 a 6mm (Fig. 57) y se encuentran en varios tipos de agua dulce, especialmente lagunas, donde se alimentan como filtradores.
Clase Maxillopoda: Subclase Branchiura
Todos los miembros de este grupo son ectoparásitos, principalmente de peces (a veces de anfibios o invertebrados) y 90% de las especies están restringidas al agua dulce. Miden de 5 a 30mm de longitud, el cuerpo es aplanado, tienen 4 pares de patas y son móviles en el hospedero. El grupo es especialmente diverso en la región neotropical (Poly 2008).
Clase Maxillopoda: Subclase Copepoda
Los copépodos representan uno de los grupos más diversos de crustáceos y aunque la mayoría son marinos, aproximadamente 20% de las especies viven en agua dulce (Boxshall & Defaye 2008). Son microcrustáceos (usualmente <3mm) con un cuerpo cilíndrico, más ancho en frente que atrás y con 5 pares de patas natatorias (Fig. 56). Los copépodos viven como plancton o en el fondo del agua y sus hábitos alimenticios son muy variables según la especie: filtradores, depredadores o parásitos de peces (a veces de moluscos).
Clase Ostracoda
Aproximadamente un tercio de las especies de ostrácodos son dulceacuícolas (Martens et al. 2008). Son microcrustáceos (usualmente <3mm) con un caparazón de dos valvas, como una almeja miniatura, similar a los “camarones almejas” (Branchiopoda; ver la clave y fig. 3). El primer par de antenas están modificado para excavar, trepar o nadar. La myoría de las especies viven en el fondo del agua y muchas son filtradoras.
Clase Malacostraca: Orden Amphipoda
Alrededor del 20% de los anfípodos viven en agua dulce pero son menos comunes en las regiones tropicales; casi la mitad de las especies dulceacuícolas habitan en aguas subterráneas (Väinölä et al. 2008). La mayoría de las especies miden de 5 a 20mm (Fig. 54); similar a los isópodos, la hembra incuba los embriones y no existen etapas larvarias independientes. Los anfípodos generalmente viven en el fondo del agua o en la vegetación acuática y pueden ser herbívoros, detritívoros, depredadores u omnívoros.
Clase Malacostraca: Orden Isopoda
Aproximadamente 10% de las especies isópodos son dulceacuícolas (Wilson 2008). Generalmente son de 5 a 20mm de largo y el cuerpo puede ser aplanado (Fig. 3) o delgado y alargado (Fig. 55). Como sucede en los anfípodos, la hembra incuba los embriones y no existen etapas larvarias independientes. El alimento varia entre especies, pero muchos se alimentan de hojarasca sumergida como fragmentadores y tienen bacterias endo-simbiontes que les ayuda en la digestión.
Clase Malacostraca: Orden Decapoda
Casi 10% de las especies de decápodos viven en agua dulce e incluyen camarones (Caridea) (De Grave et al. 2008), cangrejos (Brachyura) (Yeo et al. 2008) y una especie introducida de langosta (Astacidea; ver en “Amenazas y Conservación”). Entre los camarones, los Atyidae tienen los primeros dos pares de patas modificadas para filtrar alimento del medio mientras que los Palaemonidae (Fig. 53) son más variables en su comportamiento alimenticio. Los cangrejos son nocturnos y principalmente omnívoros. Muchas especies de camarones tienen una etapa larval acortada que les permite completar su ciclo de vida en agua dulce, pero otras especies tienen que pasar parte del ciclo larval en aguas salobres, por lo que realizan migraciones a lo largo del cauce de los ríos. Los cangrejos dulceacuícolas verdaderos (Pseudothelphusidae, Figs. 51, 52, y Trichodactylidae) tienen huevos grandes que eclosionan directamente en cangrejos pequeños (o sea, no existe una larva), pero hay otras familias que son principalmente marinas, donde algunas especies pueden vivir en agua dulce tienen una etapa larval marina.
Filo Arthropoda: Subfilo Chelicerata, Clase Arachnida
(Fig. 3)
El subfilo Chelicerata incluye tres clases, dos exclusivamente marinas y Arachnida, que es principalmente terrestre y abarca más del 99% de todas las especies queliceradas. En la clase Arachnida, algunas son semiacuáticas, sobre todo las arañas pescadoras (Pisauridae: Dolomedes spp.) que pueden bucear y quedar sumergidas por varios minutos. Sin embargo, sólo los ácaros (subclase Acari) incluyen un gran número de especies acuáticas (Figs. 58, 59). A continuación se presentan los grupos principales de ácaros dulceacuícolas, aunque existen algunos otros (Walter & Proctor 1999). La etapa larval de los ácaros tiene seis patas mientras que las ninfas y adultos tienen ocho; se pueden distinguir los ácaros con seis patas de los insectos por su cuerpo redondeado y ausencia de antenas.
Orden Trombidiformes (Suborden Prostigmata): Superfamilia Halacaroidea
La mayoría de los Halacaroidea son marinos y las especies dulceacuícolas son derivadas de éstas. Son muy pequeños (<1mm), tienen dos patas dirigidas hacia adelante y dos hacia atrás. Viven en el fondo (bentos), no son capaces de nadar y la mayoría son depredadores o carroñeros, aunque algunos se alimentan de algas (Bartsch 2008).
Orden Trombidiformes (Suborden Prostigmata): Subcohorte Hydrachnidiae
Hydrachnidiae (también conocidos como Hidracarina o Hydrachnida) es el grupo más diverso de ácaros dulceacuícolas y se encuentran en una gran diversidad de ambientes acuáticos (Di Sabatino et al. 2008). Por lo general, miden de 0.5 a 1.5mm y a menudo tienen colores brillantes, que es una advertencia de su sabor desagradable, al menos para los peces (Walter & Proctor 1999). Como sucede en otros miembros del cohorte Parasitengonina (que incluye por ejemplo las coloradillas), los Hydrachnidiae tienen un ciclo de vida complejo: una larva ectoparásita en adultos de insectos acuáticos (que salen del agua), seguido (de nuevo en el agua) por una etapa ninfal latente, una etapa ninfal depredadora, otra etapa ninfal latente y un adulto depredador.
Orden Sarcoptiformes: Suborden Oribatida
Los oribátidos son principalmente terrestres y menos del 1% de las especies son acuáticas; aunque no existen tantas especies en agua dulce (comparado con el grupo anterior) pueden ser muy abundantes (Schatz & BehanPelletier 2008). Tienen un tamaño similar al grupo anterior y se distinguen por el cuerpo más duro (más esclerotizado, como un escarabajo); se alimentan principalmente de materia vegetal en descomposición y hongos.
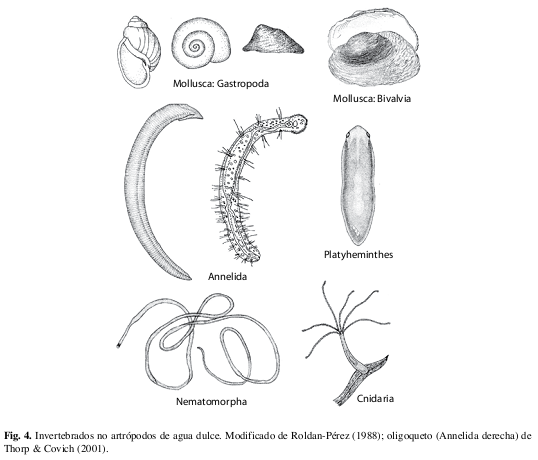
Filo Mollusca (Fig. 4)
Este filo es muy diverso, de las siete clases cinco son exclusivamente marinas; sólo los caracoles y las almejas incluyen especies dulceacuícolas. Una de las características de los moluscos es una concha de carbonato de calcio, por lo que requieren aguas relativamente alcalinas.
Clase Gastropoda
La mayoría de los caracoles son marinos, pero hay varias especies terrestres y aproximadamente 5% viven en agua dulce (Strong et al. 2008). Muchos son raspadores que se alimentan de algas unicelulares (perifiton) y/o bacterias adheridas a los sustratos, pero algunos (Ampulariidae) son macroherbívoros. Varían en tamaño desde 2 hasta 70mm (Figs. 65-67) y existen dos grupos principales. Los prosobranquios (Neritomorpha y Caenogastropoda) generalmente son grandes, con conchas relativamente gruesas, tienen branquias y a menudo requieren agua con ciertas propiedades físico-químicas. Mientras que los caracoles pulmonados (Heterobranchia) generalmente tienen conchas más pequeñas y delgadas, y en vez de branquias su cavidad de manto funciona como un pulmón para respirar aire; por lo general, ellos pueden tolerar una variedad de condiciones ambientales. Algunos miembros del último grupo (tribu Ancylini, “lapas”) tienen una concha en forma de copa en vez de una concha espiral (Fig. 4).
Clase Bivalvia
Las almejas son principalmente marinas; solo el 16% de las especies habitan en agua dulce (Bogan 2008). Éstas varían en tamaño de 2 a 180mm y su color puede ser pardo claro, verde, cobrizo o negro (Figs. 63, 64). Viven enterrados en el sustrato o fijados a la vegetación acuática. Las almejas utilizan sus branquias no solamente para su respiración, sino también para filtrar fitoplancton y detritus del agua; son más abundantes en aguas no contaminadas. En contraste con las especies marinas, la mayoría de las almejas dulceacuícolas han eliminado una etapa planctónica de su ciclo de vida, que sería especialmente problemático en aguas con corriente. Por lo general incuban los huevos entre las branquias; algunas (p. ej. Sphaeriidae) liberan almejas miniaturas, mientras que otras (unionida) liberan larvas que parasitan las branquias de peces (antes de pasar a la etapa adulta).
Filo Annelida (Fig. 4)
La clasificación tradicional de los anélidos en tres grupos (poliquetos, oligoquetos y sanguijuelas; Figs. 68-70) no se mantiene con los análisis filogenéticos recientes (Zrzavý et al. 2009). Los oligoquetos representan un grupo parafilético, aunque junto con las sanguijuelas forman un grupo monofilético, la clase Clitellata, que incluye la gran mayoría de los anélidos dulceacuícolas y terrestres. Los poliquetos, otro grupo parafilético, son principalmente marinos aunque incluyen algunas pocas especies dulceacuícolas (<2% de las especies en total), las cuales son muy escasas (Glasby & Timm 2008). La mayoría de los oligoquetos son terrestres (lombrices de tierra), pero 22% de las especies viven en agua dulce y algunas pocas son marinas (Martin et al. 2008). Las especies dulceacuícolas generalmente son pequeñas (1mm hasta algunos centímetros) y detritívoras en los sedimentos del fondo. Aproximadamente un 70% de las especies de sanguijuelas viven en agua dulce y las demás son marinas o terrestres (Sket & Trontelj 2008); son ectoparásitas o depredadoras de otros animales.
Filo Platyhelminthes (Fig. 4)
Los gusanos planos tradicionalmente se han clasificado en cuatro grupos: los turbelarios, los tremátodos, los monogeneos y las solitarias. Los últimos tres, ahora unidos en el grupo Neodermata, son parásitos de otros animales, incluso algunos de agua dulce. Los turbelarios (un grupo parafilético) son principalmente depredadores, aunque también se alimentan de animales muertos y de algas. Viven en el fondo del agua, debajo de las piedras, hojas, en los espacios intersticiales, etc. Existen varios grupos de turbelarios en el agua dulce, pero el grupo principal es el orden Tricladida. Las especies más grandes (1-5cm) de este orden, conocidas como “planarias”, han sido mejor estudiadas que los turbelarios pequeños (algunos milímetros) puesto que la identificación de los últimos es más fácil con especímenes vivos (Schockaert et al. 2008).
Filo Nemertea
Nemertea es un filo pequeño, principalmente marino, pero con algunas especies terrestres y algunas (2%) dulceacuícolas (Sundberg & Gibson 2008). Son similares a los Platyhelmintes pero son más alargados y tienen una proboscis eversible que usan para capturar presas; se encuentran principalmente en el fondo (bentos) de lagunas.
Filo Nematomorpha (Fig. 4)
Aunque existen algunas especies marinas, la gran mayoría de especies de Nematomorpha son dulceacuícolas (Poinar 2008). Los gusanos adultos son muy delgados y alargados (de varios centímetros hasta un metro), como un pelo de caballo. Las larvas son parásitos de varios artrópodos o de sanguijuelas, con la mayoría de los registros de Orthoptera y adultos de Coleoptera. En muchos casos el hospedero es terrestre, pero un hospedero infectado aparentemente busca el agua, donde salen los adultos para aparearse y poner huevos.
Filo Nematoda
Este es uno de los filos más diversos de animales, con un gran número de especies desconocidas para la ciencia. Los nemátodos habitan en todos los ecosistemas de la tierra, desde el mar y el suelo hasta los cuerpos de otros animales; algunos viven en habitats extremos, por ejemplo en sitios muy calientes, ácidos o anóxicos (con poco oxígeno). Alrededor del 40% de las familias y 7% de las especies descritas se presentan en agua dulce, y más de la mitad de estas especies pertenecen a la subclase Dorylaimia (Abebe et al. 2008). La mayoría son pequeños (0.2-2mm) y frecuentemente son los animales más abundantes en los sedimentos. Aunque su morfología externa es sencilla, los nemátodos son muy diversos en cuanto a su biología e incluyen herbívoros, fungívoros, bacterívoros, detritívoros, depredadores y parásitos o parasitoides de otros animales dulceacuícolas.
Filo Cnidaria (Fig. 4)
Este filo incluye las medusas, anémonas y corales. La gran mayoría son marinos y solo 0.3% de las especies viven en agua dulce (Jankowski et al. 2008). El único cnidario de agua dulce conocido de Costa Rica es Hydra viridissima, un pólipo verde; cuyo color proviene de las algas simbiontes (Chlorella) presentes en las células de la gastrodermis.
Filo Porifera
Las esponjas representan el filo más ancestral del reino animal y la gran mayoría son marinas, con solo 1.5% de las especies en agua dulce (Fig. 62). Sin embargo, la región neotropical tiene una mayor riqueza de especies dulceacuícolas que cualquier otra región (Manconi & Pronzato 2008). Las esponjas en general pueden tolerar condiciones físico-químicas extremas; son filtradoras sésiles y a menudo albergan una diversidad de invertebrados.
Clave para los grupos principales de macroinvertebrados dulceacuícolas.
Clave para los grupos principales de Haxapoda dulceacuícola.

Referencias
Abebe, E., W. Decraemer & P. De Ley. 2008. Global diversity of nematodes (Nematoda) in freshwater. Hydrobiologia 595: 67-78. [ Links ]
Allan, J.D. & M.M. Castillo. 2007. Stream Ecology: structure and function of running waters. Springer, Holanda. [ Links ]
Amédégnato, C. & H. Devriese. 2008. Global diversity of true and pygmy grasshoppers (Acridomorpha, Orthoptera) in freshwater. Hydrobiologia 595: 535-543. [ Links ]
Anderson, E.P., C.M. Pringle & M. Rojas. 2006. Transforming tropical rivers: an environmental perspective on hydropower development in Costa Rica. Aquat. Conserv. 16: 679-693. [ Links ]
Arthington, A.H., R.J. Naiman, M.E. McClain & C. Nilsson. 2010. Preserving the biodiversity and ecological services of rivers: new challenges and research opportunities. Freshwater Biol. 55: 1-16. [ Links ]
Bachmann, A.O. & S.A. Mazzucconi. 2009. Clave de órdenes de Insecta con representantes acuáticos, p. 47-54. In E. Domínguez & H.R. Fernández (eds.). Macroinvertebrados bentónicos sudamericanos. Sistemática y biología. Fundación Miguel Lillo, Tucumán, Argentina. [ Links ]
Bartsch, I. 2008. Global diversity of halacarid mites (Halacaridae: Acari: Arachnida) in freshwater. Hydrobiologia 595: 317-322. [ Links ]
Blair, D., Z.B. Xu & T. Agatsuna. 1999. Paragonimiasis and the genus Paragonimus. Adv. Parasit. 42: 113-222. [ Links ]
Bogan, A.E. 2008. Global diversity of freshwater mussels (Mollusca, Bivalvia) in freshwater. Hydrobiologia 595: 139-147. [ Links ]
Boxshall, G.A. & D. Defaye 2008. Global diversity of copepods (Crustacea: Copepoda) in freshwater. Hydrobiologia 595: 195-207. [ Links ]
Bradley, T.J. 2009. Animal Osmoregulation. Oxford university, Oxford, Inglaterra. [ Links ]
Brendonck, L., D.C. Rogers, J. Olesen, S. Weeks & W.R. Hoeh. 2008. Global diversity of large branchiopods (Crustacea: Branchiopoda) in freshwater. Hydrobiologia 198: 167-176. [ Links ]
Bush, J.W.M. & D.L. Hu. 2006. Walking on water: Biolocomotion at the interface. Ann. Rev. Fluid. Mech. 38: 339-369. [ Links ]
Collett, S.F. 1977. Sizes of snails eaten by snail kites and limpkins in a Costa Rican marsh. Auk 94: 365-367. [ Links ]
Cranston, P.S. & H.V. Daly. 2008. General classification and key to the orders of aquatic and semiaquatic insects, p 157164. In R.W. Merritt, K.W. Cummings & M.B. Berg (eds.). An introduction to the aquatic insects of North America. Kendall/Hunt, Dubuque, EEUU. [ Links ]
De Grave, S., Y. Cai & A. Anker. 2008. Global diversity of shrimps (Crustacea: Decapoda: Caridea) in freshwater. Hydrobiologia 595: 287-293. [ Links ]
Di Sabatino, A., H. Smit, R. Gerecke, T. Goldschmidt, N. Matsumoto & B. Cicolani. 2008. Global diversity of water mites (Acari, Hydrachnidia; Arachnida) in freshwater. Hydrobiologia 595: 303-315. [ Links ]
Domínguez, E. & H.R. Fernández (eds.). 2009. Macroinvertebrados bentónicos sudamericanos. Fundación Miguel Lillo, Tucumán, Argentina. [ Links ]
Dudgeon, D. 2006. Freshwater biodiversity: importance, threats, status and conservation challenges. Biol. Rev. Camb. Philos. 81: 163-182. [ Links ]
Forró, L., N.M. Korovchinsky, A.A. Kotov & A. Petrusek. 2008. Global diversity of cladocerans (Cladocera; Crustacea) in freshwater. Hydrobiologia 595: 177-184. [ Links ]
Gherardi, F. 2007. Biological invaders in inland waters: Profiles, distribution, and threats. Springer, Stuttgart, Alemania. [ Links ]
Gibert, J. & D.C. Culver. 2009. Assessing and conserving groundwater biodiversity: an introduction. Freshwater Biol. 54: 639-648. [ Links ]
Glasby, C.J. & T. Timm. 2008. Global diversity of polychaetes (Polychaeta; Annelida) in freshwater. Hydrobiologia 595: 107-115. [ Links ]
Greeney, H.F. 2001. The insects of plant-held waters: a review and bibliography. J. Trop. Ecol. 17: 241-260. [ Links ]
Goldschmidt, T. 2004. Environmental parameters determining water mite assemblages in Costa Rica. Exper. Appl. Acarol. 34: 171-197. [ Links ]
Harvey, B.C. & C.D. Marti. 1993. The impact of dipper, Cinclus mexicanus, predation on stream benthos. Oikos 68: 431-436. [ Links ]
Hershey, A.E., J. Pastor, B.J. Peterson & G.W. Kling. 1993. Stable isotopes resolve the drift paradox for Baetis mayflies in an arctic river. Ecology 74: 2315-2325. [ Links ]
Holmquist, J.G., J.M. Schmidt-Gengenbach & B.B. Yoshioka. 1998. High dams and marine-freshwater linkages: effects on native and introduced fauna in the Caribbean. Conserv. Biol. 12: 621-630. [ Links ]
Humphries, S. & G.D. Ruxton. 2002. Is there really a drift paradox? J. Anim. Ecol. 71: 151-154. [ Links ]
Iwata, T., S. Nakano & M. Murakami. 2003. Stream meanders increases insectivorous bird abundance in riparian deciduous forests. Ecogeography 26: 325-337. [ Links ]
Jackson, J.K. & V.H. Resh. 1989. Distribution and abundance of adult aquatic insects in the forest adjacent to a northern California stream. Environ. Entomol. 18: 278-283. [ Links ]
Jankowski, T., A.G. Collins & R. Campbell. 2008. Global diversity of inland water cnidarians. Hydrobiologia 595: 35-40. [ Links ]
Kitching, R.L. 2000. Food webs and container habitats: the natural history and ecology of phytotelmata. Cambridge University, Cambridge, Inglaterra. [ Links ]
Malmqvist, B., P.H. Adler, K. Kuusela, R.W. Merritt & R.S. Wooton. 2004. Black flies in the boreal biome, key organisms in both terrestrial and aquatic environments: a review. Ecoscience 11: 187-200. [ Links ]
Manconi, R. & R. Pronzato. 2008. Global diversity of sponges (Porifera: Spongillina) in freshwater. Hydrobiologia 595: 27-33. [ Links ]
Martens, K., I. Schön, C. Meisch & D.J. Horne. 2008. Global diversity of ostracods (Ostracoda, Crustacea) in freshwater. Hydrobiologia 595: 185-193. [ Links ]
Martin, P., E. Martinez-Ansemil, A. Pinder, T. Timm & M.J. Wetzel. 2008. Global diversity of oligochaetous clitellates (“Oligochaeta”; Clitellata) in freshwater. Hydrobiologia 198: 117-127. [ Links ]
McCafferty, W.P. 1983. Aquatic entomology. Jones and Barlett, Toronto, Canada. [ Links ]
McMahon, R.F. 1983. Physiological ecology of freshwater pulmonates, p. 359-430. In W.D. Russell-Hunter (ed.). The Mollusca. Vol. 6: Ecology. Academic, Orlando, Florida. [ Links ]
Merritt, R.W., K.W. Cummins & M.B. Berg (eds.). 2008. An introduction to the aquatic insects of North America. Kendall/Hunt, Dubuque, Iowa. [ Links ]
Moulton, T.P. & K.M. Wantzen. 2006. Conservation of tropical streams special questions or conventional paradigms? Aquat. Conserv. 16: 659-663. [ Links ]
New, M.B. & W.C. Valenti (eds.). 2000 Freshwater prawn culture: The farming of Macrobrachium rosenbergii. Blackwell Science, Oxford, Inglaterra. [ Links ]
Paetzold, A. & K. Tockner. 2005. Effects of riparian arthropod predation on the biomass and abundance of aquatic insect emergence. J. N. Am. Benthol. Soc. 24: 395-402. [ Links ]
Poinar, G. 2008. Global diversity of hairworms (Nematomorpha: Gordiaceae) in freshwater. Hydrobiologia 595: 79-83. [ Links ]
Poly, W.J. 2008. Global diversity of fishlice (Crustacea: Branchiura: Argulidae) in freshwater. Hydrobiologia 595: 209-212. [ Links ]
Pringle, C.M., F.N. Scatena, P. Paaby-Hansen & M. Nuñez-Ferrera. 2000. River conservation in Latin America and the Caribbean, p 39-75. In P.J. Boon & G.E. Petts (eds.). Global perspectives on river conservation: science, policy and practice, John Wiley and Sons, Nueva York, EEUU. [ Links ]
Pritchard, G. 1991. Insects in thermal springs. Mem. Entomol. Soc. Can. 155: 89-106. [ Links ]
Pritchard, G. 1996. The life history of a tropical dragonfly: Cora marina (Odonata: Polythoridae) in Guanacaste, Costa Rica. J. Trop. Ecol. 12: 573-581. [ Links ]
Ramírez, A. & C.M. Pringle. 2001. Spatial and temporal patterns of invertebrate drift in streams draining a Neotropical landscape. Freshwater Biol. 46: 47-62. [ Links ]
Ramírez, A., C.M. Pringle & K.M. Wantzen. 2008. Tropical river conservation, p 285-304. In D. Dudgeon (ed.). Tropical stream ecology. Academic, Nueva York, EEUU. [ Links ]
Resh, V. & D. Rosenberg (eds.). 1984. The ecology of aquatic insects. Praeger, Nueva York, EEUU. [ Links ]
Roldán-Pérez, G. 1988. Guía para el estudio de los macroinvertebrados acuáticos del Departamento de Antioquía, FEN, Medellín, Colombia. [ Links ]
Schatz, H. & V. Behan-Pelletier. 2008. Global diversity of oribatids (Oribatida: Acari: Arachnida). Hydrobiologia 595: 323-328. [ Links ]
Schockaert, E.R., M. Hooge, R. Sluys, S. Schilling, S. Tyler & T. Artois. 2008. Global diversity of free living flatworms (Platyhelminthes, “Turbellaria”) in freshwater. Hydrobiologia 595: 41-48. [ Links ]
Sket, B. & P. Trontelj. 2008. Global diversity of leeches (Hirudinea) in freshwater. Hydrobiologia 595: 129-137. [ Links ]
Smith, D.G. 2001. Pennak’s freshwater invertebrates of the united States. John Wiley & Sons, Nueva York, EEUU. [ Links ]
Springer, M. 2008. Aquatic insect diversity of Costa Rica: state of knowledge. Rev. Biol. Trop. 56 (Suppl. 4): 273-295. [ Links ]
Springer, M. 2009. Marine insects, p 313-322. In I.S. Wehrtmann & J. Cortés (eds.). Marine biodiversity of Costa Rica, Central America. Monographiae Biologicae 86. Springer Science & Business Media B.V., Alemania. [ Links ]
Strayer, D.L. 2010. Alien species in fresh waters: ecological effects, interactions with other stressors, and prospects for the future. Freshwater Biol. 55 (Suppl. 1): 152-174. [ Links ]
Strong, E.E., O. Gargominy, W.F. Ponder & P. Bouchet. 2008. Global diversity of gastropods (Gastropoda; Mollusca) in freshwater. Hydrobiologia 595: 149-166. [ Links ]
Sundberg, P. & R. Gibson. 2008. Global diversity of nemerteans (Nemertea) in freshwater. Hydrobiologia 595: 61-66. [ Links ]
Sweeney, B.W., J.K. Jackson & D.H. Funk. 1995. Semivoltinism, seasonal emergence, and adult size variation in a tropical stream mayfly (Euthyplocia hecuba). J. N. Am. Benthol. Soc. 14: 131-146. [ Links ]
Thorp, J.H. & A.P. Covich (eds.). 2001. Ecology and classification of North American freshwater invertebrates. Academic, San Diego, California, EEUU. [ Links ]
Väinölä, R., J.D.S. Witt, M. Grabowski, J.H. Bradbury, K. Jazdzewski & B. Sket. 2008. Global diversity of amphipods (Amphipoda; Crustacea) in freshwater. Hydrobiologia 595: 241-255. [ Links ]
Vásquez, D., R.W. Flowers & M. Springer. 2009. Life history of five small minnow mayflies (Ephemeroptera: Baetidae) in a small tropical stream on the Caribbean slope of Costa Rica. Aquat. Insect. 31: 319-332. [ Links ]
Wallace, J.B. & J.R. Webster. 1996. The role of macroinvertebrates in stream ecosystem function. Annu. Rev. Ecol. Syst. 41: 115-139. [ Links ]
Walter, D. & H. Proctor. 1999. Mites. Ecology, Evolution and Behaviour. CABI, Wallingford, Reino Unido. [ Links ]
Ward, J.V. 1992. Aquatic insect ecology. John Wiley & Sons, Chichester, Inlgaterra. [ Links ]
Waters, T.F. 1972. The drift of stream insects. Ann. Rev. Entomol. 17: 253-272. [ Links ]
Wilson, G.D.F. 2008. Global diversity of Isopod crustaceans (Crustacea; Isopoda) in freshwater. Hydrobiologia 595: 231-240. [ Links ]
Wotton, R.S. & B. Malmqvist. 2001. Feces in aquatic ecosystems. Bioscience 51: 537-544. [ Links ]
Yeo, D.C.J., P.K.L. Ng, N. Cumberlidge, C. Magalhães, S.R. Daniels & M.R. Campos. 2008. Global diversity of crabs (Crustacea: Decapoda: Brachyura) in freshwater. Hydrobiologia 595: 275-286. [ Links ]
Zrzavý, J., P. Říha, L. Piálek & J. Janouškovec. 2009. Phylogeny of Annelida (Lophotrochozoa): total-evidence analysis of morphology and six genes. BMC Evol. Biol. 9: 18 [ Links ]
*Correspondencia a: Paul Hanson: Escuela de Biología, Universidad de Costa Rica
Monika Springer: Escuela de Biología, Universidad de Costa Rica. Centro de Investigación en Ciencias de Mar y Limnología, Universidad de Costa Rica; monika.springer@ucr.ac.cr
Alonso Ramirez: Instituto para Estudios de Ecosistemas Tropicales, Universidad de Puerto Rico; alonso.ites@gmail.com * phanson91@gmail.com
1. Escuela de Biología, Universidad de Costa Rica
2. Centro de Investigación en Ciencias de Mar y Limnología, Universidad de Costa Rica; monika.springer@ucr.ac.cr
3. Instituto para Estudios de Ecosistemas Tropicales, Universidad de Puerto Rico; alonso.ites@gmail.com * phanson91@gmail.com