La molécula de hemoglobina (Hb) consta de 4 cadenas polipeptídicas. En adultos, la Hb predominante es un tetrámero que consta de dos subunidades α y dos β, formando la Hb A.1 Parte importante de la molécula de la Hb es el ion de hierro, tanto en su estado ferroso (Fe2+) como férrico (Fe3+); sin embargo, este último estado no tiene afinidad al oxígeno. La metahemoglobina producida por la oxidación del hierro ferroso (Fe2+) al hierro férrico (Fe3+) provoca una reducción en la capacidad de la Hb para unirse al oxígeno; esta constituye menos del 1% de la hemoglobina total. Las patologías se producen cuando los niveles de metahemoglobinemia en sangre son mayores de 1,5%.10 Esta situación, fisiológicamente anormal, puede ser congénita o adquirida.2,3La forma congénita, reportada y descrita como infrecuente, puede ser causada por una mutación que conduce a tres variantes de hemoglobina, descritas a la fecha como hemoglobina M, hemoglobina de Saint-Louis y hemoglobina inestable. Estos tipos de Hb se heredan de forma autosómica dominante.
Existe también una forma de herencia autosómica recesiva, caracterizada por la ausencia de la enzima metahemoglobina reductasa (citocromo b5 reductasa), dependiente de nicotinamida adenina dinucleótido (NADPH), necesaria para convertir el hierro férrico en hierro ferroso, lo que permite que la hemoglobina sea apta para transportar oxígeno a los tejidos.4 Los pacientes con dicho rasgo genético presentan cianosis desde el nacimiento, por lo general leve, y no existe un tratamiento específico para ellos.2,3
La mutación de la hemoglobina M ocurre tanto en la cadena alfa como en la beta. Aquellas variantes de la cadena alfa pueden presentarse de forma persistente con cianosis como único síntoma en recién nacidos, que no tienen evidencia de enfermedad cardiopulmonar. Los pacientes con la variante en la cadena beta suelen presentar manifestaciones clínicas en la segunda mitad de la infancia debido a que la concentración de la Hb A es fisiológicamente baja en recién nacidos.4,5 Los pacientes que presentan cianosis y que no responden a la administración de oxígeno al 100% son muy sugestivos de metahemoglobinemia congénita; en estos casos, conjuntamente, es posible encontrar datos de hemólisis en el hemograma.3
La formación de la hemoglobina M resulta de variantes autosómicas dominantes en los genes que codifican la globina alfa (HBA1, HBA2), la beta globina (HBB) o la gamma globina (HBG1, HBG2), por sustituciones de aminoácidos dentro del grupo heme, que, como consecuencia, ocurre un reemplazo de una histidina por una tirosina n la posición 87 de la cadena alfa (Hb M Iwate), posición 92 cadena beta (Hb M Hyde Park, Hb M Akita), posición 58 cadena alfa (Hb M Boston) o beta 63 (Hb M Saskatoon). Solo en la Hb M Milwaukee-I, el residuo de valina se reemplaza por acido glutámico en la posición beta 67. 1,4 Sustituciones análogas de histidina por tirosina en la cadena gamma de la Hb fetal también se han documentado y se han denominado HbF-MOsaka y HbF M Fort Ripley.9
Presentación del caso
Paciente femenina, recién nacida de término, de madre de 26 años en segunda gesta, es trasladada al Servicio de Neonatología del Hospital Nacional de Niños “Dr. Carlos Sáenz Herrera” de la Caja Costarricense del Servicio Social, a las 5 horas de vida, para completar abordaje diagnóstico y terapéutico debido a cianosis generalizada con desaturación demostrada por oximetría de pulso. Su nacimiento fue por parto vaginal eutócico a la edad gestacional de 40+2 semanas, contaba con 9 controles prenatales, tuvo un peso al nacer de 3.730 gramos, su tamizaje por Streptococcus Grupo B resultó negativo y presentó diagnóstico de cutis marmorata. No ameritó reanimación en sala de partos; puntaje de APGAR 9/9; por lo demás no se anotaron complicaciones.
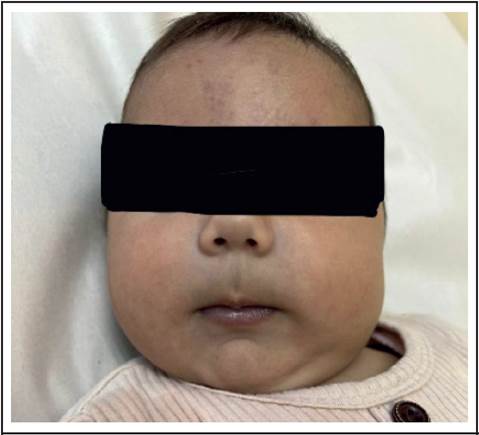
A las 2 horas de vida, presentó una coloración cianótica generalizada sin datos de dificultad respiratoria. Se monitorizó y se obtuvo saturación de oxígeno de 70% en aire ambiente, la cual no mejoró a pesar de la administración de oxígeno suplementario (Figura 1). Ante la sospecha de cardiopatía congénita, se le trasladó con infusión de prostaglandinas intravenosas a la Unidad de Cuidados Intensivos Neonatales del hospital de referencia. A su ingreso presentaba cianosis generalizada y sin datos de dificultad respiratoria. La auscultación cardíaca, sin soplos ni frémito, ni datos de hepatomegalia o edemas. Se encontraba hemodinámicamente estable, con una saturación de oxígeno preductal de 62% y un examen neurológico sin alteraciones. Sus signos vitales al ingreso fueron: frecuencia cardiaca 155 lpm, presión arterial 80/46 (57) mmHg, saturación O2 de 68%. No se detectaron otros hallazgos patológicos al examen físico. Los resultados del hemograma tomado a su ingreso fueron: Hb 18,2 g/dL, leucocitos 29.170/uL, neutrófilos absolutos 21.000/uL, linfocitos 4667/uL, monocitos 1750/uL, plaquetas 210.000/uL, glucosa 50 mg/dL, nitrógeno ureico 9,6 mg/dL, creatinina 0,91 mg/dL, sodio 135 mmol/L, potasio 5 mmol/L, cloruro 102 mmol/L, calcio 9,4 mg/dL, fósforo 4,8 mg/dL, magnesio 1,7 mg/dL, albúmina 3,9 g/dL y hemocultivos negativos definitivos.
Ante este cuadro clínico, se decidió completar estudios con un ecocardiograma que describió un ductus arterioso permeable, sin otros cortocircuitos intracardíacos ni datos de cardiopatía estructural, razón por la cual se le suspendió la infusión de prostaglandinas. Se le realizó una radiografía de tórax y no se evidenció enfermedad pulmonar. Sin embargo, debido a la presencia de hipoxemia persistente, se decidió intubar. Se aumentó la fracción inspirada de oxígeno (FiO2) a 50%, sin mejoría de la oxigenación, persistiendo con SatO2 de <60%, por lo que se sospechó de metahemoglobinemia. Por este motivo, se cuantificó el nivel de metahemoglobina, reportado en 21,6%, lo que se correlaciona con la clínica de la paciente.
Ante el diagnóstico de metahemoglobinemia, se decidió colocar 1 mg/kg IV de azul de metileno, sin presentar la respuesta clínica esperada, por lo que se optó por una segunda dosis, sin obtener tampoco un buen resultado (Cuadro). Este hallazgo orientó a la sospecha de una metahemoglobinemia de causa congénita. Se resolvió extubar ya que no se demostró un problema de ventilación.
Cuadro. Variabilidad de los niveles de metahemoglobinemia durante la hospitalización
| Fecha | Niveles de metahemoglobinemia | Intervenciones realizadas |
| 19/4/22 16:02 | 21.6% | Basal de ingreso |
| 19/4/22 17:59 | 24% | Posterior a primera dosis de azul de metileno |
| 20/4/22 00:24 | 23.70% | Posterior a segunda dosis de azul de metileno |
| 20/4/22 06:06 | 23% | Control (se mantuvo el mismo nivel) |
Debido a que no había evidencia de una causa clara de la cianosis, se estableció comunicación con médicos de la maternidad donde se encontraba hospitalizada la madre y se obtuvo información de que la madre mantenía saturaciones de oxígeno menores al 60% desde su ingreso, sin tener una causa clara (Figura 2), pero sin presentar dificultad respiratoria. Los signos vitales maternos fueron: frecuencia cardiaca 104 lpm, presión arterial 130/78 93 mmHg, saturación 42%.
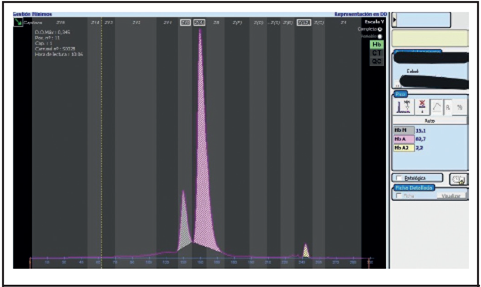
La paciente fue valorada entonces por hematología pediátrica y se procedió a ampliar los estudios, pensando como posible causa una hemoglobina M. Se le efectuó electroforesis de hemoglobina y se detectó un pico de 3.1% en la zona donde se ubica la Hb M, compatible con hemoglobina Iwate o Kankakee (Figura 3). Se le realizó electroforesis de Hb a la madre y se evidenció un pico de 15.1% en la zona donde se ubica la Hb M (Figura 4). Una vez establecido el diagnóstico de la paciente, se egresó a los 4 días de vida, tolerando la vía enteral, sin necesidad de oxígeno suplementario y con saturaciones aproximadas de 50%. A la paciente se le realizaron estudios moleculares en busca de mutaciones específicas causantes de esta patología; sin embargo, este estudio fue negativo.
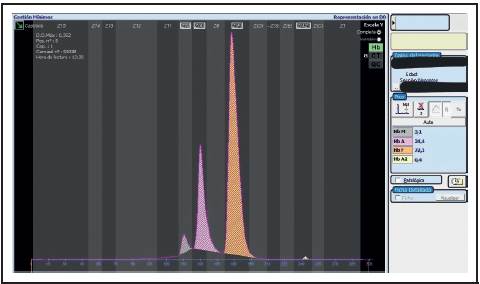
Figura 3 Electroforesis de hemoglobina de la paciente. En el recuadro gris se observa el nivel de hemoglobina M en 3.1%. Cortesía del Dr. Walter Cartín, jefe de Laboratorio de Estudios Especializados e Investigación, Hospital Nacional de Niños, Caja Costarricense Seguro Social.
Discusión
La cianosis central se define como la coloración azulada de la piel y membranas mucosas debido a un aumento en sangre de la concentración de hemoglobina reducida (más de 3-5g/dL).7,8 Podría traducirse en una patología que ponga en peligro la vida, de ahí la importancia del diagnóstico rápido y preciso. Sin embargo, existen múltiples patologías causantes de cianosis, por lo que, en muchos casos, se trata de un reto diagnóstico.7 En el caso que se presenta, se evaluaron y se descartaron sistemáticamente las causas más probables de cianosis.
Entre los diagnósticos diferenciales de cianosis en el recién nacido, están las patologías que causan cortocircuito en la ventilación perfusión, por ejemplo: síndrome de distrés respiratorio por inmadurez, taquipnea transitoria del recién nacido, síndrome de aspiración de meconio y fugas de aire.8 Otra causa fundamental de cianosis en el recién nacido son patologías que causan shunt de derecha a izquierda, lo que aumenta la sangre desoxigenada en el circuito sistémico. Entre estas causas de shunt se encuentran la hipertensión arterial pulmonar y las cardiopatías congénitas cianógenas.8 En el caso expuesto, la presencia de cianosis central sin distrés respiratorio, con un test de hiperoxia fallido, favorecía un diagnóstico más probable de cardiopatía congénita, por lo que se iniciaron prostaglandinas en espera del ecocardiograma, el cual descartó la sospecha diagnóstica.7
Al estar ante un recién nacido con cuadro de cianosis, y al desecharse las causas antes mencionadas, es de vital importancia descartar también las causas hematológicas que podrían cursar con cianosis, como la policitemia, las anemias hemolíticas y ciertas variantes de hemoglobinas inestables causantes de metahemoglobinemia. La policitemia, no obstante, no produce niveles de desaturación tan severos como los que presentaba nuestra paciente. Es posible que las anemias hemolíticas, como la deficiencia de glucosa 6 fosfato deshidrogenasa, presenten niveles altos de metahemoglobina, principalmente en períodos de crisis como luego de la exposición a agentes o drogas oxidantes. 8 Por lo anterior, a nuestra paciente, una vez descartadas las causas más comunes de cianosis en el recién nacido, se le realizó medida de los niveles de metahemoglobina que reportaron el 21,6%, nivel claramente elevado, por lo cual se procedió a descartar las causas de metahemoglobinemia.
La metahemoglobinemia es una causa rara de cianosis de origen hematológico, y se debe sospechar de ella cuando se presenta un recién nacido cianótico, sin síndrome de distrés respiratorio y con saturación disminuida, pero PA O2 normal.5 Las presentaciones clínicas generalmente dependen del porcentaje de metahemoglobinemia. Un rango del 3 al 15 % de metahemoglobina producirá una ligera decoloración de la piel y un nivel superior al 15-20% resultará en una cianosis. Niveles superiores al 25-50% provocan dolor de cabeza, disnea, mareos, síncope, debilidad, confusión, palpitaciones y/o dolor de pecho; niveles al 50-70% ocasionan delirio, convulsiones y coma; los niveles superiores al 70% suelen provocar la muerte.1,3,5
Sin embargo, en el caso de metahemoglobinemia congénita, la fisiopatología es muy distinta a la de la forma adquirida, la cual ocurre por consecuencia a exposición a toxinas.10 Las causas de la metahemoglobinemia congénita pueden ser deficiencia de citocromo b5 reductasa y enfermedad de la hemoglobina M, la cual corresponde al caso descrito. La Hb M Iwate es una variante rara, hereditaria de forma dominante, la cual resulta del reemplazo de la histidina por tirosina en la posición 87 de la cadena alfa de la hemoglobina. Por ser una variante del gen alfa, su presentación clínica se da desde el nacimiento.4 En el caso en cuestión, la madre presentaba desaturación, igual que su recién nacida, pero no existía un diagnóstico claro. La electroforesis de Hb confirmó el diagnóstico de Hb M tanto en la madre como en la recién nacida (Figuras 3 y 4). El conocimiento de la patología de la madre hubiera evitado todas las intervenciones médicas efectuadas en la recién nacida, así como el traslado a otro centro hospitalario.
La Hb M es un trastorno benigno hereditario que no responde a tratamiento con azul de metileno ya que no se debe a un déficit enzimático. Debe sospecharse siempre que se presente un recién nacido con cianosis central una vez descartadas patologías cardiopulmonares y metabólicas. La importancia de su diagnóstico temprano y oportuno radica en el buen pronóstico de la enfermedad, así como en la posibilidad de evitar intervenciones invasivas y tratamientos innecesarios. Es fundamental no olvidar el consejo genético a los padres.5