Las vacunas se encuentran recomendadas durante toda la vida y ninguna otra estrategia médica ha tenido tanto impacto en la salud pública como la vacunación.1 Los programas de inmunización constituyen una de las intervenciones más efectivas en salud pública, pues al generar una respuesta inmune que reduce la posibilidad de contagio, pueden prevenir e incluso contribuir a eliminar enfermedades mediante la reducción significativa de agentes patógenos circulantes en la comunidad.2 No obstante, la inmunización de personas adultas no ha recibido la misma prioridad que la de niños y adolescentes, aun cuando se ha documentado que tanto en países desarrollados como en naciones en desarrollo, los decesos debidos a enfermedades prevenibles mediante vacunas ocurren predominantemente en adultos,3,4 como consecuencia de mayor susceptibilidad, pérdida paulatina de protección generada por las inmunizaciones de la infancia, y disminución en la inmunogenicidad vacunal en relación con patologías crónicas, senescencia inmunitaria y fragilidad.5
En contraste con el éxito de las campañas de inmunización pediátrica, las tasas de vacunación en adultos permanecen bajas.6 Múltiples factores contribuyen con estas inadecuadas coberturas, entre ellos: socioeconómicos y educativos, información limitada, falta de interés y de costumbre, dudas sobre la eficacia y seguridad de las inmunizaciones, esquemas complejos, fallas en implementación, preocupaciones legales en cuanto a la aplicación, dificultades para el registro, ausencia de incentivos y de campañas de vacunación dirigidas a este segmento de la población, carencia de requerimiento u obligatoriedad de vacunas en adultos, excepto para los trabajadores de salud, falta de voluntad política o fondos limitados para la inmunización de adultos, fallas en incorporación de recomendaciones durante las visitas domiciliarias y las consultas médicas, e inclusive desconocimiento y carencia de motivación al respecto por parte del personal médico responsable.7-9
Pese a las barreras mencionadas, ciertas estrategias han logrado aumentar la cobertura vacunal en los adultos, por ejemplo: la incorporación de las recomendaciones de inmunización y el registro de vacunas a las evaluaciones médicas de rutina y periódicas, las campañas en atención primaria, la referencia a centros de vacunación y los progresos en sistemas de información.4,10,11
Este documento pretende analizar los esquemas actuales de inmunizaciones en la población adulta basados en las recomendaciones nacionales e internacionales para personas mayores de 18 años, con la finalidad de ofrecer una guía más completa de vacunación para este segmento poblacional costarricense. Las inmunizaciones de los funcionarios del sector de salud y de estudiantes de ciencias de la salud y carreras afines, no constituyen un objetivo de esta revisión.
Inmunidad de rebaño y estrategia capullo
El programa de vacunación pediátrica en Costa Rica es sin duda una de las estrategias de salud pública más exitosas en el país, resultando en la prevención, control y disminución significativa de la incidencia de muchas patologías infecciosas, con un claro impacto en la mortalidad general. La vacunación pediátrica no solo previene la enfermedad, sus secuelas y la muerte entre los vacunados, sino que contribuye a disminuir el riesgo de enfermedad y complicaciones entre los no vacunados, al incrementar la inmunidad general de la población y reducir la transmisión del agente infeccioso, gracias al aumento de los individuos resistentes a la infección y la disminución de los pacientes vulnerables. Este efecto indirecto de protección poblacional inducido por la vacunación se conoce como “inmunidad de rebaño” (herd immunity), y representa una estrategia de gran impacto sobre la salud general, pues reduce la probabilidad de contagio aún en personas susceptibles que residen en áreas con elevado nivel de inmunidad.
Dicho término se refiere a la resistencia de un grupo de personas de una misma comunidad, sujetas al ataque de un ente infeccioso para el cual una gran proporción de sus miembros son inmunes, lo que minimiza la probabilidad de que alguien infectado entre en contacto con un individuo susceptible o no inmune. Entre los factores que determinan el establecimiento de este tipo de inmunidad en una población, se encuentran la homogeneidad de la distribución de los individuos susceptibles y la frecuencia y forma de los contactos interindividuales.
Con un programa de inmunizaciones, la población puede adquirir inmunidad de rebaño solo si se logra alcanzar una elevada cobertura de vacunación.2Empero, los infantes menores de seis meses no han recibido aún las series completas de inmunizaciones y se encuentran vulnerables a sufrir infecciones inmunoprevenibles, principalmente influenza y tosferina.12 En Costa Rica los menores de un año constituyen el grupo más afectado por la tosferina, con tasas de hasta 172,6 por 100 mil nacidos vivos,13 y los miembros de la familia que no están vacunados han sido clásicamente descritos como responsables de la transmisión de tosferina a los lactantes.14 Debido a esta situación se recomienda vacunar a todas las personas que tienen contacto con niños recién nacidos, incluyendo el personal de salud que labora en servicios ginecoobstétricos y neonatológicos.
Dicha conducta, conocida como “estrategia capullo” (del término inglés cocooning), es una vía sencilla y efectiva para prevenir la diseminación de patógenos a los neonatos, en especial de Bordetella pertussis. Como complemento a la estrategia capullo, la Organización Panamericana de la Salud recomienda a toda mujer embarazada la vacunación con una dosis de Tdap (toxoides tetánico y diftérico y vacuna acelular de B. pertussis) durante cada gestación, preferiblemente en el tercer trimestre de embarazo en países donde se reporte reemergencia de tos ferina en el niño pequeño.15 Esta medida protege tanto a la madre como al neonato.14,16
Consideraciones previas a la aplicación de vacunas en adultos
Las vacunas recomendadas para adultos deberían estar condicionadas por: edad, inmunizaciones previas, estado actual de salud, estilos de vida, ocupación y desplazamiento geográfico (viajes y migraciones).17 Es evidente que los cambios en la pirámide poblacional y la mejoría en la sobrevida para ciertas enfermedades crónicas, han incidido en el desplazamiento de las condiciones de vulnerabilidad hacia infecciones inmunoprevenibles en grupos de edad tradicionalmente no susceptibles, permitiendo afirmar que la vacunación ya no es exclusiva para los niños y adolescentes.
Esto plantea el reto de que todo profesional de la salud debe implementar la revisión y recomendación de vacunas dentro de los planes de medicina preventiva del paciente adulto, y sobre todo en el plan de prevención de complicaciones por enfermedades crónicas propias de este grupo poblacional.4,18 La decisión última de inmunizar a un adulto debe entonces basarse en el análisis personalizado de cada caso, en consideración con la epidemiología local. Por tanto, antes de administrar vacunas a personas adultas, se recomienda considerar cuatro factores básicos: condiciones de salud, edad, estilo de vida y ocupación de la persona.19 Este esquema puede ayudar al médico a estratificar el riesgo individual de un paciente, identificar las vacunas indicadas en cada caso y las situaciones en que puede obviarse la inmunización, evaluar el beneficio potencial de la vacuna en cuestión y discernir sobre su aplicación (Cuadro 1).
Inmunización en adultos con riesgo incrementado de infecciones
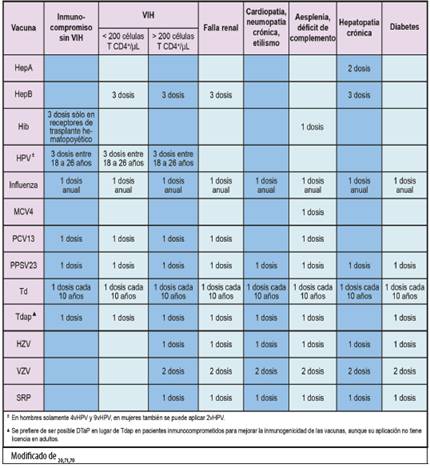
Las poblaciones con alto riesgo de presentar patologías infecciosas incluyen pacientes con inmunodeficiencias primarias y secundarias de cualquier tipo, insuficiencia renal, cardíaca o hepática, diabetes, alcoholismo, fármacodependencia y ausencia anatómica o funcional del bazo.20También se consideran en riesgo pacientes institucionalizados (privados de libertad, residentes de asilos u hospicios, etc.), quienes laboran en la manipulación de alimentos, trabajadores sexuales y personal encargado del cuidado tanto intra- como extrahospitalario de pacientes.4 Rutinariamente, estos grupos poblacionales suelen ser analizados desde la perspectiva del personal de salud como precauciones o contraindicaciones para la aplicación de vacunas, siendo en realidad grupos con elevado riesgo de sufrir enfermedades inmunoprevenibles.
En este sentido, se olvida con frecuencia que las vacunas inactivadas no suelen conllevar preocupaciones de seguridad en grupos de riesgo, y que los contactos domiciliares de dichas personas deben tener el mejor esquema de inmunizaciones disponible.
Cuadro 1 Lista de factores que indican posibles requerimientos individuales de inmunización en adultos
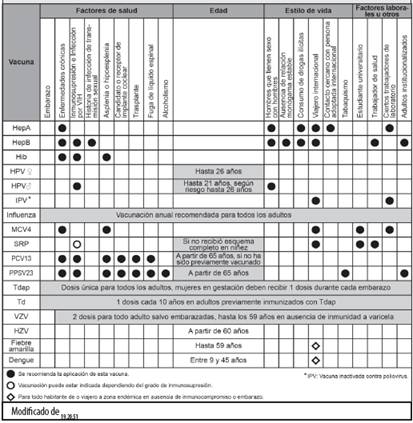
Consideraciones específicas acerca de vacunas indicadas en la población adulta
Vacuna contra virus de influenza: la efectividad de esta vacuna puede variar sustancialmente cada año, según la concordancia de cepas, la cobertura y la estacionalidad del virus, y puede ser baja entre adultos mayores. No obstante, la inmunización contra influenza es una estrategia costo-efectiva para reducir los brotes del virus, la mortalidad asociada con la infección y las hospitalizaciones, esto siendo de particular importancia tanto en el adulto mayor como en adultos menores de 65 años con enfermedades crónicas.21-23 Además, disminuye el ausentismo laboral relacionado con cuadros gripales, lo cual beneficia la economía.22,24,25
Los infantes menores de 6 meses de edad son el grupo pediátrico con mayor riesgo de hospitalización y muerte por influenza.26,27 Así mismo, la influenza se asocia con un elevado riesgo de hospitalización en mujeres gestantes, labor de pretérmino, bajo peso al nacer y defectos congénitos.28 La vacunación durante el embarazo es determinante para evitar estas complicaciones, tanto en la gestante como en el producto de la concepción, y provee transferencia transplacentaria de anticuerpos con protección pasiva del neonato, lo cual reduce el riesgo de infección y hospitalización por influenza durante los primeros 6 meses de vida.29,30
En Costa Rica se reportó, en 2015, 1575 casos por 100 mil habitantes de enfermedad tipo influenza, y más del 50% sucedió en mayores de 20 años de edad.13 Debido a los factores mencionados, los autores recomiendan la vacunación anual contra influenza en todos los grupos de edad, a partir de los 6 meses, con especial indicación para la mujer embarazada en cualquier momento del embarazo, y siempre que no haya una contraindicación médica válida.
Vacuna contra virus de herpes zoster (HZV): el riesgo de enfermedad por herpes zoster y de neuralgia postherpética incrementa con la edad, siendo tres veces más alto en adultos mayores de 65 años.31 Por esto, se recomienda la vacunación contra este virus a partir de los 60 años.32 Esta vacuna aún no cuenta con registro sanitario en el país.
Vacunas contra virus de hepatitis A (HepA) y hepatitis B (HepB): ambas se recomiendan para empleados de centros hospitalarios, estudiantes de ciencias de la salud, pacientes que requieren transfusión recurrente de hemocomponentes, hepatópatas, hombres que tienen sexo con otros hombres, habitantes de regiones donde estos virus son endémicos, especialmente en las zonas de endemicidad intermedia a baja,33 viajeros a zonas de alta endemicidad y adultos que desean reducir su posibilidad de contagio.34-36 En el caso de hepatitis B, la inmunización pediátrica rutinaria y de adultos con alto riesgo de infección, ha disminuido de manera sustancial la prevalencia de la enfermedad en todos los grupos etáreos. Sin embargo, se continúan presentando mundialmente numerosos casos nuevos, con mayor frecuencia en adultos.37
Los diabéticos tienen cerca del doble de riesgo de contraer hepatitis B que los no diabéticos, por lo que se recomienda altamente la vacunación en este grupo. Se estima que la eficacia vacunal en diabéticos es superior al 90% en adultos de 40 años o menos, pero disminuye con la edad (80% entre 41 y 59 años, 70% entre 60 y 69 años y menos del 40% en mayores de 69 años). Esto ilustra la necesidad de vacunar contra hepatitis B lo más pronto posible, una vez efectuado el diagnóstico de diabetes. Para la vacunación de diabéticos de 60 años o más, se recomienda considerar las comorbilidades, el riesgo de adquirir la infección, el compromiso de las respuestas inmunológicas relacionadas con la edad y la posibilidad individual de beneficiarse con la inmunización.38
En Costa Rica las hepatitis infecciosas afectaron a 28,08 por cada 100 mil habitantes durante 2015, concentrándose la incidencia más elevada en adultos entre 20 y 39 años, donde se ha descrito una incidencia promedio de 44,35 por 100 mil habitantes,13 de tal forma que potencialmente todo adulto que no haya sido vacunado antes y que no haya padecido la enermedad, se podría beneficiar de la vacunación contra hepatitis A y B.
Vacunas antihelmínticas (PCV13 y PPSV23): la incidencia de enfermedades asociadas con Streptococcus pneumoniae es muy elevada en adultos, si bien la epidemiología de la enfermedad neumocócica ha variado desde el inicio de la inmunización pediátrica con la vacuna 13-valente conjugada (PCV13), lo cual ha reducido la tasa de neumonía adquirida en la comunidad y de infección invasiva por neumococo, tanto en los grupos inmunizados como en los no vacunados mediante el efecto rebaño.39 A pesar del éxito obtenido con la vacunación pediátrica, en Costa Rica se reportaron 48,92 casos de neumonía por 100 mil habitantes durante 2015, y por encima de los 50 años de edad la incidencia supera los 100 casos por 100 mil habitantes.13
La reducción en enfermedad neumocócica grave en grupos centinela, por ejemplo, individuos portadores de virus de inmunodeficiencia humana (VIH), indica que los efectos del programa pediátrico han conseguido abarcar también grupos de riesgo inmunológico.40 Sin embargo, la infección neumocócica invasiva continúa siendo común, principalmente en adultos mayores.41 La PCV13 y la vacuna polisacárida 23-valente (PPSV23) están recomendadas en poblaciones adultas menores de 65 años con alto riesgo de infección neumocócica (patologías crónicas, diabetes mellitus, inmunosupresión, inmunodeficiencias, asplenia funcional o anatómica, implante de cóclea, fístula de líquido cefalorraquídeo ).42,43
La PCV13 es una vacuna altamente inmunogénica, al contener antígenos proteicos que inducen una respuesta de células B dependiente de células T y con ello una memoria inmunológica más robusta y duradera. No obstante, la PPSV23 contiene además de 12 serotipos incluidos en la PCV13, 11 serotipos adicionales, por lo que ambas vacunas pueden considerarse complementarias. Un estudio realizado con personas entre 60 y 64 años, demostró que la aplicación inicial de PCV13 aumentó la respuesta antineumocócica a la administración subsecuente de PPSV23 para muchos de los serotipos comunes a ambas vacunas. En contraste, la vacunación inicial con PPSV23resultó en disminución de la respuesta a la posterior aplicación de PCV13 para todos los serotipos. Con un intervalo de 1 año entre las dosis, las respuestas posteriores a la segunda inmunización con PCV13 (PCV13/PCV13) o PPSV23 (PCV13/PPSV23) no mostraron inferioridad para la mayoría de los serotipos comparados con la dosis inicial de PCV13, indicio que refleja la necesidad de un intervalo mayor entre las aplicaciones.44
Cuadro 2 Vacunación contra neumococo en pacientes mayores de 18 años pertenecientes a poblaciones con alto riesgo de infección
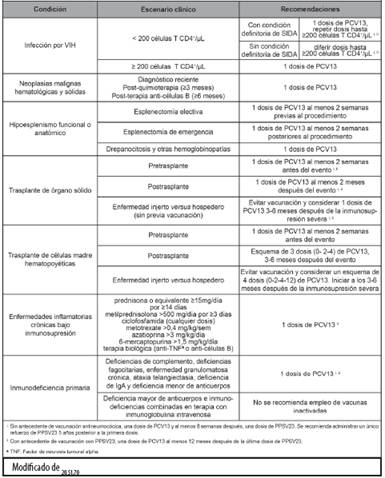
De esta manera, en adultos mayores no inmunocomprometidos debe procurarse administrar la PCV13 primero, con un intervalo de aplicación entre PCV13 y PPSV23, de al menos 12 meses.45
En pacientes inmunocomprometidos, con asplenia funcional o anatómica, fuga de líquido cerebroespinal o implante coclear, se indica administrar ambas vacunas (PCV13 seguida de PPSV23) cuanto antes, con un intervalo mínimo de 8 semanas entre ellas. Si se ha administrado la PPSV23 inicialmente, la PCV13 debe aplicarse al menos 12 meses posterior a la PPSV23, en todos los casos.46
En consideración a la evidencia publicada hasta el momento47-50 y la información disponible a nivel nacional,51 los autores estiman aconsejable ofrecer ambas vacunas a todos los grupos de riesgo, incluidos los adultos mayores. El beneficio de la vacunación contra neumococo con PCV13 en grupos de adultos sanos, requiere de más estudios para su recomendación sistemática, pero podría proveer cierto beneficio en el escenario individual (Cuadro 2).
Vacunas antimeningocócicas (MCV4, MPSV4 y MenB): en adultos menores de 56 años, se prefiere la vacuna cuadrivalente conjugada que contiene los serogrupos A, C, W y Y de Neisseria meningitidis (MCV4). Para mayores de 56 años, la única vacuna antimeningocócica que cuenta con aprobación es la polisacárida (MPSV4). Ambas pueden prevenir 4 tipos de enfermedad meningocócica.
La vacuna MCV4 está indicada para prevención primaria o para control de brotes por los serogrupos referidos en su formulación, dada su naturaleza basada en la antigenicidad de polisacáridos conjugados, mientras que la MPSV4 solo se encuentra recomendada para el control de brotes, debido a formulación basada en polisacáridos puros no conjugados.
Ambas vacunas protegen contra los serogrupos A, C, Y y W.
Entre 2008 y 2012, Costa Rica reportó un total de 15 casos de enfermedad invasora por meningococo a la red de vigilancia regional SIREVA II, de los que dos terceras partes fueron causadas por el serogrupo B, para el cual no se encuentra todavía una vacuna disponible en el país, y un tercio de los casos fue provocado por los serogupos Y y C. Durante ese periodo, más del 60% de los casos se presentó en mayores de 15 años.52 Tanto las vacunas MCV4 como MPSV4 incluyen 2 de los 3 serogrupos más frecuentes en Norteamérica y un tipo epidémico de África.53
Cuadro 3 Propuesta de recomendaciones generales de vacunación para personas mayores de 18 años en Costa Rica
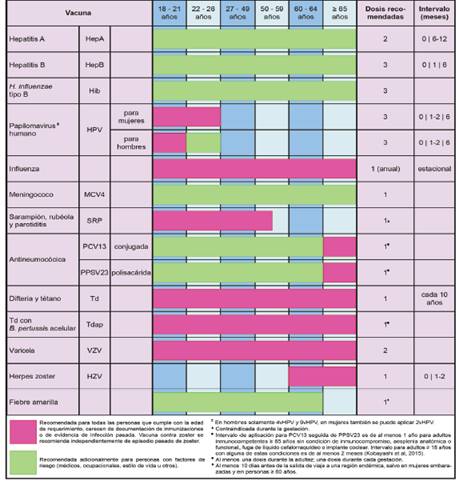
En cuanto al meningococo del serogrupo B, la Food and Drug Administration (FDA) de los Estados Unidos de América autorizó, en 2014, una vacuna conjugada (MenB) para personas entre 10 a 25 años. Su aplicación debe considerarse en personas entre los 16 y los 23 años (preferiblemente entre 16 y 18 años), para proveer protección de corto plazo contra más cepas del serogrupo B.54 En mayores de 26 años, su administración se considera “off-label”, excepto en casos de epidemia, en los cuales la indicación puede extenderse a cualquier edad. Hasta el momento se considera que la protección conferida por las vacunas antimeningococo B es de corta duración. La inmunización de pacientes inmunocomprometidos no portadores de VIH debe evaluarse individualmente, en caso de circulación endémica o brotes epidémicos de meningitis meningocócica causada por los serogrupos A, C, W y Y.20
Aunque el meningococo no es una causa común de infecciones en inmunocomprometidos, cuando ocurre un brote de meningitis meningocócica es necesario efectuar la caracterización serológica del agente causal, y considerar la inmunización con MCV4 de ciertos grupos con elevado riesgo de infección meningocócica invasiva, cuando las condiciones epidemiológicas locales lo justifiquen. Por ejemplo, un aumento de casos de enfermedad meningocócica invasora por serogrupo W135, en Chile, en 2012, obligó a esa nación a implementar un plan para inmunizar a las poblaciones vulnerables.55,56 Los factores de riesgo de infección invasora por meningococo son asplenia funcional o anatómica, deficiencia de properdina, deficiencia de componentes terminales de la vía del complemento (C5 a C9), personal de laboratorio que trabaja con aislamientos de N. meningitidis, infección respiratoria por virus de influenza, edad, exposición al humo de tabaco, hacinamiento y bajo nivel socioeconómico.57
Dependiendo de los factores epidemiológicos de la región, personas con riesgo aumentado de infección por N. meningitidis deben recibir también inmunoprofilaxis con MenB.58 En caso de que se desconozca la epidemiología local, lo más recomendable es utilizar la vacuna que ofrezca el espectro más amplio de protección. Hasta la fecha, los autores no consideran que exista evidencia robusta que sustente la recomendación universal de adultos contra esta bacteria, pero su indicación en los casos de riesgo descritos y su beneficio en el escenario individual, podrían ser considerados.
Vacunas contra virus de papiloma humano: (2vHPV, 4vHPV y 9vHPV): se ha estimado que la vacuna contra este virus (HPV) tiene una efectividad de más del 90% contra cáncer cervical y verrugas genitales asociados con serotipos de papiloma virus incluidos en las vacunas.59 La vacunación durante la adolescencia previa a la exposición viral a través de contacto sexual es la estrategia más costo-efectiva para reducir las consecuencias de la infección, incluyendo cáncer anal. Sin embargo, la inmunización en la adultez temprana puede ser también costo-efectiva, en especial cuando la cobertura en adolescentes es subóptima.60 En adultos jóvenes no vacunados se recomienda la inmunización en cualquier momento (catchup vaccination), hasta los 21 años en todos los hombres y hasta los 26 años en mujeres, hombres que tienen sexo con otros hombres y portadores de VIH.61
Recientemente se ha sumado a las vacunas bivalente (2vHPV) y tetravalente (4vHPV) disponibles, la vacuna nonavalente de HPV (9vHPV), la cual puede también ser utilizada en la vacunación rutinaria de hombres y mujeres.62
Tétanos, difteria y tosferina: (Td y Tdap): los casos de difteria y de tétanos son infrecuentes en Costa Rica, no obstante, la infección por B. pertussis o tosferina continúa siendo un problema patente. Durante 2015 se reportaron 202 casos de tosferina en Costa Rica, que afectaron sobre todo a niños menores de un año, grupo que agrupa el 61,4% de los casos, llegando a tener una incidencia de hasta 172,6 por 100 mil nacidos vivos.13 Los infantes son el grupo con mayor riesgo de infección severa y muerte por tosferina, aunque los adultos pueden presentar cuadros de tos persistente durante varias semanas, y constituyen una importante fuente de transmisión a los menores.63
Desde la implementación de vacunas acelulares de B. pertussis en la década de los 90, se ha estudiado en detalle el fenómeno de caída de la inmunidad contra dicha bacteria, en individuos vacunados durante la infancia - lo que se denomina waning immunity -, y se ha evidenciado una caída en la seroprotección para el componente de tosferina, de 10 a 15 años después de la última dosis de la vacuna.63,64 Esta situación lleva a concluir que la adición del componente antipertúsico a la vacunación rutinaria contra tétanos y difteria podría interrumpir la aparición mundial de brotes, principalmente en el lactante menor de un año. Por todas estas razones se recomienda aplicar una dosis de la vacuna Tdap en todos los adultos que no la hayan recibido, seguida de inmunización con Td (toxoides tetánico y diftérico) cada 10 años. La vacunación con Tdap se encuentra recomendada en cada embarazo y se estima que tiene alrededor del 90% de efectividad en prevenir tosferina en infantes.65
La Organización Mundial de la Salud establece como objetivo la eliminación del tétanos materno y tétanos neonatal en todo el mundo, lo cual solo se logra manteniendo a la población adulta seroprotegida y no solo a la población pediátrica. En diferentes países, la mortalidad por tétanos se ha observado de forma predominante en adultos mayores de 60 años.66,67
Otras vacunas: la aplicación de ciertas vacunas rutinariamente recomendadas durante la niñez y la adolescencia puede estar también indicada en ciertos adultos, y debe ser considerada en la asesoría individual de los requerimientos de inmunización.
Estas vacunas incluyen las de sarampión, rubéola, varicela y fiebre amarilla.2,68
En 2016 se inició la comercialización en el país de la primera vacuna tetravalente disponible contra el dengue (CYD). Está compuesta por virus vivos atenuados quiméricos utilizando el esqueleto de la vacuna 17D contra fiebre amarilla, modificado con los genes estructurales de los 4 tipos existentes del virus dengue. Costa Rica presenta un patrón epidemiológico endémico epidémico bianual para dengue, con un promedio de 23256 casos anuales, reportándose el mayor número de ellos entre los 10 y los 49 años de edad.13 La vacuna podría evitar 2 de cada 3 casos de dengue, 8 de cada 10 hospitalizaciones y 9 de cada 10 casos graves, y está indicada para adolescentes y adultos entre los 9 y los 45 años de edad.69 Los autores consideran que el beneficio de esta vacuna debe ser considerado en población adulta que resida en las regiones del país con mayor endemicidad.
Guía propuesta para la vacunación en adultos en Costa Rica
En lo referente a la inmunización de adultos, la Norma de Vacunación de Costa Rica, vigente desde 2013, establece solo la aplicación de Td cada decenio, de la vacuna contra influenza anual y de la PPSV23 una única vez. Las dos últimas se indican en este esquema a partir de los 60 años.2 Con base en la bibliografía consultada, los autores proponen en el Cuadro 3, un esquema de vacunas para adultos, el cual puede aplicarse para la mayoría de las inmunizaciones a cualquier edad y momento, después de los 18 años. Este cuadro contempla también las recomendaciones específicas para adultos mayores.
Las indicaciones propuestas de inmunización para los grupos con particular riesgo de infección se resumen en el Cuadro 4.
Es importante señalar que la vacunación con microorganismos vivos atenuados en pacientes inmunocomprometidos suele estar contraindicada, pero cada caso debe ser evaluado de manera concreta, no solo en relación con la enfermedad de fondo, sino en lo concerniente a periodos de espera, antes o después de haberse empezado terapia inmunosupresora.20,70-72
Las recomendaciones para inmunización en mujeres embarazadas comprenden la aplicación de la vacuna de influenza estacional con independencia del estado gestacional y una dosis de Tdap en cada embarazo. En el puerperio inmediato, se recomienda administrar una dosis de SRP si la mujer no ha sido vacunada y la inmunización contra varicela si no hay antecedente de infección por este virus, o vacunación previa.
Las vacunas vivas atenuadas están contraindicadas durante la gestación.2,71 Se considera indispensable que el personal de salud que maneje mujeres en gestación y en el posparto inmediato, tenga también un esquema completo de vacunas.
Conclusiones
La población adulta presenta una elevada incidencia de patologías infecciosas prevenibles por vacunación. Tasas bajas de vacunación dejan a los adultos vulnerables a sufrir enfermedades, hospitalizaciones y muerte, lo que puede ser prevenible por medio de las inmunizaciones. Las recomendaciones provenientes del personal de salud en cuanto a utilización de vacunas, constituyen el mejor predictor aislado de vacunación. Intervenciones para optimizar la inmunización rutinaria, como la asesoría en la necesidad de las vacunas en cada cita médica o valoración por parte de personal sanitario, implementación de protocolos institucionales y registros de inmunización, pueden mejorar la vacunación en adultos. El personal de salud se encuentra obligado a incorporar asesoramiento individual durante la atención de rutina de pacientes adultos, respecto de los requerimientos de vacunas cuando estén indicadas, ofrecer la vacunación o referir a otros centros en caso de que no exista disponibilidad de los agentes biológicos en su centro de salud, con el objetivo de reducir la incidencia de enfermedades inmunoprevenibles.
Conflictos de interés: el Dr. Gustavo Lazo declara haber laborado durante el primer semestre de 2014 como gerente médico para Centroamérica de la compañía Sanofi Pasteur, y ha sido contratado como conferencista y asesor externo por Sanofi Pasteur, Pfizer y MSD, en diversas oportunidades. Su participación en este reporte no está asociada a ningún ligamen comercial. rosasur@gmail.com