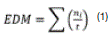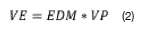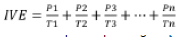Introducción
Los reguladores de crecimiento han sido un componente importante en la producción de plantas (1). Las giberelinas, citoquininas y auxinas promueven un aumento y alargamiento de brotes reproductivos y vegetativos (2). Facilitan la propagación y aumentan considerablemente el rendimiento en la producción de plantas, principalmente de cultivos in vitro (3), (4).
Las giberelinas ayudan al desarrollo temprano de embriones, a la hiper elongación de tallo, maduración de polen, floración, desarrollo del fruto y expansión foliar, tanto in vitro como ex situ (5, 6, 7). Las citoquininas como el 6-bencilaminopurina (BAP), ayudan a la formación de yemas, desarrollo de brotes, ampliación de hojas y cotiledones, mejoran el desarrollo reproductivo, la fotosíntesis y senescencia (6), (8), (9). La asociación de citoquininas y giberelinas en diferente concentración ayudan en la regeneración de células caulinarias (3). Además, el GA3, BAP y kinetinas han sido también utilizadas en inducción floral in vitro (10).
En Chlorella pyrenoidosa, se utilizó el ácido giberélico, el ácido indol-3-butírico, la kinetina, la 6-bencilaminopurina y el ácido 1-naftalenoacético, en concentraciones que iban de 2 mgl-1 a 10 mgl-1, donde 4 mgl-1 en BAP aumentó la biomasa y el rendimiento en la producción (11). En plantas jóvenes de Cinchona ledgeriana la adición de GA3 aumentó la altura y el tamaño de las hojas, mientras que la aplicación de BAP aumentó el diámetro de tallo, número de hojas y contenido de clorofila (12). En cultivos de Solanum tuberosum las citoquininas influyeron de manera positiva en la productividad del cultivo (13).
En pináceas las más utilizadas para aumento en la producción de brote reproductivo, vegetativo y en su longitud apical fueron la giberelina cuatro más siete (GA4/7), la bencilaminopurina (BAP) y el ácido naftalenacético (NAA-800) (14). De un estudio realizado con plantas en vivero de Swietenia macrophylla King, resultó que aplicar giberelinas por aspersión aumentó la relación de área foliar, causado probablemente por un mayor desarrollo de su aparato fotosintético (7). En propagación in vitro de Tectona grandis en Cuba, se reportó que concentraciones de 2,22 μM de 6-BAP produce hasta 4 brotes por explante (15). En micropropagación in vitro de T. grandis en Costa Rica, la aplicación de 10 mgl-1 de benziladenina (BA), produjo la mayor cantidad de brotación de yemas en estacas provenientes del campo (16).
En propagación in vitro es conocido que, para obtener una multiplicación y alargamiento de brotes de manera homogénea, es necesario la adición de giberelinas como el GA3, aunque también se obtiene por combinaciones entre BAP, ANA, AIB y GA3 (4). Para obtener un aumento de la tasa de multiplicación (17). Y al beneficio potencial del uso de estos fitorreguladores en la producción de plantas, combinado con el aumento del mercado de plantas clonadas para reforestación en el país (18), (19), (20).
A pesar del amplio conocimiento del uso de reguladores de crecimiento en la propagación in vitro, no se cuenta con suficiente experiencia en su aplicación en condiciones de propagación in vivo o ambiente protegido; se planteó esta investigación, cuyo objetivo fue determinar el efecto del BAP y del GA3, a diferentes dosis, en la productividad del minijardín clonal de Tectona grandis en ambiente protegido.
Materiales y métodos
Descripción de sitio y de las condiciones experimentales. El estudio se realizó en los invernaderos de la Cooperativa Internacional de Mejoramiento Genético Forestal (GENFORES), ubicados en el campus Tecnológico de San Carlos, zona norte de Costa Rica, coordenadas 10º 21 ’39,28’’ Latitud Norte y 84º 30’ 28,72’’ Longitud Oeste, a una elevación de 167 m.s.n.m (21). El sitio se ubica dentro del Bosque Muy húmedo Tropical (22). Esta región presenta un promedio de precipitación de 3200 mm anuales, con el mayor registro de lluvia de mayo a enero. Durante la estación seca (febrero-abril) la precipitación es menor a 50 mm mensuales. La temperatura promedio anual es de 25ºC; con valores más altos durante los meses de marzo a junio y los más bajos entre diciembre a febrero (23).
Descripción y manejo del ambiente protegido. El ambiente protegido fue construido con una cobertura completa de polietileno transparente con tratamiento ultravioleta. Y el minijardín por bancales a nivel del suelo. Se utilizó un sistema de fertirriego automatizado, utilizando una bomba (1 atm de presión) (25). Las plantas madre para el ensayo se produjeron vegetativamente de las colecciones genéticas de GENFORES como lo describe Badilla (24). Para el manejo del ensayo se utilizó el protocolo empleado por GENFORES en la producción comercial. Durante el experimento, la cosecha de los brotes se realizó cada 15 días durante un mes y medio.
Diseño experimental. El ensayo se estableció con un diseño factorial donde se evaluaron dos fitorreguladores y cuatro dosis de aplicación, con tres repeticiones (genotipos). La unidad experimental de cada tratamiento consistió en 14 plantas (rametos). Los fitorreguladores evaluados fueron (1) ácido giberélico (GA3) y (2) 6-bencilaminopurina (BAP). Las cuatro dosis correspondieron a 0 mgl-1 como testigo, 5 mgl-1, 10 mgl-1 y 20 mgl-1 (figura 1a).
La preparación de 100 ml para cada uno de los tratamientos (dosis de 20, 10 y 5 mgl-1), se obtuvo mediante una solución con 0,002, 0,001 y 0,0005 ± 0,0001 g de producto respectivamente. Cada concentración fue disuelta en una cantidad de 3-4 gotas de alcohol etílico al 95 % hasta conseguir la disolución total del fitorregulador (5), (12). Posteriormente, se adicionó agua destilada hasta completar 100 ml de disolución.
Se utilizó un dispensador de líquido de 50 ml de volumen, identificado para cada dosis y fitorregulador. Se procedió a rociar toda el área foliar de cada unidad experimental con aproximadamente 0,45 ml de solución por planta. Las aplicaciones se realizaron a las 6:00 am y tres días posterior a la cosecha de brotes (26). Para mantener un mejor control de la aplicación, se aisló cada parcela con una pared de cartón (figura 1b).
Figura 1. Ensayo de aplicación de dosis de GA3 y BAP en minijardines clonales de T. grandis. (a) Vista del bancal con la distribución de unidades experimentales, (b) aislamiento temporal con cartón, de cada parcela durante la aplicación del tratamiento (dosis), San Carlos, Costa Rica.
Figure 1. GA3 and BAP application trial in clonal mini gardens of Tectona grandis. (a) View of the bed with the distribution of experimental units, (b) temporary isolation with cardboard of each plot during the application of the treatment (dose), San Carlos, Costa Rica.
Variables de respuesta. Las variables fueron a) tasa de producción de brotes por planta madre en cada cosecha, b) producción de brotes por área (m2), c) longitud del brote (cm), d) mortalidad y e) tasa de enraizamiento de los brotes. Se crearon tres variables adicionales que evaluaron el enraizamiento de las estaquillas, bajo los principios utilizados con la velocidad de germinación de semillas (27, 28, 29). Para su determinación, se pusieron los brotes a enraizar al aire con base en la metodología de GENFORES (18). Los parámetros estimados fueron: enraizamiento diario medio, índice de velocidad de enraizamiento y valor del enraizamiento.
Para el enraizamiento diario medio (EDM), se utilizó la ecuación 1(29), (30):
En el que: ni= número de brotes enraizados al día i. t= tiempo de enraizamiento desde el día cero hasta el enraizamiento del último brote.
El valor del enraizamiento (VE) mediante la siguiente expresión de ecuación 2.
En donde: EDM= enraizamiento diario medio. VP= corresponde al enraizamiento diario medio máximo alcanzado en el ensayo.
El índice de velocidad de enraizamiento (IVE) se calculó mediante la fórmula dispuesta por Maguire (30) en ecuación 3.
Donde: P1, P2, P3…, Pn = número de brotes enraizados en el primer, segundo, tercer y último conteo de la evaluación. T1, T2, T3…, Tn = tiempo en días para cada enraizamiento.
Figura 2. Plantas madre de T. grandis en el minijardín clonal bajo el efecto del GA3 (a), San Carlos, Costa Rica.
Figure 2. Tectona grandis mother plants in the clonal mini garden under the effect of GA3, San Carlos, Costa Rica.
Análisis estadístico. Para el procesamiento de la información se utilizó Microsoft Excel 365 e InfoStat (IS) versión 2020. Se realizó comprobación de los supuestos de normalidad y homogeneidad de varianzas para proceder luego con un ANDEVA (p < 0,05). Una vez verificado los datos y encontradas diferencias entre los tratamientos, se aplicó la prueba de comparación múltiple de Tukey para el factor de los fitorreguladores y dosis aplicadas, y contrastes ortogonales para comparar las interacciones fitorregulador*dosis.
Resultados
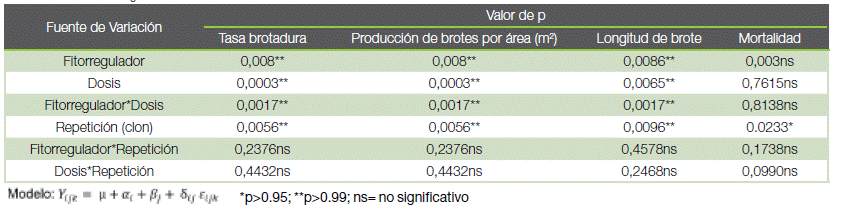
En el cuadro 1 se muestra el resultado del análisis de varianza con los valores de probabilidad basados en un nivel del 95 % de confiabilidad.
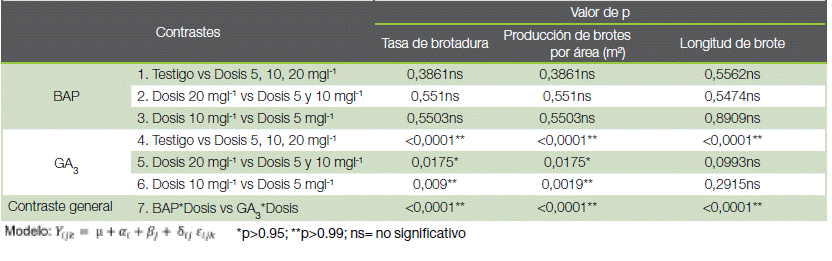
Cuadro 1. Efecto de la aplicación del GA3 y BAP en la productividad de minijardines clonales de teca, San Carlos, Costa Rica.
Table 1. Effect of GA3 and BAP application on the productivity of clonal teak mini gardens, San Carlos, Costa Rica.
El análisis de varianza, la tasa de brotadura, producción de brotes por metro cuadrado y longitud de brote mostraron diferencias significativas para los factores fitorregulador, dosis y la interacción fitorregulador*dosis. La variable mortalidad no presentó diferencias significativas en los factores mencionados (cuadro 1). En la prueba de comparación múltiple, el fitorregulador GA3 presentó el mejor rendimiento, con 1,30 brotes por planta y 188,17 brotes por área con relación al BAP que registró 0,96 brotes por planta y 139,78 brotes por metro cuadrado. Para la longitud de brote registró un promedio de 4,92 cm con GA3, mientras que con el BAP los brotes midieron 3,90 cm.
El efecto dosis, la prueba demostró la formación de dos grupos, que presentaron diferencias significativas para la producción de brotes. El primer grupo se formó entre el testigo y la dosis de 5 mgl-1 con valores entre 0,97 a 1,07 brotes por planta madre. El segundo grupo lo conformaron las dosis 10 mgl-1 y 20 mgl-1, con valores promedios de 1,23 a 1,25 brotes por planta respectivamente. Para longitud de brotes, las diferencias fueron entre el testigo (3,92 cm) y todas las dosis (4,45-4,68 cm), sin diferencias significativas entre ellas.
Se realizaron siete contrastes para la interacción (fitorregulador*dosis) en la producción y longitud de brotes (cuadro 2).
Cuadro 2. Contrastes ortogonales en la evaluación del efecto de dosis de GA3 y BAP en la productividad de minijardines clonales de T. grandis, San Carlos, Costa Rica.
Table 2. Orthogonal contrasts in the evaluation of the effect of GA3 and BAP doses on the productivity of clonal mini-gardens of Tectona grandis, San Carlos, Costa Rica.
Los resultados muestran que no hubo respuesta al aplicar el BAP en las plantas, reflejado en los tres primeros contrastes (figura 3). Para el caso del GA3 hubo diferencias significativas en los contrastes cuatro, cinco, seis y siete (cuadro y figura 2).
El cuarto contraste (GA3) presentó diferencias altamente significativas entre las dosis con respecto al testigo, para todas las variables. Con el quinto contraste (GA3), las diferencias se observaron en la producción de brotes con un mayor efecto al aplicar una dosis de 20 mgl-1 con respecto a 5 y 10 mgl-1. El sexto contraste (GA3) muestra el mismo comportamiento con la dosis 10 mgl-1 y 5 mgl-1.
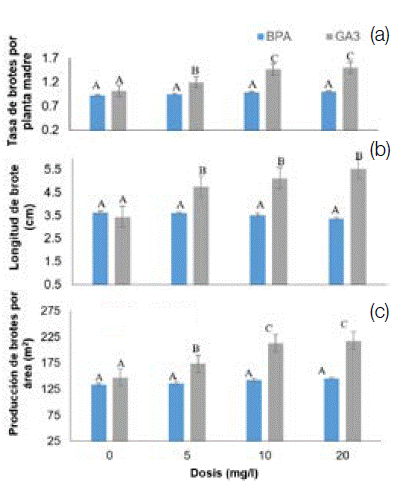
El efecto de la aplicación del GA3 en todas las dosis evaluadas, resultó en un aumento significativo y creciente para la producción (Figura 3) hasta alcanzar un 18, 44 y 47 % en los brotes por planta madre, y en un 18, 38 y 33 % por metro cuadrado con longitudes de brotes de 4,95, 5,30 y 5,61 cm respectivamente. Mientras que el testigo registró 1,02 brotes por planta madre, 147 brotes por metro cuadrado y 3,81 cm de longitud de brote.
Figura 3. Efecto de las dosis del GA3 y BAP en la tasa de brotes por planta madre, longitud de brotes y producción de brotes por área en minijardines clonales de T. grandis, San Carlos, Costa Rica.
Figure 3. Effect of GA3 and BAP doses on shoot rate per mother plant, shoot length and shoot production per area in clonal minigardens of Tectona grandis, San Carlos, Costa Rica.
El otro aspecto evaluado fue el efecto en la velocidad o vigor de enraizamiento. En el cuadro 3 se detalla el análisis de varianza de la evaluación en el proceso de enraizamiento de las mini estacas producidas en el ensayo experimental.
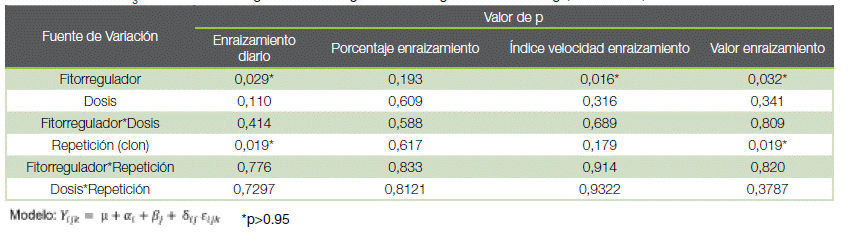
Cuadro 3. Efecto del GA3 y BAP en la tasa y vigor de enraizamiento de mini estaquillas de T. grandis, San Carlos, Costa Rica.
Table 3. Effect of GA3 and BAP on rooting rate and strenght of Tectona grandis mini cuttings, San Carlos, Costa Rica.
Se observa que el enraizamiento diario medio, índice velocidad enraizamiento y valor de enraizamiento, mostraron diferencias significativas (cuadro 3). Sin embargo, no lo hubo para el porcentaje de enraizamiento. La Repetición (clon) mostró diferencias en el enraizamiento diario medio y en el valor de enraizamiento.
En la prueba de comparación, el GA3 demostró ser superior al BAP. Para el enraizamiento diario medio, el GA3 presentó valores de 0,85 brotes, con un índice de velocidad de 1,30 brotes por día y un valor de enraizamiento de 0,42 unidades. En comparación con el fitorregulador BAP que presentó valores de 0,57 brotes a una velocidad de 0,83 brotes por día, y un valor de enraizamiento promedio de 0,25 unidades. El porcentaje de enraizamiento para ambos reguladores fue de casi el 100 %.
Discusión
En esta investigación, la aplicación de GA3, obtuvo un aumento significativo en la producción y longitud de brote, en contraste con el BAP. Sin embargo, en un estudio sobre Eustoma grandiflorum (Raf.) Shinn en vivero (31), reportó que la aplicación de 6 mg l-1 de BAP y la combinación de 6 mg l-1 de GA3 y BAP, aumentó un 300 % y 450 % el número de brotes por planta. En propagación in vitro de Prunus armenica L. se reportó un mayor número de brotes laterales a partir del uso de BAP a razón de 4,44 μmol l-1 y GA3 1,44 μmol l-1 (32).
En propagación in vitro de Gossypium barbadense L. se reportó el efecto creciente de BPA, con explantes de mayor altura, número de hojas y entrenudos con yemas axilares (33). En plantas in vitro de Amaranthus tricolor, se reportó un mayor vigor en la formación de plantas con una concentración de 0,20 mgl-1 de BAP (34). En propagación in vitro de T. grandis se reportó, que una concentración mayor a 0,5 mgl-1 de BAP, obtuvo un aumento significativo en la producción de brotes con relación al control (17).
En este estudio no se encontró diferencias significativas con la aplicación de BPA en relación con el testigo. Partiendo de la fisiología de la planta, donde el meristemo apical tras su decapitación estimula la activación de yemas dormantes (35), podría explicar la rápida aparición de nuevos brotes, producto de la acción de la auxinas AIA y ANA presentes en la zona apical; y la acción exógena de la giberelina debido a su promoción de crecimiento, lo que no sucede con las citoquininas que en su mayoría son sintetizadas en la raíz, de donde son transportadas a lo largo del tallo, por lo que se podrían ver temporalmente inhibidas a corto plazo, a pesar de su incorporación (36).
En concordancia, el estudio reveló que aplicar 10 mgl-1 y 20 mgl-1 de GA3 aumentó significativamente la producción y longitud del brote con respecto al testigo. Sin embargo, los brotes producidos bajo el efecto de la dosis de 20 mgl-1, exhibieron una hoja de menor tamaño y un tallo más fino. Akhtar et al. (37) mencionan que altas concentraciones de este fitorregulador tiende a producir brotes delgados y alargados, lo que dificulta su manipulación. Se ha reportado también en semilla artificial de Physalis peruviana L, un efecto negativo en la longitud de hoja y brote, al utilizar concentraciones altas (38). Y en tubérculos se encontró que un aumento en la concentración del GA3, promueve mayor producción vegetativa, pero reduce el peso del tubérculo, probablemente por la competencia por recursos. (39).
Por lo que la aplicación de 10 mgl-1 de GA3 no mostró evidencia de un efecto adverso, y favoreció el rendimiento en un 44 % en brotes por planta y 38 % en producción por metro cuadrado. Se analizó que el uso de 10 mgl-1 de GA3 implicaría un costo adicional mensual de US $0,10 por metro cuadrado, o US $ 0,001 por mini estaquilla.
En relación con la tasa de enraizamiento, no se determinó ningún efecto adicional al aplicar diferentes dosis de los fitorreguladores en los brotes de T. grandis. Ese mismo resultado se encontró en un estudio en propagación in vitro de S. macrophylla donde reportó que la adición de 0,5 ppm y 1 ppm de BAP, no favoreció la producción de raíces en los esquejes (40). En experiencias de propagación vegetativa en Orites myrtoidea, se reportó que los mejores resultados en la formación de raíces se lograron a partir de concentraciones de AIB entre 1 000 a 4 000 ppm, sin la necesidad de agregar ácido giberélico (GA) en la solución (41).
La mayor energía de enraizamiento observada con GA3 es un resultado que podría considerarse como esperado. La estaquilla se origina del corte del meristemo de la planta, y contiene una alta concentración de auxinas endógenas, que promoverán un rápido estímulo a la formación de raíces (42). Por tanto, la adición de dosis de giberelina pudo complementar la acción temprana e iniciar la formación de raíces.
En un estudio sobre germinación de Peumus boldus MOL se determinó que sumergir las semillas en GA3 a 10 g l-1 durante 48 horas genera el valor de germinación de 0,1 unidades, siendo el más alto con respecto a los otros tratamientos (43). En Physalis ixocarpa se observó que aplicar ácido giberélico incrementó significativamente la germinación presentando el IVE más alto de aproximadamente 5 semillas germinadas por día con respecto a otros ácidos como: el benzoico, salicílico y sulfosalicílico (44). Esto se explica con que el ácido giberélico está asociado a la rápida síntesis de aminoácidos y amidas, lo cual incrementa la tasa de germinación (46).
Este estudio, evidenció diferencias del clon en la productividad, donde el clon 2 fue el genotipo que registró el mayor rendimiento. Otros investigadores mencionan que estas diferencias son parte de la variación natural en los programas de mejoramiento genético (46). En la productividad de especies forestales y agrícolas, se menciona la alta relación con el genotipo (24), (47), (48), como en híbridos de Eucalyptus benthamii x Eucalyptus dunnii (49). En Solanum lycopersicum L. se menciona que el efecto del genotipo explica en mayor medida el rendimiento en producción clonal (50).
Finalmente, la mortalidad del ensayo se mantuvo entre 0,9 % a 5,6 %. Estos resultados estuvieron dentro de los valores utilizados en el sistema productivo (51). La sobrevivencia fue entre un 94 % y 99 %, similares a los reportados por Badilla (24) en Brasil, donde usó varios clones de T. grandis y reportó valores entre un 94 % hasta 100 %.
Conclusiones
La aplicación de GA3 en dosis de 10 mgl-1 y 20 mgl-1 aumenta la producción en un 44 y 47 % y longitud de brotes, en un 17 y 19 % respectivamente, en el minijardín clonal de T. grandis en ambiente protegido. Aplicar 10 mgl-1 de GA3 es suficiente para aumentar el rendimiento en la productividad del minijardín. La aplicación de BAP no mostró respuesta en el aumento de la producción de brotes del minijardín clonal de teca.