Introducción
La caña de azúcar (Saccharum officinarum L.) es un cultivo de gran importancia económica en el mundo, actualmente 110 países producen azúcar a partir de caña y el azúcar crudo comprende el 60 % del volumen del comercio internacional (International Sugar Organization (ISO), 2020). En Costa Rica el 17 % del área sembrada en cultivos permanentes corresponde a caña de azúcar (Instituto Nacional de Estadística y Censos (INEC), 2015). Entre las causas más importantes de la disminución de rendimiento en la producción de azúcar se encuentra el daño causado por insectos plagas (Badilla & Gómez, 2003; Cadet Piedra et al., 2016; Mendoza et al., 2013; Salazar et al., 2006).
Uno de los métodos más importantes en Costa Rica para el manejo integrado de plagas en caña de azúcar es el control biológico; el sector cañero utiliza de forma periódica la liberación de avispas parasitoides Cotesia flavipes Cameron (Hymenoptera: Braconidae), que parasita larvas de Diatraea spp., plaga importante barrenadora del tallo de la caña de azúcar (Salazar et al., 2016). Además, en las arvenses que crecen en los bordes de las plantaciones de caña, se ha observado la presencia de controladores biológicos nativos que utilizan tales plantas como refugio y alimento (Bustillo Pardey, 2013; Salazar, 2019).
Algunas arvenses comunes en lotes donde se siembra la caña, pueden servir de hospederas a insectos taxonómicamente similares a las plagas de caña de azúcar, lo que las convierte en hospederos alternos a enemigos naturales. El establecimiento de distintos eslabones y cadenas tróficas a través del tiempo, puede optimizar el establecimiento de enemigos naturales, lo que se traduce en servicios ecosistémicos importantes (Jones & Snyder, 2018). Como ejemplo, en caña de azúcar se reportó un incremento en el parasitismo de plagas de hasta un 65 % en áreas donde no se aplicó herbicidas para eliminar la vegetación nativa (Topham & Beardsley, 1975).
Distintos autores han reportado el efecto de arvenses circundantes en la disminución del ataque de plagas en varios cultivos (Banks, 2000; Boccaccio & Petacchi, 2009; Burgio, 2007; Costanzo & Bàrberi, 2013; Lamp et al., 1984; Oloumi-Sadeghi et al., 1987). La compleja red de interacciones que resulta del establecimiento de cadenas tróficas en el agroecosistema es la respuesta del ambiente para el control biológico de insectos plaga.
La presencia de insectos fitófagos es una muestra de un eslabón de las cadenas tróficas, estos pueden funcionar como hospederos alternos a parasitoides y depredadores cuando las plagas del cultivo aún no están presentes (Jones & Snyder, 2018; Norris & Kogan, 2005). Los insectos fitófagos de los subórdenes Sternorrhyncha y Auchenorrhyncha producen ligamaza, que es la secreción de un compuesto azucarado que contiene carbohidratos, aminoácidos y agua derivado del floema de las plantas, el cual es un importante recurso para insectos benéficos que se alimentan principalmente de proteína y aquellos con altas demandas energéticas como insectos voladores (Styrsky & Eubanks, 2007; Wäckers et al., 2005).
El néctar floral también es considerado un importante suplemento energético, sin embargo, este es dependiente del estado fenológico de las arvenses cercanas al cultivo, por lo que la diversidad de plantas que lo produzcan es de suma importancia en el ambiente. Además, este tipo de plantas pueden incrementar la secreción de compuestos más ricos y con mayor contenido de aminoácidos en respuesta al ataque de herbívoros, con la función de atraer enemigos naturales que ayuden a disminuir las poblaciones de fitófagos (Rudgers & Gardener, 2004; Wäckers et al., 2005). Se ha reportado también una mayor longevidad y capacidad reproductiva en depredadores que se alimentan de polen o de néctar (Takasu & Lewis, 1995).
Costa Rica presenta distintas regiones de producción de caña de azúcar que difieren entre sí por su topografía y condiciones edafoclimáticas. En este estudio se consideraron dos sitios: El Palmar en el Pacífico Central a 20 m s. n. m. y Turrialba en la provincia de Cartago, que se encuentra a 625 m s. n. m. La flora arvense presente en el Pacífico Central es representativa de otras zonas productoras de caña como el Pacífico Norte y Sur, mientras que las arvenses que se encuentran en la zona de Turrialba, son representativas de aquellas presentes en la zona Norte y el Valle Central (Soto-Saenz, 2018).
Debido a que una comunidad de diversas plantas puede estimular una mayor diversidad y abundancia de enemigos naturales que potencialmente disminuyan la incidencia de plagas en el cultivo, el objetivo de esta investigación fue estudiar la asociación entre insectos benéficos y arvenses presentes en bordes de plantaciones de cañales.
Materiales y métodos
El estudio se realizó en dos sitios: El Palmar, ubicado en el Pacífico Central, a una altitud de 20 m s. n. m. (10º1'35,60'' N; 84º46'59,15'' O), y Turrialba, Cartago a 625 m s. n. m. (9º50'8,50'' N; 83º39'17,86'' O). Estos sitios son representativos de dos de las ocho regiones productoras de caña de azúcar (Saccharum officinarum L.) de Costa Rica con diferente topografía y condiciones edafoclimáticas.
Se realizó una evaluación mensual desde abril hasta diciembre del 2018 en bordes de lotes con caña soca (plantas provenientes de un retoño que habían sido cortadas la temporada anterior), que tenían de uno a dos meses de edad al momento de la primera evaluación, mientras que la última evaluación se realizó cuando el dosel de la plantación ya había cerrado y no había ingreso de maquinaria ni disturbio dentro del cultivo. El periodo de estudio abarcó los meses de transición entre época seca y lluviosa, época lluviosa y transición entre época lluviosa y seca en ambos sitios, así como todas las etapas fenológicas del cultivo hasta maduración.
En cada evaluación se muestrearon veinte puntos por sitio, distribuidos aleatoriamente entre los bordes de los diferentes lotes de la plantación. En cada punto se colocó una estructura cuboide de 0,25 m3 envuelta en malla anti-áfidos. Se realizó un aspirado durante un minuto de todos los insectos presentes dentro de la estructura, por medio de un soplador de hojas modificado para aspirar (Cherrill, 2015; Doğramaci et al., 2011; Zou et al., 2016). En el extremo del aspirador se introdujo una bolsa de 20 cm x 15 cm, confeccionada con malla anti-áfidos, donde se recolectaron los insectos aspirados, estos se conservaron por punto de muestreo en bolsas plásticas de sello doble y se preservaron en frío para su posterior identificación según su familia, morfoespecie y hábito alimenticio. En cada punto se identificaron también las arvenses presentes. Para la identificación de los ejemplares se utilizaron claves taxonómicas y consultas a expertos nacionales e internacionales.
Los datos obtenidos fueron analizados por medio de los programas estadísticos SAS 9.4 (SAS Institute Inc, 2013) y R versión 3.6.1 (R Core Team, 2019). Por medio de los paquetes Vegan (Dixon, 2003) y BiodiversityR (Kindt & Coe, 2005), se realizaron los análisis de diversidad de morfoespecies de insectos y especies de arvenses al calcular el índice de Shannon-Wiener. También se comparó la abundancia y riqueza de morfoespecies por familia de insectos y plantas, por medio de la frecuencia de aparición acumulada en cada sitio.
Se realizó un análisis de probabilidad de ocurrencia conjunta entre las arvenses identificadas y aquella entomofauna clasificada como parasitoide o depredadora, con la ayuda del paquete estadístico Cooccur (Griffith et al., 2016). Se relacionó la probabilidad de observar ciertas familias de insectos en ciertas especies de arvenses y se obtuvo el valor de probabilidad de co-ocurrencia, se consideró como una asociación significativa positiva aquellos valores donde p<0,05 (Griffith et al., 2016).
Resultados
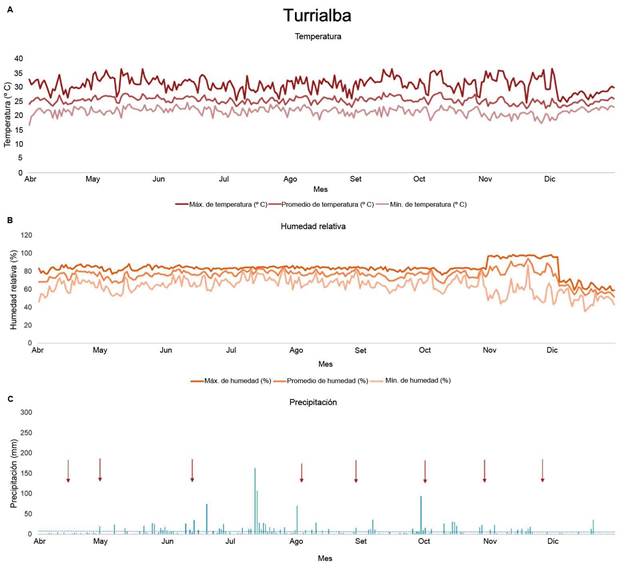
Condiciones climáticas de los sitios de estudioFigura 2
De acuerdo con los datos del Instituto Meteorológico Nacional (Solano León, 2018) en la zona del Pacífico Central, la estación lluviosa se estableció en el mes de abril, la transición entre lluviosa a seca se observó en el mes de octubre (Morera Rodríguez, 2018), se dio un evento precipitación en este mes (Poleo Brito, 2018), pero la estación seca inició en noviembre, condición que se pudo evidenciar al observar el cese de lluvias a partir de este mes (Figura 1).
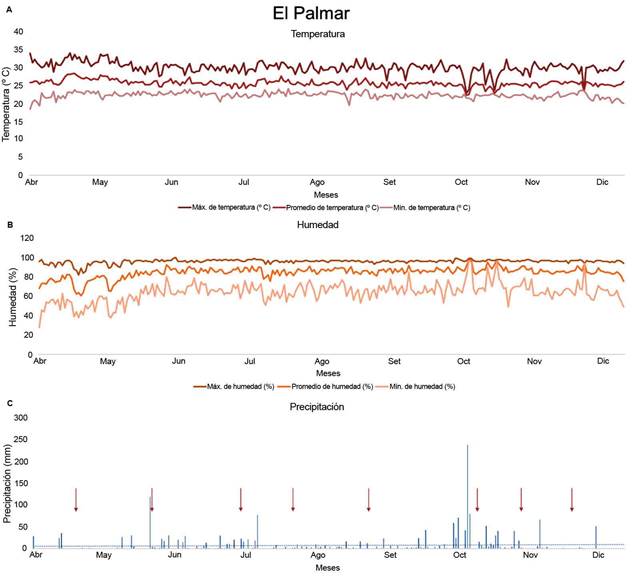
Figura 1 Datos meteorológicos de temperatura (ºC) (A), humedad relativa (%) (B) y precipitación diaria acumulada (mm) (C), recolectados por una estación meteorológica del Instituto Meteorológico Nacional de Costa Rica localizada en Aranjuez de Puntarenas, Costa Rica. Las flechas indican las fechas de muestreo. Pacífico Central, 2018.
Diversidad y ocurrencia de las arvenses
Se identificaron en ambas regiones en conjunto 157 especies de arvenses pertenecientes a 41 familias. En El Palmar se identificaron 83 especies, mientras que en Turrialba se identificaron 120 especies, en cada una de estas zonas se identificaron 33 familias.
La diversidad de arvenses fue mayor en Turrialba, se obtuvo un valor del índice de Shannon de 4,00 y de riqueza de 120 arvenses (Cuadro 1), mientras que en El Palmar el valor de Shannon fue 3,62 y el de riqueza de 83 especies (Cuadro 1).
Cuadro 1 Cantidad de familias, géneros y especies de arvenses identificadas en las áreas de El Palmar y Turrialba entre abril y diciembre del 2018. Pacífico Central y Cartago, Costa Rica. 2018.
| Sitio | Familias | Géneros | Especies |
| El Palmar | 33 | 58 | 83 |
| Turrialba | 33 | 86 | 120 |
| Total | 41 | 105 | 157 |
En ambos sitios se observó una tendencia de aumento en la diversidad de arvenses a lo largo del tiempo, excepto en el mes de agosto en Turrialba (Figura 3). Se encontraron diferencias significativas entre sitios en los meses de abril, octubre y diciembre (p=0,0389; p=0,0002 y p=0,0319, respectivamente).
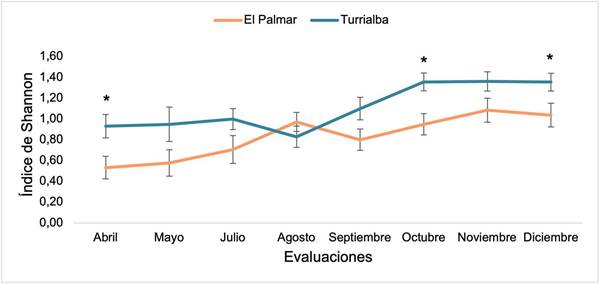
Figura 3 Diversidad de arvenses según el índice de Shannon para los sitios El Palmar y Turrialba, establecidos con caña de azúcar realizadas entre abril y diciembre (media +/- error estándar). Pacífico Central y Cartago, Costa Rica. 2018.
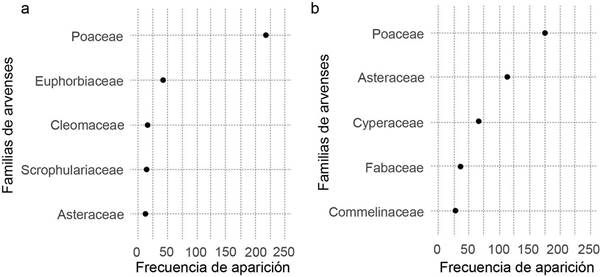
Los individuos de la familia Poaceae se presentaron con mayor frecuencia en El Palmar (50 % de todas las evaluaciones) en comparación con Turrialba (28 %). Además, en El Palmar (Figura 4a) se identificaron especies de las familias Euphorbiaceae, Cucurbitaceae y Cleomaceae, que no se observaron entre las primeras cinco en Turrialba (Figura 4b). Las arvenses de la familia Cyperaceae fueron las terceras más importantes en ambos sitios, sin embargo, en Turrialba se encontraron el triple de veces que en El Palmar (Figura 4).
Diversidad y ocurrencia de la entomofauna benéfica
En total se identificaron 13 689 insectos pertenecientes a 137 familias y 22 órdenes (Cuadro 2).
Cuadro 2 Cantidad de órdenes, familias e individuos de insectos identificados y recolectados en El Palmar y Turrialba entre abril y diciembre. Pacífico Central y Cartago, 2018.
| Zona | Órdenes | Familias | Individuos |
| El Palmar | 17 | 111 | 6917 |
| Turrialba | 20 | 112 | 6772 |
Ambos sitios presentaron valores de diversidad, riqueza (cantidad de morfoespecies) y abundancia acumulada de insectos similares (Cuadro 3).
Cuadro 3 Diversidad de insectos de acuerdo al Índice de Shannon, riqueza y abundancia de insectos de los sitios de El Palmar y Turrialba entre abril y diciembre. Pacífico Central y Cartago, Costa Rica. 2018.
| Zona | Diversidad (índice de Shannon) | Riqueza (cantidad de morfoespecies) | Abundancia (cantidad de individuos) |
| El Palmar | 4,57 | 269 | 6917 |
| Turrialba | 4,33 | 272 | 6772 |
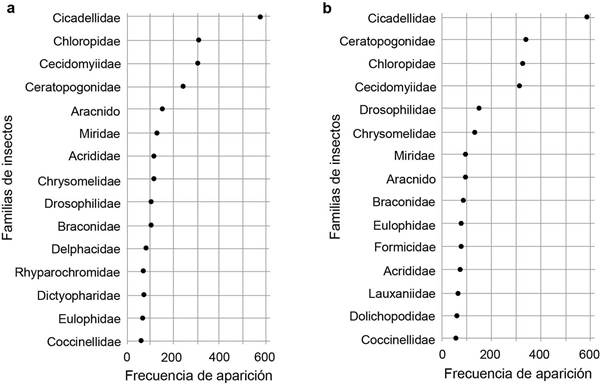
Los mayores valores correspondientes a frecuencia de aparición se observaron en individuos de la familia Cicadellidae en ambos sitios (Figura 5). La frecuencia de aparición de las familias Chloropidae, Cecidomyiidae y Ceratopogonidae, fue la más abundante entre las familias de las moscas y superior a doscientos en ambos sitios. La frecuencia de aparición de las avispas parasitoides Braconidae y Eulophidae fue similar en ambos sitios. Los depredadores Formicidae, Dolichopodidae y Coccinellidae aparecieron entre los primeros quince taxones en Turrialba, mientras que en El Palmar solo Coccinellidae apareció dentro de ese grupo. La aparición de arañas fue más frecuente en El Palmar que en Turrialba (Figura 5).
Asociación entre las arvenses y entomofauna benéfica
El análisis de ocurrencia conjunta brinda información acerca de una asociación positiva entre una planta y un insecto depredador cuando p<0,05. Se observó la mayor co-ocurrencia positiva entre dos arvenses de la familia Cyperaceae con insectos de la familia Coccinellidae (Cuadro 4). De manera similar, las asociaciones entre Peperomia pellucida (L.) Kunth y Miridae, y Murdannia nudiflora (L.) Brenan y Phyllanthus urinaria G.L.Webster con Dolichopodidae fueron también significativas (Cuadro 4).
Cuadro 4 Probabilidad de co-ocurrencia positiva entre especie de arvense y familia de insecto depredador o parasitoide. Pacífico Central y Cartago, Costa Rica. 2018.
| Especie arvense | Familia de insecto parasitoide | Probabilidad de co-ocurrencia | Valor p | Especie arvense | Familia de insecto depredador | Probabilidad de co-ocurrencia | Valor p |
| Fimbristylis miliacea (L.) Vahl | Chalcididae | 0,009 | 0,00486 | Kyllinga brevifolia Rottb. | Coccinellidae | 0,033 | 0,00045 |
| Panicum trichoides Cham. & Schltdl. | Eulophidae | 0,013 | 0,00597 | Cyperus esculentus L. | Coccinellidae | 0,014 | 0,00125 |
| Spermacoce laevis Spreng. | Eulophidae | 0,013 | 0,00597 | Peperomia pellucida (L.) Kunth | Miridae | 0,036 | 0,00450 |
| Drymaria cordata (L.) Roem. & Schult. | Eulophidae | 0,020 | 0,01055 | Murdannia nudiflora (L.) Brenan | Dolichopodidae | 0,044 | 0,00516 |
| Polygala paniculata L. | Mymaridae | 0,008 | 0,01118 | Phyllanthus urinaria G.L. Webster | Dolichopodidae | 0,009 | 0,00950 |
| Ageratum conyzoides L. | Eulophidae | 0,107 | 0,01134 | Ageratum conyzoides L. | Syrphidae | 0,038 | 0,01878 |
| Paspalum paniculatum L. | Braconidae | 0,010 | 0,01455 | Kyllinga brevifolia Rottb. | Syrphidae | 0,013 | 0,02175 |
| Hypericum gnidioides Seem. | Eulophidae | 0,010 | 0,01705 | Murdannia nudiflora (L.) Brenan | Arachnida | 0,068 | 0,03357 |
| Murdannia nudiflora (L.) Brenan | Eulophidae | 0,051 | 0,02074 | Spermacoce latifolia Aubl. | Dolichopodidae | 0,016 | 0,03408 |
| Spananthe paniculate Jacq. | Empididae | 0,013 | 0,02410 | Panicum trichoides Cham. & Schltdl. | Dolichopodidae | 0,011 | 0,03610 |
| Ageratum conyzoides L. | Mymaridae | 0,069 | 0,02587 | Kyllinga brevifolia Rottb. | Dolichopodidae | 0,031 | 0,03722 |
| Peperomia pellucida (L.) Kunth | Mymaridae | 0,020 | 0,03528 | Eryngium foetidum L. | Coccinellidae | 0,007 | 0,03780 |
| Cyperus diffusus Roxb. | Braconidae | 0,007 | 0,04273 | Spermacoce latifolia Aubl. | Coccinellidae | 0,017 | 0,04520 |
| Crassocephalum crepidioides (Benth.) S. Moore | Eulophidae | 0,008 | 0,04807 | Peperomia pellucida (L.) Kunth | Dolichopodidae | 0,027 | 0,04599 |
| Moehringia pentandra J.Gay | Eulophidae | 0,008 | 0,04807 | Emilia fosbergii | Arachnida | 0,088 | 0,04670 |
Con respecto a las probabilidades de ocurrencia conjunta entre parasitoides y arvenses, se determinó una mayor probabilidad de encontrar avispas Chalcididae en plantas de la especie Fimbristylis miliacea (L.) Vahl y Eulophidae en Panicum trichoides Cham. & Schltdl. y en Spermacoce laevis Spreng. Además, se observó la aparición de ciertas familias de insectos en múltiples plantas, como lo es el caso de Eulophidae, la cual se encontró en ocho especies diferentes arvenses (Cuadro 4).
Discusión
La presencia de múltiples depredadores y parasitoides en arvenses del cultivo de caña de azúcar registrados en este estudio brinda información sobre la importancia de estas en el ecosistema cañero. Este conocimiento permite entender la función ecológica de plantas que en muchas ocasiones son consideradas como malezas nocivas, lo cual brinda una visión más integral del agroecosistema y permite entender el establecimiento de sus cadenas tróficas.
En Turrialba se observó en promedio y a través del tiempo, una mayor diversidad y riqueza de arvenses que en El Palmar. Esto se podría deber a dos razones: primero, la aplicación de herbicidas para el control de malezas en El Palmar se realiza de forma mecanizada, ya que la zona es de topografía plana, lo que permite un control más amplio y eficiente de la vegetación, pero disminuye la diversidad de especies. En Turrialba, por su topografía irregular, las aplicaciones de herbicidas se realizan de forma manual, mediante el uso de equipo aspersor de mochila, lo que puede provocar una menor uniformidad de la aplicación y el escape de ciertas malezas. Segundo, la época lluviosa es más prolongada en Turrialba, lo que estimula el crecimiento y multiplicación de una mayor cantidad de especies e individuos de arvenses.
Con base en la teoría de los enemigos, un agroecosistema más diverso, como el brindado por una mayor diversidad de arvenses, es más efectivo en el control de las poblaciones de herbívoros (Russell, 1989). Esto se debe a que las arvenses ofrecen un reservorio de enemigos naturales disponibles para colonizar el cultivo al brindar disponibilidad de hospederos o presas (Norris & Kogan, 2005), debido a que por sus condiciones biológicas o morfológicas pueden servir de refugio, alimento suplementario como néctar o polen y vías de tránsito a insectos (Denys & Tscharntke, 2002; Mexzón, 1997; Pfiffner & Wyss, 2004; Stapel et al., 1997; Vargas Caicedo, 2011). Al respecto, Turrialba presentó una mayor diversidad de especies de plantas y una mayor frecuencia de aparición de grupos de enemigos naturales.
En cuanto a la diversidad de arvenses, las plantas pertenecientes a la familia Poaceae fueron las más abundantes en ambos sitios. Muchas gramíneas son eficientes en excluir otras arvenses (Cirujeda et al., 2019), lo que explica una menor frecuencia de aparición de otras familias en la zona de El Palmar, donde se observaron cantidades mayores de plantas clasificadas como Poaceae.
Las plantas Poaceae presentan potenciales efectos negativos como los observados con la presencia de Rottboellia cochinchinensis (Lour.) Clayton y la disminución del rendimiento de la caña de azúcar (Vibrans, 2010), o los efectos alelopáticos de Cynodon dactylon (L.) Pers. (García Torres, 1996). Se observó una relación entre la presencia de Poaceae y Cicadellidae, lo que concuerda con lo obtenido por Dietrich (1997) y Maes y Godoy (1993). Esta familia de insectos es muy valiosa en el agroecosistema, debido a su gran producción de ligamaza, la cual sirve de alimento suplementario a enemigos naturales consumidores de proteína (Wäckers et al., 2005).
En Turrialba se determinó la aparición frecuente de los parasitoides Braconidae y Eulophidae; los primeros se pueden reproducir en una gran variedad de insectos de los órdenes Hemiptera, Sternorrhyncha, Coleoptera, y Lepidoptera y en variedad de grupos de dípteros (Ayabe & Ueno, 2012; Boscán de Martínez & Godoy, 1982; Herrick et al., 2008; Hodges et al., 2013; Martínez et al., 2013; Read et al., 1970; Singer & Sttireman, 2003; Szujecki, 1987; Wen et al., 2004). Además, los Braconidae son insectos importantes para el control biológico de plagas lepidópteras en caña de azúcar (Salazar et al., 2016). La familia Eulophidae, por su parte, ataca insectos de los órdenes Sternorryncha, Coleoptera, Lepidoptera, Diptera, Hymenoptera, Thysanoptera y arañas (Bistline-East & Hoodle, 2014; Castillo et al., 2006; Fagundes Pereira et al., 2015; Gomes et al., 2013; Goulet & Huber, 1993; LaSalle, 1990; Lucia et al., 2010; Palmieri et al., 2013; Rojas Rojas, 2010; Schaefer et al., 1983; Strakhova et al., 2013).
Entre los primeros 15 insectos con mayor frecuencia de aparición en Turrialba se encontraron depredadores generalistas, que se alimentan de una gran variedad de presas y no poseen preferencia a grupos específicos como arañas, hormigas, moscas de la familia Dolichopodidae, que atacan ácaros, trips, Hemiptera, áfidos, Diptera y algunos Coleoptera (Aukema & Raffa, 2004; Brown et al., 2009; Ghahari et al., 2008), y la familia de escarabajos Coccinellidae que se pueden encontrar en el ambiente y atacan ácaros, trips, Sternorrhyncha, Auchenorrhyncha, Hemiptera, Coleoptera, y Lepidoptera (Afify & Farghaly, 1971; Crowson, 1981; De Clercq et al., 2003; Gavloski, 2017; Gerling, 1986; Hassanein & Hamed, 1984; Helle & Sanbelis, 1985; Medeiros, 2010; Nájera Rincón & Souza, 2010; Weiser Erlandson & Obrycky, 2010).
Se evidenció asociación positiva de depredadores de las familias Coccinellidae, Syrphidae y Dolichopodidae con la arvense Kyllinga brevifolia Rottb. y otras de la familia Cyperaceae. Estas plantas son importantes fuentes de néctar floral (Mexzón & Chinchilla, 2003). Estas tres familias de insectos son clasificadas como depredadoras generalistas y se alimentan de una gran variedad de insectos en el ecosistema, y como se mencionó previamente, las tres pueden alimentarse de ácaros, trips, hemípteros, áfidos, moscas y escarabajos (Afify & Farghaly, 1971; Arcaya et al., 2013; Aukema & Raffa, 2004; Brown et al., 2009; Crowson, 1981; De Clercq et al., 2003; Fréchette et al., 2007; Gavloski, 2017; Gerling, 1986; Ghahari et al., 2008; Hassanein & Hamed, 1984; Helle & Sanbelis, 1985; Medeiros, 2010; Nájera Rincón & Souza, 2010; Weiser Erlandson & Obrycky, 2010). Todos estos grupos presentan al menos una o varias especies plaga en caña de azúcar (Salazar et al., 2017).
La familia de insectos depredadores que presentó una mayor asociación con arvenses fue Dolichopodidae (p<0,05). Esta asociación se determinó con las plantas Murdannia nudiflora (L.) Brenan, Phyllanthus urinaria G.L.Webster, Spermacoce latifolia Aubl., Panicum trichoides Cham. & Schltdl., Kyllinga brevifolia Rottb. y Peperomia pellucida (L.) Kunth. Estos insectos se alimentan de artrópodos de cuerpo suave, tanto en su forma larval, como cuando son adultos, y han sido reportados como controladores de plagas importantes (Brown et al., 2009; Cisneros, 1995; Zumbado & Azofeifa, 2018).
La familia de insectos parasitoides Eulophidae presentó asociación positiva con ocho especies de arvenses. La mayor probabilidad de observar insectos Eulophidae se encontró en Panicum trichoides Cham. & Schltdl., Spermacoce laevis Spreng. y Drymaria cordata (L.) Roem. & Schult. (p<0,01), además de Ageratum conyzoides L., Hypericum gnidioides Seem. y Murdannia nudiflora (L.) Brenan (p<0,05). Se tiene evidencia de eulófidos que atacan a Diatraea spp., lepidóptero que barrena el tallo de la caña de azúcar y causa grandes pérdidas en el cultivo (Pyñeyro et al., 2016; Salazar et al., 2006; Vargas Caicedo, 2011).
La familia Braconidae, la cual se reporta como muy importante para el control biológico de plagas lepidópteras en caña de azúcar (Salazar et al., 2016), se asoció con Paspalum paniculatum L. (p<0,01) y Cyperus diffusus Roxb. (p<0,05). En Costa Rica se emplea la liberación masiva de Cotesia flavipes (Cameron) (Hymenoptera: Braconidae), de la familia Braconidae, para el control biológico de Diatraea spp., una de las principales plagas de caña de azúcar (Salazar et al., 2016). El conocimiento de las plantas que favorecen la presencia de este controlador biológico en el agroecosistema es de gran importancia para entender la ecología y establecimiento de las poblaciones de este parasitoide.
Ageratum conyzoides L. registró una asociación con las familias Eulophidae y Mymaridae (p<0,05). Mymaridae es una familia ampliamente registrada como parasitoide en un extenso rango de hospederos de los órdenes Orthoptera, Hemiptera, Auchenorrhyncha, Sternorrhyncha, Coleoptera, Diptera y Lepidoptera (Byrne & Toscano, 2006; Huber, 1986; Hanson, 2019; Hanson & Gauld, 1995; Triapitsyn & Shih, 2014). Se han registrado mymáridos como controladores de insectos de la familia Cercopidae, plaga importante en caña de azúcar (Salazar et al., 2017). Además, A. conyzoides es una fuente conocida de néctar y polen para insectos polinizadores en variados ecosistemas (Deeksha et al., 2023).
Este estudio brinda información acerca de la forma en la cual las poblaciones de insectos se comportan en los ambientes naturales en bordes de la caña de azúcar, lo cual es importante para un efectivo establecimiento de cadenas tróficas que ayuden a controlar sus plagas. De acuerdo con los principios de conservación de los recursos naturales, se deben identificar los elementos particulares de cada recurso y su papel en el ecosistema, al identificar las incertidumbres ecológicas e incrementar el conocimiento de los recursos del ecosistema es posible desarrollar e implementar su manejo eficiente (Badii et al., 2008). Cada elemento dentro del ecosistema, tiene una función, la preservación de la biodiversidad a un nivel de espacio como el paisaje, puede llegar a ser extremadamente complejo en sus procesos e interacciones espaciotemporales (Büchs, 2003). Al tener en cuenta que la biodiversidad en los agroecosistemas a nivel mundial se encuentra en rápido decrecimiento (Gliessman, 2019), investigaciones que buscan comprender, conservar y utilizarla de manera productiva son de gran importancia.
Conclusiones
Se identificaron en total 140 especies de arvenses pertenecientes a 41 familias diferentes, 83 especies en El Palmar y 120 en Turrialba. Se identificaron 137 familias de artrópodos, 111 en El Palmar y 112 en Turrialba, y en total se clasificaron 13 689 individuos. Se determinó una mayor diversidad, riqueza y abundancia de arvenses en Turrialba, mientras que para insectos estos parámetros se mantuvieron similares.
La familia de arvenses e insectos con mayor aparición en ambas zonas de estudio fueron Poaceae y Cicadellidae respectivamente, lo que demostró una relación entre la presencia de ambas familias en el ecosistema.
La mayor co-ocurrencia de insectos depredadores se observó con Coccinellidae en Kyllinga brevifolia Rottb. y Cyperus esculentus L., y para insectos parasitoides con Chalcididae en Fimbristylis miliacea (L.) Vahl y con Eulophidae en Panicum trichoides Cham. & Schltdl., Spermacoce laevis Spreng y Drymaria cordata (L.) Roem. & Schult.
Se determinó una relación entre las arvenses de la caña de azúcar y potenciales enemigos naturales de las plagas de este cultivo. A través del establecimiento de este tipo de cadenas tróficas se podrían utilizar estas relaciones como herramientas ecosistémicas para el manejo integrado de plagas de la caña de azúcar.