Introducción
La reproducción es uno de los factores principales que limitan la productividad de un sistema ganadero y está relacionada con la demanda de alimentos a nivel mundial (Fernandes Júnior et al., 2022; Thundathil et al., 2016; Ugur et al., 2019). En la producción de ganado de carne el macho juega un rol importante, debido a que gran parte de los bajos porcentajes de preñez en los hatos están relacionados con problemas de fertilidad o subfertilidad (Barth, 2018). Un factor determinante en el desempeño reproductivo de un toro es el manejo que se le brinda, de manera que si el animal se tiene en constante monta el desempeño será diferente a los animales en descanso, lo que repercute en la posible fertilidad de este (Pongsiri et al., 2020; Şahin et al., 2020; Schenk, 2018; Taaffe et al., 2022).
La fertilidad es multifactorial (Calderón-Calderón et al., 2022; Ilacqua et al., 2018; Kondracki et al., 2012; Valverde et al., 2018; Wu et al., 2019), por lo que esta no puede ser diagnosticada a partir de un solo análisis (Thundathil et al., 2016). Uno de los métodos más utilizados para el diagnóstico de la fertilidad potencial de un macho bovino es el análisis de semen (Valverde, Madrigal, et al., 2019; Valverde, Madrigal-Valverde, et al., 2019); sin embargo, este solo evalúa la concentración, la integridad de la membrana y la movilidad de las células dentro de un eyaculado. No obstante, la determinación de estas variables no es objetiva para diagnosticar la fertilidad de un animal (Gadea et al., 2004).
Dada la relevancia de la evaluación del semen en la reproducción de las especies, la tecnología CASA (Computer Assisted Semen Analysis) fue desarrollada en la penúltima década del siglo XX (Amann & Waberski, 2014; Mortimer et al., 2015). Esta tecnología fue diseñada para la evaluación de la movilidad de los espermatozoides, sin embargo, debido a su potencial se ha ampliado su funcionalidad, lo cual ha permitido un análisis más profundo de las características cinemáticas y morfométricas del eyaculado (Waberski et al., 2022). La implementación de estos sistemas de análisis seminal sustituye los diagnósticos subjetivos realizados bajo otras metodologías, disminuye el error de muestreo y brinda un ahorro considerable de tiempo en el análisis de las muestras (Valverde & Madrigal-Valverde, 2018).
A pesar de que los sistemas CASA son una herramienta en la predicción de la fertilidad asociada al macho, aplicable a la hora de utilizar un padrote o utilizar su semen en inseminación artificial (IA) dentro del hato (Sundararaman et al., 2012), existen una serie de factores que pueden condicionar el análisis de las muestras como es el caso del frame rate (Bompart et al., 2018; 2019; Caldeira et al., 2019; Valverde, Madrigal et al., 2019; van der Horst, 2020), profundidad y tipo de cámara de recuento utilizada (Ibănescu et al., 2016; Valverde, Madrigal et al., 2019; van der Horst, 2020; Víquez et al., 2021), la temperatura de análisis (Víquez et al., 2021) y resolución de la cámara de video (van der Horst, 2020), especie (Kondracki et al., 2012), dilución (Broekhuijse et al., 2011), tiempo entre la extracción y el análisis (Hahn et al., 2019) y el diluyente utilizado (Víquez et al., 2021).
La principal función del empleo de sustancias para dilución de las muestras de semen es proveer una fuente de energía a las células, la cual permita su conservación por un tiempo mayor (Tvrdá et al., 2013), con el fin de mantener la integridad de la membrana in vitro de las células (Siudzińska & Łukaszewicz, 2008). Los diluyentes tienen la función de regular el pH y mantener la presión osmótica sin importar si son isotónicos o hipertónicos (Gadea, 2003) y pueden también tener en su composición antioxidantes que evitan que los espermatozoides sufran estrés oxidativo, lo que disminuye el daño celular y la afectación de las características de las células (Sikka, 2004).
La composición y características propias de los medios de dilución afectan la cinética de las células espermáticas (Morrell et al., 2018) y la dinámica de las subpoblaciones (Víquez et al., 2021), ya sea por la temperatura, el tipo utilizado (Murphy et al., 2016; Murphy, Eivers, et al., 2018), la disolución empleada (Büyükleblebici et al., 2014)y la especie que se analice (Víquez et al., 2021). El objetivo del presente trabajo fue evaluar el efecto de dos diluyentes comerciales, la edad y estado sexual de los toros sobre la movilidad y cinética espermática del semen fresco bovino.
Materiales y métodos
Sitio de estudio y periodo experimental
El estudio se llevó a cabo durante el periodo de marzo a agosto del 2021, en las fincas ganaderas ''La Vega'', ubicada en La Vega de Florencia, San Carlos (10°25'20,98'' norte; 84°31'17,57'' oeste); este sistema de producción se encuentra a una altitud de 70 m s. n. m.; y la finca ''La Balsa'' localizada en San Lorenzo, San Ramón (10°21'8,60'' norte, 10°31'17,13'' oeste) a 180 m s. n. m. Ambos sistemas de producción corresponden a la Unidad de Ganado de Carne, del Programa de Producción Agropecuario (PPA) de la Escuela de Agronomía del Instituto Tecnológico de Costa Rica, Campus Tecnológico Local San Carlos. Al momento de realizar la investigación, las fincas contaban con un certificado veterinario de operación (CVO) vigente, los hatos se encontraban libres de tuberculosis y brucelosis, se contó con un control sanitario mediante vacunaciones y desparasitaciones, y se llevaban registros genealógicos y productivos de todos los animales.
Animales y recolección de las muestras
El uso y cuidado de los animales en tratamientos experimentales cumplió con los principios éticos en la investigación científica, aprobados por el Comité Técnico del Centro de Investigación y Desarrollo de la Agricultura Sostenible para el Trópico Húmedo del Instituto Tecnológico de Costa Rica (CIDASTH-ITCR), de acuerdo con la sección 01/2019, artículo 1.0, DAGSC-074.
Se utilizaron trece animales seleccionados como reproductores de la raza Brahman (Bos indicus), cuya edad promedio fue de 45,50 ± 19,24 meses. Se definieron dos cohortes de animales por edad, con un punto de inflexión en 48 meses. Los grupos de edades tuvieron una edad promedio de 57,29 ± 13,59 meses (>48 meses) y 25,83 ± 1,60 meses (<48 meses).
Se definió el estado sexual de los animales en función de si provenían de exposición a vacas (monta) o descanso sexual. Los animales en monta natural rotaron en parejas con el grupo de hembras durante intervalos de siete días. A cada toro se le extrajeron al menos dos eyaculados por medio de la técnica de electroeyaculación descrita por Ball y Furman (1972). El intervalo de extracción de una muestra a otra fue de al menos siete días y se obtuvo 45 eyaculados en total. Para la extracción de las muestras se utilizó un electroeyaculador marca Pulsator V® (Lane Manufacturing Inc, Denver, CO, EEUU) y una prensa hidráulica para inmovilizar el animal sin sedación. Una vez el animal estaba inmovilizado se evaluó la condición física en general y en los testículos se examinó la movilidad dentro de la bolsa escrotal, simetría, consistencia y circunferencia escrotal (CE).
Previo a la implementación de la técnica de electroeyaculación, se revisó el área del prepucio, se limpió y recortó el pelo del área con el fin de evitar la contaminación de la muestra. De igual forma, se introdujo la mano con guante en el área del recto para extraer la materia fecal que se encontraba en el intestino del animal. Una vez se hizo el retiro de la materia fecal, se procedió a realizar un masaje transrectal del área cuyo fin fue estimular las glándulas accesorias (glándulas vesiculares y ampollas de los conductos deferentes) y la próstata por un lapso de uno a dos minutos, para lograr un relajamiento del esfínter anal previo a la introducción de la sonda-electrodo del electroeyaculador.
Para la introducción de la sonda transrectal, de 75 mm, se lubricó la misma y luego se ingresó en el recto del animal. La cola del animal se levantó a 90º para facilitar el proceso de introducción, una vez se introdujo la sonda se dirigió hacia abajo con movimientos rotatorios. Se utilizó el modo automático del electroeyaculador (Pulsator®) como se ha descrito por Romano et al. (2021). Se comenzó con estímulos mínimos que según la reacción el animal se aumentaron. De forma automática se aplicaron estímulos de 36 ciclos (dos segundos por ciclo). Sin embargo, si no se observó una respuesta del animal (exposición del pene) o este no eyaculaba durante el lapso supra citado, este se dejó descansar desde cinco a ocho minutos y se volvió a iniciar con otros 36 ciclos.
La recolección del semen se hizo de forma directa del pene del animal, mediante un tubo colector estéril desechable (tubo Falcon® de 15 mL). Se colocaron submuestras del eyaculado en dos tubos Eppendorf® (Sigma-Aldrich, St. Louis, MO, EEUU), que contenían los diluyentes Optixcell® (IMV Technologies, L'Aigle, Francia) y Bioxcell® (IMV Technologies, L'Aigle, Francia) en una proporción 1:1 v/v y a 37 °C.
La preparación de cada uno de los diluyentes se hizo previo a la recolección de las muestras y de acuerdo con las instrucciones del fabricante mediante una dilución 1:2 v/v con agua bidestilada. Las muestras se colocaron en una placa calefactora a 37 °C mientras se extraía la del siguiente toro, con el fin de evitar el choque térmico en las células espermáticas. Una vez se finalizó con la labor de extracción, tanto los tubos Eppendorf® con las disoluciones y los tubos Falcon® con los eyaculados se transportaron en una hielera de poliestireno a 37 °C al Laboratorio de Reproducción Animal del Instituto Tecnológico de Costa Rica, Campus Tecnológico Local San Carlos para su posterior análisis.
Análisis espermático
Se colocaron 2,7 μL de la muestra en una cámara de recuento espermático Spermtrack®; de 20 μm de profundidad, que estuvo precalentada por una placa calefactora a 37 °C antes de colocar la muestra, previo a la toma de la alícuota de la muestra, esta se mezcló y homogenizó. Para el análisis de la movilidad del semen se utilizó el sistema comercial de análisis de esperma asistido por computadora, el sistema CASA-Mot ISAS®v1 (Proiser R + D, S.L., Paterna, España), equipado con una cámara de video Proiser 782M (Proiser R + D). Se tomaron veinticinco imágenes con una velocidad de fotogramas de 40 fotogramas/s por un periodo de 0,625 s con una resolución final de 768 x 576 píxeles. La cámara se conectó al microscopio UB203 (UOP / Proiser R + D) con un ocular 1X, un objetivo de contraste de fase negativa 10X (AN 0,25) y una placa calefactora integrada a 37,0±0,5 °C. Los demás parámetros utilizados para la especie fueron los del equipo por defecto.
Se realizaron dos repeticiones de cada uno de los eyaculados, uno por cada diluyente, en los cuales se capturaron siete campos por repetición a lo largo de la cámara de recuento espermático para alcanzar un promedio de seiscientos espermatozoides por muestra. Los resultados obtenidos se almacenaron para realizar el análisis detallado de las trayectorias de cada una de las células estudiadas. Las variables de respuesta en el análisis de movilidad fueron la frecuencia de entrecruzamiento (BCF) en Hz, los porcentajes de movilidad total (MT), movilidad progresiva (MP), linealidad (LIN), rectitud (STR), oscilación (WOB), velocidad rectilínea (VSL µms-1), velocidad curvilínea (VCL µms-1), velocidad media (VAP µms-1), el desplazamiento lateral de la cabeza (ALH) en µm y la variable dance (DNC) en µm2 s-1, la cual es producto de VCL×ALH (Contri et al., 2012).
Se calculó la concentración de espermatozoides en el eyaculado mediante el uso de un fotómetro marca Accuread® (IMV Technologies, L'Aigle, Francia). Previo a realizar el cálculo de la concentración, se calibró el fotómetro con agua destilada. Una vez calibrado el equipo en una micro cubeta, se realizó una disolución en una proporción 1:100 v/v de semen puro con agua destilada. De cada eyaculado se realizaron dos repeticiones y se reportó el promedio en millones de espermatozoides por mililitro de semen.
Análisis estadístico
El análisis de normalidad y homocedasticidad se realizaron mediante las pruebas de Shapiro-Wilks y Levene, respectivamente, para los datos de los análisis CASA-Mot de todos los espermatozoides analizados. Se confirmó el supuesto de la distribución normal mediante la utilización del papel probabilístico normal. Se realizó un análisis de varianza para determinar los efectos del diluyente, la edad y el estado sexual de los toros, así como las interacciones entre factores. El efecto de los factores se determinó sobre las variables cinéticas y de movilidad espermática. Se agregó un efecto residual aleatorio al modelo para tomar en cuenta las correlaciones entre diferentes eyaculados obtenidos del mismo toro. Cuando los efectos antes descritos fueron significativos se realizaron pruebas de comparación de medias ± error estándar de la media (EE) mediante la prueba de Bonferroni. La significancia estadística se definió con un p-valor (p<0,05). Los datos se analizaron con el paquete IBM SPSS, versión 23.0 para Windows (SPSS Inc., Chicago, IL, EEUU).
Resultados
En al análisis de movilidad espermática, no hubo un efecto significativo (p>0,05) al utilizar los diluyentes comerciales Bioxcell® y Optixcell® sobre la MT. Sin embargo, sí se observó un efecto significativo (p<0,05) sobre la MP, donde los valores más altos se obtuvieron en Bioxcell® (64,03±2,01 %) respecto a un 54,10±2,01 % en Optixcell® (Cuadro 1). Los espermatozoides diluidos en Bioxcell® presentaron un movimiento lineal rápido y progresivo en relación con un movimiento más lento, no progresivo y oscilatorio presentado con el diluyente Optixcell® (Figura 1). La VSL (103,70±0,26 μm s-1) y VAP (110,65±0,26 μm s-1) fueron significativamente mayores (p<0,05) en Bioxcell® en comparación con Optixcell® con 86,60±0,24 μm s-1 y 106,67±0,24 μm s-1, respectivamente (Cuadro 1).
Cuadro 1 Variables de movilidad y cinética espermática (media ± EE) en semen fresco de toros Brahman (Bos indicus), medidas en dos diluyentes seminales. Instituto Tecnológico de Costa Rica, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos, Costa Rica. 2021.
| Variable | Bioxcell® | Optixcell® |
| MT | 71,33±2,20 | 73,88±2,20 |
| MP | 64,03±2,01a | 54,10±2,01b |
| VCL | 140,88±0,40b | 179,27±0,37a |
| VSL | 103,70±0,26a | 86,60±0,24b |
| VAP | 110,65±0,26a | 106,67±0,24b |
| LIN | 72,47±0,11a | 50,34±0,10b |
| STR | 89,99±0,11a | 79,35±0,10b |
| WOB | 78,05±0,08a | 61,26±0,07b |
| ALH | 2,63±0,01b | 3,77±0,01a |
| BCF | 15,24±0,03b | 17,17±0,03a |
| DNC | 429,54±3,08b | 814,98±2,84a |
MT: movilidad total (%); MP: movilidad progresiva (%); VCL: velocidad curvilínea (µm s-1); VSL: velocidad rectilínea (µm s-1); VAP: velocidad promedio de la trayectoria (µm s-1); LIN: linealidad de la progresión (%); STR: índice de rectitud (%); WOB: oscilación de la trayectoria (%); ALH: amplitud del desplazamiento lateral de la cabeza (µm); BCF: frecuencia de entrecruzamiento (Hz); DNC: dance (µm2 s-1). EE: error estándar de la media. a-b Letras diferentes dentro de línea, indican diferencias entre los diluyentes p<0,05. / MT= total motility (%); MP= progressive motility (%); VCL: curvilinear velocity (µm s-1); VSL: straight-line velocity (µm s-1); VAP: average path velocity (µm s-1); LIN: linearity of forward progression (%); STR: straightness index (%); WOB: oscillation of the trajectory (%); ALH: amplitude of lateral head displacement (µm); BCF: beat-cross frequency (Hz); DNC: dance (µm2 s-1). EE: standard error of the mean. a-b Different letters within rows, indicate differences between extenders p<0.05.
La VCL presentó un patrón significativamente diferente, con un valor mayor con el diluyente Optixcell® (179,27±0,37 μm s-1) respecto a Bioxcell® (140,88±0,40 μm s-1). Las variables de relaciones de la velocidad espermática LIN (72,47±0,11), STR (89,99±0,11) y WOB (78,05±0,08) fueron mayores significativamente con el diluyente Bioxcell®. Las variables de oscilación espermática ALH (3,77±0,01 μm) y BCF (17,17±0,03 Hz) fueron mayores significativamente en el diluyente comercial Optixcell®. La variable DNC (814,98±2,84) fue significativamente mayor en Optixcell® (Cuadro 1).
El efecto de la edad de los animales sobre la variable MT no fue estadísticamente significativo (p>0,05), sin embargo, sí influyó significativamente sobre la MP. Los animales mayores a 48 meses presentaron MP de 62,27±1,87 % respecto a 55,86±2,14 % en los toros menores de 48 meses. Se observó un efecto (p<0,05) de la edad de los animales sobre la VSL, los animales mayores de 48 meses presentaron los valores medios más altos respecto a los menores de 48 meses con 95,66±0,26 μm s-1 y 94,64±0,26 μm s-1, respectivamente (Cuadro 2).
Cuadro 2 Variables de movilidad y cinética espermática (media ± EE) en semen fresco de toros Brahman (Bos indicus), medidas en diferentes edades. Instituto Tecnológico de Costa Rica, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos, Costa Rica. 2021.
| Variable | >48 meses | <48 meses |
| MT | 75,20±2,05a | 70,00±2,34a |
| MP | 62,27±1,87a | 55,86±2,14b |
| VCL | 159,93±0,38a | 160,22±0,39a |
| VSL | 95,66±0,26a | 94,64±0,26b |
| VAP | 108,66±0,25a | 108,66±0,25a |
| LIN | 61,19±0,11b | 61,63±0,11a |
| STR | 85,14±0,10a | 84,20±0,10b |
| WOB | 69,08±0,08b | 70,23±0,08a |
| ALH | 3,16±0,01b | 3,24±0,01a |
| BCF | 16,43±0,03a | 15,97±0,03b |
| DNC | 605,29±2,93b | 639,22±2,99a |
MT: movilidad total (%); MP: movilidad progresiva (%); VCL: velocidad curvilínea (µm s-1); VSL: velocidad rectilínea (µm s-1); VAP: velocidad promedio de la trayectoria (µm s-1); LIN: linealidad de la progresión (%); STR: índice de rectitud (%); WOB: oscilación de la trayectoria (%); ALH: amplitud del desplazamiento lateral de la cabeza (µm); BCF: frecuencia de entrecruzamiento (Hz); DNC: dance (µm2 s-1). EE: error estándar de la media. a-b Letras diferentes dentro de línea, indican diferencias entre las edades de los toros p<0,05. / MT: total motility (%); MP: progressive motility (%); VCL: curvilinear velocity (µm s-1); VSL: straight-line velocity (µm s-1); VAP: average path velocity (µm s-1); LIN: linearity of forward progression (%); STR: straightness index (%); WOB: oscillation of the trajectory; ALH: amplitude of lateral head displacement (µm); BCF: beat-cross frequency (Hz); DNC: dance (µm2 s-1). EE: standard error of the mean. a-b Different letters within rows, indicate differences between bull ages p<0.05.
Los parámetros de velocidad espermática (VAP y VCL) no presentaron diferencias entre los dos grupos de edades (p>0,05). Sí hubo un efecto de la edad (p<0,05) sobre LIN, STR y WOB. La LIN fue superior (p<0,05) en animales menores de 48 meses respecto de los adultos (>48 meses) con valores de 61,63±0,11 % y 61,19±0,11 %, respectivamente. Un fenómeno similar se presentó para la variable WOB. Esto sugiere un comportamiento menos lineal y oscilatorio en la trayectoria de estos últimos (Figura 1).
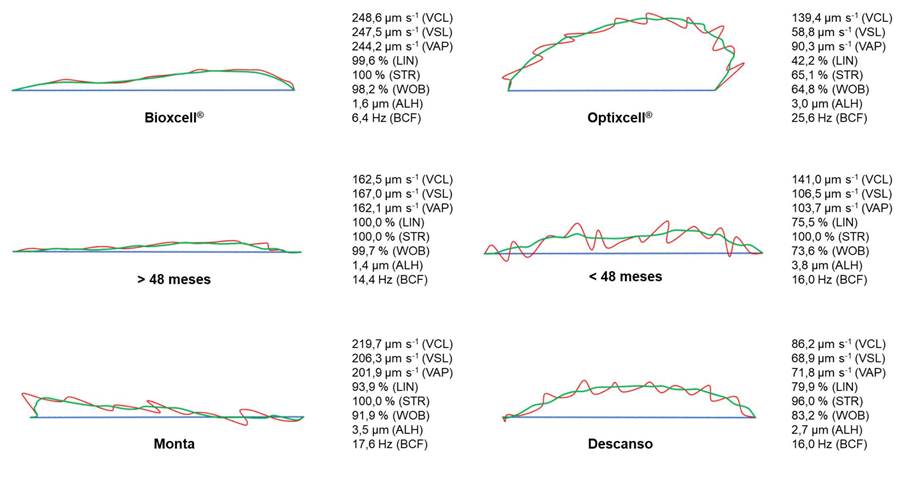
Figura 1 Trayectoria de espermatozoides según diluyente, edad y estado sexual en toros Brahman (Bos indicus). Instituto Tecnológico de Costa Rica, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos, Costa Rica. 2021.
La STR fue mayor (p<0,05) en los animales de mayores de 48 meses (85,14±0,10 %) respecto a los menores de esa edad (84,20±0,10 %). Los animales menores de 48 meses presentaron valores más altos para la ALH (3,24±0,01 μm) y DNC (639,22±2,99), que fueron significativamente diferentes (p<0,05) a los observados para los animales mayores de 48 meses. La BCF presentó diferencias significativas entre los dos grupos de edades (p<0,05), y los valores más altos se observaron en los animales mayores de 48 meses (Cuadro 2).
En cuanto al estado sexual de los animales, no se encontró un efecto estadísticamente significativo (p>0,05) sobre las variables MT y MP. Sin embargo, este sí influyó (p<0,05) sobre las variables de cinética espermática. La VSL y VAP fueron significativamente mayores (p<0,05) en los animales que estuvieron en monta (99,09±0,32 µm s-1; 112,13±0,31 µm s-1) respecto a los que estaban en descanso (91,21±0,17 µm s-1; 105,20±0,17 µm s-1). La VCL (163,22±0,26 µm s-1) fue significativamente mayor en los animales que estuvieron en descanso. Se evidenció un efecto (p<0,05) sobre las variables de linealidad y rectitud de las células (LIN, STR y WOB), que fueron las medias mayores durante la monta (Cuadro 3), lo que describe una mayor progresividad en la trayectoria respecto al descanso (Figura 1). Las variables de oscilación espermática ALH y BCF fueron mayores (p<0,05) durante el descanso sexual. La variable DNC presentó el mismo comportamiento, ya que fue significativamente mayor (p<0,05) durante el descanso sexual respecto a la monta natural (Cuadro 3).
Cuadro 3 Variables de movilidad y cinética espermática (media ± EE) en semen fresco de toros Brahman (Bos indicus), medidas según estado sexual. Instituto Tecnológico de Costa Rica, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos, Costa Rica. 2021.
| Variable | Descanso | Monta |
| MT | 74,76±1,72a | 70,44±2,60a |
| MP | 59,71±1,57a | 58,42±2,37a |
| VCL | 163,22±0,26a | 156,93±0,48b |
| VSL | 91,21±0,17b | 99,09±0,32a |
| VAP | 105,20±0,17b | 112,13±0,31a |
| LIN | 57,50±0,07b | 65,32±0,13a |
| STR | 83,47±0,07b | 85,87±0,13a |
| WOB | 66,10±0,05b | 73,21±0,10a |
| ALH | 3,38±0,01a | 3,02±0,01b |
| BCF | 16,51±0,02a | 15,89±0,04b |
| DNC | 660,77±2,00a | 583,75±3,68b |
MT: movilidad total (%); MP: movilidad progresiva (%); VCL: velocidad curvilínea (µm s-1); VSL: velocidad rectilínea (µm s-1); VAP: velocidad promedio de la trayectoria (µm s-1); LIN: linealidad de la progresión (%); STR: índice de rectitud (%); WOB: oscilación de la trayectoria (%); ALH: amplitud del desplazamiento lateral de la cabeza (µm); BCF: frecuencia de entrecruzamiento (Hz); DNC: dance (µm2 s-1). EE: error estándar de la media. a-b Letras diferentes dentro de línea, indican diferencias entre el estado sexual del animal p<0,05. / MT: total motility (%); MP: progressive motility (%); VCL: curvilinear velocity (µm s-1); VSL: straight-line velocity (µm s-1); VAP: average path velocity (µm s-1); LIN: linearity of forward progression (%); STR: straightness index (%); WOB: oscillation of the trajectory (%); ALH: amplitude of lateral head displacement (µm); BCF: beat-cross frequency (Hz); DNC: dance (µm2 s-1). SEM: standard error of the mean. a-b Different letters within rows, indicate differences between sexual state of the animal p<0.05.
La interacción entre las variables fijas diluyente × edad y edad × estado sexual del animal, presentaron diferencias significativas estadísticamente (p<0,05) para todas las variables de cinética espermática (VCL, VSL, VAP, LIN, STR, WOB, ALH, BCF y DNC). La interacción diluyente × estado sexual del animal fue significativa para VCL, VSL, LIN, WOB, ALH y DNC, sin embargo, esta no fue significativa para la variable de velocidad VAP, la relación de velocidades STR y la variable de oscilación espermática BCF. La interacción de las tres variables fijas diluyente × estado sexual × edad fue significativa para todas las variables de cinética espermática con excepción de la VCL (Cuadro 4).
Cuadro 4 Valores p de las interacciones bidireccionales de las variables fijas (diluyente, edad y estado sexual) en semen fresco de toros Brahman (Bos indicus). Instituto Tecnológico de Costa Rica, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos, Costa Rica. 2021.
| Variable | Interacción | |||
| Diluyente × edad | Diluyente × estado sexual | Edad × estado sexual | Diluyente × estado sexual × edad | |
| VCL | * | * | * | 0,42 |
| VSL | * | * | * | * |
| VAP | * | 0,65 | * | * |
| LIN | * | * | * | * |
| STR | * | 0,54 | * | * |
| WOB | * | * | * | * |
| ALH | * | * | * | * |
| BCF | * | 0,22 | * | * |
| DNC | * | * | * | * |
VCL: velocidad curvilínea (µm s-1); VSL: velocidad rectilínea (µm s-1); VAP: velocidad promedio de la trayectoria (µm s-1); LIN: linealidad de la progresión (%); STR: índice de rectitud (%); WOB: oscilación de la trayectoria (%); ALH: amplitud del desplazamiento lateral de la cabeza (µm); BCF: frecuencia de entrecruzamiento (Hz); DNC: dance (µm2 s-1). *: p<0,05. / VCL: curvilinear velocity (µm s-1); VSL: straight-line velocity (µm s-1); VAP: average path velocity (µm s-1); LIN: linearity of forward progression (%); STR: straightness index (%); WOB: oscillation of the trajectory (%); ALH: amplitude of lateral head displacement (µm); BCF: beat-cross frequency (Hz); DNC: dance (µm2 s-1). *: p<0.05.
Discusión
En los análisis seminales diversos factores influyeron sobre el resultado final. Uno de ellos fue el diluyente utilizado para preservar el eyaculado, pero para lograr obtener un resultado sobre el mejor diluyente, según el material genético que se desea preservar, se deben realizar pruebas que permitan comparar la movilidad y cinética de los espermatozoides contenidos en el eyaculado (Víquez et al., 2021).
El efecto del diluyente en semen fresco ha sido estudiado en gallos (Łukaszewicz et al., 2020; Siudzińska & Łukaszewicz, 2008), macho cabrío (Yodmingkwan et al., 2016), morueco (Fernandes et al., 2021; Kumar Paul et al., 2019; Leugoué Kameni et al., 2021; O'Hara et al., 2010), búfalo (Akhter et al., 2011; Kumar et al., 2015), caballo (Hernández-Avilés et al., 2018) y toro (Beran et al., 2012; Murphy et al., 2017; Murphy, Eivers, et al., 2018; Teik Chung et al., 2019; Víquez et al., 2021). Lo anterior debido a que sin un correcto análisis se podría asumir que los diluyentes no influyen sobre el movimiento, tal como se obtuvo en esta investigación para la movilidad total. Sin embargo, al ser más robusto el análisis se podrían presentar diferencias que generan un impacto significativo en la calidad seminal y hasta en la rentabilidad.
Al utilizar Optixcell® se generó una disminución sobre la cinética espermática al reducirse el movimiento rectilíneo de los espermatozoides, lo que impactó de forma directa la movilidad progresiva. La evidencia causa-efecto indica que el diluyente fue el responsable de esta disminución, debido a que se analizó el mismo eyaculado y el movimiento total fue similar; sin embargo, mediante las variables cinéticas se obtiene una reducción en la progresividad, de manera que las características de cada diluyente condicionan los resultados (Víquez et al., 2021), lo que genera una desventaja considerable sobre el potencial de fecundación de los espermatozoides.
La práctica habitual de reducir la cantidad de dosis seminales debido a que se debe aumentar la concentración espermática para contrarrestar la disminución en la calidad espermática, es una rutina que debe minimizarse en los laboratorios de inseminación artificial. Esto hace que se necesite una mayor cantidad de espermatozoides para producir una dosis y por ende, la cantidad de dosis totales disminuirá. Además, se genera una disminución en la eficiencia reproductiva y, en los centros de biotecnologías reproductivas, los ingresos por concepto de dosis serán menores. Por lo tanto, no se aprovecharía la ventaja competitiva del semen fresco que permite generar más dosis seminales por eyaculado (Murphy, Eivers, et al., 2018).
Factores intrínsecos del animal como la edad generan diferentes resultados (García et al., 2017; Kondracki et al., 2012; Snoj et al., 2013; Tatman et al., 2004). Esto debido a que los animales muy jóvenes están en crecimiento y cuando inician en su edad de servicio no se ha completado su desarrollo fisiológico (Majić Balić et al., 2012; Murphy, Kelly, et al., 2018). En contraparte, los animales longevos ya han alcanzado su desarrollo y su comportamiento reproductivo es muy estándar a lo largo de su ciclo; sin embargo, al alcanzar cierta edad, la cual estará determinada por su raza, su rendimiento decae y deben descartarse como reproductores (Argiris et al., 2018; Schenk, 2018).
En este estudio se analizaron animales de 45,50 ± 19,24 meses y se clasificaron según su edad en longevos (>48 meses) y jóvenes (<48 meses), donde los animales de >48 meses presentaron un mejor rendimiento al presentar una mayor movilidad progresiva en comparación con los animales jóvenes. Además, al analizar el patrón del movimiento y ondulación de la célula se obtiene un mayor movimiento circular por parte de los espermatozoides de animales <48 meses.
Los datos de movilidad y cinética espermática observados son consistentes con estudios realizados en macho cabrío, donde se demuestra que la edad del animal influye sobre parámetros espermáticos, animales más maduros presentan mayores valores para el volumen del eyaculado (macroscópico) y a nivel microscópico la concentración, viabilidad, integridad de la membrana, movilidad y anomalías de las células espermáticas (García et al., 2017). Este efecto se ha estudiado en toros, donde se correlaciona la edad y desarrollo del animal con la circunferencia escrotal, por consiguiente la circunferencia escrotal es un parámetro determinante en la calidad seminal (Fuerst-Waltl et al., 2006; Snoj et al., 2013).
Hubo diferencias en la linealidad, velocidad y oscilación espermatica, de manera que los animales en descanso poseían mayor movimiento circular y menor progresividad en comparación con los animales en periodo de monta. Algunos investigadores han demostrado que los animales en descanso sexual no poseen una alta tasa de renovación de espermatozoides y almacenan los que producen, con el tiempo los reabsorben y producen más espermatozoides (Clermont, 1972; Staub & Johnson, 2018). En contraparte, los animales con actividad sexual se encuentran en constante producción de espermatozoides y esto se asocia con una mejor calidad espermática, debido a la alta tasa de renovación y el tiempo de sobrevivencia de estos gametos.
Conclusiones
Con base en los diluyentes de semen bovino analizados, el tipo de diluyente influyó sobre la movilidad y cinética espermática medida con sistemas CASA-Mot. Los animales de mayor edad presentaron patrones cinemáticos más progresivos que animales más jóvenes. El estado sexual en monta presentó valores de progresividad celular mayores que los animales que se encontraban en descanso sexual. Es necesario realizar estudios posteriores, a la luz de los resultados del presente trabajo, para estandarizar protocolos de manejo seminal en semen fresco y determinar umbrales óptimos de edad, así como optimizar los tiempos de descanso y monta de toros en edad reproductiva.















