Tabla de contenido
INTRODUCCIÓN . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
1. Atención centrada en el paciente . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
1.1 ¿Qué es la atención centrada en la persona? . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
1.2 Autogestión . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
1.3 Atención multidisciplinaria estructurada . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
2. Diabetes de aparición temprana (Debut diabético temprano) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
2.1 Desafíos del tratamiento para DMT2 de aparición temprana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3. Tratamiento farmacológico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3.1 Agentes hipoglucemiantes orales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
Recomendaciones sobre terapia farmacológica para la DMT2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3.1.1 Metformina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3.1.2 Sulfonilureas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3.1.2.1 Gliburida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.2.2 Glipizida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.2.3 Glimepirida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.2.4 Gliclazida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.3 Tiazolidinedionas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.3.1 Pioglitazona . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.4 Acarbosa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.5 Inhibidores de la dipeptidil peptidasa-4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3.1.4.1 Vildagliptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.4.2 Sitagliptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.4.3 Saxagliptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.4.4 Linagliptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.4.5 Alogliptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.5 Agonistas del receptor del péptido similar al glucagón tipo 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.5.1 Exenatida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3.1.5.2 Liraglutida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3.1.5.3 Lixisenatida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3.1.5.5 Dulaglutida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3.1.5.6 Semaglutida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3.1.6 Inhibidor del cotransportador sodio-glucosa tipo 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3.1.6.1 Canagliflozina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3.1.6.2 Dapagliflozina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3.1.6.3 Empagliflozina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3.1.6.4 Ertugliflozina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3.1.6.5 Nueva evidencia de Resultados CV Inhibidores del cotransportador sodio/glucosa tipo 2 . . . . . . . . . . 47
4. Terapia farmacológica para la diabetes tipo 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
4.1 Insulinas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
Recomendaciones sobre uso de insulina en pacientes con DMT1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
4.2 Tratamientos sin insulina para la diabetes tipo 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
5. Terapia con insulina para pacientes con diabetes tipo 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
5.1 Control intensificado de la glucosa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
Recomendaciones para uso de insulinas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
5.1.2 Limitantes con la intensificación del control glucémico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53
5.2 Tratamiento de la hiperglucemia en el hospital . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
Recomendaciones para aplicación de insulina a pacientes hospitalizados . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
5.2.1 Objetivos de glucemia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
5.2.2 Entorno de cuidados intensivos de terapia con insulina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
5.2.3 Entorno de atención no crítica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
5.2.4 Transición de insulina intravenosa a subcutánea . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
5.2.5 Cuidado perioperatorio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
REFERENCIAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
Recibido 01-VI-2022. Aceptado 24-VI-2022
Introducción
El control de la persona con diabetes tiene como metas evitar los síntomas de la diabetes, prevenir las complicaciones agudas y crónicas, mantener buena calidad de vida, reducir incapacidades y prevenir la muerte prematura. Por su parte, el tratamiento intensificado y orientado a los factores de riesgo en el paciente diabético reduce eventos micro y macrovasculares.1
Los objetivos de control glucémico han variado a través de los años. Antes de 2008, la meta se centraba en la efectividad de los hipoglucemiantes (reducción de la hemoglobina glicosilada -HbA1c). Posteriormente, los objetivos se centraron en la seguridad (prevención de hipoglucemia) y más recientemente se amplía los componentes tomando en cuenta el impacto de nuevos agentes sobre la protección cardiovascular (CV), sin olvidar la meta de la HbA1c y la reducción de hipoglucemia.
Las metas de control reconocidas mundialmente son: alcanzar una hemoglobina glicosilada < 7.0 % o < 6.5 %, dependiendo de varios factores específicos de cada paciente, los cuales incluyen la edad, la expectativa de vida y la presencia de comorbilidades.2
Cuando la HbA1c es > 1.5 % por encima del objetivo de glucemia, muchos pacientes requerirán una terapia de combinación dual para alcanzar su nivel de HbA1c objetivo incluyendo insulinoterapia. Sin embargo, los eventos hipoglucémicos son más frecuentes con la intensificación del tratamiento.3
Para prevenir las enfermedades cardiovasculares ateroescleróticas (ECVAS) en personas con diabetes mellitus tipo 2 (DMT2), es importante la identificación temprana y el manejo óptimo los factores de riesgo cardiovascular (FRCV) como obesidad o sobrepeso, hipertensión (HTA), dislipidemia, fumado, historia familiar de enfermedad coronaria prematura y enfermedad renal crónica (ERC).4
En la práctica general, los pacientes diabéticos generalmente se controlan en centros de atención primaria, desde la identificación de pacientes en riesgo hasta el cuidado de pacientes al final de la vida. El Grupo Diabetes Costa Rica utilizó las habilidades y el conocimiento de sus compañeros de práctica general que tienen interés en el manejo de la diabetes y son miembros de la red de diabetes de intereses específicos.
Tabla 1 Abreviaturas
| Abreviatura | Significado |
| AACE | Asociación Americana de Endocrinología Clínica |
| AAR | Análogos de insulina de acción rápida |
| AR GLP-1 | Agonistas del receptor del péptido similar al glucagón tipo 1 |
| cAMP | Monofosfato de adenosina cíclico |
| CCSS | Caja Costarricense del Seguro Socia |
| CrC | Aclaramiento de creatinina |
| CSII | Infusión continua de insulina |
| CV | Cardio Vascular |
| DM | Diabetes mellitus |
| DMG | Diabetes mellitus gestacional |
| DMT1 | Diabetes mellitus tipo 1 |
| DMT2 | Diabetes mellitus tipo 2 |
| DPP-4 | Dipeptidil peptidasa 4 |
| EAG | Eventos adversos graves |
| ECV | Enfermedad cardiovascular |
| ECVAS | Enfermedad cardiovascular aterosclerótica |
| EMA | Agencia Europea de Medicamentos |
| ERC | Enfermedad renal crónica |
| FDA | Administración de Medicamentos y Alimentos de los EE. UU |
| FRCV | Factores de riesgo Cardiovascular |
| GIP | Péptido insulinotrópico dependiente de glucosa |
| GLP-1 | Péptido similar al glucagón tipo 1 |
| GP | Glucosa plasmática |
| GPA | Glucosa plasmática en ayunas |
| HbA1c | Hemoglobina glicosilada |
| HR | Razón de riesgo |
| HS | Hipoglucemia severa |
| HTA | Hipertensión arteria |
| IC | Insuficiencia cardíaca |
| IMC | Índice de masa corporal |
| MG | Médicos generales |
| NPH | insulina isofánica |
| PA | Presión arterial |
| PAS | Presión arterial sistólica |
| SC | Subcutánea |
| SCA | Síndrome coronario agudo |
| SGLT-2 | Cotransportador sodio- glucosa tipo 2 |
| SII | Síndrome de intestino irritable |
| SU | Sulfonilureas |
| TFGe | Tasa de filtración glomerular estimada |
| TZD | Tiazolidinediona |
| UKPDS | Prospective Diabetes Study Group |
| VADT | Veterans Affairs Diabetes Trial |
1. Atención centrada en el paciente
La atención centrada en el paciente es esencial para un buen manejo de la diabetes, ya que incorpora la experiencia de cuidado de un paciente y lo trata como un socio en su propia atención médica.
1.1 ¿Qué es la atención centrada en la persona?
La atención centrada en el paciente es el tratamiento holístico de los pacientes en función de su condición clínica evaluada, considerando sus preferencias individuales, prioridades y contextos socioculturales.5
La atención centrada en el paciente se caracteriza por un estilo de comunicación con lenguaje sencillo, basado en la escucha activa para conocer las necesidades, preferencias y creencias del paciente, así como las posibles barreras en la atención del paciente (alfabetización, nivel socioeconómico, etc.), con el fin de optimizar los recursos para obtener los mejores resultados en cuanto a salud y calidad de vida del paciente.6
Una consulta centrada en el paciente ofrece una atención coordinada y habilitante, la cual garantiza un trato digno al paciente, con compasión y respeto. A su vez, implica evaluar los signos y los síntomas clínicos de una persona, así como sus pensamientos, miedos, preferencias, expectativas y contexto social. Esto asegura una comprensión completa de la persona que vive con DMT2.5
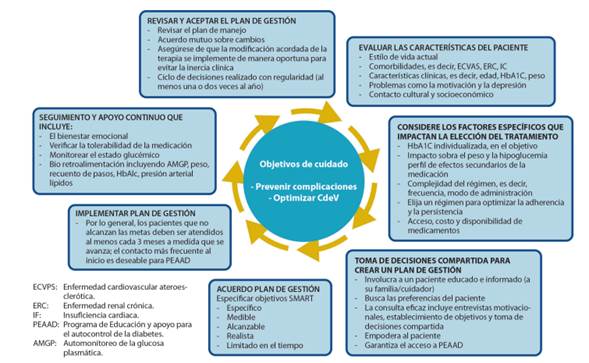
Como resultado de la atención centrada en el paciente, es más probable que la persona diabética participe activamente en la autogestión y se logren resultados de salud óptimos. Desde una posición de entendimiento mutuo, utilizando un proceso de toma de decisiones compartido (Figura 1), se pueden desarrollar planes de manejo con el paciente y adaptarlos para satisfacer específicamente sus necesidades, valores y elecciones.
1.2 Autogestión
El autocuidado implica que el paciente diabético trabaje en colaboración con sus cuidadores y profesionales de la salud5 con el fin de:
Comprender su condición y diversas opciones de tratamiento.
Contribuir, revisar y monitorear el plan de atención y cuidado del paciente.
Participar en actividades que protegen y promueven la salud.
Monitorear y manejar los síntomas y signos de la condición.
Manejar el impacto de la condición en el funcionamiento físico, las emociones y las relaciones interpersonales.
En la autogestión para el manejo de la diabetes mellitus (DM), también existen barreras: problemas relacionados con la cognición, la discapacidad física, la salud mental, la alfabetización en salud, las limitaciones socioeconómicas, la ubicación y el acceso a los servicios. Todos ellos pueden afectar la capacidad de la persona para autocontrolar su diabetes.5
Diabetes Care 2021;44(Suppl. 1):S40-S52 | https://doi.org/10.2337/dc21-S004.
1.3 Atención multidisciplinaria estructurada
Un programa de educación en diabetes permite brindar una atención estructurada, ya que se emplea un equipo multidisciplinario de profesionales de la salud para alcanzar objetivos de salud individualizados, de modo que mejoran los resultados clínicos y la calidad de vida de los pacientes.7
Asimismo, estos programas de atención multidisciplinaria permiten una atención más oportuna de los pacientes, por ejemplo, las dificultades sociales de un paciente pueden detectarse durante una evaluación de un educador en diabetes o por un auxiliar de enfermería, sin tener que esperar por una consulta médica de rutina.
Como parte del equipo multidisciplinario, es importante integrar también al paciente y su familia en la elaboración del plan de manejo integral del paciente, el cual debe incluir cambios en el estilo de vida para alcanzar los objetivos de tratamiento que mejoren su calidad de vida y prevengan posibles complicaciones por comorbilidades.5
Por tanto, se puede considerar miembros del equipo multidisciplinario de atención de la diabetes a todo el personal involucrado en el manejo de la enfermedad: paciente y familia, enfermera de cuidado comunitario, enfermera auxiliar, educadores en diabetes, trabajador social, trabajador de salud comunitaria, médico general, nutriólogo/nutricionista, fisiatra/fisioterapeuta, psicólogo, dentista, podólogo, endocrinólogo, oftalmólogo/optometrista, endocrinólogo y farmacéutico.
2. Diabetes de aparición temprana (debut diabético temprano)
Se conoce como DMT2 de aparición temprana a la que ocurre antes de los cuarenta años.8,9 Esto se puede dividir aún más en niño y adolescente (<18 años) y adulto joven (<25 años).9
La prevalencia de la DMT2 en niños, adolescentes y adultos jóvenes se ha incrementado en los últimos años.
La DMT2 de aparición temprana o “de aparición en la juventud” implica una exposición más prolongada a la hiperglucemia y sus complicaciones a lo largo de la vida8.
También se ha demostrado que la DMT2 de inicio temprano es más agresiva en comparación con la DMT2 de inicio tardío y presenta una progresión más rápida de las complicaciones macrovasculares y microvasculares, pues se asocia con mayor mortalidad y factores de riesgo de enfermedad cardiovascular (ECV) desfavorables en comparación con la diabetes mellitus tipo 1 (DMT1).8-11
A diferencia de la DMT2 de inicio en la vejez, el diagnóstico de la DM de aparición temprana es un desafío para los médicos generales (MG), esto en cuanto a diferenciar entre DMT1, enfermedad autoinmune latente de adultos y DMT2 de inicio en la madurez de los jóvenes.9
Además, es necesario realizar una evaluación diagnóstica cuidadosa, la cual garantice el manejo adecuado y los mejores resultados de las intervenciones.
2.1 Desafíos del tratamiento para DMT2 de aparición temprana
La DMT2 de aparición temprana tiene más probabilidades de tener un control glucémico subóptimo, hipertensión diastólica, inicio más temprano de uso de insulina y una mayor probabilidad de complicaciones relacionadas con la DM, lo que resulta en una reducción de la calidad de vida, mayor morbilidad y mortalidad prematura.5 Adicionalmente, se ha demostrado que hay una reducción en la esperanza de vida (catorce años en los hombres y dieciséis años en mujeres) en comparación con las personas no diabéticas.8
3. Tratamiento farmacológico
La escogencia del o los agentes reductores de la glucemia dependen de la evolución de la diabetes, del estado metabólico y de la presencia de complicaciones crónicas. Consecuentemente, la decisión de las estrategias farmacológicas debe ser discutidas con el paciente diabético y su familia.
Cabe hacer notar que, a partir del año 2008, la Food and Drug Administration (FDA) y la Agencia Europea de Medicamentos (EMA) solicitaron estudios de seguridad CV para los nuevos agentes reductores de la glucemia. Por esto, se han realizado investigaciones aleatorizadas para los fármacos nuevos incluyendo los inhibidores de la dipeptidil peptidasa (DPP-4), inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT-2), antagonistas del receptor de péptidos similar al glucagón tipo 1 (GLP-1) y análogos de insulina. En consecuencia, la metformina, las sulfonilureas (SU), las tiazolidinedionas y las insulinas humanas no fueron sometidas al mismo proceso de valoración de seguridad CV o renal.
Tabla 2 Complicaciones en la DMT2 de inicio temprano en comparación con la DMT2 de inicio más avanzado
| El riesgo de complicaciones a lo largo de la vida aumenta con el inicio a una edad más temprana. Se reduce la esperanza de vida. |
| La enfermedad del hígado graso no alcohólico es dos veces más común. |
| Inicio más temprano de microalbuminuria e insuficiencia renal en etapa terminal. |
| Inicio más temprano y mayor prevalencia de retinopatía diabética. |
| Inicio más temprano de neuropatía. |
| La concentración de apolipoproteína B es mayor a pesar del tratamiento con estatinas. |
| El riesgo de infarto de miocardio es catorce veces mayor en comparación con la cohorte de edad, mientras que el riesgo de DMT2 de inicio más avanzado es 2-4 veces mayor. |
| Inicio temprano de disfunción miocárdica diastólica. |
| Fertilidad reducida y mayores complicaciones del embarazo. |
| Riesgo de deterioro prematuro de la función cognitiva. |
| Mayor índice de angustia y problemas psicológicos relacionados con la diabetes, especialmente depresión. |
| Capacidad de trabajo limitada y el consiguiente impacto socioeconómico. |
| Reducción de la calidad de vida. |
3.1 Agentes hipoglucemiantes orales
Los medicamentos hipoglucemiantes se clasifican en:12
Sensibilizadores de insulina (metformina y pioglitazona).
Proveedores de insulina (SU y meglitinidas).
Terapias basadas en incretinas (inhibidores de AR-GLP-1 y DPP-4).
Inhibidor de la absorción de glucosa intestinal (acarbosa).
Inhibidores de la reabsorción de glucosa renal (inhibidores SGLT-2).
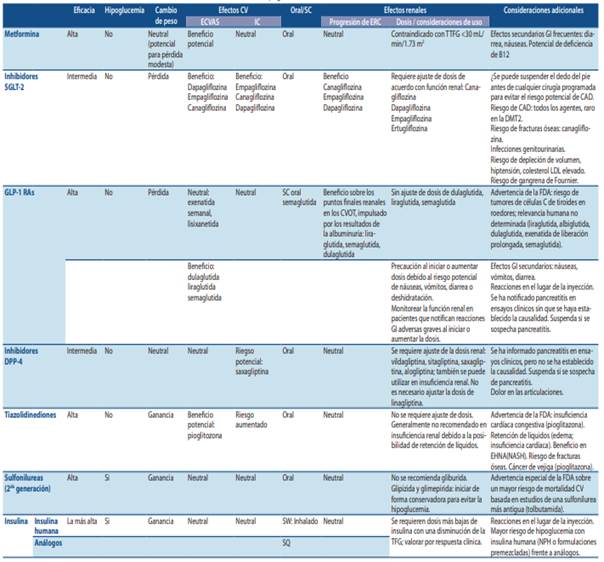
Recomendaciones sobre terapia farmacológica para la DMT2
Adaptado de Diabetes Care 44.Supplement 1 (2021): S111-S124.
3.1.1 Metformina
La metformina es un sensibilizador de la insulina que reduce principalmente la producción hepática de la glucosa. Es considerado el medicamento de elección en primera línea de tratamiento para pacientes con DMT2, a menos que existan contraindicaciones, y debe recomendarse junto con modificaciones en el estilo de vida.3
La metformina es eficaz, segura13 y se puede utilizar durante mucho tiempo a lo largo del ciclo de manejo del paciente con DMT2, excepto cuando el aclaramiento de creatinina se encuentra deteriorado. En comparación con las SU, la metformina como tratamiento de primera línea tiene efectos beneficiosos sobre la HbA1c y puede contribuir a la reducción de peso.14 En un metaanálisis realizado por Zhang y colaboradores con 1,160,254 pacientes con DMT2 (701 843 en metformina), se reportó evidencia estadísticamente significativa de una reducción en eventos cardiovasculares (OR 0.57, 95 % CI 0.48-0.68) con efecto en mortalidad (OR 0.44.5, CI 95% 0.34-0.57).
También metformina, en el ámbito preventivo, ha demostrado incidencia (OR 0.73, 95 % CI 0.59-0.90).15 Entre los principales efectos adversos de la metformina, se pueden mencionar: intolerancia gastrointestinal (distensión) malestar abdominal y diarrea; los cuales pueden mitigarse mediante una titulación gradual de la dosis.3
La metformina se puede utilizar de forma segura en pacientes con tasas de filtración glomerular estimadas (TFGe) reducidas; con TFGe ≥ 30 ml / min / 1.73 m2. 3,16 Un ensayo aleatorio confirmó observaciones previas de que el uso de metformina está asociado con la deficiencia de vitamina B12 y el empeoramiento de los síntomas de la neuropatía.17
3.1.2 Sulfonilureas
Las SU son secretagogos de insulina que se unen a receptores de SU en las células betapancreáticas para estimular la secreción de insulina. Generalmente, pueden reducir la HbA1c en un 1-2 % y las concentraciones de glucosa en sangre en aproximadamente un 20 %.18 En un ensayo clínico en el que se compara gliburida, metformina y rosiglitazona, se reveló que la sulfonilurea redujo tempranamente la glucemia y la HbA1c, pero este efecto fue de poca duración comparado con los otros agentes.19
Otro estudio comparativo realizado en pacientes con DMT2 permitió comparar el efecto a largo plazo sobre eventos CV de pioglitazona versus SU en pacientes DMT2 que recibían metformina. En este estudio, se asignaron a pioglitazona 1535 y 1493 a SU (glibenclamida 24 [2 %], glimepirida 723 [48 %], gliclazida 745 [50 %]). Al inicio, 335 (11 %) participantes tenían algún evento CV previo. El estudio fue detenido tempranamente debido a inefectividad del estudio después de un seguimiento medio de 57.3 meses. El punto final primario ocurrió en 105 pacientes (1.5 por 100 personas-año) en aquellos que recibieron pioglitazona y 108 (1.5 por 100 persona-años) en los que recibieron SU (HR 0.96, 95 % CI 0.74-1.26, p=0.79). Menos pacientes tuvieron hipoglucemias en el grupo de pioglitazona (148 [10 %] vs 508 [34 %], p<0.0001).
En promedio, se observó un aumento de menos de 2 kg en ambos grupos. Tasas de falla cardiaca, cáncer de vejiga y fracturas no fueron diferentes entre los grupos.20
La seguridad cardiovascular de las SU de segunda y tercera generación fue evaluada Rados y colaboradores por medio de un metanálisis, el cual evaluó mortalidad por cualquier causa, mortalidad cardiovascular e infarto de miocardio y evento cerebrovascular. A partir de este estudio, se demostró que las sulfonilureas no aumentan eventos adversos respecto a placebo ni comparadores activos.21
Las SU se han utilizado como monoterapia y en combinación con otros hipoglucemiantes orales o con insulina. Estos fármacos están aprobados como tercera a cuarta línea en el abordaje terapéutico del paciente con DMT2. Igualmente, es muy importante la educación al paciente sobre nutrición y cómo reconocer, prevenir o manejar los eventos hipoglucémicos, incluida la hipoglucemia posterior al ejercicio.
Cabe destacar que, en tratamiento combinado, se comparó Metformina con inhibidores de SGLT-2 y Metformina con Sulfonilureas, y no hubo diferencia estadísticamente significativa en cuanto a mortalidad. Sin embargo, no se tienen estudios que permitan establecer si existen diferencias entre ambos grupos en periodos de seguimiento mayores.22
3.1.2.1 Gliburida
La gliburida, también conocida como glibenclamida, es una sulfonilurea de segunda generación. Es más potente y presenta menos interacciones farmacológicas que los agentes de primera generación, tiene una vida media más larga que la mayoría de las SU. En el tratamiento de la diabetes mellitus gestacional (DMG), la gliburida se ha utilizado como alternativa a la insulina, aunque no está aprobada por la FDA para esta indicación. Por lo tanto, no se recomienda en mujeres embarazadas con DMT2. La gliburida fue una de las SU utilizadas en el estudio prospectivo de diabetes del Reino Unido (UKPDS).23
3.1.2.2 Glipizida
La glipizida es otra sulfonilurea de segunda generación, al igual que la gliburida, es más potente y presenta menos interacciones farmacológicas que los agentes de primera generación. Puede causar una liberación de insulina más fisiológica, se asocia con menos riesgo de hipoglucemia18 y aumento de peso que otras SU.
3.1.2.3 Glimepirida
Puede disminuir la tasa de producción de glucosa hepática y aumentar la sensibilidad del receptor de insulina. Igual que otras SU, las Guías internacionales las colocan como agentes de 3ª - 4ª elección. La hipoglucemia y el aumento de peso son efectos adversos comunes. No tiene estudios de seguridad CV.
3.1.2.4 Gliclazida
Según los resultados del estudio ADVANCE, la gliclazida MR sola o en combinación con otros agentes sigue siendo una opción terapéutica eficaz y segura para controlar la hiperglucemia.24 Zoungas S reportó que la glicazida MR redujo los niveles de HbA1c al 6.5 % en pacientes con DMT2, lo que redujo el criterio de valoración combinado de eventos CV y microvasculares importantes en un 10 %, sin aumento de peso, con duplicación del riesgo de hipoglucemia.
3.1.3 Tiazolidinedionas
Las tiazolidinedionas representan una clase terapéutica que reduce la resistencia a la insulina en la periferia y quizás en un pequeño grado en el hígado. Asimismo, activan el receptor activado por proliferador de peroxisomas gamma, un factor de transcripción nuclear que es importante en la diferenciación de las células grasas y el metabolismo de los ácidos grasos. La principal acción de las tiazolidinedionas es probablemente la redistribución de grasas. Estos medicamentos pueden tener propiedades potenciales de conservación de células beta.19 Las tiazolidinedionas además, secaracterizan por presentar un bajo riesgo de hipoglucemia y una eficacia glucémica moderada, entre los inhibidores de la alfa-glucosidasa y las SU.25
Los efectos secundarios más comunes de las Tiazolidinedionas son: aumento de peso, mayor riesgo de fracturas óseas en mujeres posmenopáusicas y hombres ancianos, y riesgo elevado de edema crónico, así como desencadenar IC.26,27
3.1.3.1 Pioglitazona
Como complemento de la dieta y el ejercicio, la pioglitazona ayuda a mejorar el control glucémico, pues mejora la respuesta a la insulina de las células diana, sin aumentar la secreción de insulina del páncreas. También aumenta el uso de glucosa dependiente de insulina en el músculo esquelético y el tejido adiposo.28,29
El uso prolongado de pioglitazona y las dosis altas acumuladas se han relacionado con un riesgo ligeramente mayor de cáncer de vejiga. Se recomienda no prescribir pioglitazona a pacientes con cáncer de vejiga activo y usarlo con precaución en pacientes con antecedentes de cáncer de vejiga.30
La pioglitazona también se ha empleado en pacientes con esteatohepatitis.
3.1.4 Acarbosa
Es una clase terapéutica que disminuye la absorción de glucosa en el intestino, lo cual minimiza la excursión posprandial de glucosa. El efecto reductor de la glucemia es modesto, tiene efectos adversos gastrointestinales y es de poco uso. Ahora bien, no existe en Costa Rica.
3.1.5 Inhibidores de la dipeptidil peptidasa-4
Las hormonas incretinas son parte de un sistema endógeno involucrado en la regulación fisiológica de la homeostasis de la glucosa. La DPP-4 degrada numerosos péptidos biológicamente activos, incluidas las incretinas endógenas GLP-1 y el péptido insulinotrópico dependiente de glucosa (GIP). Por su parte, los inhibidores de la dipeptidil peptidasa 4 (DPP-4) prolongan la acción de las hormonas incretinas, lo que incrementa la secreciónendógena de insulina y reduce la HbA1c entre 1.8-1.2 %, solas o en combinación con metformina. Pueden emplearse en combinación con inhibidores de SGLT-2 y tiazolidinedionas, y no inducen aumento de peso.
Un dato importante es que tienen bajo riesgo de producir hipoglucemia y pueden usarse en ancianos solo o en combinación con insulina.25 Además, es necesario realizar una reducción de dosis de alogliptina, saxagliptina, sitagliptina y vildagliptina cuando la TFGe es < 60mL/min/1.73 m2 debido a acumulación farmacológica sin toxicidad.5
Los estudios de seguridad CV con inhibidores de DPP-4 fueron el SAVOR-TIMI 5331 realizado con saxagliptina, el estudio EXAMINE32 con alogliptina y el TECOS33 con sitagliptina.
En estos estudios, el grupo control mantuvo una estrategia farmacológica necesaria para que la HbA1c fuera similar a la del grupo que recibió el inhibidor de DPP-4 de acuerdo con lo establecido por FDA y EMA. Estos estudios alcanzaron la meta de no inferioridad, pero no se obtuvo reducciones en la incidencia de eventos CV con el inhibidor de DPP-4 estudiado.
Asimismo, como hallazgo de interés clínico, en SAVOR-TIM 53 se presentó un aumento en las hospitalizaciones por insuficiencia cardiaca (IC).
3.1.4.1 Vildagliptina
La vildagliptina se puede usar por vía oral como monoterapia y en combinación con metformina en pacientes con un glucemia incontrolada, a pesar de recibir la dosis máxima tolerada de metformina en monoterapia; con una sulfonilurea en pacientes con un control insuficiente de la glucemia, a pesar de recibir la dosis máxima tolerada de una sulfonilurea y para los que la metformina está contraindicada o no la toleran; con una tiazolidinediona en pacientes con un control insuficiente de la glucemia y para los que es adecuado el uso de una tiazolidinediona.34 No existen estudios de seguridad CV con vildagliptina.
3.1.4.2 Sitagliptina
La sitagliptina demuestra selectividad por DPP-4 y no inhibe la actividad de DPP-8 o DPP-9 in vitro a concentraciones que se aproximan a las de las dosis terapéuticas. Además, la sitagliptina se puede utilizar como monoterapia o en combinación con metformina, tiazolidinediona o insulina.
Se administra una vez al día y es de peso neutro. El estudio TECOS demostró seguridad CV, poco riesgo de hipoglucemias y, comparada con inhibidores de SGLT-2, es más efectiva en reducir la glucemia en pacientes con deterioro de la función renal.33
3.1.4.3 Saxagliptina
La saxagliptina inhibe la DPP-4 que aumenta las concentraciones de GLP-1 y GIP, las cuales estimulan la liberación de insulina en respuesta al aumento de los niveles de glucosa en sangre después de las comidas, lo que mejora el control glucémico. La saxagliptina está indicada como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con DMT2. Igualmente, estudios de seguridad CV demostraron un aumento en la hospitalización debida a IC.
3.1.4.4 Linagliptina
La linagliptina es un inhibidor de DPP-4 que aumenta y prolonga la actividad de las incretinas. Indicado junto con dieta y ejercicio, ayuda a reducir los niveles de glucosa plasmática (GP) en pacientes diabéticos adultos. Puede usarse como monoterapia o en combinación con otros medicamentos hipoglucemiantes como metformina, sulfonilurea o pioglitazona; no se ha estudiado en combinación con insulina.
Comparado contra glimepirida, no demostró aumento del riesgo CV.
3.1.4.5 Alogliptina
Inhibidor selectivo de DPP-4 que retarda la inactivación de las incretinas (por ejemplo, GLP-1 y GIP), pues reduce las concentraciones de glucosa plasmática en ayunas (GPA) y posprandial de una manera dependiente de la glucosa.
3.1.5 Agonistas del receptor del péptido similar al glucagón tipo 1
Los agonistas del péptido similar al glucagón tipo1 (GLP-1) son análogos del receptor GLP-1 que estimulan la liberación de insulina dependiente de glucosa mediante el aumento del monofosfato de adenosina cíclico intracelular (cAMP), lo que conduce a la liberación de insulina en presencia de concentraciones elevadas de glucosa y reduce el glucagón y el vaciamiento gástrico. También tienen sólidas propiedades reductoras del HbA1c, las cuales se asocian con pérdida de peso, reducción de lípidos y de la presión arterial. Algunos de estos agentes también reducen eventos CV y complicaciones renales.25,35,36 Todos los análogos del receptor de GLP-1 reducen la glucemia y HbA1c en tasas similares.
En la actualidad, hay varios AR GLP-1 aprobados para el tratamiento de la DMT2. Se agrupan en dos clases de acuerdo con su capacidad de activar el receptor de GLP-1: La exanetida de corta acción y el lixisanetide de una vez al día y los de acción prolongada, como liraglutida una vez al día y exanetida, albiglutida y dulaglutida una vez por semana. El exanentida que se administra dos veces al día y el lisixanetida una vez al día son moléculas que tienen 53 % de identidad con el GLP-1 nativo, mientras que los otros tienen homología de más del 90 % con el GLP-1 nativo. Los últimos ostentan beneficio, pues reducen de riesgo CV.
3.1.5.1 Exenatida
La exenatida fue el primer agonista de GLP-1 disponible que mejora el control glucémico en pacientes con DMT2.
La secuencia de 39 aminoácidos del fármaco se superpone parcialmente a la de la incretina humana GLP-1. Al igual que las incretinas endógenas, mejora la secreción de insulina dependiente de glucosa por las células beta pancreáticas, suprime la secreción de glucagón inadecuadamente elevada y ralentiza el vaciamiento gástrico. La exenatida está indicada como terapia adyuvante para mejorar el control glucémico en pacientes con DMT2, quienes no han logrado el control glucémico con metformina o una SU.3,37
Es un producto de liberación inmediata que se administra mediante inyección subcutánea (SC). Se debe administrar antes del desayuno y antes de la cena. No se recomienda si el aclaramiento de creatinina es < 30. Existe también una suspensión inyectable que se administra por vía SC una veza la semana (exanetida ER). Estas presentaciones tampoco se recomiendan si el aclaramiento de creatinina es < 30. Los estudios de seguridad no demostraron reducción de eventos CV. Por su parte, los AR-GLP-1 presentan efectos adversos gastrointestinales, los cuales incluyen náuseas, vómitos y diarrea, estos efectos son la causa principal de descontinuación del tratamiento.
3.1.5.2 Liraglutida
La liraglutida es un AR-GLP-1 indicado en DMT2 con y sin ECV y obesidad. Como complemento de la dieta y el ejercicio ayuda a mejorar el control glucémico en adultos con DMT2.
La presentación de liraglutida a dosis de 3 mg está indicado como estrategia farmacológica para pérdida de peso.
Los resultados del estudio clínico LEADER condujeron a la aprobación de liraglutida para la reducción del riesgo de eventos CV importantes (muerte CV, infarto de miocardio no fatal y accidente cerebrovascular no fatal) en adultos con DMT2 y enfermedad CV establecida. La tasa de muerte por cualquier causa fue menor con liraglutida (381 pacientes [8.2 %]) comparado al grupo placebo (447 [9.6 %]) (HR 0.85; 95 % CI, 0.74 - 0.97; P=0.02). Las tasas de infarto no fatal, accidente cerebral no fatal y hospitalizaciones por IC no fueron significativamente menores en el grupo de liraglutida.38
La liraglutida puede emplearse como tratamiento de primera línea en caso de intolerancia a la metformina y está contraindicada en pacientes con antecedentes o antecedentes familiares de carcinoma de tiroides medular o síndrome de neoplasia endocrina múltiple tipo 2, ya que se han producido tumores de células C tiroideas dependientes de la dosis y la duración en estudios de liraglutida con animales.
Asimismo, existen reportes en los cuales se sugiere que liraglutida puede causar pancreatitis, aunque no se han establecido pruebas concluyentes en estudios clínicos controlados. Sin embargo, los pacientes deben ser monitoreados por dolor abdominal severo, persistente e inexplicable, con o sin vómitos, y debe suspenderse la administración de liraglutida si se sospecha pancreatitis.39
3.1.5.3 Lixisenatida
Es un AR-GLP-1 inyectable indicado solo o en combinación con insulina o metformina, el cual se administra por vía SC. Se debe administrar una hora antes de las comidas. En pacientes con TFGe entre 30-89, no se requiere ajustes en la dosis. No se recomienda si la TFGe es < 15. Según los estudios de seguridad realizados en pacientes con DMT2 y síndrome coronario agudo reciente, el adicionar lixisenatida al tratamiento usual no cambió la tasa de eventos CV mayores ni de los efectos adversos.40
3.1.5.5 Dulaglutida
La dulaglutida es un agonista GLP-1 que actúa como mimético de incretina. Se indica en pacientes con DMT2 con y sin ECV, como complemento de la dieta y el ejercicio para mejorar el manejo de la DMT2.3
Aumenta la secreción de insulina en presencia de niveles elevados de glucosa en sangre, retrasa el vaciado gástrico para disminuir la glucosa posprandial y disminuye la secreción de glucagón.41 Además, se administra como una inyección SC una vez a la semana. Debe emplearse con precaución en pacientes con enfermedad renal terminal (ERT) y deterioro de la función hepática.
Los estudios de seguridad revelaron que Dulaglutida 1.5 mg por 5.4 años redujo significativamente eventos CV cuando se comparó con placebo (HR=0.88 [IC del 95 % 0.79, 0.99]; p = .026), lo cual muestra seguridad en una población que incluyó una mayoría de participantes sin enfermedad CV establecida. La mortalidad total en el grupo con dulaglutida fue similar al grupo placebo.42
3.1.5.6 Semaglutida
La semaglutida, otro agonista del GLP-1, estimula la secreción de insulina y reduce la secreción de glucagón. Se administra como una tableta oral una vez al día o una inyección
SC semanal. En nueve estudios multicéntricos fase 3 (Estudios SUSTAIN), se comparó la eficacia y la seguridad de semaglutida contra placebo y contra otras terapias farmacológicas para la diabetes. En estos estudios con el uso de semaglutida SC una vez por semana, se reportó una reducción de HbA1c en aproximadamente 1.5 % y reducción de peso de aproximadamente 4.5 kg comparado con dulaglutide. Asimismo, semaglutida tiene estudios que mostraron una disminución significativa del riesgo de muerte por causa CV, infarto no fatal o accidentes cerebrovascular no fatal (HR = 0.74; 95 % intervalo de confianza = 0.58-0.95).
En cuanto a seguridad, el tratamiento con semaglutida se asoció con un aumento en la retinopatía en pacientes con retinopatía preexistente. Los estudios fase 3 con la formulación oral mostraron reducciones de HbA1c de aproximadamente 1.5 % y pérdida de peso de aproximadamente 4.1 kg para la dosis de 14 mg. Los efectos adversos más comunes fueron los eventos gastrointestinales.43
3.1.6 Inhibidor del cotransportador sodio-glucosa tipo 2
Los inhibidores de co-transportador sodio glucosa (iSGTL-2) inhiben la reabsorción de glucosa en el segmento proximal del túbulo renal. El SGLT-2 se expresa en los túbulos renales proximales y es responsable de la mayor parte de la reabsorción de glucosa filtrada del lumen tubular. Como resultado de la inhibición de esos cotransportadores sodio glucosa, se promueve la glucosuria y la natriuresis lo cual contribuye en una amplia gama de beneficios metabólicos, incluida la reducción de la HbA1c, el peso corporal, la presión arterial sistólica (PAS) y la albuminuria.25
Estos agentes tienen efectos extraglucémicos particularmente en cuanto a reducir muerte súbita, complicaciones renales y disminución de hospitalización por IC, complicación asociada a tasa de mortalidad elevada en DMT2. En el capítulo 4, “Poblaciones especiales ICC”, de la guía se detallan los beneficios cardiovasculares de los SGLT-2.
Existen varios estudios controlados en los cuales se reportan reducciones estadísticamente significativas de eventos CV en pacientes con DMT2 con ECVAS establecida tratados con SGLT-2.3,44 Por su parte, las pautas de la Asociación Americana de Diabetes y de la Asociación Americana de Endocrinólogos Clínicos recomiendan el uso de inhibidores de SGLT-2 como terapia de segunda línea después de la metformina, específicamente en pacientes con ECV establecida.3,25 En pacientes con deterioro de la función renal, su impacto sobre el control glucémico es menor comparado contra otros agentes orales como la sitagliptina.
El tratamiento con inhibidores de SGLT-2 (iSGLT-2) se asocia a un leve aumento del colesterol de lipoproteínas de alta densidad (cHDL). En pacientes femeninas, hay un mayor riesgo de infecciones micóticas genitales.5,25 En personas ancianas, particularmente si se emplean concomitantemente con diuréticos, se puede presentar hipotensión postural. Por esta razón, se recomienda disminuir la dosis del diurético o suspenderlo en ancianos.
A su vez, se han reportado episodios de cetoacidosis diabética en pacientes con DMT2 en tratamiento con insulina y que presentan diversas condiciones, tales como: infecciones, reducción u omisión de la dosis de insulina, ingesta de etanol y ayuno prolongado. En DMT1, no están indicados los iSGLT-2; sin embargo, se han usado sin indicación. En DMT1, el efecto glucosúrico de los iSGLT-2 promueve la reducción de la dosis de insulina y se incrementa el riesgo de desarrollar cetoacidosis en parte porque se induce la liberación de glucagón y al reducir u omitir la dosis de insulina, la maquinaria metabólica se modifica a un estado cetogénico. Aunque en los estudios clínicos controlados esta complicación no es frecuente, el médico debe tener presente que la cetoacidosis diabética asociada con el tratamiento con iSGLT-2 es seria, por lo que debe instruir al paciente a que busque atención si presenta síntomas y signos sospechosos de esta complicación y que no los prescriban en pacientes con DMT1.
3.1.6.1 Canagliflozina
Canagliflozina es un inhibidor de SGLT-2 que reduce el umbral de glucosa renal (es decir, la concentración de glucosa en plasma que excede la capacidad máxima de reabsorción de glucosa del riñón), lo cual da como resultado un aumento de la excreción urinaria de glucosa. Además, la canagliflozina como complemento de la dieta y el ejercicio, mejora el control glucémico en adultos con DMT2 y puede combinarse con metformina. En adultos con DMT2 y nefropatía diabética con albuminuria de más de 300 mg / día, la canagliflozina está indicada para reducir las posibilidades de enfermedad renal en etapa terminal, duplicación de la creatinina sérica, muerte CV y hospitalización por insuficiencia cardíaca.45
3.1.6.2 Dapagliflozina
La dapagliflozina reduce la reabsorción de glucosa en los túbulos renales proximales y reduce el umbral renal de glucosa, lo cual aumenta la excreción urinaria de glucosa. Como complemento de la dieta y el ejercicio, mejora el control glucémico en la DMT2, ya sea como monoterapia (terapia inicial) o como complemento de otros hipoglucemiantes orales, como metformina, pioglitazona, glimepirida, sitagliptina e insulina. También está indicado para reducir el riesgo de hospitalización por IC en pacientes con DMT2 y enfermedad CV establecida o múltiples factores de riesgo CV.46
3.1.6.3 Empagliflozina
Inhibidor de SGLT-2 que disminuye la glucosa en sangre al aumentar la excreción urinaria de glucosa. El SGLT-2 se expresa en los túbulos renales proximales y es responsable de la mayor parte de la reabsorción de glucosa filtrada del lumen tubular. Los inhibidores de SGLT-2 reducen la reabsorción de glucosa y disminuyen el umbral renal de glucosa.47 Asimismo, está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con DMT2 y para reducir el riesgo de muerte CV en adultos con DMT2 y enfermedad CV.
3.1.6.4 Ertugliflozina
La ertugliflozina está indicada para mejorar el control glucémico en adultos con DMT2, como complemento de la dieta y el ejercicio. Se puede encontrar en combinación con metformina o con sitagliptina. Sin embargo, no está disponible en Costa Rica.48
3.1.6.5 Nueva evidencia de Resultados CV Inhibidores del cotransportador sodio/glucosa tipo 2
Debido a los hallazgos de efectos benéficos extraglucémicos de los SGLT-2 encontrados en los estudios iniciales, se diseñaron estudios específicos para conocer mejor el impacto de esta clase terapéutica sobre el sistema CV y renal. Los resultados del efecto benéficos a nivel CV se discutirán en la sección de diabetes y enfermedades del corazón.
En el estudio CREDENCE,49 que reclutó a personas, quienes tenían un alto riesgo vascular, pero que no tenían ECV al inicio del estudio, la inhibición de eventos CV mayores se vio restringida a aquellos con y sin ECV. Además, aportó pruebas claras y significativas por separado de protección contra la IC y la combinación de IC o muerte vascular, en el subconjunto de prevención primaria. Estos datos soportan sólidamente el uso de estos agentes en el ámbito de la prevención primaria.
Esta descripción general confirmó los grandes beneficios de la inhibición de SGLT-2 sobre la IC y mostró efectos consistentes de la inhibición de SGLT-2 en los puntos finales CV entre aquellos con y sin antecedentes de IC al inicio del estudio. (Tabla 3)
Tabla 4 Dosificación de hipoglucemiantes orales
| Clase | Componente | Dosificación | Dosis máxima diaria |
| Biguanida | Metformina | 500-850mg 2-3 v/d | 3g/d en 3 tomas |
| Sulfonilureas | Glimepirida | 1mg/d | 6mg |
| Glipizida | 5mg/d | 40mg. Dosis >15mg dividir en 2 tomas | |
| Gliburida (glibenclamida) | 2.5-5mg/d | 15mg | |
| Glicazida | 30mg-120 una vez/d | 120mg | |
| Tiazolidinedionas | Pioglitazona | 15-30mg una vez/d | 45 mg/d |
| Inhibidores de la α glucosidasa | Acarbosa | 50mg 3v/d | 100mg 3v/d (600mg) |
| Inhibidores DPP-4 | Alogliptina | 25mg una vez/d adicional a metformina u otro hipoglucemiante | 25mg |
| Saxagliptina | 5mg/día | 5mg | |
| Linagliptina | 5mg/día | 5mg | |
| Sitagliptina | 100mg una vez/día | 100mg | |
| Vildagliptina | 50mg 2v/d | 100mg | |
| AR GLP-1 | Exenatida | 5µg 2v/d | 10µg 2v/d |
| Dulaglutida | 0.75mg una vez/sem | 4.5mg una vez/sem | |
| Semaglutida | 0.25mg una vez/sem | 1mg una vez/sem | |
| Liraglutida | 0.6mg/d | 1.8mg | |
| Lixisenatida | 10 µg una vez/d | 20µg | |
| Inhibidores SGLT-2 | Ertugliflozina | 5mg una vez/d | 15mg una vez/d |
| Dapagliflozina | 10mg una vez/d (DMT2) • 5mg una vez/d (DMT1) | 10mg | |
| Empagliflozina | 10mg una vez/d | 25mg | |
| Canagliflozina | 100mg una vez/d | 300mg una vez/d |
Adaptado de ADA Diabetes Care 44. Suplement 1 (2021): S111-S124.
Varios estudios han confirmado las características de seguridad conocidas de esta clase de fármacos, aunque no se dispuso de datos para evaluar sistemáticamente los eventos adversos graves (EAG) con respecto a cada subgrupo de interés. No se reportó aumento en los riesgos de fractura, pero hubo poca evidencia de heterogeneidad entre los estudios, lo que sugiere que el mayor riesgo de fractura observado en el estudio CANVAS50 puede haber surgido por casualidad. A pesar de la ausencia de riesgo de amputación en el ensayo CREDENCE,49 permaneció un riesgo aumentado general en todos los estudios combinados, con una heterogeneidad significativa de efectos entre los ensayos constituyentes. La amplia constancia de los hallazgos en los subgrupos sugiere una amplia utilidad clínica para la clase de fármaco y que las pocas diferencias en los efectos observadas en la descripción general deben tratarse con precaución. (Tabla 4)
4.1 Insulinas
La insulina es el agente reductor más potente de la glucemia. Está indicada en el tratamiento de los pacientes con DMT1 con franca descompensación diabética sin cetoacidosis; en mujeres embarazadas quienes no alcanzan la meta de control glucémico con solo dieta; en DMT2 cuando la HbA1c es superior a 8 % en tratamiento con dos agentes orales o cuando el paciente diabético tiene varios años de evolución y es poco probable que adicionar un tercer agente oral permita mejorar el control glucémico.
Recomendaciones sobre uso de insulina en pacientes con DMT1
Adaptado de Diabetes Care. 2021;44:S111-S124.
Los pacientes con DMT1 deben recibir un curso formal de educación en diabetes, el cual incluya cómo ajustar las dosis de insulina prandial con la ingesta de carbohidratos, glucemia antes de la comida, actividad física e identificar decisiones clave, y ante la presencia de condiciones agudas como, por ejemplo: infecciones urinarias o del tracto respiratorio. Es importante educar bien al paciente e involucrarlo en el manejo adecuado de la insulina, el autocontrol y la dieta adecuada para evitar hipoglucemias.
La insulina humana recombinante está disponible en formulación de acción rápida o insulina regular. Su acción inicia a los treinta minutos, el efecto máximo se presenta a las 1.5 a 3.5 horas, con una duración de acción aproximada de 7-8 horas. La insulina humana NPH tiene un inicio del efecto de la insulina de 1-2 horas, un efecto pico de 4-6 horas y una duración de la acción de más de doce horas.
En los últimos 25 años, se han desarrollado análogos de insulina de acción rápida (AAR), como aspart, lispro, glulisina, los cuales tienen un inicio de acción de 5-15 minutos, efecto pico de 1-2 horas y duración de la acción de unas 4-6 horas.
Los análogos de acción prolongada tienen una farmacocinética distinta en comparación con las insulinas humanas recombinantes. Los análogos de insulina basal (glargina, levemir y degludec) tienen una duración de acción más larga con concentraciones plasmáticas y perfiles de actividad más planos y constantes que la insulina NPH.3
Su inicio de la acción ocurre en los 60-90 minutos, su efecto máximo en alrededor de cinco horas y gradualmente se desvanece durante las siguientes 12-24 horas. La insulina glargina es idéntica a la insulina humana, excepto por una sustitución de glicina por arginina en posición A21 y por la adición de dos moléculas de arginina en la cadena B de la insulina. Estas modificaciones producen un cambio en el pH, de tal manera que después de la administración SC, la glargina se precipita formando hexámeros, los cuales permiten una reducción en su absorción, hecho que prolonga la duración de su acción. La glargina no tiene un pico significativo en su concentración y su duración es generalmente de veinticuatro horas. No puede administrarse mezclada con insulinas de acción rápida.
La insulina detemir es una insulina acetilada, los ácidos grasos en la cadena lateral permiten su unión a la albumina, lo que prolonga su acción. Detemir no tiene un pico apreciable después de su administración y generalmente su acción dura menos de veinticuatro horas. Por su parte, los estudios clínicos en pacientes con DMT1 y DMT2 sugieren que es necesario administrarla dos veces al día. Detemir no puede ser mezclada con insulinas de acción rápida.
La insulina degludec es la más parecida a la insulina humana excepto por la ausencia del último aminoácido de la cadena B y la unión de glutamil LysB29 al ácido hexadecanedioico. Esto permite la formación de multihexámeros solubles en el sitio de la inyección, de los cuales los monómeros se separan lentamente y se absorben. Esta característica confiere una duración de acción prolongada (> 40 horas) y reduce la variabilidad de la concentración plasmática con una sola dosis al día. A diferencia de las insulinas glargina y detemir, degludec puede ser mezclada con insulinas de acción rápida sin que se altere la cinética de degludec o la insulina de acción rápida.
Hay insulinas premezcladas a dosis fija que no se aconseja emplearlas en DMT1. Las insulinas premezcladas pueden ser consideradas para algunos pacientes con DMT2 por conveniencia en la dosificación. Igualmente, en los pacientes con DMT1, el tratamiento con insulinas análogas se asocia con menos hipoglucemia y aumento de peso, así como con una HbA1c más baja en comparación con las insulinas humanas.51-53
Existen múltiples enfoques para el tratamiento con insulina y el precepto central en el manejo de la DMT1 es que se administre alguna forma de insulina en un régimen planificado, adaptado al paciente de forma individual para mantenerlo a salvo, fuera de la cetoacidosis diabética y para evitar una hipoglucemia significativa.
También existen pequeños estudios de corta duración que comparan múltiples inyecciones diarias con infusión continua de insulina (CSII). Sin embargo, Yeh H y colaboradores en una revisión sistemática reportaron una modesta ventaja de la terapia con bomba para reducir la HbA1c (-0.30 % (95 % a -0.58 a -0.02)) y las tasas de hipoglucemia severa (HS) en niños y adultos.54 En un metaanálisis realizado por Pickup JC, se reportó que no existe consenso para apoyar la elección de la terapia de inyección o infusión continua de insulina en un paciente determinado y se necesita investigación para orientar esta toma de decisiones.55 Los monitores continuos de glucosa han demostrado ser beneficiosos en circunstancias específicas. En pacientes con DMT1 que utilizan bombas de insulina con sensores de glucosa, la reducción de la hipoglucemia nocturna se mejora mediante la suspensión automática de la administración de insulina a un nivel de glucosa prestablecido. Al elegir entre los sistemas de administración de insulina para un paciente determinado, es importante considerar las preferencias del paciente, el costo, el tipo de insulina y el régimen de dosificación, así como las capacidades de autocuidado.3
Los pacientes con DMT1 requieren 50 % de su insulina diaria como basal y 50 % como prandial.3
Las necesidades diarias totales de insulina se pueden estimar en función del peso, con dosis típicas que oscilan entre 0.24 y 0.5 unidades / kg / día; durante la pubertad, el embarazo y las enfermedades médicas, se requieren cantidades mayores. La American Diabetes Association / JDRF Type 1 Diabetes Sourcebook señala 0.5 unidades / kg / día como dosis inicial típica en pacientes con DMT1 que son metabólicamente estables, administrando la mitad como insulina prandial para controlar la GP después de las comidas y la otra la mitad de insulina basal para controlar la glucemia en los períodos entre la absorción de las comidas.56
Para pacientes con DMT1, los regímenes multidosis típicos combinan el uso antes de las comidas de insulinas de acción más corta con una formulación de acción más prolongada, generalmente por la noche. La dosis basal de acción prolongada se titula para regular la glucosa en ayunas durante la noche.3
Las excursiones de glucosa posprandial se controlan mejor con una inyección oportuna de insulina prandial. Para determinar el momento óptimo para administrar insulina prandial, deben considerarse varios factores: la farmacocinética de la formulación (regular, AAR), el nivel de GP antes de las comidas y la ingesta de carbohidratos. Por tanto, las recomendaciones para la administración de una dosis de insulina prandial deben hacerse de forma personalizada. La secreción fisiológica de insulina varía con la glucemia, el tamaño de la comida y la demanda tisular de glucosa.3
Debido a la variabilidad de los requerimientos de los pacientes en tratamiento con insulina, se han desarrollado estrategias para ajustar las dosis prandiales en función de las necesidades previstas. Por esta razón, es necesario incluir en el programa de educación de los pacientes una explicación clara sobre cómo ajustar la insulina prandial teniendo como referencia la ingesta de carbohidratos, los niveles de glucosa antes de las comidas y la actividad.57,58 Para obtener un beneficio adicional en pacientes en los que el recuento de carbohidratos es eficaz, se pueden incorporar las estimaciones del contenido de grasas y proteínas de las comidas.59 (Tabla 5 y Tabla 6)
Tabla 5 Características de los diferentes tipos de insulinas
| Insulina | Inicio de acción | Pico de acción | Duración |
| Rápida o regular | 30-60 min | 2-3 h | 8-10 h |
| Aspártica | 10-20 min | 40-50 min | 3-5 h |
| Lispro | 5-15 min | 30-90 min | 4-6 h |
| Glulisina | 20 min | 90 min | 5 h |
| Intermedia o NPH | 2-4 h | 4-10 h | 12-18 h |
| Glargina | 2-4 h | No hay | ~24 h |
| Detemir | 0.8-2 h | No hay | ~24 h |
| Degludec | 0.8-2 h | No hay | ~36 h |
| Glargina U300 | 0.8-2 h | No hay | ~36 h |
| Humana bifásica 70/30 | 0.5-1 h | 2 y 16 h | 18-24 h |
| Bifásica aspártica 70/30 | 10-20 min | 1 y 4 h | ~24 h |
| Bifásica lispro 75/25 | 15-30 min | 0.5 y 2.5 h | ~24 h |
Fuente: Siegfried Rhein Cardio Metabólico. Edición de Intersistemas SA de CV, 2020.
Tabla 6 Esquema recomendado para ajustar la insulina
| Glucosa en ayunas | Dosis para ajustar |
| < 80 mg/dL | Disminuir 2 U |
| 80 - 100 mg/dL | No hacer ajuste |
| > 100 - 150 mg/dL | Aumentar 2 U |
| > 150 - 200 | Aumentar 4 U |
| > 200 mg/dL | Aumentar 6 U |
Los ajustes se realizan de acuerdo con los valores de glucosa en ayunas en un período de 5 a 7 días
Fuente: Siegfried Rhein Cardio Metabólico. Edición de Intersistemas SA de CV, 2020.
4.2 Tratamientos sin insulina para la diabetes tipo 1
La pramlintida se basa en el péptido amilina de células ß de origen natural y está aprobada para su uso en adultos con DMT1. Estudios controlados aleatorizados han demostrado que la adición de pramlintida a la insulina ayuda a reducir los valores de HbA1c (0-0.3 %) y peso corporal (1-2 kg) en pacientes con DMT1.60,61
También se han reportado resultados similares con la adición a la insulina de varios agentes actualmente aprobados solo para el tratamiento de la DMT2. El uso de metformina más insulina en adultos con DMT1 provocó pequeñas reducciones en los niveles de lípidos, pero no mejoró la HbA1c.62,63
No obstante, la metformina no se indica en personas con DMT1.Adicionar un AR- GLP-1 como liraglutida o exenatida a la terapia insulínica puede causar una reducción de la HbA1C (0.2 %) y una reducción de peso en aproximadamente 3 kg comparada con la insulina sola en DMT1.64
Recientemente, se ha evaluado que adición de un inhibidor del SGLT-2 al paciente con DM1 que recibe insulina se asocia con mejoras en la HbA1c y peso corporal comparado con insulina sola;65,66 sin embargo, se ha reportado aumento de dos a cuatro veces en la cetoacidosis diabética. Se continúan evaluando los riesgos y los beneficios de los agentes adyuvantes, pero solo la pramlintida está aprobada para el tratamiento de la DMT1.
5. Terapia con insulina para pacientes con diabetes tipo 2
La DMT2 es progresiva y el uso de insulinas trae beneficio a los pacientes, pues ayuda a mejorar el control glucémico cuando no es posible mantenerlo solo con tratamiento oral.
Asimismo, es importante educar bien al paciente e involucrarlo en el manejo adecuado de la insulina, el autocontrol y la dieta adecuada para lograr un control metabólico adecuado y evitar hipoglucemias.
5.1 Control intensificado de la glucosa
Cuando el paciente diabético no alcanza la meta de HbA1c, el médico debe considerar si es oportuno intensificar el tratamiento. También debe evaluarse cuidadosamente la inercia terapéutica, que representa un retardo en la intensificación, como avanzar en el tratamiento.
Los resultados de los estudios ACCORD,67 ADVANCE68 y VADT69 alertaron que la intensificación del tratamiento puede ser de riesgo al aumentar la incidencia de hipoglucemias, particularmente en pacientes frágiles con complicaciones CV preexistentes. Después de 2015, los estudios de seguridad con iSGLT-2 y AR- GLP-1 han demostrado el beneficio CV extra glucémicos.
Los objetivos de control glucémico han variado a través de los años. Antes de 2008, la meta era lograr una reducción de la HbA1c. Posteriormente, los objetivos se centraron en a prevención de la hipoglucemia y seguridad CV guiados por los resultados de los estudios ACCORD, ADVANCE, VADT; y después de 2015, se basaron en la evidencia de los estudios de seguridad con iSGLT-2 y AR-GLP-1 gracias a los beneficios demostrados con eso nuevos agentes controladores de la glucemia.
La Asociación Americana de Endocrinología Clínica y el Colegio Americano de Endocrinología (AACE) recomiendan una meta de HbA1c de <6.5 % para la mayoría de los pacientes o <7.0 % en pacientes con riesgo de hipoglucemias, por lo que la meta de HbA1c debe ser individualizada.70 En pacientes con DMT2, es necesario un abordaje personalizado para alcanzar los objetivos de GPA y HbA1c, considerando la edad, las comorbilidades, el riesgo de hipoglucemia y muchos otros factores.25
A la luz de estudio ADVANCE, se observaron reducciones significativas en el riesgo o la progresión de la nefropatía en pacientes que lograron un control metabólico adecuado68 sin incrementar el riesgo de muerte. En contraste, en el estudio ACCORD, el control glucémico intensivo redujo significativamente el riesgo y/o la progresión de retinopatía, nefropatía y neuropatía,67,71 pero se observó un aumento de riesgo de muerte. En este estudio ACCORD, el cual involucró a pacientes mayores y de mediana edad, con DMT2 de larga duración, quienes tenían ECVAS establecida o un alto riesgo de desarrollarla y una HbA1c basal > 8.5 %, los pacientes asignados al azar a la terapia intensiva hipoglucemiante (un objetivo de HbA1c de <6.0%) tuvieron un aumento de la mortalidad.72
La mayor mortalidad ocurrió en pacientes cuyo HbA1c permaneció >7.0 % a pesar de la terapia intensiva y esta distinción crítica a veces se olvida cuando se discuten los riesgos y los beneficios de la terapia intensiva. ACCORD también mostró que la neuropatía autonómica CV puede ser otro predictor útil del riesgo CV.73 Alternativamente, los participantes de este estudio que presentaban diversos factores de riesgo e historia de ECV podrían representar un grupo de diabéticos frágiles susceptibles de sufrir eventos CV.
El tercer estudio de esta índole fue el VADT, que tenía una meta más alta de HbA1c para los pacientes tratados intensivamente (1.5 % más bajo que el grupo de tratamiento estándar), no reportó diferencias entre los grupos en los criterios de valoración de ECVAS, muerte CV o muerte general durante el período de estudio de 5.6 años.69,72
Después de aproximadamente diez años de seguimiento observacional a los pacientes del estudio VADT, se observó que tenían 17 % menor probabilidad de sufrir un evento CV mayor si recibían terapia intensiva durante el estudio, mientras que el riesgo de mortalidad se mantuvo igual entre los grupos de tratamiento.74
En consecuencia, la intensificación del control glucémico debe ser analizado en el contexto del paciente. Como se señaló previamente, varios estudios han demostrado que la hipoglucemia grave ocurre con mayor frecuencia con un control glucémico intensivo en los estudios clínicos aleatorizados en los que se utiliza insulina y/o SU.67,69,72,75,76
En adultos con inicio reciente de DMT2 y sin ECVAS clínicamente significativa, un HbA1c <6.5 %, si se logra sin hipoglucemia sustancial u otras consecuencias inaceptables, puede reducir el riesgo de complicaciones micro y macrovasculares de por vida. En la Figura 2, se presenta el algoritmo para prevención de ECV que incluye el tratamiento no farmacológico.
Recomendaciones para uso de insulinas
Adaptado de: Diabetes Ther. 2020;11(8):1645-1666
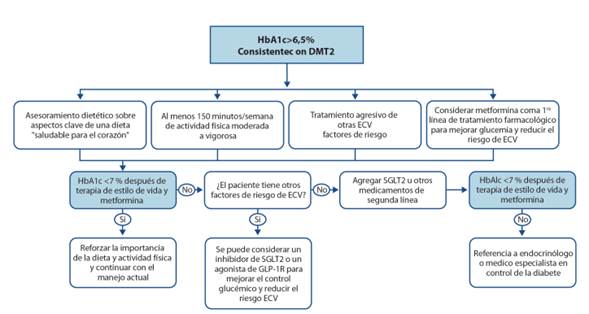
Adaptado de J Am Coll Cardiol 2019;March 17. Circulation. 2019;140:e596-e646
Figura 2. Tratamiento de DMT2 para prevención primaria de ECV. CVD indica enfermedad cardiovascular; GLP-1R, receptor peptídico similar al glucagón; HbA1c, hemoglobina glicosilada; SGLT-2, cotransportador de sodio-glucosa 2 y DMT2 diabetes mellitus Tipo 2. .
5.1.2 Limitantes con la intensificación del control glucémico
La hipoglucemia representa una barrera para el control glucémico adecuado y se asocia con riesgo de complicaciones agudas y crónicas, especialmente en pacientes con diabetes evolucionada que usen dosis altas de insulina humana y con factores de riesgo para la hipoglucemia. Es importante hacer notar que muchos pacientes en terapia intensificada presentan HbA1c elevada, lo que induce a pensar que es necesario subir aún más la dosis de insulina y, en consecuencia, esto empeora el escenario del paciente. Los pacientes intensificados pueden presentar hipoglucemia no percibida, condición compleja que se asocia con pocas manifestaciones adrenérgicas, entre las cuales predominan las neuroglucopénicas. El médico tiene que detectar la hipoglucemia no percibida para lo cual existen herramientas y estrategias de prevención.77,78
Tanto la incidencia como la mortalidad del SCA entre los pacientes diabéticos son mucho más altas que entre los no diabéticos. Actualmente, hay muchos estudios que evaluaron el control glucémico y el riesgo CV, pero hay muy poca información sobre el control glucémico estricto en SCA. La hiperglucemia se relaciona con daño vascular y la muerte de miocitos cardíacos a través de diferentes mecanismos moleculares como productos finales de glicación avanzada, proteína quinasa C, flujo de la vía de poliol y vía de la hexosamina.79
Altas concentraciones de ácidos grasos libres pueden ser tóxicas en el miocardio isquémico agudo, así como conducir a una disfunción endotelial. Los estudios DIGAMI sugirieron que el nivel GP es un predictor de mortalidad en los pacientes diabéticos con SCA reciente, por lo que es importante controlar la glucosa en el manejo de estos pacientes.79
La mayoría de los pacientes diabéticos son obesos, con múltiples comorbilidades críticas como ECV, IC y ERC. En cuanto a pacientes con HbA1c fuera del objetivo, en las guías ADA 2021 se recomienda evaluar el balance riesgo/beneficio centrado en el paciente, del uso de fármacos hipoglucemiantes, de un agonista GLP-1, o cambiar a insulina.
El inicio oportuno de la insulina puede prevenir la progresión de la diabetes y reducir las complicaciones relacionadas con menos efectos adversos graves. La insulina basal es la opción preferida en la mayoría de las situaciones clínicas como consecuencias del tratamiento insuficiente de la hiperglucemia crónica.80
Las consecuencias en el retraso del inicio de la terapia con insulina y del tratamiento insuficiente de la hiperglucemia son las siguientes:81
Mayor riesgo de complicaciones relacionadas con la diabetes.
Sarcopenia y mareos.
Reducción del estado físico y mental.
Reducción de resistencia a las infecciones.
Reducción de libido y potencia sexual.
Riesgo de nicturia e incontinencia en ancianos.
Deficiencia progresiva en la masa y la función de las células β.
Necesidad de una dosis más alta de insulina con mayor riesgo de hipoglucemia grave.
El inicio oportuno de la insulina en pacientes con DMT2 para obtener niveles de glucosa cercanos al normal, así como para controlar la glucotoxicidad y la inflamación, puede darse en cualquier momento, con el fin de proteger las células ß y evitar la remodelación dañina de la memoria metabólica, pero es importante considerar los efectos adversos graves de la insulina: la hipoglucemia y el aumento de peso. La HS se relaciona con un muy alto riesgo de eventos CV y muertes, por lo que es esencial un enfoque individualizado para iniciar la terapia con insulina considerando siempre el equilibrio riesgo / beneficio.80
Los estudios a largo plazo (DIGAMI,82,83 UKPDS,23,84 Legacy13y ORIGIN85-87) reportaron que con el inicio temprano de la insulina, se observó un beneficio significativo sobre la enfermedad microvascular, en eventos CV y en los estudios con un seguimiento de más de diez años, una mejoría en la esperanza de vida.80
Hanefeld y colaboradores proponen dos estrategias para el uso de insulina:80
Insulina como fármaco de primera línea al momento del diagnóstico de diabetes en caso de HS, con HbA1c > 9-10% y subtipos con déficit de insulina severo y enfermedad clínica. Esta estrategia es más eficaz para controlar la gluco-lipotoxicidad, favorece la reactivación de la función de las células ß, evita efectos nocivos sobre la memoria metabólica y tiene una alta tasa de remisión de la diabetes.
Insulina como combinación con hipoglucemiantes orales y / o GLP-1RA cuando la HbA1c está fuera del objetivo, si el paciente desarrolla complicaciones relacionadas con la diabetes o sufre infecciones, sarcopenia, etc., que se benefician de los efectos pleiotrópicos de la insulina.
5.2 Tratamiento de la hiperglucemia en el hospital
La hiperglucemia y la hipoglucemia se asocian con resultados adversos, incluyendo la muerte en pacientes diabéticos hospitalizados, por lo que estos pacientes deben manejarse cuidadosamente en el ámbito hospitalario para obtener beneficios directos e inmediatos.
Para facilitar el manejo de la diabetes en pacientes hospitalizados, acortar su estadía hospitalaria, reducir la necesidad de readmisión y obtener mejores resultados es necesario lo indicado a continuación:88
Un tratamiento adecuado de la hiperglucemia previo a la admisión en pacientes que se someten a procedimientos electivos.
Un cuidado adecuado de la diabetes para pacientes hospitalizados con la aplicación de estándares bien establecidos.
Una transición cuidadosa a un tratamiento ambulatorio en el momento del alta.
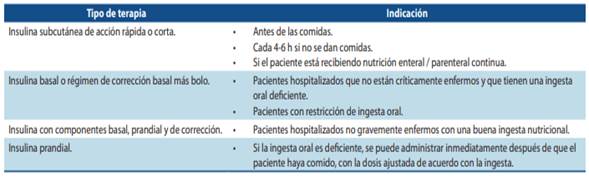
Recomendaciones para aplicación de insulina a pacientes hospitalizados
Adaptado de Diabetes Care. 2021;44(1):S211-S220.
5.2.1 Objetivos de glucemia
En un estudio clínico, Van den Berghe y colaboradores89 demostraron que con la implementación de un régimen intensivo de insulina intravenosa para alcanzar del objetivo de glucemia de 80-110 mg / dL (4.4-6.1 mmol / L), se redujo la mortalidad en un 40 % en pacientes críticos con cirugía reciente, comparado con el tratamiento estándar en pacientes con GP de 180-215 mg / dL (10 -12 mmol / L) y proporcionó pruebas sólidas sobre el beneficio del tratamiento intensivo para reducir la GP en pacientes hospitalizados.
Por el contrario, el estudio (NICE-SUGAR)90 reportó que los pacientes críticamente enfermos asignados al azar a un control intensivo de glucemia (80-110 mg / dL) no obtuvieron ventajas significativas, comparado con un grupo con objetivos de glucemia más moderados (140-180 mg / dL [7.8-10.0 mmol / L)). Incluso reportó una mortalidad leve, pero significativamente mayor (27.5 % vs. 25 %). Los pacientes en control intensivo presentaron tasas de hipoglucemia de diez a quince veces mayores, lo que puede haber contribuido a los resultados adversos observados.
Estos hallazgos están respaldados por varios metaanálisis. También sugirieron que el control estricto de la glucemia aumenta la mortalidad y provoca tasas más altas de hipoglucemia comparado con los objetivos de glucemia más moderados.91-93 Con base en estos resultados, para los pacientes críticamente enfermos con hiperglucemia persistente ≥180 mg / dL (10.0 mmol / L), se recomienda iniciar la terapia con insulina para el tratamiento enfocada a un rango de glucosa de 140-180 mg / dL (7.8-10.0 mmol / L). Aunque no están tan bien respaldadas por datos de ensayos controlados aleatorios, estas recomendaciones se han extendido a pacientes hospitalizados sin enfermedades críticas.88
En algunos pacientes específicos (pacientes posquirúrgicos en estado crítico o pacientes con cirugía cardíaca), puede ser apropiado un objetivo más estricto de control glucémico como 110-140 mg / dL (6.1-7.8 mmol / L), siempre que sea alcanzable sin hipoglucemia.94,95 En pacientes con comorbilidades graves y en entornos de atención hospitalaria donde no se pueda realizar un control frecuente de la glucosa o una estrecha supervisión de enfermería, pueden aceptarse concentraciones de glucosa entre 180 mg / dL y 250 mg / dL (10-13.9 mmol / L). En pacientes terminales con una esperanza de vida corta pueden considerarse niveles de glucemia por encima de 250 mg / dL (13.9 mmol / L). Por lo tanto, para la dosificación de insulina en pacientes hospitalizados, es importante considerar el criterio clínico, la evaluación del estado del paciente, los cambios en los valores de glucosa, la gravedad de la enfermedad, el estado nutricional del paciente y la medicación concomitante que podría afectar los niveles de glucosa (por ejemplo: Glucocorticoides).96
5.2.2 Entorno de cuidados intensivos de terapia con insulina
En el caso de pacientes diabéticos en cuidados intensivos, el método más eficaz para alcanzar los objetivos de glucemia es por medio de la infusión continua de insulina intravenosa, la cual debe administrarse según protocolos validados escritos o computarizados que permitan ajustes predefinidos en la velocidad de infusión, considerando las fluctuaciones de glucemia y la dosis de insulina.97
5.2.3 Entorno de atención no crítica
Fuera de las unidades de cuidados intensivos, se recomiendan regímenes de insulina programados para controlar la hiperglucemia en pacientes diabéticos. Los regímenes que utilizan análogos de insulina e insulina humana dan como resultado un control glucémico similar en el entorno hospitalario.98 (Tabla 7)
Para los pacientes con ingesta normal, las inyecciones de insulina deben coincidir con las comidas y se les debe realizar la prueba de glucosa en el punto de atención, justo antes de las comidas.98 En un estudio controlado aleatorio, Umpierrez y colaboradores demostraron que el tratamiento con bolo basal mejoró el control glucémico y redujo las complicaciones hospitalarias en comparación con los regímenes de insulina reactiva o de escala variable (es decir, la dosis administrada en respuesta a la glucosa elevada en lugar de forma preventiva) en pacientes de cirugía general con DMT2.99 Por ende, se desaconseja enérgicamente el uso prolongado de la escala móvil para los regímenes de insulina como único tratamiento de los pacientes hospitalizados hiperglucémicos.100,101
Si bien existe evidencia sobre el uso de formulaciones de insulina premezcladas en el ámbito ambulatorio, Bellido y colaboradores realizaron un estudio en pacientes hospitalizados comparando el uso de 70/30 NPH / insulina regular versus terapia de bolo y reportaron un control de glucemia comparable, pero con un aumento significativo de la hipoglucemia en el grupo que recibió insulina premezclada.102 Por lo tanto, no se recomiendan el uso de forma rutinaria de estos regímenes de insulina premezclada en el ambiente hospitalario.
5.2.4 Transición de insulina intravenosa a subcutánea
Al suspender la insulina intravenosa, se recomienda el uso de un protocolo de transición a insulina SC asociada con menos morbilidad y menores costos de atención.103,104 Un paciente con DMT1 o DMT2 en transición a un régimen subcutáneo ambulatorio debe recibir una dosis de insulina basal SC 2-4 h antes de que se interrumpa la infusión intravenosa.
La conversión a insulina basal al 60-80 % de la dosis diaria de infusión es un enfoque eficaz.105
Para los pacientes que están en transición a regímenes con insulina concentrada (U-300) en un ambiente hospitalario, es importante garantizar la dosificación correcta mediante el uso de una pluma y un cartucho individuales para cada paciente y supervisar cuidadosamente la dosis administrada.106 Asimismo, para controlar la GP en grupos seleccionados de pacientes diabéticos hospitalizados, algunos estudios respaldan la administración de insulina en circuito cerrado con dispositivos de bomba / sensores.107,108 Aún no se ha determinado el efecto del tratamiento de ciclo cerrado sobre los resultados clínicos, la mejor aplicación de estos dispositivos y la rentabilidad de este enfoque.
5.2.5 Cuidado perioperatorio
Se puede considerar el siguiente enfoque para atención perioperatoria:109,110
El rango objetivo de GP en el período perioperatorio debe ser de 80-180 mg / dL (4.4-10.0 mmol / L).
Se debe evaluar el riesgo preoperatorio para los pacientes diabéticos que tienen un alto riesgo de cardiopatía isquémica y aquellos con neuropatía autonómica o insuficiencia renal.
La metformina debe suspenderse el día de la cirugía.
Suspender cualquier otro hipoglucemiante oral la mañana de la cirugía o el procedimiento y administrar la mitad de la dosis de NPH o dosis del 60-80 % de análogo de acción prolongada o insulina basal con bomba.
Controlar la glucemia al menos cada 4-6 h mientras el paciente no esté tomando nada por vía oral y administrar la dosis con insulina de acción corta o rápida según sea necesario.