Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.7 n.2 San José May. 2005
Células Madre en la reparación de tejido miocárdico:
Biología y Clínica.
*Dr Fernando Zeledón S.,Dr Orlando Morales,Dr Edgar Méndez J.,§Dra Abigail Porras.,**Dr José Zamora L.,Dra Priscilla Orlich
En los últimos años se ha visto como las células madre han pasado de ser un concepto de interés científico,a ocupar tantas páginas en las revistas científicas como esperanzados comentarios en la prensa.Los conocimientos que en este campo de la medicina se vienen produciendo de forma casi diaria han disparado las expectativas de los enfermos y de los médicos de que las células madre vayan a contribuir a la curación de múltiples enfermedades humanas como la diabetes,la enfermedad de Parkinson,el infarto de miocardio u otras muchas.En el centro del debate científico,político y ético se ha situado la utilización e investigación con células madre embrionarias.No obstante,ante el descubrimiento de células madre adultas,ya sean del propio enfermo o de un donador, pareciera que existen menos obstáculos en el campo ético,más grados de libertad para el investigador y ciertamente mayores esperanzas para los enfermos.Es por esta razón,que vamos a comentar algunos de los aspectos básicos sobre este tema,en especial,en el interés que ha provocado la terapia con células madre en la reparación de corazones lesionados.
In spite of the controversies involving stem cells,their future utilization has raised enormous expectations.Be as a therapeutic maneuver for degenerative disorders up until now of incurable nature,such as Parkinson s disease,muscular dystrophies, diabetes and cardiac diseases,or as a vehicle of genetic therapy,the truth is that we have only started to imagine their therapeutic possibilities.
Unfortunately this wide field,has opened more questions than answers.Which is the ideal source for stem cells?Would the different stem cell types cause a beneficial effect in different situations.How many cells should be transplanted?Which is the most advisable access?Is it better to perform cell therapy during the acute phase of a myocardial infarction, or during the chronic phase?What type of stem cells should be transplanted?What mechanisms govern stem cells to survive and to differentiate?What is the average life of the new myocites?How safe is the procedure?Is there a role for pharmaceuticals in conjunction with stem cell therapy?And so on.
We have to keep in mind that to make stem cell therapy a reality,is absolutely necessary to continue rigorous basic research,since the ultimate use of this approach in the management of myocardial infarction in the acute or chronic phase of an MI should be based in solid scientific principles and randomized studies that can assure more benefits than side effects.
¿Qué son las Células Madre?
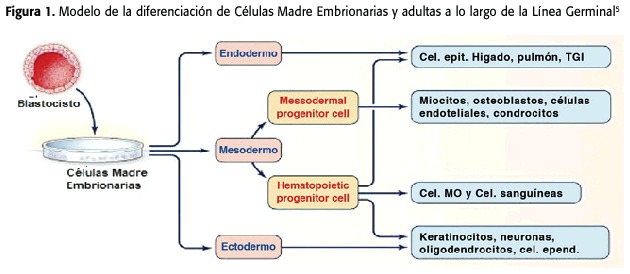
Las Celulas Madre (CM)comparten dentro de su definición las siguientes dos características:la capacidad de diferenciarse dentro de un amplio espectro de tipos celulares y la capacidad de renovarse ellas mismas.1 (Figura 1)
Además,el principio biológico que subyace el uso de CM es el fenómeno de diferenciación dirigida por tejido;es decir,células madre aisladas del tejido hepático y reinyectadas en el hígado llegan a ser hepatocitos,mientras que estas mismas células inyectadas en el miocardio se convierten en miocitos.1
Clasificación de las Células Madre
La clasificación de las CM desde un punto de vista biológico se ha basado en un largo número de marcadores celulares, de los cuales,en párrafos siguientes mencionaremos los más importantes.
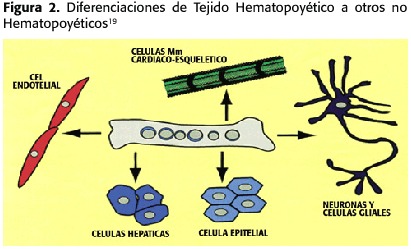
A la vez,las células madre se pueden clasificar según su potencial de diferenciación:las células madre totipotenciales son capaces de producir tejido embrionario y extraembrionario; y en consecuencia un organismo completo (a partir de un blastocisto y células);las células madre pluripotenciales tienen la habilidad de diferenciarse a tejidos procedentes de cualquiera de las tres capas embrionarias y,por último,las células madre multipotenciales,son capaces de diferenciarse en distintos tipos celulares procedentes de la misma capa embrionaria 2.(Figura 2) Tradicionalmente se han considerado a las células madre embrionarias como células pluripotenciales,a diferencia de las células madre adultas que se han caracterizado sólo como multipotenciales.Sin embargo,trabajos publicados recientemente sugieren que la potencialidad de algunos tipos de células madre adultas podría ser mayor de lo esperado,existiendo células pluripotenciales en algunos órganos adultos con capacidad de diferenciarse en tejidos derivados de cualquiera de las capas embrionarias.3
Es importante destacar que para que una célula madre pueda considerarse pluripotencial tiene que cumplir las siguientes condiciones:en primer lugar ,una única célula debe ser capaz de diferenciarse a células especializadas procedentes de cualquier capa embrionaria;en segundo lugar ,demostrar la funcionalidad in vitro e in vivo de las células a las que se han diferenciado y finalmente,que se produzca un asentamiento claro y persistente de estas células en el tejido blanco,tanto en presencia o ausencia de daño en los tejidos en los cuales se implanta.En estos momentos no existe ningún estudio que cumpla todos estos criterios de forma estricta,aunque algunos trabajos indican de manera bastante evidente la posible existencia de células madre adultas pluripotenciales.3,4
Las CM embrionarias son aquellas que se derivan de la masa celular interna al inicio del desarrollo embrionario en estado de blastocisto (7-14 días),y luego,tras múltiples divisiones celulares éstas dan origen a las CM adultas.5 (ver figura 1)
Biología de las Células Madre
Se han descrito diferentes tipos de células madre en la médula ósea:hematopoyéticas (HSC)2, mesenquimatosas (MSC)6,7 y recientemente las células progenitoras adultas multipotenciales o MAPCs8 ,de las cuales,las dos últimas no se tratarán en esta revisión.
Las células madre hematopoyéticas de médula ósea y de sangre periférica también son capaces de contribuir a la angiogénesis y vasculogénesis in vivo de tal forma que estas células no sólo contienen progenitores hematopoyéticos sino también células progenitoras endoteliales.
Las células madre mesenquimatosas,también denominadas células madre estromales (MSC) presentan distintos marcadores de superfície tales como SH2,SH3,CD29,CD44,CD71,CD90 y CD10621.Las MSC no expresan antígenos de superficie típicos de las HSC,como CD34,CD45 o CD14.Experimentos recientes han demostrado in vitro que las MSC son capaces de diferenciarse a tejidos mesodérmicos funcionales,como osteoblastos, condroblastos,en adipocitos y mioblastos esqueléticos 9.
La mayoría de las células madre,al igual que las demás células del cuerpo humano expresan proteínas en la membrana plasmática, cuya función es variada dependiendo del microambiente celular y de la función de la célula en cuestión.Es así como las CM hematopoyéticas en humanos expresan el antígeno CD34,una proteína integral de membrana de 90-120 kD,que también se
expresa en progenitores comprometidos.Se ha sugerido que esta molécula funciona como regulador de la adhesión celular a las células del estroma del microentorno hematopoyético.La frecuencia de las células CD34 +en médula ósea se ha estimado entre 1-3%de las células mononucleadas y en sangre de cordón umbilical (SCU)oscila entre 0.2-1%.
Es interesante resaltar que su frecuencia en la SCU disminuye con la edad de gestación.Así,se ha observado que a las 17 semanas de gestación suponen el 11%de las células mononucleares, mientras que a las 38 semanas son el 1%, aproximadamente.Las células CD34+,tanto en médula ósea como en SCU constituyen una población muy heterogénea en la que se incluyen también progenitores hematopoyéticos.9,10
La separación celular basada en la coexpresión de otros antígenos ha permitido obtener poblaciones celulares enriquecidas a partir de células más primitivas.Así la expresión del antígeno CD38 aumenta con la diferenciación.Esta es una proteína de membrana de 45 kD,cuya principal expresión se da en células plasmáticas, timocitos y células T activadas.Tan sólo entre 1-10%de las células CD34 +son CD38.
Las células madre hematopoyéticas se encuentran en la subpoblación celular CD34 +CD38 y L i n -.También expresan el antígeno CD133,el cual no se encuentra después de la diferenciación;el Thy-1 (CD90),de 25-35 kD que juega un papel importante en la activación de las células T;y además,tienen una baja o nula expresión de c-kit o receptor de la célula madre (CD117).El CD45,cuyo peso oscila alrededor de 220 kD,se expresa tras la diferenciación en los leucocitos principalmente y es importante en la transducción de señal vía tirosinfosfatasa.
La existencia de células madre adultas en distintos tejidos, incluyendo hematopoyético, neuronal, epidérmico, gastrointestinal, músculo esquelético,músculo cardíaco,hígado,páncreas o pulmón no admite controversia.Sin embargo,cada vez parece más evidente que las células madre adultas derivadas de estos órganos,no sólo pueden generar células maduras de dicho tejido sino también tejidos derivados de otras capas embrionarias, siendo el caso más típico el de las células madre hematopoyéticas capaces de diferenciarse a tejidos como hepatocitos 11,músculo cardíaco 12, endotelio 13 o a tejidos derivados de las tres capas embrionarias (Figura 1).Este fenómeno, denominado plasticidad o capacidad de transdiferenciación de las células madre adultas, no está exento de controversia,ya que mientras algunos estudios lo apoyan,otros trabajos recientes cuestionan la existencia de una auténtica plasticidad de las células,justificando algunos de los hallazgos de versatilidad en función de fenómenos de fusión celular 14,15,16 o incluso cuestionando abiertamente los resultados experimentales.17
Ante un daño tisular,por ejemplo un infarto agudo del miocardio (IAM),se ha comprobado que ocurre un aumento de CM en la zona lesionada,cuyo pico se da al sétimo día y que cubre tres eventos:
a)Movilización de células madre de la médula ósea
b)Anidamiento en el sitio dañado
c)Diferenciación en las células del tejido lesionado
Por lo tanto,cada uno de estos pasos pueden permitir una potencial herramienta terapéutica.1
El anidamiento de las células madre hacia áreas de tejido dañado podría potencialmente ocurrir por dos vías.Una hipótesis sugiere que la necrosis celular que sigue a un lesión tal como un infarto cardíaco podría causar la liberación de señales químicas que circulen e induzcan la movilización de las células madre de la médula ósea.El tejido lesionado podría expresar adecuados receptores o ligandos que faciliten el tráfico y la adhesión de las CM al sitio dañado en donde la iniciación de una cascada de diferenciación resulta en la generación de células de un adecuado linaje tisular.
Una hipótesis alternativa sugiere que las CM están continuamente circulando traficando en los diferentes tejidos,pero sólo en el momento de la agresión tisular éstas salen hacia la sangre y comienzan a infiltrarse en el sitio dañado.
No se conocen del todo los factores que inducen que las CM se movilicen y aniden en el tejido dañado,pero entre los más estudiados hasta el momento,se encuentran el factor de células madre o c-kit ,el receptor de la quimioquina CXCR4,el factor derivado de las células mesenquimatosas,factor estimulante de las colonias granulocíticas y el factor de crecimiento endotelial vascular,entre otros.
Las CM,las células de la cresta neural y las células de la línea germinal expresan el c-kit ,un receptor tirosinacinasa.La migración de estas células durante el desarrollo embrionario podría ser regulado por el ligando de c-kit ,es decir,el factor de células madre.El ARNm de este factor es expresado en el corazón fetal,neonatal,en los fibroblastos miocárdicos adultos y en macrófagos.
En teoría,el factor de células madre (SCF) podría proveer las señales para la migración de las células madre en respuesta a un daño miocárdico.
Se piensa que hay un insuficiente suministro de CM locales en el tejido para proveer la regeneración durante un infarto agudo del miocardio.Además,sin el aumento del número de las CM circulantes a través de la movilización por parte de las citoquinas, se favorece la cicatrización más que la regeneración. La intensa respuesta inflamatoria que inicia después de un IAM causa un acúmulo local de células mastoideas que son positivas para el CD117 (c-kit),por lo tanto, las CM podrían migrar localmente en respuesta a la secreción del SCF por parte de los macrófagos.18
El CXCR4 es importante para el tráfico y reclutamiento linfocitario en los sitios de inflamación como en el IAM.Parece que sirve como el receptor de una quimioquina y que junto a su ligando,el factor 1 de las células estromales (SDF-1),juega un rol importante en la vasculogénesis y la hematopoyesis.Se piensa que la disrupción entre la interacción SDF-1/CXCR4 provoca un aumento de los receptores CXCR4 en las CM CD34 y aumenta su migración en respuesta del SDF-1.18
El factor estimulante de colonias granulocíticas (G-CSF)también promueve la movilización de las CM,aunque por un mecanismo desconocido,ya que las células madre no presentan el receptor para el G-CSF.No obstante,se ha observado que pequeñas dosis de G-CSF pueden inducir un regulación hacia abajo de los niveles del SDF-1 en 24 h y por lo tanto,un aumento de la expresión del CXCR4 en las células hematopoyéticas.18
Por último,el factor de crecimiento endotelial vascular (VEGF)y su receptor tipo tirosin cinasa,el Flk-1 ,también se han estudiado ampliamente en la proliferación y diferenciación de las células endoteliales y por ende,en la movilización de precursores hematopoyéticos.18
Ahora bien,¿Cómo pueden las Células Madre diferenciarse en otros linajes de células?
La respuesta en parte no se ha contestado,pero existen pruebas que los progenitores hematopoyéticos multipotentes expresan bajos niveles de genes característicos para diferentes linajes y también diversos genes de receptores de citocinas;por consiguiente,tanto los mecanismos intríncicos como extrínsecos juegan un papel importante en la plasticidad de CM.
Sin embargo,en última instancia el fenotipo de una célula está establecido y mantenido por combinaciones de factores de transcripción que regulan genes de tipos celulares específicos; es así,que se postula que el relativo exceso de un determinado factor de transcripción sobre otros puede guiar al desarrollo de determinado tipo celular a partir de una célula madre,en donde se suprimen y se activan determinados genes.
Dentro de los factores de transcripción más investigados en este proceso se encuentran el Pax-5,GATA-1 y 4,FOG-1, C/EBP,PU.1, E26,Maf-B,MEF-2,entre otros.Sin embargo,los mecanismos celulares y moleculares de dichas moléculas se escapa a esta revisión y los lectores interesados son referidos a excelentes artículos sobre este tema.19
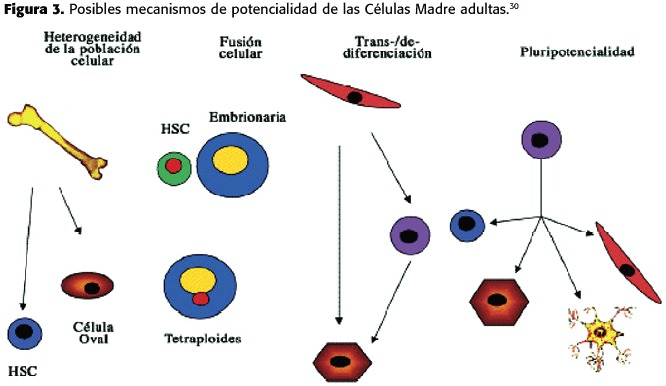
A pesar de los múltiples estudios publicados que sugieren la existencia de células madre adultas pluripotenciales o incluso de la capacidad de ciertas células madre de transdiferenciarse, existen importantes interrogantes e incluso nuevas evidencias científicas que han cuestionado la verdadera naturaleza de estos fenómenos de diferenciación.Quizás la pregunta fundamental radica en cuál es el posible mecanismo(s)que justifica las observaciones que hemos comentado.Cuatro serían las hipótesis que se discuten en la actualidad (Figura 3).
1-La mayor parte de los estudios publicados hasta el momento que sugieren la existencia de células madre adultas pluripotenciales no han sido capaces de demostrar esta potencialidad a nivel clonal,es decir,una única célula dando origen a dos poblaciones celulares diferentes.En este sentido es posible que muchas de las observaciones realizadas,correspondan realmente a la heterogeneidad de las células estudiadas,pudiendo existir diversas células madre en la misma población,cada una con distintas capacidades.En este sentido,sin embargo,si existen trabajos en los que se demuestra a nivel clonal,la potencialidad de las células madre identificadas.4,8
2-Varios trabajos recientes han demostrado que al menos algunas de las observaciones de pluripotencialidad podrían estar justificadas por procesos de fusión entre las células madre transplantadas y las células residentes 7,9. El fenómeno de fusión se suele acompañar con la formación de células con características de ambas poblaciones fusionadas y generalmente con doble dotación cromosómica,lo que induce una desventaja proliferativa.La existencia del fenómeno de fusión es indudable y la pregunta que cabe hacer es si podría justificar todas las observaciones de pluripotencialidad realizadas hasta la fecha, lo cual parece poco probable,e incluso hasta qué punto este fenómeno puede ser ventajoso para la regeneración de un órgano o tejido 16.
Algunos investigadores que están en contra del proceso de fusión celular alegan que si el evento es la fusión,la carga alta del contenido de ADN nuclear podría implicar inestabilidad genética y un potencial de replicación reducido.Por ejemplo,después de la oclusión de una arteria coronaria en roedores,la mayoría de las células en la región miocárdica que era abastecida por dicha arteria mueren en menos de 5 horas,no dejando células socias, es decir,células diferenciadas para el proceso de fusión. Si la fusión celular ocurre,los nuevos miocitos generados podrían tener un volumen celular mayor o igual a de 25000 µm3 ,pero de cualquier modo,el volumen de los nuevos miocitos alcanzan un máximo de 2500 µm3 y un mínimo de 200 µm3.
Aunque la fusión celular podría teóricamente explicar la colonización de los antígenos de superficie de células madre en los nuevos miocitos,esta no podría explicar la mejoría funcional asociada con la inyección o movilización de células madre.El mejoramiento de la función cardíaca requiere un incremento en el número de miocitos,no de la fusión de las células madre con preexistentes miocitos.Por último,más del 90%de los miocitos ventriculares residentes son binucleados y 6%son mononucleados.Inversamente,más del 90%de los nuevos miocitos son mononucleados y menos del 10%son binucleados.
Si la reconstitución miocárdica involucra fusión celular tiene relevancia clínica porque las células híbridas tienen un potencial de multiplicación limitado.Sería imposible formar millones de miocitos en el corazón infartado inyectando menos de 105 células derivadas de la médula ósea o por la movilización de dichas células por el uso de citoquinas o factores de crecimiento adecuados.
No obstante,la polémica que existe entre si el mecanismo que se da es la transdiferenciación o la fusión aún no termina.20
3-De igual forma,durante el proceso de clonación,el núcleo de la célula somática sufre un proceso de reprogramación,es posible que las células madre adultas,en determinadas circunstancias, puede desdiferenciarse para posteriormente diferenciarse hacia células de distinta estirpe.
4-Finalmente,es posible que en los tejidos del adulto persistan células madre indiferenciadas, remanentes de tejido embrionario con capacidad pluripotencial.
Regeneracion Miocárdica
También se han publicado recientemente trabajos que apoyarían la capacidad de las HSC de diferenciarse en células de músculo cardíaco.El grupo de Orlic y Anversa han demostrado,en un modelo de infarto de miocardio murino,que una inyección de células de médula ósea Lin-y c-kit+(fenotipo de marcadores de superficie típico de HSC)en el corazón dañado,resulta de la colonización de estas células en más de la mitad del área infartada.Estas posibles HSC adquirieron un fenotipo característico de células de miocardio y contribuyen a la mejora y supervivencia de los animales 5 al disminuir el remodelado ventricular.1,12 (Figura 4)
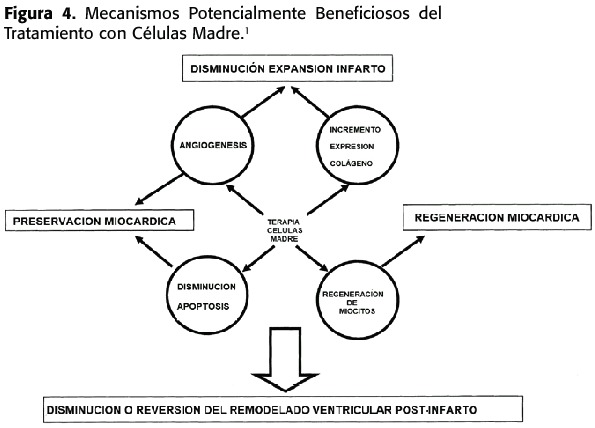
La contribución de las células madre adultas a la regeneración cardíaca ha sido sugerida en modelos de trasplante cardíaco en humanos.En un grupo de pacientes varones trasplantados con corazones de donantes mujer,el análisis de biopsias cardíacas permitió identificar que un porcentaje de entre el 7-10%de los cardiomiocitos provenían del propio receptor ya que en ellos se podía identificar el cromosoma Y 15 .Aunque el origen de dichas células no se pudo determinar,claramente estos hallazgos sugieren la capacidad de células adultas de diferenciarse a tejido cardíaco.21 Es necesario,sin embargo,establecer una nota de precaución en relación con muchos de los trabajos existentes en este campo y es que los resultados experimentales de ciertos trabajos no han podido ser reproducidos por otros grupos de investigación.Estas discrepancias pueden deberse a diferencias en los modelos experimentales,las técnicas de laboratorio o incluso al entusiasmo de los investigadores. A pesar de todos estos esfuerzos,ninguno de los estudios publicados hasta el momento demuestra que una única célula madre hematopoyética contribuya de forma robusta y funcional a la regeneración de un tejido distinto del hematopoyético y por tanto en sentido estricto no cumple los criterios necesarios para hablar de versatilidad. Cada uno de los trabajos mencionados pueden ser criticados en este sentido.Sin embargo,si tomamos los estudios de forma conjunta,sí se aportan evidencias de la existencia de HSC con estas características y potencialidades.
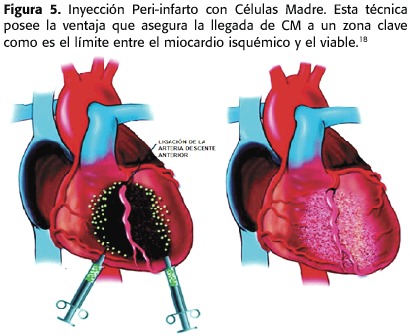
Por ejemplo,Orlic et al.,ocluyeron la arteria coronaria izquierda y 5 horas después inyectaron las células madre.(Figura 5)
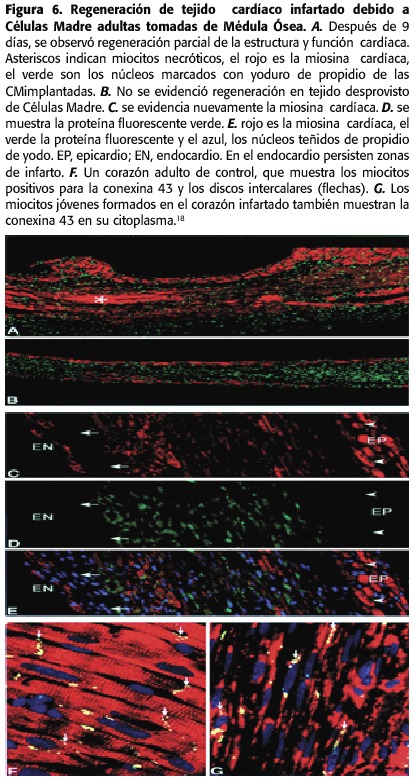
A los nueve días la presión telediastólica disminuyó 36%y disminuyó el remodelado ventricular,aunque también hubo células madre que manifestaron el fenotipo fibrótico.22 También se han realizado estudios con la movilización previa de CM con citoquinas.Por ejemplo,Kocher et al.,estimularon 30 días antes de provocar infartos en ratas mediante la administración de G-CSF y VEGF;luego,tras la oclusión de la arteria coronaria inyectaron las células madre,dos días después se detectó el anidamiento de dichas células en el tejido miocárdico,15 semanas después se encontraron nuevos vasos,disminución de células apoptóticas, el tejido infartado disminuyó de 36 al 12%y el gasto cardíaco mejoró de 26%al 48%con respecto a los controles.18 (Figura 6)
Mientras tanto,Orlic et al.,también trabajaron con la estimulación pre-infarto.Tomaron ratas y le administraron G-CSF 5 días pre-infarto y 3 días post-infarto.A los 21 días,mortalidad disminuyó el 68%,la zona de infarto 40%,la presión telediastólica a 26%. La fracción de eyección mejoró en forma progresiva,es decir,a los 9 días un 48%,a los 16 días un 62%y a los 26 días un 114%.El incremento de nuevos miocitos fue de 5 x 10.6
Con respecto a estudios en humanos,la mayoría no han sido randomizados,lo que supone una desventaja.No obstante,6 pacientes a los cuales se les realizó un bypass coronario,Stamm et al.,inyectaron 1,5 x 106 células autólogas mononucleares AC133+tomadas de la médula ósea del paciente en la zona peri-infarto.A los 9-16 meses después de la cirugía,ninguno de los pacientes había experimentado arritmias ventriculares.Todos los 6 pacientes mostraron notable mejoría en la capacidad de ejercicio y mejoraron en la clasificación de la New York Heart Association ,además de mejorar la fracción de eyección de un 37%a un 48%.Las pruebas de perfusión miocárdica también mostraron mejoría en 5 de 6 pacientes.
Strauer et al.,realizaron un estudio no randomizado,en el cual tomaron 10 pacientes y les administraron células madre y fueron comparados con 10 pacientes control.1
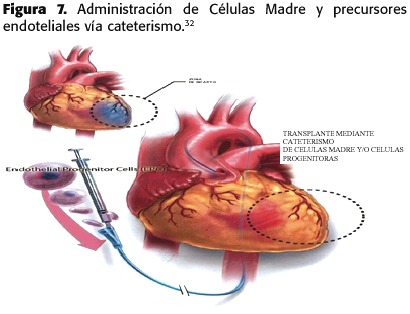
Células madre autólogas extraídas de la médula ósea fueron inyectadas intracoronariamente de 5 a 9 días después de sufrir un IAM.El retraso en parte refleja el tiempo requerido para la aspiración,separación y cultivación de las células madre autólogas de médula ósea.(Figura 7)
Las células fueron administradas mediante infusiones de alta presión de 2 a 3 ml de una suspensión celular directamente en el sitio del infarto.A los 3 meses,los pacientes controles no mostraron diferencias estadísticamente en la función cardíaca o la perfusión.El grupo tratado tuvo una reducción en las dimensiones del infarto,como una mejoría en el movimiento de la pared ventricular del 30 al 12%y una reducción en la región del infarto con métodos de perfusión con talio.Aunque el volumen sistólico incrementó significativamente,la fracción de eyección permaneció sin mayores cambios.No se reportaron efectos adversos.23
Otros estudios arrojan resultados semejantes,pero en algunos casos fueron contradictorios.
Por lo tanto,y como se ha mencionado anteriormente,la administración de células madre puede realizarse por varios métodos,a saber:
1)Inyección intramiocárdica (Figura 5)
2)Inyección transendocárdica.
3)Inyección intracoronaria (Figura 7)
4)Endovenosa.
5)En el seno coronario.
No se sabe aún cual de éstas ofrece mayores ventajas para el paciente.24
Por otro lado,se han analizado algunas de las posibles limitantes a la extensión humana de los estudios en animales.Por ejemplo, las medidas del corazón murino no se comparan con las del humano,y por lo tanto,el número de células madre podría ser muy pobre para la regeneración del tejido miocárdico,ya que las dosis que se han usado van de 10 a 40 x 106 ,las cuales pareciera que no son suficientes.25 El hecho de utilizar factores estimulantes pre-infarto pareciera no aplicable a humanos,ya que no se sabe cuando una persona presentará un evento coronario agudo. No obstante,la aplicación de G-CSF e interleucinas en el momento del infarto se ha visto que también mejoran la función miocárdica,con el inconveniente de que también se elevan otras células como por ejemplo los leucocitos,cuyo aumento en el IAM se ha correlacionado con un peor pronóstico,quizá por un aumento en la respueta inflamatoria miocárdica.1
Las arritmias son efectos secundarios bastante frecuentes en corazones a los cuales se les ha administrado CM,y tal pareciera que los nuevos miocitos muestran mayor actividad espontánea, bajo dv/dt,prolongada duración del potencial de acción y fácilmente la inducción de una actividad proarrítmica por los tres mecanismos conocidos:la reentrada,el aumento de automaticidad o los focos ectópicos.26
A la vez,en un estudio con 14 ratas a las cuales se les administró CM postinfarto,en 4 de ellas (28,5%)se presentó una severa calcificación,lo cual amerita más estudios que comprueben dichos resultados.27
El futuro:pluripotencialidad y células madre no derivadas de la médula ósea.
La existencia de células madre en diferentes tejidos como el sistema nervioso central, hígado, corazón, piel y músculo no admite controversia.La visión tradicional de que órganos como el corazón o el sistema nervioso central no son capaces de regenerarse ya que carecen de células con potencial de proliferar y diferenciarse, ha sido superada.Sin embargo,por limitaciones de espacio,no vamos a entrar en detalle en los distintos tipos de células madre, sino que exclusivamente vamos a hacer una breve referencia a algunos estudios que indican la posibilidad de que células madre obtenidas de alguno de estos órganos tengan un mayor potencial del esperado,es decir que existan células pluripotenciales en estos órganos.Los argumentos tanto contrarios como a favor de la versatilidad de las células madre derivadas de tejidos adultos,que hemos mencionado en el párrafo anterior,son también válidos en este caso.
El grupo de Qu-Petersen y col.ha sido capaz de aislar diferentes poblaciones de células madre musculares murinas basándose en su capacidad de adhesión y proliferación.Estas células pueden mantenerse en cultivo durante más de 60 divisiones celulares sin anormalidades cromosómicas siendo capaces de diferenciarse in vitro e in vivo en endotelio, músculo, y células del linaje neuronal.
Una vez más la crítica que los investigadores hacen es la ausencia de experimentos clonales que prueben que es una única célula y no una población heterogénea la causante del potencial diferenciador.
De forma casi continua aparecen nuevos estudios en los que se aíslan células madre a partir de tejidos adultos con capacidad multipotencial.Uno de los trabajos que más expectativas ha levantado sugiere que es posible aislar en el músculo cardíaco, células madre multipotenciales capaces de diferenciarse in vitro e in vivo a cualquiera de los tejidos necesarios para reconstituir un corazón dañado,esto es endotelio,músculo liso y músculo cardíaco.28,29 (Figura 8)
Incluso más sorprendente es el hecho de que dichas células son fácilmente identificables en el corazón gracias a la expresión de c-kit junto con la ausencia de expresión de marcadores específicos de línea (c-kit+,Lin-).Por lo tanto,quizás ni siquiera se necesita inyectar células madre;sino más bien,estimular las que ya posee el organismo.Si estos resultados pudieran ser reproducidos por otros grupos tanto en animales así como en humanos,las perspectivas terapéuticas serían enormes.29,30,31
Conclusión
A pesar de todas las controversias existentes en este campo,no cabe duda de que la utilización de células madre en el futuro ha despertado unas enormes expectativas.Bien como materia prima para terapia regenerativa de enfermedades hasta ahora incurables como la enfermedad de Parkinson, distrofias musculares,diabetes y enfermedades cardíacas,o bien como vehículo de terapia génica,lo cierto es que sólo se ha empezado a imaginar las posibilidades terapéuticas de las células madre.
Desafortunadamente,el amplio campo de posibilidades abiertas por la terapia de células madre ha arrojado más preguntas que respuestas:¿Cuál es la fuente ideal de células madre?,¿Producirán los distintos tipos celulares beneficios en distintas situaciones?, ¿Cuántas células es necesario transplantar?,¿Cuál será la vía más recomendable?¿Será mejor la terapia celular en la fase aguda de infarto que en etapas crónicas?, ¿Cuál tipo de célula madre es mejor transplantar?,¿Por cuáles mecanismos las células madre se anidan,sobreviven y se diferencian?,¿Cuál es la vida media de los nuevos miocitos? ¿Qué tan seguro es este procedimiento?o ¿Qué papel jugarán los fármacos aunados a células madre?;quedando un gran número de preguntas no formuladas en esta revisión.
Sin embargo,es fundamental recordar que para conseguir que las células madre se trasformen en una realidad terapéutica es imprescindible continuar la investigación básica rigurosa,ya que la inclinación final de la eficacia de esta terapéutica en el manejo del infarto,tanto agudo como crónico,debería sustentarse en sólidos conceptos científicos y en los estudios clínicos randomizados que aseguren que la balanza se encuentra más desplazada hacia los beneficios que a potenciales perjuicios.
Bibliografía
1. Forrester JS,Price MJ,Makkar RR.Stem cell repair of Infarcted Myocardium: an overview for clinicians.Circulation 2003;108:1139-1145. [ Links ]
2.Weissman IL,Anderson DJ,Gage F.Stem and progenitor cells:origins, phenotypes,lineage commitments,and transdifferentiations.Annu Rev Cell Dev Biol 2001;17:387-403. [ Links ]
3.Jiang Y,Vaessen B,Lenvik T,Blackstad M,Reyes M,Verfaillie CM. Multipotent progenitor cells can be isolated from postnatal murine bone marrow,muscle,and brain.Exp Hematol 2002;30:896-904. [ Links ]
4.Grant MB,May WS,Caballero S,Brown GA,Guthrie SM,Mames RN et al. Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization.Nat Med 2002;8:607-612. [ Links ]
5.Korbling M,Estrov Zeev.Adult Stem Cell for Tissue Repair:a new therapeutic concept?.N Engl.J Med 2003;349:570-82. [ Links ]
6.Pittenger MF,Mackay AM,Beck SC,Jaiswal RK,Douglas R,Mosca JD et al. Multilineage potential of adult human mesenchymal stem cells.Science 1999;284:143-147. [ Links ]
7.Asakura A,Seale P,Girgis-Gabardo A,Rudnicki MA.Myogenic specification of side population cells in skeletal muscle.J Cell Biol 2002;159:123-134. [ Links ]
8.Jiang Y,Jahagirdar BN,Reinhardt RL,Schwartz RE,Keene CD,Ortiz- Gonzalez XR et al.Pluripotency of mesenchymal stem cells derived from adult marrow.Nature 2002;418:41-49. [ Links ]
9.Hao QL,Thiemann FT,Smogorzewska EM,Crooks GM.Extended long-term culture reversals a highly quiescent and primitive human hematopoietic progenitor population.Blood 1996;88:3306-3313. [ Links ]
10.Hao QL,Shah AJ,Thiemann FT,et al.A functional comparison of CD34+ CD38 cells in cord blood and bone marrow.Blood 1995;86:3745-3753. [ Links ]
11.Lagasse E,Connors H,Al-Dhalimy M,Reitsma M,Dohse M,Osborne L et al. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med 2000;6:1229-1234. [ Links ]
12.Orlic D,Kajstura J,Chimenti S,Jakoniuk I,Anderson SM,Li B et al.Bone marrow cells regenerate infarcted myocardium.Nature 2001;410:701-705. [ Links ]
13.Krause DS,Theise ND,Collector MI,Henegariu O,Hwang S,Gardner R et al.Multi-organ,multi-lineage engraftment by a single bone marrow-derived stem cell.Cell 2001;105:369-377. [ Links ]
14.Terada N,Hamazaki T,Oka M,Hoki M,Mastalerz DM,Nakano Y et al.Bone marrow cells adopt the phenotype of other cells by spontaneous cell fusion.Nature 2002;416:542-545. [ Links ]
15.Ying QL,Nichols J,Evans EP,Smith AG.Changing potency by spontaneous fusion.Nature 2002;416:545-548. [ Links ]
16.Wang X,Willenbring H,Akkari Y,Torimaru Y,Foster M,Al-Dhalimy M et al. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature 2003;422:897-901 [ Links ]
17.Wagers AJ,Sherwood RI,Christensen JL,Weissman IL.Little evidence for developmental plasticity of adult hematopoietic stem cells.Science 2002; 297:2256-2259. [ Links ]
18.Orlic D,Hill J,Arai AE.Stem Cell for Myocardial Regeneration.Circ.Res. 2002;91:1092-1102. [ Links ]
19.Graf T.Differentiation plasticity of Hematopoietic cells.Blood 2002; 99:3089-3001. [ Links ]
20.Anversa P,Sussman M,Bolli R.Molecular Genetic Advances in Cardiovascular Medicine:Focus on the Myocyte.Circulation 2004;109:2832-2838. [ Links ]
21.Laflamme MA,Myerson D,Saffitz JE,Murry CE.Evidence for cardiomyocyte repopulation by extra cardíac progenitors in transplanted human hearts. Circ Res 2002;90:634-640. [ Links ]
22.Wang JS,Shum-Tim D,Chedrawy E,et al.The coronary delivery ofmarrow stromal cells for myocardial regeneration:pathophysiologic and therapeutic implications.J Thorac Cardiovasc Surg.2001;122:699 –705. [ Links ]
23.Strauer BE,Brehm M,Zeus T,et al.Repair of infarcted myocardium byautologus intracoronary mononuclear bone marrow cell transplantation in humans.Circulation.2002;106:1913 –1918. [ Links ]
24.Perin EC,Geng YJ,Willerson JT.Adult Stem Cell Therapy in Perspective. Circulation 2003;107:935-938. [ Links ]
25.Shake JG,Gruber PJ,Baumgartner WA,et al.Mesenchymal stem cell implantation in a swine myocardial infarct model:engraftment and functional effects.Ann Thorac Surg.2002;73:1919 –1925. [ Links ]
26.Zhang YM,Hartzell C,Narlow M,Dudley S.Stem Cell-Derived Cardiomyocytes Demonstrate Arrhythmic Potential.Circulation 2002;106:1294-1299. [ Links ]
27.Yoon YS,Seon J et al.Unexpected Severe Calcification After Transplantation of Bone Marrow Cells in Acute Myocardial Infarction.Circulation 2004;109:3154-3157. [ Links ]
28.Chien KR.Lost in translation.Nature 2004;428:607-608 [ Links ]
29.Mummery,C.Solace for the broken hearted?.Nature 2004;433:585-587. [ Links ]
30.Mathur A,Martin JF.Stem cells and repair of the heart.Lancet 2004;364:183- 192. [ Links ]
31. Lovel-Badge R.The future for stem cell researche.Nature 2001;414:88-91. [ Links ]
32.Szmitko PE,Fedak PW,Weisel RD,Stewart DJ,et al.Endothelial Progenitor Cells:New Hope for the Broken Heart.Circulation 2003;107:3093-3100 [ Links ]
*Prof.Fisiología,Departamento de Fisiología,Universidad de Ciencias Médicas,San José,Costa Rica.
(e-mail:fzszeledon@hotmail.com).
Prof.Fisiología,Jefe del Departamento de Fisiología,Universidad de Ciencias Médicas,San José,C.R.
Prof.Cirugía,Hospital México,Universidad de Ciencias Médicas,San José,Costa Rica.
§Prof.Fisiología,Departamento de Fisiología,Universidad de Ciencias Médicas,San José,Costa Rica
**Residente de Cirugía General,Hospital México,San José,Costa Rica.
Inmunohematóloga,Banco de Sangre,Hospital San Juan de Dios,San José,Costa Rica.