Introducción
El cáncer es una patología cuya principal característica es la proliferación celular descontrolada, porque las células sufren mitosis indefinidamente. Es ocasionado por cualquier fenómeno capaz de lesionar el ADN, como un agente mutagénico (radiaciones o sustancias químicas) o factores que estimulen la mitosis, entre ellos, algunas hormonas, lesiones crónicas en los tejidos, agentes inflamatorios, virus y oncogenes (1).
El adenocarcinoma ductal pancreático es la neoplasia pancreática maligna más frecuente. Se le conoce comúnmente como cáncer de páncreas (2). Representa la cuarta causa de mortalidad atribuible a ella en países desarrollados (aunque se prevé que podría ser la segunda en algunos años) y la segunda de cáncer digestivo (2, 3).
El riesgo de desarrollarlo se ha relacionado con tabaquismo, obesidad, sedentarismo, diabetes, dieta rica en carne y grasas saturadas, así como pobre en frutas y verduras, consumo excesivo de alcohol, café, ácido acetilsalicílico e infecciones por Helicobacter pilori y hepatitis B. Además, la pancreatitis crónica y los quistes pancreáticos propician el riesgo de padecerla. En cuanto al factor genético, entre un 5 y un 10 % de los casos tienen antecedentes familiares y se ha relacionado con mutaciones de BRCA-1, BRCA-2, PALB2, ATM y CDKN2A (4). El factor demográfico más relevante es la edad avanzada. Cerca del 80 % de los casos se da entre los 60 y los 80 años, y se relaciona primordialmente con el sexo masculino, personas de tez negra y ascendencia judía (2).
Su pronóstico es poco alentador, porque sus tasas de incidencia y de mortalidad son muy similares (1). Por lo general, el diagnóstico se da en etapas avanzadas, ya que sus síntomas son sumamente inespecíficos y ciertos casos son asintomáticos. Adicionalmente, existen dificultades para obtener imágenes de tumores en etapas tempranas, así como falta de marcadores tumorales sensibles y específicos para el diagnóstico (3).
Con respecto al tratamiento, la cirugía solo es posible en un 15 a un 20 % de los casos y la supervivencia a cinco años de los pacientes operados no supera el 25 %. Más de la mitad de estas personas presenta recidivas. Este pronóstico se debe a la afectación ganglionar, los márgenes quirúrgicos y el tamaño del tumor, entre otros (4). En algunos casos, también se recomienda quimioterapia con gemcitabina o FOLFIRINOX, una combinación de cuatro fármacos: ácido folínico o leucovorina (FOL), 5-fluorouracilo, irinotecan (IRIN) y oxaliplatino (OX). Es primordial resaltar que desde el diagnóstico, cualquier paciente debe recibir un adecuado tratamiento paliativo, simultáneo al abordaje oportuno, según su situación y el estadío de la enfermedad (4, 5).
Debido a los efectos adversos de estos tratamientos y su poca efectividad, se están buscando nuevas opciones para tratarlo. Una de ellas es la inmunoterapia, pues los tumores escapan de la vigilancia inmunológica por diversos mecanismos como la secreción de sustancias inmunosupresoras, entre ellas el factor de necrosis tumoral-beta (TGF-β, por sus siglas en inglés), así como la ausencia de células T efectoras y la baja inmunogenicidad por expresión de ligandos de muerte celular programada: PD-L1 y PD-L2 (por sus siglas en inglés). Dada la gran promesa de las terapias inmunes en otras neoplasias malignas, hay razones para esperar que la modulación del microambiente tumoral pueda aumentar su control en el cáncer de páncreas (3, 6).
Los anticuerpos monoclonales se han convertido en parte indispensable de la oncología clínica, reemplazado la quimioterapia en el tratamiento de melanoma metastásico y convirtiéndose en primera línea para hacerle frente a otros tumores malignos. Estas son inmunoglobulinas (Ig) que se secretan de una población de células idénticas. Todas las moléculas aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) comprenden la clase IgG, aunque numerosos artículos de investigación han propuesto fármacos de IgM, IgG, IgA e IgE dirigidos específicamente contra antígenos asociados a tumores (6, 7).
Por tanto, el objetivo de este artículo es realizar una revisión sobre la inmunoterapia activa con anticuerpos monoclonales como opción terapéutica para el tratamiento del cáncer pancreático.
Generalidades del cáncer de pancreas
El páncreas es una parte esencial de la glándula gastrointestinal. Está conformado por células acinares (secretan una enzima digestiva), células ductales (secretan bicarbonato), islotes endocrinos y células estrelladas inactivas. Es un órgano endodérmico capaz de regular la digestión de proteínas y de carbohidratos, junto con el control de la glucosa y la homeostasis (8).
Desde el punto de vista anatómico, se diferencia en endocrino y exocrino, formando el 20 y el 80 % del órgano, respectivamente. La parte exocrina está constituida por las células acinares y las conductoras, mientras que el endocrino comprende los islotes de Langerhans. Estos últimos actúan como una maquinaria de secreción hormonal que proporciona insulina, glucagón y somatostatina al torrente sanguíneo (8).
Dentro de las patologías que afectan el páncreas está el cáncer. Se pueden definir tres subtipos: clásico, cuasimesenquimal y exocrino. El subtipo clásico tiene una alta expresión de genes asociados a la adhesión y a las células epiteliales, el quiasimesenquimal muestra una elevada presencia de genes asociados a la mesénquima (tejido primitivo mesodérmico del que derivan gran parte de los tejidos orgánicos) y el de tipo exocrino una expresión relativamente alta de genes de enzimas digestivas derivadas de células tumorales. El cáncer pancreático puede surgir de una variedad de precursores de células, activando el oncogén K-RAS, que al mutar puede provocar esta patología. Dependiendo del subtipo, así va a ser su prevalencia. Por ejemplo, existe mayor presencia de K-RAS en el clásico que en el cuasimensenquimal (9).
El cáncer tiene la tendencia a propagarse e invadir tejidos cercanos (metástasis). La mayoría de los casos son adenocarcinomas que surgen en las células epiteliales. Los mismos son específicos de los tejidos glandulares (8).
Es importante indicar su clasificación de acuerdo con la etapa en que se encuentre. Según el Comité Conjunto Estadounidense sobre el Cáncer (AJCC, por sus siglas en inglés), se clasifica en cuatro estadíos. Las mismas se aprecian en el cuadro 1.
Participación del sistema inmune en el desarrollo de cáncer pancreático
A nivel del sistema inmune, se caracteriza por la presencia de un entorno inmunosupresor. Se ha mostrado que las células inmunosupresoras, sobre todo infocitos T reguladores (Treg), macrófagos asociados a tumores M2 y supresores derivados de mieloides (MDSC, por sus siglas en inglés), están ampliamente presentes en las primeras etapas de la enfermedad (11).
La respuesta inmune tiene la capacidad de retrasar el crecimiento tumoral. Sin embargo, estos mecanismos de defensa pueden no ser efectivos por la evasión de la vigilancia inmune. Los linfocitos T cooperadores (CD4+, de cúmulo de diferenciación 4) producen interferón-gamma (IFN-γ) al reconocer antígenos tumorales. Provoca que el endotelio aumente la expresión de moléculas de los complejos mayores de histocompatibilidad clases I y II (MHC-I y II, por sus siglas en inglés). Los antígenos tumorales expresados por células cancerígenas son presentados en las moléculas de clase I a los linfocitos T citotóxicos (CD8+). Estas células secretan citoquinas hacia las células tumorales y provocan su muerte celular programada. Los linfocitos CD8+ y los CD4+ o cooperadores también liberan factor de necrosis tumoral-alfa (TNF-α, por sus siglas en inglés), promoviendo la inflamación del tejido tumoral y la atracción de más leucocitos (12).
A pesar de ello, las células cancerígenas son capaces de suprimir estas acciones a través de distintos mecanismos. Por ejemplo, se presentan anomalías en las células presentadoras de antígenos (APC, por sus siglas en inglés), afectando la maduración y la capacidad funcional de las células dendríticas. Igualmente, existe la posibilidad de limitar la generación de linfocitos T específicos efectores e inducir su anergia o apoptosis. Asimismo, en diversos tumores se ve la supresión de la producción de interleucina-2 (IL-2) e IFN-γ (12).
La acción de los linfocitos Treg puede provocar una inadecuada expansión de células T efectoras frente a los antígenos tumorales, las cuales controlan el número de CD4+. Como complemento, las células tumorales pueden producir quimioquinas que atraen células Treg al entorno del tumor y suprimir el reconocimiento de antígenos tumorales, como sucede con los linfocitos NK (del inglés Natural Killer) (12).
Desarrollo del cáncer de pancreas
Los protooncogenes, genes supresores y genes de reparación juegan un papel importante. Se detalla cada uno para entender la participación en su desarrollo.
Protoncogenes
Son responsables de estimular y controlar la proliferación celular. Su mutación conlleva a un crecimiento sin control y por ende, al desarrollo de cáncer. Si una de las copias del gen se encuentra mutada por un cambio puntual o por su amplificación, se produce su activación (13). Algunos de los identificados en cáncer pancreático son:
Familia de genes Erb: dentro de ella se encuentra el HER-2/neu, una familia de receptores de crecimiento epidérmico conocido como ErbB2 y el factor de crecimiento epidérmico (EGF, por sus siglas en inglés). Estos factores activan y promueven la diferenciación celular. Su amplificación genera una proliferación descontrolada de las células. Se encuentran presentes entre el 16 y el 65 % de los pacientes (13).
Notch 1 y Hedgehog: tienen como función regular el crecimiento y el desarrollo durante la vida embrionaria de muchos órganos, entre ellos, el páncreas. Inducen la actividad de NF-κB y la neovascularización del tumor. Si se desregula alguna de estas vías, puede ocasionar cáncer en células madre y provocar el crecimiento de tumores (13).
K-RAS: es un protooncogen localizado en el cromosoma 12p12.1. Pertenece a la familia RAS, la cual cuenta con los protooncogenes H-RAS, K-RAS y N-RAS. Controlan cascadas de señalización preponderantes para la regulación de la proliferación celular, la diferenciación, la modulación del citoesqueleto y la supervivencia de las células (14). En cáncer pancreático, las mutaciones en K-RAS se hallan entre el 70 y el 90 % de los casos. Desde el punto de vista clínico, esta mutación ha sido relacionada con disminución en la sobrevida (13, 15). Asimismo, la activación de mutaciones oncogénicas de K-RAS a menudo se asocian con resistencia a la quimioterapia y terapias dirigidas (9, 15.)
Cuando ocurre una mutación en un protooncogen, no permite que éste sea regulado por un supresor de tumor, entonces pasa a denominarse oncogen. Por esta razón, la localización de sus mutaciones es muy específica y se repite en cada protooncogen en los distintos tipos de cáncer (16).
Genes supresores de tumores
Se encargan de impedir el comienzo del desarrollo cancerígeno, actuando sobre diversos puntos del ciclo celular. Su inactivación propicia el crecimiento tumoral. Son genes recesivos, por lo cual ambas copias deben estar mutadas para que se dé la pérdida de su función (13).
Cabe señalar que la regulación del ciclo celular incide sobre los protooncogenes. Las mutaciones que suceden en los genes que codifican para los supresores tumorales anulan la función de las proteínas asociadas a ellos (16).
Un ejemplo en el cáncer de páncreas es el gen p53, cuya proteína regula la expresión de otros genes como p21 y p16. Asimismo, los productos de los oncogenes p21, p16, p27 actúan como inhibidores de quinasas (CKIs, por sus siglas en inglés), bloqueando la hiperfosforilación del oncogen Rb por inactivación de CDK4-ciclina D y de CDK2-ciclina E (13).
Otros involucrados en cáncer pancreático son SMAD4, CDKN2A y P16/INK4. Su mutación se ha asociado con su progresión (13, 14).
Genes de reparación de AND
Regulan las enzimas encargadas de la monitorización del ADN formado y reparan los errores generados durante la replicación. Las mutaciones que afectan ambos alelos acumulan errores en el material genético. Cuando se relacionan con los genes reguladores del crecimiento celular, se estimula el cáncer (13, 16).
También existen ciertos factores (además de la susceptibilidad genética) implicados en el desarrollo del cáncer de páncreas. Algunos de ellos son: edad, obesidad, estilo de vida y consumo de alcohol (alto consumo de alcohol puede provocar pancreatitis severa, incrementándose la posibilidad de desarrollarlo) o tabaco (fumadores tienen un mayor riesgo en comparación a los no fumadores). La mayoría de los pacientes son diagnosticados después de la quinta década de edad o más. Del mismo modo, una asociación de obesidad y malos hábitos físicos, junto con factores dietéticos como alto consumo de grasas saturadas, carnes rojas procesadas, y bajo consumo de frutas y verduras propician el riesgo de padecerlo (9).
Epidemiología
El cáncer es la segunda causa de muerte más frecuente en el mundo y el de páncreas se posiciona como el sexto más mortal (17). Se estimó que en el año 2020 habrían más de 57 000 nuevos casos solo en Estados Unidos y alrededor de 47 000 muertes, en el mismo año, por su causa (18).
En Latinoamérica, Chile presenta una incidencia de 5,5 y 4,9 casos por cada 100 000 personas para hombres y mujeres, respectivamente, con una tasa de mortalidad por cada 100 000 individuos de 5,8 y 5,2 en el mismo orden (19). En Brasil, se presentan 4,2 casos por cada 100 000 habitantes, equivalente al 2 % de todos los tipos de cáncer (20). En lo que respecta a Argentina, la incidencia se encuentra alrededor de 7,45 por cada 100 000 hombres y de 5,26 por cada 100 000 mujeres (21).
Para Costa Rica, las últimas estadísticas publicadas por el Ministerio de Salud durante el 2014 exhiben que la incidencia en varones fue de 1,87 y en mujeres de 3,34 por cada 100 000 personas, apareciendo con mayor frecuencia en mayores de 65 años (22). En cuanto a la mortalidad, en el 2015 se ubicó en el sétimo puesto para ambos sexos en el país. 107 hombres y 126 mujeres fallecieron ese año por su causa (23).
Diagnóstico
Actualmente, el cáncer de páncreas posee reducida sobrevivencia. Un factor asociado a esta condición es que la mayoría de los casos logran identificarse en fases muy avanzadas. El inicio es asintomático y hay falencias para un proceso de diagnóstico eficiente (24, 25).
Por ello, varios organismos han emitido la relevancia de clasificar a los pacientes con factores de riesgo y hacerles pruebas diagnósticas de forma frecuente. Entre los aspectos de mayor atención se pueden mencionar: predisposición genética, en especial la presencia de la enfermedad en un familiar de primer o segundo grado, los síndromes hereditarios y los polimorfismos genéticos asociados a este cáncer. Otros elementos son tabaquismo, exposición a disolventes con base de hidrocarburos o compuestos de cromo, y padecimiento de diabetes mellitus y/o pancreatitis crónica (25, 26).
También, se debe tener un claro concepto de los síntomas y signos más frecuentes de los pacientes que lo padecen. Ellos son: ictericia, dolor abdominal y pérdida de peso (comúnmente llamados la triada del cáncer pancreático). Igualmente, puede presentarse astenia (debilidad o fatiga generalizada), anorexia, dolor abdominal, coluria (presencia de bilis en orina), náuseas, dolor de espalda, diarrea, esteatorrea (presencia de secreciones lipídicas en heces) y tromboflebitis (3, 26). En estadíos más avanzados, puede haber una masa epigástrica palpable, hepatomegalia por metástasis a hígado, dolor intenso por infiltración vascular y nerviosa, obstrucción a la salida gástrica por infiltración duodenal y ascitis por carcinomatosis peritoneal (26).
El diagnóstico se realiza mediante los marcadores tumorales o biomarcadores. Son elementos de naturaleza variable (ácido nucleico, proteína, péptido, o procesos como apoptosis, angiogénesis o proliferación) producidos por diferentes células. Sin embargo, se obtienen en mayor cantidad cuando hay cáncer. Las mismas son detectables en fluidos biológicos como sangre, orina y líquido pleural. Su cantidad en sangre depende de la variabilidad genética del paciente, dado que no se secretan únicamente en condiciones cancerígenas. Como complemento, el origen de algunos biomarcadores es por la respuesta generada por el huésped (26, 27, 28).
Los marcadores tumorales pueden agruparse según dos criterios: origen y utilidad clínica, expresada en términos de sensibilidad y especificidad. Con base en su origen, se han clasificado en producidos por las mismas células tumorales (derivados del tumor) e inducidos por su presencia, producto de la reacción del huésped ante el cáncer (27).
Los marcadores más útiles en cáncer pancreático son el antígeno carbohidrato 19-9 (CA 19-9) y el antígeno carcinoembrionario (CEA, por sus siglas en inglés). Este último se emplea con menor frecuencia en comparación con el primero. No obstante, ninguno es altamente preciso como para indicar con certeza si una persona lo ha desarrollado (26, 27).
Antígeno sializado de Lewis (CA 19-9)
Es un glicolípido monosialogangliósido sintetizado en varios epitelios. Se eleva típicamente en el suero de pacientes con tumores pancreáticos. Cifras inferiores a 40 U/mL se consideran normales para ambos sexos, y no existen diferencias entre fumadores y no fumadores. Valores por encima de 300 U/mL tienen un valor predictivo positivo superior al 90 % (27, 29).
Una razón de utilizarlo en este diagnóstico es que sus niveles séricos aportan información sobre si el tumor detectado es benigno o maligno (30). También han mostrado el poseer alta especificidad y sensibilidad. Inclusive, algunos estudios señalan que puede ser un indicador de la posibilidad de extraerlo por medio de la cirugía (resecabilidad). Sin embargo, un inconveniente es que valores menores de 121 U/mL generan que su especificidad caiga inclusive al 70 %. Ante este panorama, se debe verificar dicha resecabilidad con una tomografía axial computarizada (TAC) de la zona para aumentar la predicción certera (29).
Otro inconveniente es que otros tumores como los biliares, gástricos, de colon, hígado, ovario, endometrio, pulmón y urotelio pueden cursar con un CA 19.9 sérico elevado. Lo mismo sucede con procesos benignos, entre ellos hepatitis, cirrosis, colangitis, colecistitis, pseudoquiste pancreático, pancreatitis, fibrosis pulmonar, asma bronquial, asbestosis, bronquiectasias, tuberculosis, insuficiencia renal, quistes mucinosos, hidronefrosis, síndrome de Sjögren, artritis reumatoide, lupus eritematoso, dermato/polimiositis y arteritis de células gigantes. En estas situaciones, los valores obtenidos son más moderados (27). Otra limitación es que la presencia de niveles elevados de bilirrubina disminuye sus niveles, haciéndolo indetectable (29).
Antígeno carcinoembrionario (CEA)
Es una glucoproteína oncofetal asociada a tumores del tracto gastrointestinal, frecuentemente elevada en el cáncer colorrectal. Puede hallarse en otras enfermedades malignas y benignas o incluso en pacientes sin enfermedad aparente. Su aclaramiento sucede por vía hepática, por lo cual suele estar aumentado en casos de metástasis en hígado. Se consideran valores normales por debajo de 2,5 ng/mL en no fumadores e inferiores a 5 ng/mL en fumadores. Su grado de elevación parece correlacionarse con el estadío del tumor. Valores superiores a 20 ng/dL son indicativos de una etapa avanzada (27).
Este biomarcador cuenta con mayor expresión en adenocarcinomas de colon y recto, especialmente en los bien diferenciados, pero pueden observarse incrementos en cáncer de mama, pulmón, páncreas, estómago, vejiga y tiroides. Otras condiciones benignas asociadas con un nivel elevado son: tabaquismo, cistoadenoma mucinoso de ovario, colecistitis, cirrosis, diverticulitis, enfermedad inflamatoria intestinal, pancreatitis, neumonía y tabaquismo (27).
Otras técnicas diagnósticas empleadas, que no requieren biomarcadores, son la ecografía abdominal (poca eficacia en este tipo de cáncer), la tomografía computarizada (complemento del diagnóstico con marcadores tumorales), la tomografía por emisión de positrones (alta sensibilidad en casos metastásicos), la ecoendoscopia (útil incluso en la detección de tumores pequeños, además de poseer gran especificidad y sensibilidad) y la resonancia magnética abdominal (conocimiento del grado de infiltración del tumor) (4).
Tratamiento tradiciona
Para el tratamiento de un paciente con cáncer de páncreas, primero se deben evaluar aspectos básicos tales como estadío, ubicación, extensión, tipo de cáncer, infiltración vascular y potencial de resecabilidad. Idealmente, su manejo se debe hacer por parte de un equipo de trabajo multidisciplinario (31).
Uno de los tratamientos es la cirugía. Cuando el tumor es resecable, representa la mejor opción terapéutica a largo plazo. A pesar de ello, cuenta con complejidad técnica, posibles complicaciones derivadas y una mala supervivencia del paciente (31, 32). Se considera resecable el tumor que no muestre compromiso local avanzado (a nivel de tronco celíaco, arteria hepática o arteria mesentérica superior), no posea obstrucción de una vena, no exhiba invasión de órganos distintos contiguos (excepto el duodeno) y no sea metastásico (33, 34).
En tumores pancreáticos potencialmente resecables, menos del 20 % son aptos para cirugía, ya que deben estar confinados al órgano, sin infiltración vascular (4). Para los que se encuentran en la cabeza del páncreas se recomienda una duodenopancreatectomía cefálica. Este procedimiento implica la resección de la cabeza del páncreas, en ocasiones acompañada de la región antropilórica y la porción distal de la vía biliar principal (35). Por su parte, los que se presentan en cuerpo y cola requieren una pancreatectomía distal o corporocaudal, necesitándose una extirpación del tumor en el área donde se encuentra. Esta estrategia frecuentemente lleva a una esplenectomía (4). En casos donde es avanzado e irresecable, se aconseja realizar una biopsia previa para descartar factores que conlleven un cuidado especial durante el tratamiento (4, 31).
En cuanto a los regímenes terapéuticos, dependen del tipo de terapia que requiere el paciente. Los considerados de primera línea según la Red Nacional Integral del Cáncer (NCCN, por sus siglas en inglés) se describen en el cuadro 2.
Cuadro 2 Esquemas quimioterapéuticos de primera línea para el cáncer pancréatico de acuerdo al tipo de terapia (36).
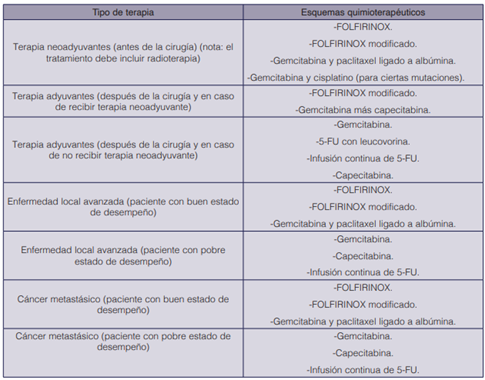
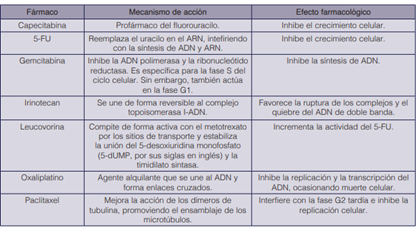
Se denomina FOLFIRINOX a la combinación de cuatro fármacos (ácido folínico o leucovorina, 5-FU, irinotecan y oxaliplatino). Su modificación corresponde a un cambio de dosificación de sus componentes (5). Los mecanismos de acción y las acciones farmacológicas de los medicamentos mencionados en los regímenes se detallan en el cuadro 3.
Cuadro 3 Mecanismo de acción y efecto farmacológico de los medicamentos usados en los regímenes de primera línea de la guía de la NCCN (37).
En términos generales, es un cáncer muy agresivo. Se caracteriza por una notable tolerancia o resistencia a la mayoría de tratamientos comunes como quimioterapia y radioterapia. Además, cuenta con muchas alteraciones epigenéticas, complejos y densos microambientes tumorales, y crecimiento perineural y vascular, así como metástasis temprana (impidiendo la resección quirúrgica en la mayoría de personas). Todos estos factores propician una tasa de supervivencia general a cinco años menor al 7 % y casi todos los sobrevivientes en este momento son el 10 a 20 % de pacientes sometidos a resección quirúrgica. Para ellos, la tasa de supervivencia a cinco años es de alrededor de 15 a 25 % (3).
Su diagnóstico tardío, la escasa disponibilidad de tratamiento realmente eficaz, los porcentajes bajos de tumores resecables, la complicación quirúrgica y su alta mortalidad han ocasionado la búsqueda de terapias más efectivas como son las biológicas, convirtiéndose en un recurso preponderante a nivel médico en los últimos años. Algunos de estos fármacos son capaces de estimular o restaurar las funciones del sistema inmune, contrarrestando patologías como el cáncer. Se pueden clasificar según su origen en: anticuerpos monoclonales, citoquinas (interleucinas, interferones, entre otros), vacunas y terapias génicas. Presentan menos efectos secundarios y son mejor toleradas, siendo específicos y dirigidos contra dianas determinadas (38, 39).
Para la presente investigación fueron de interés los anticuerpos monoclonales. Los mismos se explican a continuación.
Generalidades de los anticuerpos monoclonals
Las terapias con estas moléculas han aportado avances en la medicina durante los últimos años con aplicaciones tanto diagnósticas como terapéuticas (40). Actualmente, se encuentran aprobados por la FDA y la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) más de 90 fármacos para el tratamiento de cáncer, autoinmunidad, enfermedades infecciosas e inflamatorias (41).
Los anticuerpos son glicoproteínas que forman parte del sistema inmune. Se producen por las células B y son susceptibles a reconocer antígenos, estimulando o inhibiendo células específicas (42, 43). Están constituidos por cuatro cadenas de aminoácidos unidas entre sí, dos pesadas y dos ligeras. Poseen una fracción constante denominada cristalizable (Fc) y una variable llamada de unión al antígeno (Fab, por sus siglas en ingles). La región variable incluye tres secuencias yuxtapuestas de 10 aminoácidos llamadas regiones determinantes de complementariedad (CDR, por sus siglas en inglés) 1, 2 y 3. Forman bucles en la superficie y sirven como sitio de unión con el antígeno (40, 44).
Referente a su caracterización y su descubrimiento, se debe señalar el aporte de Behring y Kitasato, quienes establecieron las bases de la inmunidad humoral a finales del siglo XIX. Por su parte, Erlich a finales del siglo XX señaló que las células sanguíneas eran capaces de producir sustancias que reaccionaban ante las toxinas. A continuación, Landsteiner identificó estas funciones y las centró en una molécula que fue llamada anticuerpo. Además, se varió el nombre de toxina por antígeno. Seguidamente, en los años 1940s se identificó el origen de los anticuerpos provenientes de las células B y unos años más tarde se establecieron las IgA, IgD e IgE. No obstante, fue hasta el año 1975 cuando Milstein y Kohler descubrieron los anticuerpos monoclonales murinos en Cambridge. Ellos desarrollaron la técnica del hibridoma (44, 45).
Cuando se habla de anticuerpos monoclonales, pueden establecerse cuatro categorías: murinos, quiméricos, humanizados y humanos. Los murinos se obtienen a partir de ratones (aunque también de otros animales como conejos o ratas) por la técnica del hibridoma. Tienen baja eficiencia en la destrucción de células diana. De igual forma, desarrollan problemas de tolerancia y pueden producir efectos secundarios como hipersensiblidad (46, 47).
Por ello, se construyeron los anticuerpos quiméricos. Constan de una combinación que involucra la parte variable de unión al antígeno del anticuerpo murino con las partes efectoras de la región constante del ser humano, siendo un 30 y un 70 %, respectivamente. El propósito era disminuir el efecto inmunogénico ocasionado por el componente murino (47).
Luego, se elaboraron los humanizados. En este caso, se obtiene con un 95 % de naturaleza humana y un 5 % murina, mediante la presencia de la región CDR del ratón. A pesar de eso, las secuencias no humanas siguieron provocando reacciones cruzadas o sensibilización. De esta manera, se desarollaron los anticuerpos humanos (47). Otra clasificación como agentes terapéuticos implica si son conjugados o no conjugados, dependiendo de su unión covalente con otras moléculas con actividades farmacológicas. Una forma conjugada son las inmunotoxinas. Al darse la unión, se disminuye la toxicidad asociada a ellas (47), producto de la especificidad que brinda el anticuerpo, reconociendo la diana terapéutica y eliminando exclusivamente la célula de interés (48).
Otra alternativa de conjugación es la terapia con profármacos de enzimas dirigida por anticuerpos (ADEPT, por sus siglas en inglés). Así, pueden activarse determinadas toxinas, fármacos y radioisótopos capaces de reconocer las células tumorales (47, 49).
Como complemento, mediante técnicas de ingeniería genética se ha logrado disponer de anticuerpos artificiales, adquiriendo la capacidad de unirse a dos epítopos en el mismo o en distintos antígenos. El reconocimiento de ambos objetivos funciona como mediador para el redireccionamiento de las células del sistema inmune, como las NK y las T. Adicionalmente, pueden modificar las señalizaciones moleculares, inactivando la proliferación celular o las vías inflamatorias (50).
Existen dos categorías de anticuerpos monoclonales biespecíficos a nivel estructural. Un grupo se acerca a una IgG con una región Fc, incorporando la función de citotoxicidad celular dependiente de anticuerpos (ADCC, por sus siglas en inglés) y la citotoxicdad dependiente de complemento (CDC). El segundo grupo consiste en estructuras más pequeñas. Cuentan con dominios de unión a antígeno minimizados, en los cuales se eliminó la porción Fc. Debido a ello, sus vidas medias son más cortas y tienen mayor toxicidad (50).
Inmunoterapia
La inmunoterapia empezó cuando William Coley, en 1891, trató de estimular el sistema inmune inyectando Streptococcus pyogenes y Serratia marcescens inactivados para mejorar la condición de un paciente con cáncer (52). En la actualidad, es uno de los pilares para tratarlo, modulando la actividad de este sistema e induciendo un retroceso tumoral duradero (52).
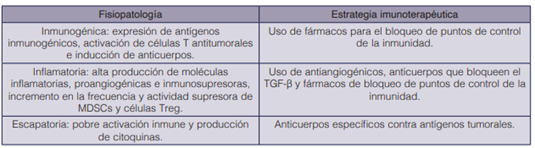
El cáncer puede presentar tres tipos de fisiopatología dependiendo de la respuesta inmune (51). Estas posibilidades junto con las estrategias con las cuales dispone la inmunoterapia para combatirlas se describen en el cuadro 4.
A continuación se mencionan algunos anticuerpos monoclonales en investigación para el tratamiento del cáncer de páncreas, relacionados con la inmunidad activa. Su intención es el estímulo del sistema inmune para atacar las células tumorales (53).
Antígeno 4 del linfocito T citotóxico (CTLA-4)
El antígeno 4 del linfocito T citotóxico (CTLA-4, por sus siglas en inglés) y la proteína 1 de muerte celular programada (PD-1, por sus siglas en inglés) son moléculas inhibidoras de la superficie de las células T. Atenúan una variedad de las funciones de los linfocitos T activos, incluidas la proliferación celular, la secreción de citocinas y la citólisis. En enfermedades oncológicas, se ha demostrado que las células tumorales y las infiltrantes de tumores expresan ligandos para estos receptores que permiten la evasión de la inmunovigilancia (54, 55).
CTLA-4 inhibe las respuestas de las células T por medio de mecanismos intrínsecos y extrínsecos. En cuanto al intrínseco, su participación a través de los ligandos B7 conduce a una regulación negativa de la activación de estos linfocitos. Como complemento, de forma extrínseca se encuentra la capacidad de las células que lo expresan de competir con CD28 por los ligandos B7 o la eliminación transendocítica de ligandos coestimuladores de APC. Además, es fundamental para la labor de las células Treg, esenciales para suprimir la autoinmunidad y para mantener la auto tolerancia. En contraposición, su bloqueo ha inducido la actividad antitumoral en modelos animales de cáncer (54, 56).
Ipilimumab es un anticuerpo monoclonal humano IgG1 dirigido contra CTLA-4, el cual media remisiones duraderas en pacientes con melanoma avanzado. Estudios clínicos recientes han identificado una reducción en las células Treg infiltrantes de tumores después del tratamiento con este fármaco y los estudios in vitro señalan que agota las células Treg que lo expresan (57). Actualmente, se han realizado estudios clínicos de fases II y III, en los cuales se ha estudiado solo o en combinación con diversas terapias (55, 56).
Otro anticuerpo contra este receptor es tremelimumab. Ha mostrado actividad en estudios de fase temprana. Para su desarrollo, se seleccionó un isotipo IgG2 humano para minimizar la actividad potencial de ADCC. El bloqueo de la regulación negativa asociada a CTLA-4 para la activación de células T incrementó la respuesta inmune y la actividad antitumoral (57, 58).
Proteína 1 de muerte celular programada (PD-1) y su ligando (PD-L1)
PD-1 se expresa mayoritariamente en células T activadas. Transmite señales inhibitorias a ellas después de unirse con sus ligandos PD-L1 y PD-L2 en células neoplásicas y en el microambiente tumoral. PD-L1 puede unirse a CD80/B7-1, promoviendo tolerancia inmunológica (54, 59).
La expresión persistente de PD-1 está altamente asociada con tumores. Debido a ello, los anticuerpos anti PD-1 y anti PD-L1 han mostrado actividad antitumoral en algunos modelos. Por ello, su bloqueo terapéutico puede mejorar la eficacia de los efectos de los linfocitos T y revertir su inhibición (54, 60).
Entre los fármacos se tiene el nivolumab. Es un anticuerpo monoclonal humano IgG4 que se une con gran afinidad al receptor PD-1 (55). Está aprobado por la FDA para el tratamiento de melanoma, cáncer de pulmón de células no pequeñas, carcinoma de células renales, linfoma de Hodgkin, cáncer de cabeza y cuello, carcinoma urotelial y carcinoma hepatocelular (60).
Por su parte, el pembrolizumab es un anticuerpo monoclonal humanizado IgG4κ anti-PD1. Su unión no compromete a los receptores Fc, ni activa el complemento, careciendo de actividad citotóxica (61).
Por su parte, el durvalumab es un anticuerpo monoclonal humano IgG1 aprobado para el carcinoma urotelial de segunda línea y el cáncer de pulmón en estadío III (no resectable) que no ha progresado después de la quimioterapia basada en platino y la radioterapia. Bloquea el PD-L1 y sus receptores, pudiendo aliviar los efectos inmunosupresores dependientes de su interacción, potenciando la actividad citotóxica de las células T antitumorales (58).
Finalmente, atezolizumab es un anticuerpo humano IgG1 que bloquea la interacción de PD-L1 con PD-1 y B7 (62).
Aunque el bloqueo de PD-1 ha logrado cierto éxito como monoterapia, las respuestas no son efectivas o sostenidas en un subconjunto de pacientes con cáncer. Los problemas por resolver son la identificación del mecanismo de falta de respuesta a la terapia y el desarrollo de opciones combinadas basadas en diversos mecanismos (60).
En cuanto al cáncer de páncreas, el desafío imunoterapéutico se debe a la presencia de una cápsula fibrosa gruesa con estroma desmoplásico intenso capaz de contrarrestar la entrada de células inmunes. Asimismo, el medio tumoral pancreático tiene una preponderancia de células Treg, MDSCs y macrófagos M2, contribuyendo al microambiente inmunosupresor (63). Igualmente, tiende a producir IL-10 (citoquina antiinflamatoria que juega un papel importante en la regulación negativa de la respuesta inmune) (64), TGF- β (citocina esencial para la inducción de la respuesta fibrótica y para la activación del estroma del cáncer) (65) y una mayor expresión de PD-L1, impidiendo la activación de las células T específicas contra antígenos tumorales (63).
Cabe resaltar que los mecanismos de acción de los anticuerpos monoclonales anti-PD-L1 y anti-CTLA-4 no son redundantes. Su combinación puede tener actividad aditiva o sinérgica. Ejemplo de ello es la utilización de durvalumab con tremelimumab, mostrándose una mayor actividad en ciertos tipos de tumores (58).
Otros mecanismos de acción
Las células cancerígenas emplean varios mecanismos para escapar de la respuesta inmune, siendo uno la generación de adenosina. Su sobreexpresión se ha asociado con el desarrollo de cáncer y un mal pronóstico, porque tiene actividad inmunosupresora, inhibiendo la proliferación y la función de células inmunes, principalmente linfocitos T. Adicionalmente, promueve la proliferación de células cancerosas, angiogénesis y metástasis. Todas estas funciones están mediadas por receptores localizados en la expresión superficial de CD73. En consecuencia, es un objetivo inmunoterapéutico para su tratamiento (66).
Aunque los estudios en animales han brindado resultados prometedores, la evidencia en cáncer humano es poca. Ante esto, hay grupos de investigación trabajando para esclarecer la seguridad y la eficacia de los inhibidores dirigidos a CD73 mediante ensayos clínicos (66).
Oleclumab es un anticuerpo monoclonal IgG1λ humano desarrollado contra el receptor CD73. Se está investigando para el tratamiento de ciertos tipos de cáncer, incluido el de páncreas (67).
Actúa contra la enzima CD73, uniéndose selectivamente e inhibiendo su actividad ectonucleotidasa, haciendo que se agrupen los receptores y sean internalizados. De esta forma, se evita la supresión de linfocitos mediada por adenosina y aumenta la actividad de las células efectoras CD8+. Además permite la activación de macrófagos, así como la reducción de MDSCs y células Treg. Otro efecto es la agrupación y la internalización de CD73, reduciendo la migración de las células cancerosas y previniendo la metástasis (67).
Otra molécula de interés es la de adhesión celular epitelial (EpCAM, por sus siglas en inglés) (CD326). Se trata de una glicoproteína transmembrana de tipo I que funciona como una molécula de adhesión celular específica del epitelio. Está involucrada en una serie de procesos, incluida la migración celular, la proliferación y la diferenciación. La creación de anticuerpos capaces de unirse simultáneamente a objetivos en las células tumorales e inmunes han abierto las puertas a nuevos tratamientos. Actualmente, se están desarrollando terapias anticancerígenas dirigidas contra EpCAM, incluyendo anticuerpos biespecíficos. Esta proteína se expresa en la gran mayoría de pacientes con cánceres epiteliales, como los tumores de ovario, gástrico, colorrectal, pancreático, de mama, de pulmón y endometrial (68, 69, 70).
Catumaxomab es un anticuerpo monoclonal biespecífico que reconoce EpCAM y el CD3 del complejo receptor de células. Consiste en una IgG2a murina asociada con el segmento Fab anti-EpCAM y una IgG2b de rata asociada con el segmento Fab anti-CD3. Ambas subclases de IgG fueron seleccionadas por su alta afinidad de unión a los receptores Fcγ humanos. Este dominio funcional de Fc activa las células inmunes positivas para los receptores Fcγ I, Fcγ IIa y Fcγ III presentes en células NK y macrófagos. Por lo tanto, se ha definido como un anticuerpo trifuncional, debido a su capacidad de yuxtaponer simultáneamente poblaciones de células inmunes efectoras que expresan FcγR, junto con los linfocitos T, con células tumorales (68, 69, 70).
Finalmente, otro receptor es el factor estimulante de colonias de macrófagos 1 (CSF-1, por sus siglas en inglés). El cabiralizumab es un anticuerpo monoclonal dirigido a él. Se tiene información sobre terapias combinadas con nivolumab (71, 72). Sin embargo, los resultados no han sido alentadores en cáncer pancreático (73).
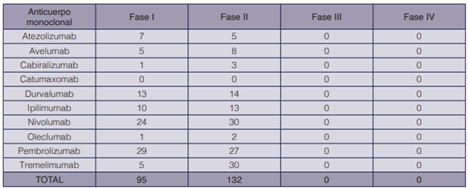
Finalmente, en el cuadro 5 se pueden observar los estudios clínicos que se están realizando o se han efectuado con anticuerpos monoclonales a junio de 2020 para el tratamiento del cáncer de páncreas (74). Se encontraron 227 resultados, la mayoría de los cuales corresponden a terapias combinadas, donde se dispone de dos o más anticuerpos monoclonales con distintos mecanismos. La investigación para esta patología es bastante reciente, dado que todos se hallan en fase I o II. Asimismo, la mayoría de estudios están relacionados con el receptor PD-1, teniendo al nivolumab y al prembolizumab con mayor presencia.
Cuadro 5 Estudios clínicos relacionados con anticuerpos monoclonales para el tratamiento del cáncer de páncreas (74).
Conclusiones
El cáncer de páncreas es una enfermedad letal, cuyo diagnóstico es tardío. Su desarrollo está ligado en gran parte al protooncogen K-Ras, manifestado en alrededor del 90 % de los casos. A nivel global, es el sexto cáncer más mortal, y en Costa Rica se ubica en la sétima posición. El diagnóstico se realiza mediante biomarcadores como el CA 19-9 y el CEA, en conjunto con otras técnicas.
Existen regímenes de terapias para el tratamiento farmacológico como el FOLFIRINOX. Otras opciones terapéuticas son la radioterapia y la cirugía. No obstante, menos del 20 % de los adenocarcinomas son admisibles para cirugía.
Ante esta situación, el uso de anticuerpos monoclonales ofrece alternativas para su manejo por medio de la inmunoterapia activa. En este momento, se encuentran en fase de investigación varias moléculas (atezolizumab, avelumab, cabiralizumab, catumaxomab, durvalumab, ipilimumab, nivolumab, oleclumab, pembrolizumab, tremelimumab), en estudios clínicos de fases I y II. Gran parte de ellos se están evaluando en combinación con otros fármacos, pues estas terapias no son redundantes, ni se antagonizan. Por el contrario, han mostrado tener una acción sinérgica. Los resultados sobre estos ensayos son escasos, pero se espera que a futuro se disponga de mayor información, junto con un número creciente de opciones que permitan en el mediano plazo su disponibilidad como alternativas terapéuticas para mejorar la esperanza y la calidad de vida de las personas que lo padecen.