Introducción
Las microalgas son consideradas biofábricas que convierten el dióxido de carbono y luz solar en biocombustibles, alimentos, piensos, biofertilizantes y bioactivos, potenciales. Estos organismos tienen también la capacidad de ser utilizados en servicios de biorremediación, fijación de nitrógeno y absorción de CO2 (Chisti, 2007; Loera-Quezada & Olguín, 2010; Lafarga, 2012). Por esta razón, las microalgas son vistas como materia prima alternativa para la próxima generación de combustibles, que se acompañará de una mayor cantidad de subproductos y servicios con alto valor agregado (Chisti, 2007).
Las microalgas en situaciones de estrés provocadas por condiciones ambientales, tanto químicas como físicas, sintetizan y acumulan ácidos grasos. Los principales estímulos que afectan el crecimiento de estos microorganismos son la temperatura, la intensidad luminosa, la deficiencia de nutrientes (nitrógeno, fósforo, azufre y silicio), la salinidad, la concentración de CO2 y el pH del medio de cultivo, de estos la deficiencia de nitrógeno es el principal factor que incide en el metabolismo de los lípidos (Loera-Quezada & Olguín, 2010). Santos et al. (2013) comprobaron que un aumento en la concentración de CO2 en la entrada de aire de un cultivo autotrófico de Chlorella protothecoides incrementó la productividad de biomasa y lípidos en 94% y 87% respectivamente, en comparación con el control.
Una alternativa económicamente viable para la producción industrial de biocombustible a base de microalgas es utilizar un sistema de crecimiento auto- y heterotrófico, el cual permite aumentar la producción de biomasa y la acumulación de alta cantidad de lípidos (Miao & Wu, 2006). Investigaciones reportaron que C. protothecoides cultivada en un medio adicionado con glucosa y disminuido en nitrógeno inorgánico alcanzó un contenido de lípidos de 69,32%, más alto que en un medio autotrófico (Xiong et al., 2010). Santos et al. (2011) utilizaron una conexión de CO2 gaseoso de un cultivo heterotrófico de C. protothecoides a uno autotrófico y obtuvieron un aumento de biomasa del 30% y un aumento de lípidos del 100%, en comparación con los controles. Estos resultados permiten deducir que este sistema de crecimiento es uno de los más eficientes en la producción de biomasa y de ácidos grasos para biocombustible.
El crecimiento algal depende de factores intrínsecos como la proliferación, la viabilidad celular, la fase de crecimiento y la edad del cultivo (Arias et al., 2013). El monitoreo de la concentración de biomasa es crucial durante el proceso bioquímico, ya que permite la obtención de los lípidos en una alta concentración y con el máximo rendimiento (Lopes da Silva et al., 2004). Por ello, Lopes da Silva et al. (2009) validaron el uso de la citometría de flujo en un cultivo heterotrófico de C. protothecoides como instrumento para obtener información exacta y precisa sobre los estados fisiológicos de las células presentes en una población. Estos investigadores obtuvieron como resultado que existe una alta correlación entre la fluorescencia del colorante Rojo Nilo y el contenido total de lípidos.
La citometría de flujo mejora los alcances de las técnicas microbiológicas clásicas que controlan la viabilidad y la proliferación celular. Entre ellas, la densidad óptica, el peso seco y el recuento manual de las células o colonias dan información del crecimiento ligado con la división celular, pero no sobre el estado fisiológico individual de las células (Hewitt & Nebe-Von-Caron, 2001; Hewitt & Nebe-Von-Caron, 2004). La citometría, por su parte, permite conocer en detalle lo que ocurre en el cultivo celular in situ, muy cerca del tiempo real y con alto grado de resolución estadística (Elsey et al., 2007). Esta técnica utiliza fluorocromos, los cuales facilitan el análisis de la viabilidad celular mediante la integridad de la membrana citoplasmática, como el Yoduro de Propidio (PI) (Lopes da Silva et al., 2004). Además, por medio de la tinción fluorescente Rojo Nilo se puede cuantificar el contenido celular de lípidos in situ (Lopes da Silva et al., 2012).
Estudios relacionados con el cultivo auto- y heterotrófico de C. protothecoides se han centrado en la manipulación de las variables, para mejorar las productividades y rendimientos de lípidos y biomasa. Sin embargo, no se conoce en detalle la fisiología de las células en el proceso de crecimiento y acumulación de lípidos, ni su relación con el tamaño y viabilidad celular. Es por ello que se determinó como objetivo de esta investigación estudiar las características morfológicas y fisiológicas de C. protothecoides cultivada en un medio autotrófico y heterotrófico en cascada para la producción de lípidos para biocombustible, mediante citometría de flujo.
Materiales y métodos
Este estudio se llevó a cabo en el Departamento de Bioenergía del Laboratorio Nacional de Energía y Geología (LNEG), en Lisboa, Portugal.
Se utilizó la microalga Chlorella protothecoides cepa B25 procedente de la Colección de Cultivos de Algas UTEX de la Universidad de Austin Texas, EE.UU. Los inóculos provenientes de un cultivo autotrófico crecieron en Medio de Cultivo Básico (MCB) con una entrada de aire de 1 L/min a una temperatura de 27 °C y luz constante.
Para establecer un cultivo microalgal heterotrófico, se inoculó un biorreactor de columna de burbujas con 100 ml de la microalga C. protothecoides y 1 L de medio de cultivo compuesto de 20 g/L de dextrosa monohidratada, 2 g/L de extracto de levadura y 100 ml de agua de mar filtrada, a un pH de 7,2. El crecimiento se llevó a cabo a una temperatura de 28±1 °C, una entrada de aire de 1 L/min y en oscuridad.
Para llevar a cabo el crecimiento autotrófico, se introdujo un biorreactor de columna de burbujas con 100 ml de microalgas y 1 L de medio de cultivo MCB compuesto de 1,25 g/L KH2PO4; 0,5 g/L NaHCO3; 1,25 g/L KNO3; 1 g/L MgSO4·7H2O; 0,11 g/L CaCl2·2H2O; 1,15 g/L FeEDTA·3H2O; 0,01mg/L de vitamina B1 y 10 ml de solución de elementos traza, a un pH de 7,2. Estos últimos en una concentración por litro de 286 mg H3BO3; 154 mg MnSO4·H2O; 22 mg ZnSO4; 5 mg CuSO4; 6 mg Na2MoO4·2H2O y 8 mg CoCl·6H2O. Este tratamiento se cultivó en condiciones constantes de luminosidad, establecida a 2414,5 lux, a una temperatura de 28±1 °C y entrada de aire de 1 L/min.
Para monitorear el crecimiento celular en cada reactor, cada 24 horas se tomó una muestra de 5 ml de la cual se midieron el pH y la temperatura, y se observó al microscopio para valorar el crecimiento. La biomasa expresada en peso seco (g/l) se determinó por densidad óptica a 450 nm por duplicado, utilizando el espectrofotómetro de luz visible GENESYS 20 (Thermo Scientific, USA).
Con el fin de cuantificar in vivo el contenido de lípidos totales (neutrales y estructurales) y la viabilidad según el estado de la membrana celular, se tomaron muestras en cada uno de los modelos de crecimiento a los 3, 6 y 7 días y se analizaron por medio de un citómetro de flujo (Becton-Dickison Instruments™, FACS Calibur, Erembodegem, Belgium), equipado con un láser de argón de 488 nm. Para ello se utilizaron los colorantes Rojo de Nilo (Riedel de Haën, Buchs SG, Switzerland) para la cuantificación de lípidos, y Yoduro de Propidio (Invitrogen, Carlsbad, USA), para viabilidad celular, siguiendo el protocolo establecido por Lopes Da Silva et al. (2009). Además, para el análisis del tamaño y el contenido celular, se estudió la dispersión de la luz en los detectores FSC-H y SSC-H del citómetro.
Resultados y discusión
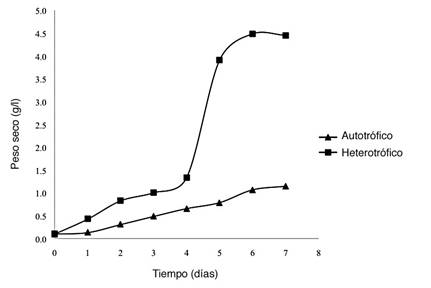
Los resultados de la comparación de las variables tomadas en el cultivo heterotrófico y en el autotrófico, respectivamente, demuestran que el primero superó en productividad al segundo, en biomasa, ácidos grasos y en tasa de crecimiento (Cuadro 1, Figura 1). Esto probablemente se debe a la abundancia de carbono orgánico que contenía el cultivo heterotrófico, lo que incentivó un estrés nutricional. Meng et al. (2009) explican que el metabolismo fotosintético propio de las microalgas transforma el nitrógeno, la luz solar y el dióxido de carbono, en azúcares, lípidos y proteínas. Sin embargo, aumenta la acumulación de lípidos cuando se agota un nutriente esencial del medio, por lo general el nitrógeno, y existe un exceso de carbono en forma de glucosa (Wu, 2006), situación que posiblemente ocurrió en el reactor heterotrófico y que provocó el aumento en ácidos grasos y biomasa en relación con el autotrófico.
Cuadro 1 Parámetros de cinética y rendimiento de C. protothecoides en dos sistemas diferentes de crecimiento después de 7 días de cultivo.
| Reactor | Productividad biomasa gl-1h-1 | Tasa de crecimiento h-1 | Ácidos grasos, % m/m | Productividad á. grasos gl-1h-1 |
|---|---|---|---|---|
| Heterotrófico | 0,59 | 0,02 | 24,5 | 0,14 |
| Autotrófico | 0,16 | 0,01 | 7,0 | 0,01 |
Los datos reportados del contenido de lípidos por citometría de flujo demuestran que en el reactor heterotrófico disminuyó la concentración de este metabolito del inicio al final de la fase estacionara (días 5 y 7), mientras que en el reactor autotrófico fue aumentando gradualmente la concentración de lípidos en el tiempo, hasta llegar a un máximo en la fase estacionaria (cuadro 2). Esto indica que el contenido lipídico es mayor en la fase de crecimiento estacionario que en la fase exponencial, debido a que estos compuestos solo se acumulan cuando las células están bajo condiciones de estrés fisiológico. Li et al. (2008) reportan que generalmente el contenido de lípidos durante la fase exponencial de crecimiento es menor o igual al 15% en peso seco, y en crecimiento estacionario, por la falta de nitrógeno, podría aumentar hasta el 70%.
Los resultados del análisis de viabilidad celular por citometría de flujo señalan que el cultivo heterotrófico presentó el mayor porcentaje de células viables y el menor porcentaje de células no viables, en comparación con el cultivo autotrófico (Cuadro 2), esto debido posiblemente a que en comportamiento autotróficos las microalgas se ven más afectadas por factores ambientales que en comportamiento heterotróficos. Vonshak & Torzillo (2004) señalan que el cultivo autotrófico limita su crecimiento según la intensidad lumínica y la concentración de CO2 y nitrógeno presentes. A pesar de esto, ambos cultivos presentaron datos aceptables de viabilidad, sin que se evidenciaran efectos drásticos de las condiciones de cultivo sobre las células.
Cuadro 2 Porcentaje de células viables según integridad de la membrana celular y contenido de lípidos totales en un cultivo autotrófico y heterotrófico de C. protothecoides
| Reactor | Días | Lípidos totales, % | Células viables, % | Células no viables, % |
|---|---|---|---|---|
| Heterotrófico | 5 6 7 | 38,8 32,5 16,4 | 84,5 93,8 92,5 | 15,5 6,2 7,5 |
| Autotrófico | 3 | 6,5 | 78,1 | 21,9 |
| 6 | 7,5 | 88,4 | 11,6 | |
| 7 | 8,5 | 89,7 | 10,3 |
Los resultados del análisis de la dispersión intrínseca de la luz mediante la citometría de flujo demuestran que las células tomadas a los días 5 y 7 de crecimiento, en el reactor heterotrófico, presentaban gran semejanza en el tamaño y contenido celular. No se observaron cambios importantes en estos parámetros, a pesar de la disminución en la cantidad total de lípidos determinada por fluorescencia (Figura 2), esto debido a que ambas muestras se tomaron en la fase estacionaria. Según Tomaselli, (2004), la acumulación de lípidos intracelulares no es la única causa de cambio en el tamaño de las células; este también tiene que ver con la fase de división celular en que se encuentre el cultivo. En este reactor ambas muestras se encontraban en la fase estacionaria, donde hay mínima división celular.
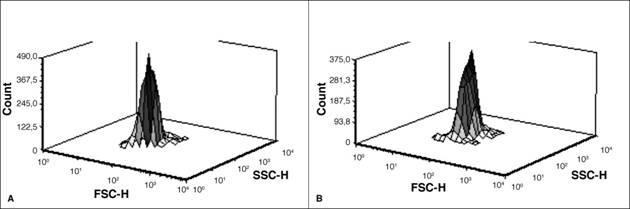
Figura 2 Análisis de la dispersión intrínseca de la luz por citometría de flujo multiparamétrica en dos diferentes muestras de cultivo heterotrófico de C. protothecoides, A) del día 5 y B) del día 7
En el reactor autotrófico, la dispersión intrínseca de la luz en las células tomadas el día 3 (fase exponencial), analizada por medio de citometría, mostró que la mayoría se aglomeraban en una subpoblación (a) en torno a una señal alta en SSC-H y FSC-H. Esto representa células más grandes y voluminosas que las de la subpoblación (b). Para el día 7 (fase estacionaria), se evidenció la presencia de dos grandes subpoblaciones, siendo la primera, (c), más densa, con células menos grandes y menos voluminosas que la segunda, subpoblación (d) (Figura 3). Esta diferencia de tamaños está relacionada con la fase de división celular en que las microalgas se encontraban, en el momento de la toma de la muestra. Según Tomaselli (2004), en la división celular la célula crece y todos los constituyentes celulares aumentan en número, de manera que cada célula hija reciba la misma información genética y una copia de todas las estructuras celulares (interfase), para luego realizar la división nuclear (mitosis). Por lo tanto, es probable que en crecimiento exponencial las células más abundantes correspondan a células madre en las primeras fases de división y, por el contrario, en la fase estacionaria la mayoría sean células más pequeñas y menos voluminosas, correspondiendo a una población con mayor cantidad de células hijas.
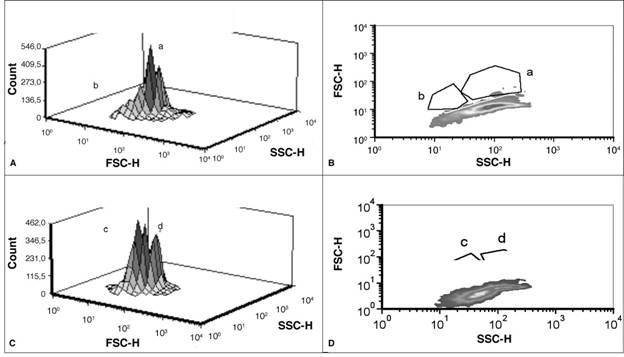
Figura 3 Análisis de la dispersión intrínseca de la luz por citometría de flujo multiparamétrica en dos diferentes muestras de cultivo autotrófico de C. protothecoides: A) y B) tomadas el día 3 de crecimiento, C) y D) el día 7
El monitoreo continuo del crecimiento celular en el reactor heterotrófico demostró, tanto macroscópica como microscópicamente, un cambio de color consistente en la pérdida de color verde conforme la microalga se adaptaba a las condiciones heterotróficas (Figura 4). Este fenómeno se explica debido a la biodegradación de la clorofila, provocada por la falta de luz y de nitrógeno, condiciones ambientales esenciales para que se lleve a cabo la fotosíntesis. Xiong et al. (2010) realizaron un estudio por microscopía electrónica, donde demostraron que los cloroplastos eran claramente visibles en las células fotosintéticas, pero conforme pasaba el tiempo y las células se adecuaban al crecimiento heterotrófico, un número de gránulos de almidón se hacía visible. Las membranas de los tilacoides desaparecieron rápidamente en las 48 horas y en lugar de ello, el citoplasma se llenó totalmente de grandes gotas de lípidos. Al respecto, experimentos bioquímicos sugieren que la ruptura de la clorofila y la degeneración del cloroplasto se asocian con lipogénesis durante la etapa de fermentación.
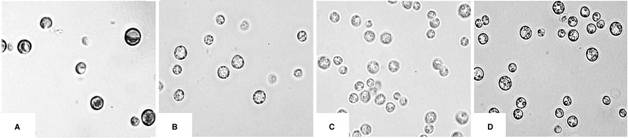
Figura 4 C. protothecoides en diferentes fases del crecimiento en el reactor heterotrófico, A) el día 7, B) el día 9, C) el día 11, D) el día 14. A: 1000X.
Los resultados de esta investigación indican que en células en crecimiento heterotrófico se obtiene mejor productividad en biomasa, en ácidos grasos, en porcentaje de lípidos, y una tasa de crecimiento y una viabilidad celular más altas, con respecto al crecimiento autotrófico; además, que las fases de crecimiento y los sistemas de cultivo se relacionan directamente con el estado morfológico y fisiológico de las microalgas, permitiendo o impidiendo su aumento de tamaño, la división celular y la acumulación de lípidos.