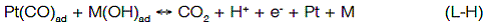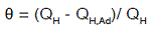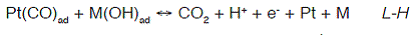Introducción
La obtención de catalizadores para celdas de combustible o con fines ambientales es uno de los campos más importantes de la electroquímica actual.
El uso de metanol como combustible es amplio, por lo que su oxidación catalítica presenta interés energético (por ejemplo, en celdas de combustible de metanol o DMFC por sus siglas en inglés) y ambiental.
La mejora de los ánodos para realizar dicha oxidación en las celdas de combustible se plantea en función de la optimización de la producción energética y la minimización de la formación de residuos o venenos catalíticos sobre la superficie, tales como el CO.
En general, se utilizan ánodos a base de platino o platino aleado, y existe una amplia variedad de aleaciones y tipos de deposición y distribución superficial de los metales (Herrero, Buller & Abruña, 2001; Gurau et al., 1998; Gerischer, Kolb & Sass, 1978; Cleghorn et al., 1997; Friedrich, Geyzers, Dickinson & Stimm, 2002).
Otra consideración es la relativa selectividad por algunos tipos de planos cristalinos en la deposición, lo que condiciona su capacidad catalítica (Frelink, Visscher & van Veen, 1996; Liu et al., 2000).
Se han propuesto numerosos métodos de deposición con resultados variables según los elementos involucrados, dependiendo de la naturaleza del sustrato y las características de la superficie, así como del potencial de deposición, teniendo en su mayoría al metanol como molécula modelo de oxidación (Frelink, Visscher & van Veen, 1996; Liu et al., 2000; McBreen & Mukerjee, 1995; Stalnionis, Tamašauskaiteˉ-Tamašieˉnaite˙, Pautieniene˙, Sudavicius & Jusys, 2004a; Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautienieneˉ, Sudavicˇius & Jusys, 2004b; Ishikawa, Liao & Cabrera, 2000).
Una metodología básica muy utilizada para la deposición de metales sobre la superficie de platino es la aplicación de un potencial constante inferior al potencial de deposición masiva (técnica conocida en inglés como under potential deposition o upd), con lo cual, a partir de una solución con el metal que se va a adicionar, se logra un cubrimiento superficial parcial, con reactividad variable y compleja. De manera similar la deposición espontanea se realiza al sumergir el metal base en una disolución del metal a depositar, sin aplicación de potencial, solo al potencial libre de la disolución, el cual depende de las características de la disolución. (Bonilla et al., 2005; Gurau et al., 1998; Gerischer, Kolb & Sass, 1978).
La existencia de diferentes métodos de deposición hace particularmente atractiva la consideración de la deposición a subpotenciales o espontánea en virtud de su facilidad, rapidez y relativa estabilidad (Janssen & Moolhuysen, 1976; Davies, Hayden, Pegg & Rendall, 2002).
Algunos autores plantean que los mejores resultados para la oxidación de metanol con superficies mixtas se deben a la acción de los átomos superficiales sobre la adsorción del mismo (Bonilla et al., 2005; Iwasita, Hoster, John-Anacker, Lin & Vielstich, 2000; Waszczuk, Barnard, Rice, Masel & Wieckowski, 2002; Spinacé, Neto & Linardi, 2004).
El presente estudio se basó en la generación de nuevas superficies mixtas y la evaluación de la acción de estas superficies modificadas sobre la oxidación del metanol.
La literatura indica que la proporción de estaño más efectiva se encuentra en el rango del 30-50%, dependiendo del tipo de deposición, el medio y el potencial utilizados, así como las características del depósito formado, que se discuten ampliamente, y en general para el estaño se describen como una mezcla de Sn, SnO, SnO2 y Sn(OH)2, principalmente (Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius, & Jusys, 2004a; Stalnionis, Tamašauskaite˙Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004b; Watanabe & Motoo, 1975).
Usualmente, se expresa que los depósitos de Sn se producen en islas sobre estructuras cristalinas de Pt con orientaciones (110), planteando que su actividad está asociada a su situación de carga parcial o a la posibilidad de bismutar a Snº o Sn+4 desde su estado como Sn+2 (Bittins-Cattaneo & Iwasita, 1987; Sobkowski, Franaszczuk & Piasecki, 1985; Zinola, Rodriguez & Obal, 2001).
El mecanismo de reacción más aceptado es el de Lagmuir Hinshelwood (L-H), que plantea la acción de los hidróxidos del metal adicionado, como donador de oxígeno para la oxidación del CO, que se forma como etapa intermedia de la oxidación de compuestos orgánicos sobre platino (Frelink, Visscher & van Veen, 1996; Janssen & Moolhuysen, 1976; Watanabe & Motoo, 1975; Bittins-Cattaneo & Iwasita, 1987; Janssen & Moolhuysen, 1976; Markovic´ & Ross, 2002; Reddington et al., 1998):
De este modo, se facilita la oxidación final del compuesto, siendo en general este el paso determinante de la velocidad de reacción.
Las técnicas de deposición a subpotenciales (upd) y espontáneos son muy utilizadas y para el estaño muestran actividad en varios tipos de reacciones (Bonilla et al., 2005; Iwasita, Hoster, John-Anacker, Lin & Vielstich, 2000; Waszczuk, Barnard, Rice, Masel & Wieckowski, 2002; Spinacé, Neto & Linardi, 2004).
El depósito por métodos cíclicos en la región de subpotenciales (ciclic upd) se deriva del concepto de estabilización dinámica indicada por otros autores (McBreen & Mukerjee, 1995; Bonilla et al., 2005; Massong, Tillman, Langkau, Abd El Meguid & Baltruschat, 1998; Xia, 1999).
El presente trabajo enmarca su acción en la comparación entre deposiciones, así como su actividad frente a la acción catalítica para oxidar metanol.
Metodología
Electrodos
Los experimentos se llevaron a cabo usando alambres de platino policristalino (pc) de 0,5 mm de diámetro y 99,999% de pureza (Good Fellow Co.) como electrodos de trabajo.
Como contraelectrodo se utilizó un electrodo de platino de gran área, más de 10 cm2, y como electrodo de referencia un electrodo normal de hidrógeno (ENH) generado con el electrolito soporte. Todas las medidas se refieren a este electrodo.
El área real del electrodo de trabajo se determinó por integración matemática del área de adsorción de hidrógeno. Los resultados se expresan en función de esta área disponible.
Disoluciones
El electrolito soporte utilizado fue H2SO4 1 mol*L-1, preparado con un ácido Dorwil (97,8% ACS), con agua de calidad Millipore MilliQ plus (resistividad 18,2 MΩ cm)
La solución de deposición 2 mmol*L-1 en estaño se preparó a partir de SnSO4 (Sigma Aldrich 99,5%) en ácido sulfúrico 1 mol*L-1.
Tratamiento de generación de electrodos columnares
Algunos electrodos fueron sometidos a tratamientos de aumento del área por métodos electrodinámicos para la generación de columnas (Arvia, Salvarezza, & Triaca, 1989; Martins, Salvarezza & Arvia, 1991).
Este tratamiento se realizó en ácido sulfúrico 1 mol*L-1, con la aplicación de ondas cuadradas entre 0 V y 2,6 V a una frecuencia de 5KHz por 5 minutos. Luego se mantuvo el potencial en 0V por 1 minuto, para después realizar un barrido lineal desde 1,6 V a 0 V, a 0,001V*s-1 y una estabilización por voltamperometría cíclica entre 0 V y 1,6V a 0,01 V*s-1.
Se calculó un Factor de Rugosidad (FR) del electrodo, definido como la relación de áreas en la región de adsorción de hidrógeno antes y después de la aplicación del tratamiento.
Métodos de deposición
Para poder evaluar los efectos del Sn en Pt pc se realizaron tres deposiciones de éste, según las siguientes metodologías (Bonilla et al., 2005; Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius, & Jusys, 2004a; Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004b; Massong, Tillman, Langkau , Abd El Meguid & Baltruschat, 1998):
Deposición espontánea de estaño por inmersión del platino en una solución de SnSO4 en ácido sulfúrico a circuito abierto o potencial libre de disolución.
Deposición a subpotenciales (upd), realizada a potencial constante de 0,2 V en disolución de estaño en ácido sulfúrico, sobre el electrodo de platino.
Ciclado dinámico en la región de subpotenciales (ciclic upd) de estaño en la región de máxima deposición de estaño, 0,05 a 0,35 V, a baja velocidad de barrido, 0,01 V*s-1.
Todas las deposiciones se hicieron desoxigenando las disoluciones con nitrógeno de alta pureza (Air Lyquide 5.0).
Los depósitos de estaño obtenido fueron estabilizados por voltamperometría cíclica, entre 0 V y 0,6 V, a una velocidad de barrido de 0,1 V s-1, en ácido sulfúrico 1 mol*L-1.
Cálculos de cubrimiento
El valor de cubrimiento superficial (θ) se define como (Zinola, Rodriguez & Obal, 2001):
Donde QH representa la carga de hidrógeno adsorbido por el electrodo de platino antes de la deposición y QHAd representa la carga después de la deposición, ambas en ácido sulfúrico 1 mol*L-1.
Para los cálculos de Q, se considera el área anódica generada entre 0,05 V y 0,4 V vs ENH.
Los tiempos de deposición varían de acuerdo con el grado de cubrimiento requerido para upd y ciclic upd, mientras que para la deposición espontánea el ajuste del cubrimiento se realiza por deposiciones repetidas con estabilizaciones intermedias.
Por ejemplo, para 10 minutos con deposición espontánea se obtiene alrededor de 15-20%, mientras que para upd se obtiene cerda de 40-50% de cubrimiento. El intervalo de cubrimientos de interés es del 25% al 50%.
La solución para la deposición espontánea presenta degradación con el tiempo, decreciendo su efectividad, por lo que su tiempo máximo de uso es una semana (Bittins-Cattaneo & Iwasita, 1987; Solis, Iwasita, Pavese & Vielstich, 1988; Szabo, 1984; Rodríguez-Yañez, 2012).
Oxidación de metanol
La oxidación de metanol se estudió por cronoamperometria entre 0,65 V y 0,8V, en soluciones de 0,1 mol*L-1 de metanol en 1 mol*L-1 de ácido sulfúrico.
También se llevaron a cabo voltamperometrías de barrido lineal entre 0 V y 0,8V a 0,01 V*s-1 con la misma disolución, a fin de evaluar el comportamiento de los electrodos modificados, su estabilidad y la formación de venenos superficiales.
Eliminación de residuos de metanol
La eliminación de los residuos de metanol, normalmente CO, por barrido en la región de su oxidación (stripping) permite ver la actividad de los electrodos modificados bajo estas condiciones.
Para ello, se realiza una adsorción de residuos a 0,25 V (Ead) durante 10 minutos. Luego, y manteniendo el potencial, se elimina la disolución de metanol y se deja solo el electrolito soporte. A continuación, se efectúa un barrido lineal entre Ead y 0 V, para hacer a continuación un barrido de potencial entre 0 y 1,5 V, a 0,1 V*s-1, obteniendo así la respuesta a la eliminación del residuo de metanol en el electrodo modificado.
Se utiliza ese potencial de adsorción porque es el indicado como de máxima generación de residuos para el metanol (Solis, Iwasita, Pavese & Vielstich, 1988).
Como respuesta, se calcula la carga obtenida en la región de adsorción de hidrógeno y se compara con la del electrodo original, asociando las diferencias al residuo generado.
Actividad de los electrodos modificados con estaño en la oxidación de metanol en solución
La actividad de los electrodos modificados con Sn fue probada al compararla con el Pt pc, en una disolución de metanol 0,1 mol*L-1en 1 mol*L-1 de ácido sulfúrico. Esta se realizó por voltamperometría cíclica desde Ead, a 0 V y luego a 0,8 V a 0,01 V*s-1
Se utilizó dicha región ya que algunos autores consideran que el Sn depositado no se oxida pasando a disolución hasta potenciales superiores a 0,8V (Sobkowski, Franaszczuk & Piasecki, 1985).
A esta baja velocidad de barrido de potencial (0,01 V*s-1), se ponderó la estabilidad de las corrientes de oxidación para cada sistema, el envenenamiento y la cinética de Tafel para las curvas obtenidas (Bonilla et al., 2005; Davies, Hayden, Pegg & Rendall, 2002).
Resultados y discusión
La deposición de Sn en platino
La superficie de platino fue modificada por las deposiciones de estaño, con niveles de cubrimiento θ del orden del 30% al 50%. Estos valores permiten considerar un orden de relación Pt/Sn de 3:1 a 2:1. Luego de modificada la superficie, se realizó su estabilización.
El perfil voltamperométrico del Pt pc a 0,1 V*s-1 antes y después de la deposición de Sn puede observarse en la Figura 1. Las voltamperometrías fueron corridas entre 0,05 V y 0,6V para evitar la desorción oxidativa del estaño depositado. La comparación entre los perfiles antes y después de la deposición evidencia la inhibición parcial de la adsorción de hidrógeno por parte del estaño depositado, así como el engrosamiento de la doble capa.
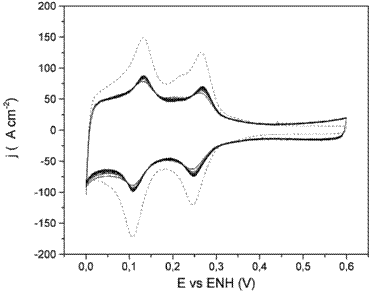
Figura 1: Estabilización de los depósitos de Sn en Pt por ciclado en la región de upd. Voltamperometría cíclica entre 0,05 V y 0,6 V a 0,1 V*s-1, por 10 ciclos. Depósito Sn upd 32% (__), Pt limpio (---).
Varios autores ya han indicado esta situación, incluso marcando preferencias por regiones cristalinas de adsorción débil del hidrógeno y la dependencia del efecto con el grado de cubrimiento (Zinola, Rodriguez & Obal, 2001; Xia, 1999; Bakos & Szabo, 2001).
Oxidación de residuos de metanol en electrodos modificados
En la Figura 2 se expone el comportamiento de la oxidación de los residuos de metanol ocurrida en electrodos de Pt modificados con Sn, por las diferentes técnicas ya expuestas.
Si se comparan entre sí las curvas obtenidas, no se observan diferencias sustanciales en su trazado general. Sin embargo, se pueden distinguir claramente dos zonas que separaremos para su estudio detallado.
En electrodos de Pt a potenciales menores a 0,4 V, se observa el bloqueo de la superficie por especies de CO formadas durante la oxidación catalítica de metanol (Stalnionis, Tamašauskaite˙Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004b). Sin embargo, aplicando el potencial de adsorción de máximo CO se encontró que aun el de mayor recubrimiento no presenta un bloqueo total de la superficie, lo cual indica que la superficie no se encuentra saturada de CO.
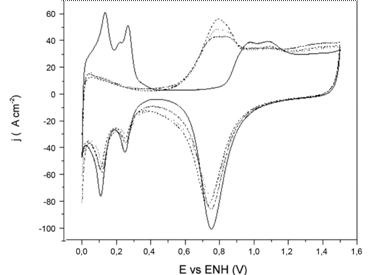
Figura 2: Voltamperometría cíclica de eliminación de residuos de adsorción de metanol(CO) para los distintos tipos de deposición de Sn, espontáneo 49% (_._._), upd 51% (….) y cupd 47% (---), blanco de Pt limpio (__), en ácido sulfúrico 1 mol*L-1, a 0,01 V*s-1
Debe recordarse que, para los electrodos modificados, parte del bloqueo de la superficie se debe al Sn depositado sobre el electrodo base de platino. Bajo esta consideración, en los electrodos modificados se determinó que la cantidad de CO adsorbido superficialmente, en función del área libre de Pt, son menores que para Pt limpio. Lo que indicaría que la deposición de Sn dificulta la formación de residuos de oxidación de metanol, ya sea por acción catalítica o estérica.
En este sentido, los tres tipos de depósitos de Sn presentaron valores diferentes en dicha afectación a iguales cubrimientos. Se observa que la cantidad de Pt disponible para la reacción que no presenta adsorción de CO es de apenas del 5% en el depósito por ciclic upd, mientras que para depósitos por upd es del 12% y para los depósitos espontáneos es de casi el 23%.
Más allá de la región de adsorción de hidrógeno se aprecia una corriente de oxidación a potenciales cercanos a 0,5V, lo que representa un potencial de oxidación de CO menor que los usuales para platino limpio de aproximadamente 0,7V. Estos valores deben ser tomados con cuidado, ya que se determinó que según el método de deposición, las corrientes pueden estar alteradas por una corriente adicional correspondiente a la oxidación del Sn depositado sobre platino.
Para considerar esta corriente adicional por la oxidación del Sn depositado, se realizaron blancos de comparación con depósitos equivalentes sin la presencia de residuos de metanol, a fin de evaluar las corrientes de oxidación para cada tipo de Sn depositado, lo que puede apreciarse en la Figura 3. Dicha figura muestra que, para el caso de los depósitos espontáneos, la corriente de oxidación del Sn es muy pequeña y es apenas significativa a potenciales superiores a 0,8V. Esto ratifica lo expresado por otros autores en cuanto a la estabilidad de este tipo de depósitos (Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004a; Bonilla, et al., 2005). Se encontró que para los depósitos por upd o cupd, gran parte de la corriente de oxidación, a potenciales menores a 0,6V, corresponde a la oxidación del Sn superficial, y a potenciales superiores la oxidación del Sn representa también una parte importante de la corriente. En este sentido, en la figura 4 se muestra la proporción de la oxidación del Sn en la corriente de oxidación en un electrodo con deposición de Sn por upd.
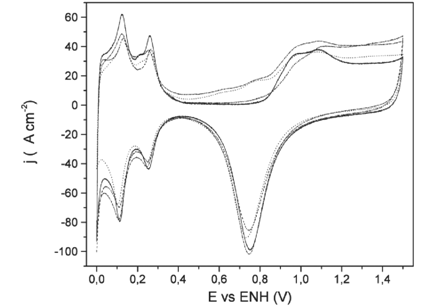
Figura 3: Voltamperometría cíclica para la comparación de la redisolución de Sn en los electrodos modificados de Pt/Sn en el primer ciclo, espontáneo 21%(---), upd 27%(….), cupd 25%(_._._), Pt limpio (___) en ácido sulfúrico 1 mol*L-1, a 0,1 V*s-1
Teniendo en cuenta este efecto, los picos de oxidación de los residuos de metanol (CO adsorbido) presentan algunas características que se deben resaltar:
Si se compara con Pt limpio, los picos de oxidación se inician a potenciales menores (aproximadamente 0,1V menores).
Para valores de potencial situados entre 0,6 V y 0,7 V, las corrientes de oxidación son mayores en electrodos modificados. Posteriormente, y hasta llegar a 0,9V, los valores de corriente son algo menores.
Se puede asumir que existen dos picos de oxidación traslapados (superpuestos), los cuales se situarían aproximadamente a 0,8 V y 0,85 V, asociados según algunos autores a la oxidación del CO (Sobkowski, Franaszczuk & Piasecki, 1985).
Las cargas netas de oxidación del residuo de metanol, que surge de restar la carga del pico de la oxidación del CO adsorbido menos la carga de oxidación del Sn depositado, aumenta con el grado de cubrimiento de Sn (θ Sn ), siendo la relación dependiente del tipo de depósito. En el caso de cupd, la variación no es significativa, mientras que en los depósitos por upd es leve (14% para θ de 50%) y resulta significativa para la deposición espontánea (50% o más con un θ de 50%).
Estas correlaciones entre el aumento de actividad y el grado de cubrimiento (θSn) llevan a considerar que existe una cantidad mínima de Sn a depositar, para que la superficie de Pt modificada por Sn sea más activa catalíticamente que el Pt solo, siendo del orden del 10% para deposición espontánea. (Bittins-Cattaneo & Iwasita, 1987; Stalnionis, Tamašauskaite˙Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004a; Waszczuk, Barnard, Rice, Masel & Wieckowski, 2002).
Los potenciales de inicio de oxidación de los adsorbatos de metanol son coincidentes con los potenciales reportados para los picos de oxidación del Sn upd, lo que estaría relacionado con la formación de los intermediarios necesarios para el mecanismo bifuncional del tipo propuesto por Lagmuir-Hinshelwood (L-H). (Watanabe & Motoo, 1975; Zinola, Rodriguez & Obal, 2001; Xia, 1999; Solis, Iwasita, Pavese & Vielstich, 1988; Koch, Rand & Woods, 1976).
Actividad de los electrodos modificados frente a metanol
Los electrodos de Pt modificados con Sn fueron enfrentados a una solución de 0,1 mol*L-1 en metanol en un medio ácido sulfúrico 1mol*L-1, a fin de apreciar su estabilidad para su utilización en las celdas de combustible de metanol directas (DMFC) y como catalizador anódico (oxidativo) de moléculas orgánicas simples.
Los ensayos en los electrodos de Pt modificado con Sn se realizaron mediante voltamperometría cíclica a baja velocidad de barrido (0,001V*s-1) y por cronoamperometrías.
Cronoamperometrías
Se realizaron curvas cronoamperometrias en potenciales asociados a la región de oxidación del metanol sobre platino, con el fin de ver las características de dicha oxidación en los electrodos generados, eligiéndose un potencial de 0,65V y 0,8V (Waszczuk, Barnard, Rice, Masel & Wieckowski, 2002; Xia, 1999; Szabo, 1984).
La elección de los valores de potencial para dichas cronoamperometrías de trabajo corresponde al primero y segundo pico de oxidación del Sn depositado por el método upd, lo que puede apreciarse en la Figura 4. En ellas no se presentaron diferencias significativas en las curvas obtenidas en ambos potenciales.
Las medidas cronoamperométricas normalizadas por unidad de área de electrodo para los ensayos a 0,65V se muestran en la Figura 5. Se utilizó como blanco la cronoamperometría del Pt limpio en electrolito soporte (H2SO4 1mol*L-1) y en la solución de metanol 0,1 mol*L-1 en H2SO4 1mol*L-1.
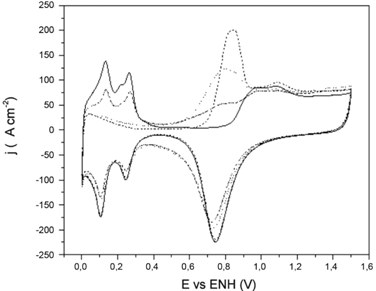
Figura 4: Voltamperometría cíclica en H2SO4 1 mol*L-1, a 0,01 V*s-1, blanco de Pt limpio (___), adsorbato de metanol en Pt limpio (---), adsorbato de metanol en Pt con Sn updθ = 51% (….), redisolución de Sn en electrodos de Pt con Sn upd 45% (_._._).
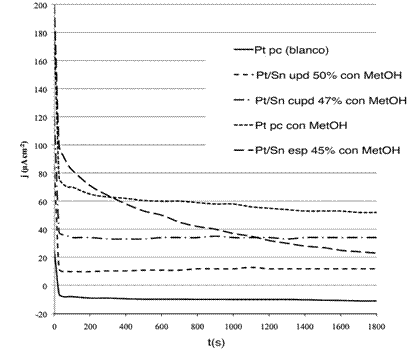
Figura 5: Cronoamperometrías a 0,65V por 30 min, (___) Pt pc en H2SO4 1M (blanco), (---) Pt pc, (_._._)Pt/Sn cupd 47%, (- - -) Pt/Sn upd 50% y (--) Pt/Sn esp 45% con metanol 0,1 mol*L-1 en H2SO4 1 mol*L-1
Los electrodos modificados presentaban curvas de decaimiento exponencial similares, en las que se puede apreciar que las diferencias radicaron en la velocidad de decaimiento inicial y en los valores constantes finales de corriente obtenidos.
Mientras que para upd y cupd se obtienen corrientes constantes de oxidación de metanol, con valores menores que para Pt limpio, en cambio para la deposición espontánea, la curva tiene un decaimiento continuo tendiente a cero.
Teniendo en cuenta que, además, para upd y cupd existen --a estos potenciales-- valores de corrientes de oxidación del Sn, se recalculó la cobertura final y se obtuvo una disminución de ésta para ambos del orden del 5% y el 20%, respectivamente. Por ende, las curvas cronoamperométricas marcan que los sistemas upd y cupd están dando corrientes de oxidación a expensas de su propia degradación; mientras que el depósito espontáneo presenta un decaimiento rápido asociado a una mejor velocidad de reacción y obtención del equilibrio sin que se observara pérdida de cubrimiento.
En la literatura se indica que a dichos potenciales (y en particular a 0,65 V) la oxidación de metanol es incompleta, obteniéndose CO2, ácido fórmico y formaldehído, por lo cual los residuos de metanol o la formación de estos podrían estar afectando la estabilidad de los depósitos de Sn utilizados (Stalnionis, Tamašauskaite˙-Tamašiuˉnaiteˉ, Pautieniene˙, Sudavicˇius & Jusys, 2004b).
Voltamperometrías cíclicas a baja velocidad
Se desarrollaron curvas de voltamperometría cíclica a baja velocidad (0,001V*s-1), con el fin de despreciar los efectos difusivos en la medida. Dichas curvas se realizaron dentro del límite de trabajo máximo definido para evitar la oxidación de Sn depositado a altos potenciales (superiores a 0,8 V) (Sobkowski, Franaszczuk & Piasecki, 1985).
La Figura 6 y Figura 7 muestran las curvas típicas de comportamiento obtenidas para los electrodos con depósitos de Sn, frente a una solución de metanol 0,1mol*L-1 en H2SO4 1 mol*L-1 a baja velocidad de barrido.
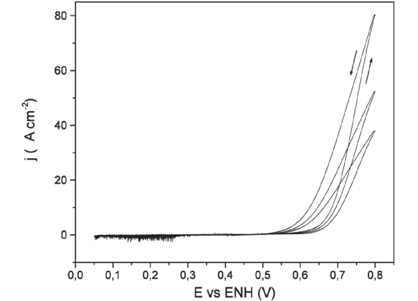
Figura 6: Decaimiento de la corriente de oxidación de metanol en cada ciclo para las voltamperometrías cíclicas de baja velocidad (0,001 V*s-1) en Pt/Sn upd 33%, en solución de metanol 0,1 mol*L-1 en H2SO4 1 mol*L-1
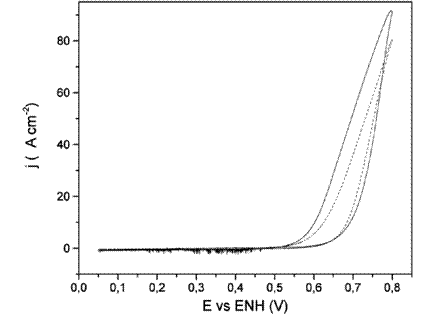
Figura 7: Comparación del primer ciclo de las voltamperometrías cíclicas de oxidación de metanol para electrodos de Pt/Sn upd con cubrimientos de 47% (___) y con 33% (---), en solución de metanol 0,1 mol*L-1 en H2SO4 1 mol*L-1
Se pueden apreciar en dichas figuras las siguientes características:
Los valores máximos de corriente se dan a 0,8 V, decayendo en cada ciclo. El valor de la corriente de pico es proporcional a la cantidad de Sn depositado, aumentando con este.
El decaimiento del máximo de corriente es menor cuanto mayor es la cantidad de Sn y en relación con los depósitos decae más con cupd, luego con upd y por último con espontáneo.
Las curvas presentan histéresis, siendo las corrientes del barrido de oxidación menores que en el barrido de reducción (ver Fig. 6), aparentemente debido a la liberación de sitios de platino realizada en la primera parte del barrido al aumentar el potencial (Massong, Tillman, Langkau, Abd El Meguid & Baltruschat, 1998). La histéresis se acentúa con la cantidad de Sn depositado y disminuye con el decaimiento de los picos en cada ciclo, producto del envenenamiento de la superficie.
Las curvas comparativas normalizadas para electrodos de Pt/Sn con distintos tipos de cubrimiento, mostraron que el Sn espontáneo y el cupd presentan mayores valores de corriente máxima y menor histéresis del pico de oxidación de metanol, pero este último con un aporte a la corriente por la oxidación del propio Sn depositado, con pérdida de cubrimiento.
Una vez evaluada la cantidad de Sn residual luego de los ensayos, se aprecia que los depósitos de Sn upd y cupd son lábiles para cubrimientos superiores al 10%, por lo tanto, hay que considerar que parte de la corriente de oxidación en los picos con estos depósitos corresponde a la oxidación del propio Sn. Aparentemente, esto depende de los ciclos de estabilización del depósito y de la estructura del Pt, siendo más acentuada la pérdida en electrodos columnares.
Para el caso de Sn espontáneo, no se producen pérdidas apreciables a potenciales inferiores a 0.8 V.
En el Cuadro 1 se presenta los valores de las pendientes de Tafel observadas en las curvas voltamperométricas, discriminadas según el tipo de Sn depositado, su cubrimiento (30% y 50% aproximadamente) y el barrido de potencial considerado. Se indican entre paréntesis los valores teóricos considerados asociados a dichas pendientes.
Cuadro 1: Cálculo de las pendientes de Tafel para los distintos electrodos de Pt modificados con Sn con las metodologías utilizadas y en los dos rangos principales de cubrimiento.
| Ensayo | θSn | Pend And | Pend Cat | Observaciones | Ejo and | Ejo cat |
|---|---|---|---|---|---|---|
| . | (%) | (mV*dec-1) | (mV*dec-1) | . | (mV) | (mV) |
| . | . | . | . | . | . | . |
| Pt limpio | 0% | 112 (120) | 88 (90) | Blanco | 636 | 601 |
| . | . | . | . | . | . | . |
| Pt/Sn esp | 45% | 99 (90) | 119 (120) | Sin pérdida aparente de cobertura | 298 | 400 |
| Pt/Sn esp | 29% | 93 (90) | 108 (120) | Sin pérdida aparente de cobertura | 288 | 437 |
| . | . | . | . | . | . | . |
| Pt/Sn upd | 47% | 82 (90) | 87 (90) | Con pérdida de cobertura (10%) | 600 | 481 |
| Pt/Sn upd | 33% | 63 (60) | 93 (90) | Sin pérdida aparente de cobertura | 569 | 433 |
| . | . | . | . | . | . | . |
| Pt/Sn cupd | 51% | 84 (90) | 92 (90) | Con pérdida de cobertura (20%) | 518 | 380 |
| Pt/Sn cupd | 28% | 58 (60) | 94 (90) | Con pérdida de cobertura (10%) | 600 | 410 |
En términos generales, los barridos anódicos muestran un aumento de la pendiente con el aumento del cubrimiento por Sn, mientras que los catódicos son estables. Esto último se debe a la liberación de sitios activos de Pt en el barrido anódico, lo que modificaría el paso limitante de la reacción.
La tendencia a altos cubrimientos en los barridos anódicos es de una pendiente cercana a los 90 mV*dec-1.Esta pendiente estaría asociada a una segunda transferencia unielectrónica, como paso limitante de la velocidad de reacción, condicionada a la variación del recubrimiento de COad y Sn depositado activo existente, asociado a un mecanismo bifuncional o del tipo LagmuirHinshelwood.
Mientras que en Pt limpio la pendiente anódica de 120 mV dec-1 la cual se corresponde más con un mecanismo cuyo paso limitante es la transferencia de un segundo electrón en la oxidación de COad, luego de una etapa reversible rápida inicial.
Los valores de pendientes de Tafel de 60 mV dec-1, para bajos cubrimientos en upd y cupd, responderían a una reacción controlada por una segunda transferencia electrónica, posterior a una primera transferencia rápida.
Los valores de la pendiente en los barridos catódicos están más asociados al tipo de depósito, siendo similares para upd y cupd, con valores cercanos a los 90 mV*dec-1, manteniendo la tendencia observada para el barrido anódico. En cambio, para los depósitos espontáneos de Sn, las pendientes presentan valores más elevados, cercanos a los 120 mV dec-1, similares a los del Pt limpio.
Los potenciales de corriente cero (Ejo) presentan una marcada diferencia para el depósito de Sn espontáneo, que tiene potenciales de iniciación del orden de los 0,3V. Esto implicaría que éste ya estaría reaccionando con el metanol y sus residuos al inicio de la doble capa del Pt, mientras que los otros depósitos iniciarían la oxidación entre los 0,5 y los 0,6V, siendo esto una situación ligeramente menor que con Pt limpio, que inicia la oxidación a 0,6V.
Conclusiones
Los electrodos de Pt con deposiciones de distintos metales han sido considerados como ánodos de celdas de combustibles, en particular, variaciones de los mismos con distinto tipos de depósitos superficiales para mejorar su funcionamiento.
En este trabajo, los electrodos de Pt modificados con depósitos de Sn que se estudiaron presentaron una dependencia de su actividad, según el tipo y la cantidad de cubrimiento superficial utilizados, así como el tipo de estructura cristalina del electrodo (policristalino, columnar).
Las nuevas metodologías empleadas no solo son de simple aplicación, sino que, en general, los electrodos obtenidos presentaron buenas propiedades oxidativas para el metanol como ánodos para una celda de combustible directa de metanol (DMFC).
Entre los electrodos evaluados se destacó el electrodo de Pt con Sn depositado en forma espontánea, el cual presentó no solo buena estabilidad frente a la autooxidación, dentro del ámbito de estabilidad de este tipo de electrodos mixtos, sino también mejores características de oxidación del metanol en solución.