Introducción
Un banco de tejidos es una entidad que provee servicios relacionados con la conservación y distribución de células y/o tejidos provenientes de donantes vivos o fallecidos, para utilizarlos con fines terapéuticos y/o de investigación. Las actividades de un banco de tejidos incluyen tanto los estudios de viabilidad de los tejidos a partir de los donantes como su obtención, procesamiento, almacenamiento y distribución (Suso Vergara y Segur Vilalta, 2009). Además, puede actuar como una entidad centralizada para la estandarización y supervisión de protocolos para el procesamiento y almacenamiento de las muestras, y también fungir como un mediador honesto en la protección de la confidencialidad de donantes y receptores (Pollack, 2011). Su principal objetivo es garantizar la calidad de los tejidos y procedimientos de confidencialidad desde el momento de su obtención hasta el trasplante (Suso Vergara y Segur Vilalta, 2009).
Se define como aloinjerto al injerto en el cual el donante y el receptor son individuos de la misma especie (Suso Vergara y Segur Vilalta, 2009). El uso de aloinjertos de piel en pacientes humanos fue reportado por primera vez en la medicina moderna a finales del siglo XIX. Sin embargo, el desarrollo de estrategias para la conservación de este tejido ocurrió hasta inicios del siglo XX, y no fue hasta la década de 1950 que se establecieron formalmente los primeros bancos de piel (Kagan, Robb y Plessinger, 2005). Desde entonces, el uso de aloinjertos de piel humana como apósitos biológicos es considerado el tratamiento ideal para la cobertura temporal de lesiones extensas en la piel (Kagan et al., 2005) o cuando no se dispone de suficiente tejido para el autoinjerto (Hautier et al., 2008).
Aparte de proveer a la lesión de una cobertura, reduciendo la deshidratación y la pérdida de fluidos y de calor (Hautier et al., 2008 y Kagan et al., 2005), diversos estudios han descrito las propiedades curativas de los aloinjertos de piel, incluyendo la reducción de infecciones bacterianas y del dolor, así como la estimulación de vascularización y una mejor recuperación (Kagan et al., 2005). Sin embargo, debido a la fuerte antigenicidad y recambio normal de la epidermis, los aloinjertos suelen ser rechazados por el receptor a las 2 o 3 semanas (Hautier et al., 2008). Por ello, y a pesar de los beneficios y propiedades curativas de los aloinjertos de piel, se debe considerar que se trata únicamente de una cobertura temporal, que prepara la zona receptora para una cobertura permanente (Kagan et al., 2005).
Para la posterior utilización del tejido, es necesario garantizar su adecuada conservación. A nivel internacional, se han establecido diversos protocolos que incluyen (de forma general) la conservación a corto plazo del tejido “fresco” (piel refrigerada a 4 °C), y la criopreservación y liofilización para el almacenamiento a largo plazo (Hautier et al., 2008 y Kagan et al., 2005). La refrigeración del tejido sumergido en soluciones nutritivas (medios de cultivo) permite mantener su viabilidad por un tiempo limitado (De, Mathur & Gore, 2008). Sin embargo, debido a la dificultad de mantener suplementos continuos y abundantes de piel fresca, la práctica estándar para los bancos de piel implica su criopreservación (Kagan et al., 2005).
Por otro lado, debido a la naturaleza de su aplicación clínica, un paso crítico en el procedimiento implica la adecuada desinfección y/o esterilización del tejido. Al respecto, mientras que algunos autores toleran la presencia de bajos niveles de contaminación microbiana (<103 organismos/g de tejido), algunas agencias exigen que el tejido se encuentre totalmente estéril para su utilización (Kagan et al., 2005).
El objetivo del presente trabajo fue comparar diferentes procesos de manejo de piel cadavérica según los protocolos internacionales de los bancos de tejidos, con el fin de ofrecer un criterio técnico respecto a las técnicas disponibles en el país.
Materiales y Métodos
La metodología empleada para el procesamiento y conservación de la piel en este trabajo se basó en los protocolos del Centro Comunitario de Sangre y Tejidos del Principado de Asturias (Oviedo, España), siguiendo procedimientos internacionales estándar para bancos de piel, los cuales se pueden consultar de forma resumida en el trabajo de Kagan y colaboradores (2005).
Toma y desinfección de muestras
Las muestras de piel se obtuvieron a partir de un cadáver de cerdo (Sus scrofa domesticus) eviscerado de aproximadamente 8 meses de edad, con una masa de ≈120 kg, adquirido a un productor local. La ablación de la piel se realizó dentro de las primeras 12 horas luego del fallecimiento del animal, en un área limpia. Para ello, las zonas de interés (lomo y abdomen) fueron rasuradas y luego refregadas con un jabón antibacterial comercial (Prolimza), utilizando gasa estéril. El jabón fue lavado con agua destilada estéril y suero fisiológico. Seguidamente, la piel se desinfectó con iodo povidona y etanol 70% (v/v). Finalmente, fue lubricada con glicerol puro. El tejido fue ablacionado utilizando un dermatomo eléctrico (Padgett Instruments), en láminas de 0,03 a 0,045 cm de grosor. Todas las muestras se colocaron inmediatamente en un medio de recogida DMEM con glucosa 4,5 g/L (GIBCO, Invitrogen), suplementado con suero fetal bovino al 10% (GIBCO), 3,7% NaHCO3, 2% antibióticos (10 000 I.U. mL-1 penicilina y 10 000 µg/mL estreptomicina; GIBCO) y 0,5% de un antimicótico (anfotericina 25 µg/mL), donde permanecieron por 24 horas a 4 ºC (desinfección con antibióticos). Inmediatamente después de la desinfección con antibióticos, una parte de cada fragmento de piel fue desinfectada químicamente por inmersión (3 minutos) en solución de Dakins (0,25% NaClO) en agitación continua.
Procesamiento del tejido
Inmediatamente después de su desinfección, y trabajando en condiciones asépticas empleando una cámara de flujo laminar de bioseguridad tipo II (ESCO), todas las muestras se sometieron a tres lavados consecutivos con suero fisiológico. El tejido se cortó en rectángulos de 5 x 10 cm y los excedentes de piel se usaron para el control microbiológico del ensayo, descrito más adelante. La metodología empleada para este trabajo se resume en la figura 1, en la que también se señalan los puntos de muestreo para los análisis histológicos y microbiológicos.
Criopreservación
Seis de las muestras tratadas únicamente con antibióticos y tres de las muestras tratadas también con desinfección química fueron preparadas en una disposición tipo “sándwich” para su criopreservación. Para ello, se colocó una muestra de piel cortada entre dos gasas vaselinadas, sobre la cual se dispuso otra muestra de piel y finalmente otra gasa vaselinada. Esta disposición se dobló sobre sí misma en un doblez tipo carta y se colocó en bolsas plásticas metalizadas P600 (Quimifarma) de 13 x 21,5 cm con 15-30 ml (hasta cubrir por completo) de solución criopreservante (DMEM con glucosa 4,5 g/L, suplementado con 20% suero fetal bovino y 10% glicerol). Las bolsas fueron selladas herméticamente con un sellador térmico para plásticos. Para congelar el tejido, se realizó un método de descenso controlado de temperatura rápido y sencillo, colocando las bolsas a 0 °C durante 20 minutos, seguido por 2 horas de incubación a -20 °C y almacenamiento a -70 °C. El tejido se mantuvo criopreservado a esta temperatura durante 5,5 meses.
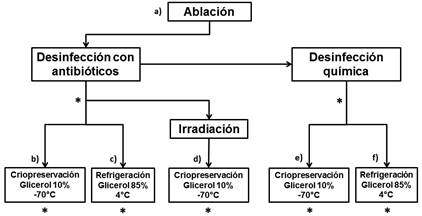
Figura 1 Resumen de la metodología empleada en este estudio. Luego de la ablación, la piel fue lavada con suero fisiológico y desinfectada mediante dos métodos. El tejido fue almacenado por 5,5 meses en criopreservación o en conservación en glicerol en refrigeración. Además, algunas muestras del tejido fueron tratadas con irradiación con haz de electrones (25 kGy). Los asteriscos (*) marcan los puntos de muestreo de tejido para el análisis microbiológico. Para el análisis histológico, se tomaron muestras de piel desinfectada con antibióticos y criopreservada (b); piel desinfectada con antibióticos y conservada en glicerol a 4°C (c); piel desinfectada con antibióticos, irradiada (25 KGy) y criopreservada (d); piel desinfectada con antibióticos y con solución de Dakins y criopreservada (e); y piel desinfectada con antibióticos y con solución de Dakins y conservada en glicerol a 4°C (f).
Conservación en glicerol
Seis de las muestras tratadas únicamente con antibióticos y tres de las muestras tratadas también con desinfección química fueron conservadas en glicerol a bajas temperaturas (4 °C). Para ello, el tejido ya cortado se incubó sumergido en glicerol 70% a 33 °C durante 3 horas, seguido por otras 3 horas de incubación a la misma temperatura en glicerol al 85%. La piel se mantuvo durante 3 semanas en esta solución a 4 °C, tras lo cual el tejido se empacó en la misma disposición tipo “sándwich” descrita anteriormente. Tres de las muestras desinfectadas únicamente con antibióticos y gliceroladas mediante este protocolo fueron además criopreservadas en bolsas metalizadas selladas, pero empleando glicerol al 85% en lugar de solución criopreservante. El resto del tejido se almacenó a 4 °C sumergido en glicerol al 85% en bolsas metalizadas selladas o en frascos de plástico estériles con tapa de rosca.
Esterilización por irradiación con haz de electrones
Del tejido desinfectado únicamente con antibióticos, se esterilizaron por irradiación con haz de electrones (25 kGy) tres de las muestras criopreservadas con glicerol al 10%. La irradiación se realizó por contrato en la empresa Synergy Health (Alajuela, Costa Rica).
Análisis microbiológico
Los excedentes de piel obtenidos del tejido lavado con suero fisiológico (tres muestras procedentes de la desinfección con antibióticos y tres muestras de la desinfección química) fueron utilizados para realizar controles microbiológicos en agar Sabouraud (AS; OXOID), agar papa dextrosa (APD; OXOID) y tioglicolato (SIGMA). El tejido fue incubado sobre el medio de cultivo (en los medios semisólidos) o por inmersión (en tioglicolato) a 37 °C durante 5 días. Estos análisis se realizaron con tres muestras de piel después de cada tratamiento de desinfección.
Además, se realizó un análisis microbiológico postalmacenamiento (a los 5,5 meses), en el que se incluyeron controles en agar de recuento estándar (ARE, OXOID); sin embargo, no se realizaron controles en AS postalmacenamiento. En todos los medios semisólidos, la incubación del tejido se realizó tanto por muestreo directo (colocando un trozo de tejido sobre el medio) como por la técnica de vaciado (utilizando pequeños fragmentos del tejido disueltos en 1 ml de solución salina). En AS, APD y ARE, se tomó como resultado positivo (contaminación) la presencia de cualquier tipo de crecimiento microbiano, mientras que en el tioglicolato se tomó como resultado positivo (contaminación) la aparición de turbidez. No se cuantificó ni se identificó la carga microbiana.
Análisis histológico
El efecto de las desinfecciones y/o del método de conservación sobre la estructura general del tejido se evaluó en tres muestras de piel de cada tratamiento (postalmacenamiento), fijadas con paraformaldehído 3,5%, y teñidas con hematoloxina-eosina, tinción tricrómica de Gomori, tinción para fibras reticulares y tinción con orceína, a partir de cortes histológicos parafinados. La preparación del tejido y las tinciones se hicieron por contrato en el Departamento de Anatomía de la Escuela de Medicina de la Universidad de Costa Rica. Los cortes histológicos teñidos se observaron en un microscopio Motic BA400, con una cámara digital Motic 300. Las imágenes no fueron modificadas, excepto para mejorar el brillo y/o el contraste.
Resultados
Análisis microbiológico
En los muestreos realizados de forma previa a la conservación del tejido, se demostró presencia de microorganismos tanto en la piel desinfectada con antibióticos y químicamente (con solución de Dakins) como en la piel tratada únicamente con antibióticos. Sin embargo, para la desinfección química, la contaminación se observó únicamente en el muestreo directo en medios semisólidos (AS y APD), mientras que en la desinfección con antibióticos se observó solo en la zona anaerobia del tioglicolato. Por otro lado, en los controles realizados postalmacenamiento, se encontró contaminación microbiana (AS, ARE y tioglicolato positivos) en todas las muestras que fueron criopreservadas a -70 °C con glicerol al 10%, sin importar el método de desinfección inicial, excepto en las muestras irradiadas. Además, también se encontró contaminación microbiana (tioglicolato positivo) en la piel desinfectada únicamente con antibióticos y almacenada a 4 °C con glicerol al 85%. Por su parte, todas las muestras que fueron irradiadas, así como el tejido desinfectado químicamente y almacenado a 4 °C con glicerol, no mostraron crecimiento microbiano en ningún control.
Histología
Epidermis
En todos los casos, la epidermis mostró conservación del patrón celular usual, con leve erosión en algunas áreas de los estratos superficiales. Esto se observó en la tinción con hematoxilinaeosina (figura 2), en la cual los ácidos nucleicos se tiñen de color azul, mientras que las proteínas se tiñen de color rojo a naranja (Cardiff, Miller y Munn, 2014). Esta tinción mostró una mejor conservación estructural de la epidermis en las muestras de piel tratadas con glicerol al 85% y almacenadas a 4 °C, incluyendo en la piel tratada con desinfección química, específicamente en términos de la conservación de los núcleos, muchos de los cuales se observan vacíos en las muestras criopreservadas.
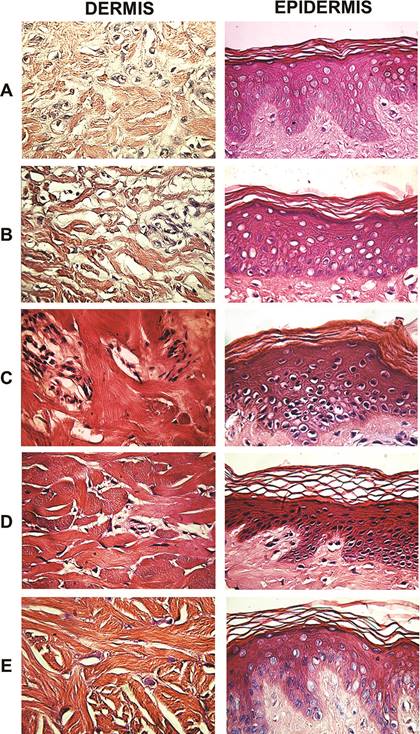
Figura 2 Tinción con hematoxilina-eosina de la dermis y la epidermis de piel cadavérica (Sus scrofa domesticus) procesada para su desinfección y almacenamiento. A, piel desinfectada con antibióticos (penicilina, estreptomicina y anfotericina) y criopreservada (-70ºC, 5,5 meses); B, piel desinfectada con antibióticos, irradiada (25 KGy) y criopreservada; C, piel desinfectada con antibióticos y conservada en glicerol (85%, 4°C, 5,5 meses); D, piel desinfectada con antibióticos y con solución de Dakins (0.25% NaClO, 3 min) y conservada en glicerol (85%, 4°C); D, piel desinfectada con antibióticos y con solución de Dakins y criopreservada (-70 ºC). Se muestra la mejor de tres réplicas (40x).
Dermis
Además de las células residentes (mayoritariamente fibroblastos), el tejido conectivo está conformado por tres tipos principales de fibras proteicas, a saber, colágeno, fibras reticulares y fibras elásticas (Ross y Pawlina, 2010). Se realizaron tinciones selectivas para observar cada una de estas estructuras en la dermis. Al igual que con la epidermis, la tinción con hematoxilinaeosina (figura 2) mostró una mejor conservación estructural de los componentes fibrosos de la dermis en las muestras de piel tratadas con glicerol al 85% y almacenadas a 4 °C, sin importar el método de desinfección. Sin embargo, la tinción tricrómica de Gomori (figura 3) reveló gran cantidad de estructuras oxidadas (tejido de color rojo, Figs. 3D-3E), en la piel desinfectada con solución de Dakins, siendo que las fibras de colágeno tipo I (azules) se mantuvieron intactas únicamente en el tejido desinfectado solo con antibióticos (figuras 3A, 3B y 3C). De forma general, no se observó disociación de la unión dermis-epidermis en ningún tratamiento.
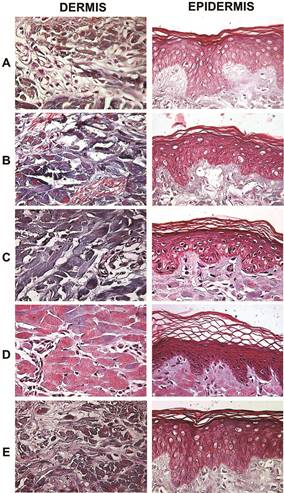
Figura 3 Tinción tricrómica de Gomori (fibras de colágeno) de la dermis y la epidermis de piel cadavérica (Sus scrofa domesticus) procesada para su desinfección y almacenamiento. A, piel desinfectada con antibióticos (penicilina, estreptomicina y anfotericina) y criopreservada (-70ºC, 5,5 meses); B, piel desinfectada con antibióticos, irradiada (25 KGy) y criopreservada; C, piel desinfectada con antibióticos y conservada en glicerol (85%, 4°C, 5,5 meses); D, piel desinfectada con antibióticos y con solución de Dakins (0.25% NaClO, 3 min) y conservada en glicerol (85%, 4°C); D, piel desinfectada con antibióticos y con solución de Dakins y criopreservada (-70 ºC). Se muestra la mejor de tres réplicas (40x).
Para confirmar la conservación estructural del tejido, también se realizó una tinción de fibras reticulares (PAS, ácido periódico de Schiff) y una tinción de fibras elásticas con orceína. Las fibras reticulares son fibras de colágeno tipo III presentes en el tejido conectivo, las cuales se tiñen de color morado-magenta con la tinción del ácido periódico de Schiff (Ross y Pawlina, 2010). Los resultados obtenidos muestran mayor cantidad de estas fibras en los tejidos que no fueron tratados con glicerol (figuras 4A, 4B y 4E). Sin embargo, esto no significa que el glicerol haya dañado estas fibras, sino que es posible que no se observen en la muestra. Por su parte, la tinción con orceína se realizó para observar las fibras elásticas, las cuales no se observan claramente en ninguno de los tratamientos, aunque parecen estar levemente reducidas en la piel desinfectada con antibióticos y conservada en glicerol a 4 ºC (figura 5C).
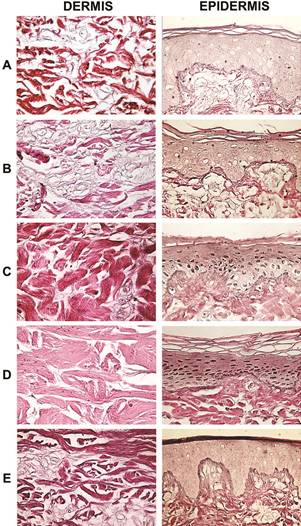
Figura 4 Tinción de fibras reticulares de la dermis y la epidermis de piel cadavérica (Sus scrofa domesticus) procesada para su desinfección y almacenamiento. A, piel desinfectada con antibióticos (penicilina, estreptomicina y anfotericina) y criopreservada (-70ºC, 5,5 meses); B, piel desinfectada con antibióticos, irradiada (25 KGy) y criopreservada; C, piel desinfectada con antibióticos y conservada en glicerol (85%, 4°C, 5,5 meses); D, piel desinfectada con antibióticos y con solución de Dakins (0.25% NaClO, 3 min) y conservada en glicerol (85%, 4°C); D, piel desinfectada con antibióticos y con solución de Dakins y criopreservada (-70 ºC). Se muestra la mejor de tres réplicas (40x).
Discusión
Formalmente desde el año 2006, el Instituto Tecnológico de Costa Rica (ITCR), con el apoyo de la Organización Internacional de Energía Atómica (OIEA), ha implementado en el país estrategias para mejorar el tratamiento de pacientes con lesiones en la piel, principalmente a través del cultivo celular y aplicación de equivalentes epidérmicos autólogos generados in vitro. Además, durante el período 2009-2012, el ITCR participó en un programa regional latinoamericano (ARCAL-RLA-6062) organizado y financiado por el OEIA, con el fin de favorecer la implementación de bancos de tejidos en la región. A través de este programa, se facilitó la capacitación en esta área de profesionales de la Caja Costarricense del Seguro Social y del propio ITCR. Esto, a la vez, favoreció el establecimiento del Banco Nacional de Tejidos del Hospital Nacional de Niños, el primer banco de tejidos en Centroamérica.
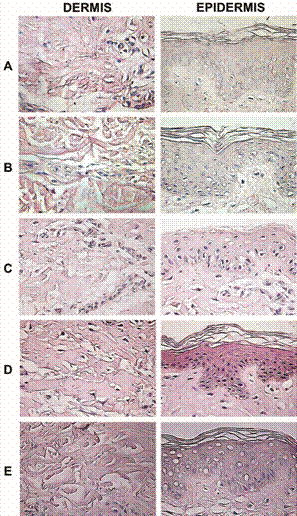
Figura 5 Tinción con orceína (fibras elásticas) de la dermis y la epidermis de piel cadavérica (Sus scrofa domesticus) procesada para su desinfección y almacenamiento. A, piel desinfectada con antibióticos (penicilina, estreptomicina y anfotericina) y criopreservada (-70ºC, 5,5 meses); B, piel desinfectada con antibióticos, irradiada (25 KGy) y criopreservada; C, piel desinfectada con antibióticos y conservada en glicerol (85%, 4°C, 5,5 meses); D, piel desinfectada con antibióticos y con solución de Dakins (0.25% NaClO, 3 min) y conservada en glicerol (85%, 4°C); D, piel desinfectada con antibióticos y con solución de Dakins y criopreservada (-70 ºC). Se muestra la mejor de tres réplicas (40x).
Dada la necesidad de asegurar la calidad y garantizar la optimización continua de los procedimientos, el ITCR se dio a la tarea de reproducir y analizar algunas de las técnicas más comunes a nivel internacional para el manejo de piel cadavérica para bancos de tejidos, con el fin de proveer un criterio técnico respecto a las estrategias disponibles en el país.
Para el aseguramiento de la calidad microbiológica, se siguieron las recomendaciones de Kagan y colaboradores (2005), evaluando la carga microbiana total (bacterias aerobias y anaerobias, levaduras y hongos) a partir de muestras de 1 cm2 de piel por cada 10% de superficie corporal removida. Estos autores indican que la piel ablacionada no se debe utilizar como aloinjerto si contiene estafilococos coagulasa-positivos, estreptococos beta-hemolíticos del Grupo A, enterococos, organismos Gram-negativos, Clostridia sp., y hongos o levaduras. Sin embargo, en este trabajo no se identificaron los microorganismos contaminantes, dado que se asumió el máximo criterio de esterilización, aceptándose como válidos únicamente los tratamientos que esterilizaron por completo el tejido. En este caso, solamente la irradiación con haz de electrones (25 kGy) logró eliminar por completo la carga microbiana en todos los tratamientos, mientras que la desinfección química alcanzó este criterio solo cuando fue acompañada por la conservación en glicerol a altas concentraciones, lo cual puede atribuirse a las propiedades antibacteriales y antivirales del glicerol (De et al., 2008).
Para este estudio, se utilizó la dosis de esterilización internacional estándar adoptada por la OIEA (25 kGy) para productos médicos. Esta dosis provee un nivel de aseguramiento de la esterilidad (SAL, por sus siglas en inglés) de 10-6, cuando se cuenta con una carga microbiana (bioburden) inicial baja. Para ello, se debe asegurar un manejo adecuado del material desde la ablación, con el fin de reducir la contaminación del tejido en cada paso del procesamiento. Sin embargo, aunque esta dosis de irradiación es suficiente para inactivar el virus de la Hepatitis C, no logra eliminar el VIH. Esto implica que, de utilizarse este método de esterilización, se debe realizar un escaneo muy estricto de los donantes, y que los tejidos deben ser manejados en condiciones asépticas y lavados y desinfectados durante el procesamiento, con el fin de reducir progresivamente la carga microbiana (Lobo Gajuwala, 2003), tal y como se hizo en este estudio.
Por otro lado, el uso de antibióticos para la desinfección del tejido se considera controversial, debido a que muchos no son efectivos a la temperatura de incubación (4 °C) y a que no se han determinado las dosis y combinaciones que garanticen la eliminación o reducción de la carga microbiana sin resultar tóxicas para los componentes celulares de la piel (Kagan et al., 2005). Por otro lado, se busca reducir el uso de antibióticos con el fin de no propiciar procesos de desarrollo de resistencia a estas sustancias. En este trabajo, se demostró que la desinfección con antibióticos no fue efectiva para eliminar por completo la contaminación microbiana, ni siquiera en los casos donde se conservó la piel con glicerol a altas concentraciones (85%). Por lo tanto, se recomienda emplear este tipo de desinfección únicamente cuando sea acompañado por un tratamiento de esterilización subsecuente. Al respecto, y con base en el uso que se le quiera dar al material biológico, también se deben considerar los efectos dañinos de estos tratamientos sobre el tejido, ya que podrían destruir su viabilidad y funcionalidad, limitando su uso para trasplante, pero resultando aún funcional como cobertura temporal.
Por otro lado, aunque la transmisión de enfermedades en los trasplantes ha sido minimizada mediante el establecimiento de estrictas normas internacionales para el aseguramiento de la calidad microbiológica, se han reportado casos de transmisión de enfermedades virales y bacterianas en trasplantes de piel cadavérica (Kagan et al., 2005). Así mismo, los programas de bancos de tejidos deben procurar la utilización de estrictas medidas para el aseguramiento de la calidad microbiológica de sus tejidos. Aunque la irradiación representaría el método ideal de esterilización, el sector público de Costa Rica no cuenta con las facilidades requeridas para este fin, resultando mucho más viable y económica (en tiempo y dinero) la desinfección química. Sin embargo, cabe mencionar que el ITCR, en colaboración con la OIEA, se encuentra realizando esfuerzos para la instalación de facilidades de irradiación comercial y científica en Costa Rica, lo que podría solventar esta y otras necesidades del sector público a mediano y largo plazo.
En relación con los métodos de conservación, los resultados obtenidos en este trabajo mostraron una mejor preservación de la arquitectura del tejido en las muestras de piel glicerolada (85%) mantenida en refrigeración (4 °C), incluso después de casi 6 meses de almacenamiento. No obstante, se ha demostrado que los métodos actualmente preferidos a nivel internacional para la conservación de la piel (refrigeración a 4 °C y criopreservación) no previenen la reducción en la viabilidad celular (Hautier et al., 2008). Al respecto, se ha mostrado que, en el almacenamiento en refrigeración, la capacidad de crecimiento de los fibroblastos y queratinocitos decrece desde el sétimo día de almacenamiento, y se pierde casi completamente en los queratinocitos y totalmente en los fibroblastos hacia el día 35 (Hautier et al., 2008). Otros autores (De et al., 2008) han reportado que, en la criopreservación (-70 °C) de piel cadavérica tratada con glicerol al 15%, el tejido puede mantener la viabilidad hasta por un mes de almacenamiento, mientras que la piel refrigerada al 4 °C en PBS (sin glicerol) pierde por completo su viabilidad a las 2 semanas.
Debido a la cualidad temporal de los aloinjertos de piel, el mantenimiento de la viabilidad del tejido es también un aspecto controversial. Esto se debe a que la viabilidad y la integridad estructural son clave para la toma del injerto y la vascularización (Hautier et al., 2008 y Kagan et al., 2005); además, los aloinjertos de piel también pueden proveer factores de crecimiento a la herida (Hautier et al., 2008). Sin embargo, tal como se mencionó anteriormente, es difícil mantener suplementos continuos y abundantes de piel fresca por más de dos semanas (De et al., 2008). Debido a ello, aunque la piel criopreservada presenta menor viabilidad que la piel fresca, la práctica estándar para los bancos de piel implica su criopreservación. Para ello, el tejido debe ser tratado con crioprotectores y luego ser enfriado paulatinamente, hasta alcanzar los -70 °C a -100 °C, conservando hasta un 85% de su viabilidad. La piel almacenada en congeladores (-70 °C a -100 °C) puede mantenerse por 3 a 6 meses, mientras que los tejidos almacenados en nitrógeno líquido (-150 °C a -196 °C) pueden mantenerse viables hasta por 10 años (Kagan et al., 2005). En el caso de este trabajo, la piel conservada en altas concentraciones de glicerol (85%) a 4 °C mostró mejor mantenimiento de la arquitectura histológica que la piel criopreservada, incluso luego de 5 meses de almacenamiento. Sin embargo, no se realizó un análisis de la viabilidad del tejido.
Por otro lado, los agentes crioprotectores son sustancias que protegen al tejido del daño mecánico que puede causar la congelación. Los dos crioprotectores más utilizados para la criopreservación de piel son el glicerol (usualmente al 15%) y el DMSO. De éstos, el glicerol es el agente preferido, debido a que no es tóxico como el DMSO y a que penetra en los tejidos lentamente. Sin embargo, a concentraciones mayores al 15%, el glicerol destruye la viabilidad del tejido (De et al., 2008). Esto sugiere la ausencia total de viabilidad en la piel conservada en glicerol al 85% en este estudio, a pesar de haber mostrado la mejor preservación de la estructura tisular.
La piel, o más específicamente, su matriz extracelular, también puede utilizarse como una cobertura biológica acelular no viable (De et al., 2008 y Richters et al., 2008), con el fin de evitar la deshidratación y la pérdida de calor. Así, por ejemplo, la preservación del tejido en glicerol al 85% es un método económico que resulta en piel acelular pero con su estructura tridimensional intacta, con las fibras de colágeno y elastina bien preservadas. Esta matriz acelular funciona como una matriz de soporte que puede ser utilizada como cobertura temporal para el tratamiento de lesiones en la piel. Los fibroblastos y los vasos capilares del receptor pueden migrar y colonizar el tejido injertado, integrándolo a la dermis propia. Además, con el tiempo, el colágeno del tejido injertado es reemplazado por colágeno propio (Richters et al., 2008).
Cabe mencionar que, debido a las dificultadas para trabajar con piel cadavérica humana, especialmente debido a su gran valor clínico, en este trabajo se empleó piel animal proveniente de un cerdo doméstico para alimentación. Histológicamente, se puede observar que el tejido empleado es muy similar a la piel humana; además, se debe considerar que los xenoinjertos (cuando el donante es de una especie distinta a la del receptor) también se pueden usar como sustitutos dérmicos en humanos (Richters et al., 2008).
Consideraciones Finales
A diferencia de la donación y trasplante de órganos, lamentablemente la donación de tejidos ha recibido poca atención del público, por lo que la disponibilidad de piel humana para trasplante sigue siendo limitada a nivel internacional (Kagan et al., 2005). Sin embargo, según se ha divulgado en la prensa nacional en Costa Rica, para marzo de 2013, el Banco Nacional de Tejidos del Hospital Nacional de Niños (Costa Rica) había recibido donaciones de 36 donantes cadavéricos, con lo cual se han tratado 30 pacientes desde junio de 2010. Además, para 2013 este Banco contaba con aproximadamente 14 000 cm2 de piel cadavérica almacenada, lo cual podría cubrir la necesidad de trasplantes durante ese año (La Prensa Libre, 2013).
Por otro lado, en Costa Rica, el Banco Nacional de Tejidos del Hospital Nacional de Niños y el Banco de Ojos, ambos de la Caja Costarricense del Seguro Social, son los únicos entes que actualmente almacenan tejidos para trasplantes en el país. El Banco Nacional de Tejidos almacena mayoritariamente piel cadavérica, mientras que el Banco de Ojos se dedica principalmente al almacenamiento de córneas. Esto implica que no existen en el país bancos que almacenen otros tejidos de gran demanda, como lo son el hueso y el cartílago, por lo que deben ser importados o extraídos de emergencia de forma usualmente autóloga en el momento en que se requieren, lo cual evidencia la necesidad de ampliar los programas de bancos de tejidos. Además, cabe mencionar que en el país es muy limitada la información global respecto a la cantidad, localización, tipo e histocompatibilidad de los tejidos almacenados. Instituciones de investigación y formación de recurso humano como el ITCR pueden contribuir al desarrollo de protocolos, técnicas y herramientas tecnológicas que solventen estas necesidades y trasladarlas a los profesionales en salud, que finalmente pueden hacer accesibles todos estos aspectos ventajosos a los pacientes para mejorar su calidad de vida.
Finalmente, se debe considerar que los aloinjertos proveen únicamente una cobertura temporal, preparando la zona receptora para una cobertura permanente de piel autóloga (De et al., 2008). En este sentido, el uso de autoinjertos epidérmicos cultivados in vitro, una estrategia desarrollada y aplicada clínicamente a nivel internacional desde la década de 1980, se postula como una alternativa eficiente para mejorar la recuperación de los pacientes con lesiones en la piel. Se ha demostrado que estos equivalentes epidérmicos permiten la reepitelización de la epidermis e incluso de la piel completa (Brychta et al., 2002). Al respecto, el ITCR cuenta con un laboratorio especializado para la elaboración de láminas de piel reconstruida mediante ingeniería de tejidos, la cual se ha utilizado para el tratamiento exitoso de pacientes con diversas lesiones en la piel (datos no publicados).














