Introducción
La ingeniería de tejidos se basa en la obtención de nuevas estructuras tisulares tridimensionales a partir de fragmentos pequeños de tejido sano. Estas estructuras reconstruidas pueden ser trasplantadas, usualmente empleando sistemas poliméricos naturales o artificiales para el soporte de las células, con el fin de restaurar la funcionalidad parcial o total de los tejidos u órganos dañados (San Román, Gallardo, Vázquez y López, 2000; Horch, 2009; Kwan, Slater, Chang, Longaker y Gurtner, 2009). Estos dos pilares fundamentales de la ingeniería de tejidos (las células y el andamio o soporte) se complementan con la adición de factores solubles, o moléculas de señalización, de origen local y sistémico, para lograr un ambiente físico-químico apropiado que permita la reconstrucción del tejido u órgano (Estrada, Paz y López, 2006). Además, la materia prima para los injertos puede ser de origen autólogo (del mismo individuo) o alogénico (proveniente de un donador) (Böttcher-Haberzeth, Biedermann y Reichmann, 2010 y Boyce y Warden, 2002).
Si bien se han hecho grandes avances en la producción de este tipo de sustitutos, aún existen algunos problemas relacionados con el desarrollo de estructuras que ofrezcan una funcionalidad inmediata y óptima después del trasplante. En este sentido, los retos actuales incluyen la elaboración de tejidos de larga duración y adecuada vascularización (BöttcherHaberzeth et al., 2010).
Las siguientes páginas resumen el estado actual de la tecnología en el desarrollo de equivalentes dermoepidermales para el tratamiento de lesiones o afecciones de la piel (Fig. 1). Esta área de estudio de la ingeniería de tejidos ha cobrado gran importancia tanto dentro como fuera de nuestro país, y en ella se han centrado los esfuerzos multidisciplinarios del Laboratorio de Ingeniería de Tejidos del Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (ITCR).
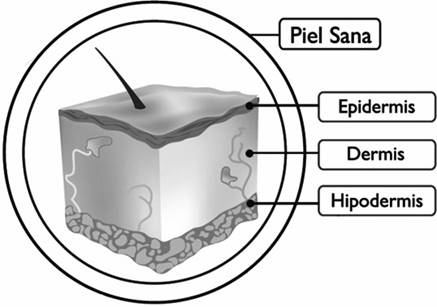
Figura 1 Estructura general de la piel humana. Como se observa en la ilustración, la piel está conformada por tres estratos: la epidermis, compuesta principalmente por células llamadas queratinocitos; la dermis, que es tejido conjuntivo de soporte compuesto principalmente de fibroblastos embebidos en matriz extracelular; y la subdermis o hipodermis, constituida principalmente por tejido graso.
Sustitutos e injertos de piel desarrollados por ingeniería de tejidos
De acuerdo con Brychta, Adler, Rihovd y Komdrkovd (1994), el desarrollo de sustitutos o injertos mediante ingeniería de tejidos para el tratamiento de daños en la piel dio sus primeros pasos en 1950, cuando se logró la separación enzimática de la epidermis y la dermis utilizando tripsina, pero sin destruir la viabilidad de las células epiteliales. A inicios de 1960 se demostró que los queratinocitos pueden sobrevivir en cultivo artificial, mientras que en 1975 Rheinwald y Green publicaron el trabajo de referencia sobre el crecimiento y proliferación de células cutáneas in vitro, a partir del cual lograron desarrollar un epitelio trasplantable.
El trabajo de Rheinwald y Green (1975) permitió no solo establecer el cultivo in vitro de queratinocitos, sino que para 1978 se logró su cultivo en forma de pequeñas láminas para implante, y para la década de 1980 se inició la aplicación clínica de cultivos autólogos y se desarrollaron alternativas dermales sintéticas (Chern, Baum y Arpey, 2009). Sin embargo, no fue hasta la década de 1990 cuando se comprendió la codependencia entre queratinocitos y fibroblastos y, poco después, se determinó que los queratinocitos no son capaces de sobrevivir a largo plazo en caso de provenir de un donador alogénico. Sin embargo, desde 1995 se ha reportado la reconstrucción de amplias regiones de piel dañada utilizando cultivos autólogos de células epidérmicas en colágeno bovino y otras matrices de soporte análogas a las estructuras reales in vivo (MacNeil, 2007).
Se han realizado muchos esfuerzos para desarrollar sustitutos de piel sin necesidad de donantes, los cuales permitan aumentar la disponibilidad de piel para injertar en caso de lesiones masivas. En este aspecto, se debe tener en cuenta que se considera que cualquier lesión cutánea de más de 4 cm de diámetro no sanará correctamente sin un implante. Aunque hasta ahora no se ha podido reconstruir en su totalidad la compleja estructura de la piel, se han desarrollado diversos tipos de equivalentes monocapa o multicapa (cuadro 1), donde la monocapa más simple es equivalente a una lámina o a una suspensión de queratinocitos autólogos (Hierner et al., 2005).
Como características ideales para estos sustitutos se busca que sean capaces de resistir infecciones y soportar la hipoxia en la lesión, así como que sean resistentes, costoeficientes, fáciles de preparar, almacenar, usar y adquirir, con espesor flexible, ausencia de inmunogenicidad, resistencia a microorganismos y estabilidad a largo plazo. Además, es deseable que provean de cobertura permanente a la herida, recreando los componentes dérmicos y epidérmicos naturales (Chern et al., 2009 y Shores, Gabriel y Gupta, 2007).
Cuadro 1 Tipos de implantes para el tratamiento de lesiones en la piel.
| Tipo de implante | Descripción |
|---|---|
| Tejidos naturales | Injertos de piel propia (autoinjertos), de un donante (aloinjertos) o de origen animal (xenoinjertos). También se utiliza membrana amniótica. |
| Sustitutos artificiales de la piel | Láminas y matrices poliméricas, de estructura usualmente porosa y de origen artificial, que pueden usarse como recubrimiento temporal análogo de la epidermis y la dermis. |
| Matrices dérmicas acelulares | Tejido epitelial, usualmente de origen animal, tratado química o físicamente para eliminar todas las células dérmicas y epidérmicas, dejando solo la matriz extracelular biológicamente activa. |
| Tejidos cultivados | Fibroblastos humanos embebidos en una matriz de soporte, con o sin una capa superficial análoga a la epidermis que contiene únicamente queratinocitos. Pueden ser producidos de forma autóloga o alogénica. |
Durante los últimos 30 años se han desarrollado y comercializado varios productos del tipo implante como sustitutos temporales o permanentes de la piel (Cuadro 2). Funcionalmente, su principal alcance ha sido proporcionar una cobertura al lecho de la lesión, evitando la deshidratación y las infecciones. Estos productos contienen células de diversos orígenes (autólogo, alogénico o xenogénico) y materiales biodegradables (naturales o polímeros sintéticos) que sirven como matrices para la adhesión y proliferación celular, al mismo tiempo que facilitan la manipulación para la aplicación terapéutica (Böttcher-Haberzeth et al., 2010).
Cuadro 2 Algunos productos comerciales desarrollados mediante la ingeniería de tejidos para el tratamiento de lesiones en la piel.
Compilado de Böttcher-Haberzeth et al., 2010; Boyce y Warden, 2002; Jones, Lachlan y Robin, 2002; Flasza et al., 2007; Shores, Gabriel y Gupta, 2007 y MacNeil, 2007. Las estructuras son interpretaciones ilustrativas de los autores basadas en la descripción de la composición de los productos. La clasificación en el grupo “Sustitutos dermoepidérmicos” se refiere a materiales que contienen tanto queratinocitos como fibroblastos, aunque otros de los productos en esta lista también podrían cumplir la función dermoepidérmica.
Origen del tejido y/o de las células para los sustitutos de piel
Autoimplantes (autoinjertos)
El donador del material que compone el injerto es el mismo receptor, lo cual implica que no hay riesgo de rechazo del implante, ya que no existen problemas de compatibilidad (Wysocki y Dorsett-Martin, 2008). La principal desventaja que presentan los autoinjertos es que, irremediablemente, se debe generar una lesión en el sitio donador, lo que involucra dolor, cicatrización y riesgo de infección adicional a la de la lesión original. Además, en caso de pérdida de grandes áreas de piel como, por ejemplo, en los grandes quemados, no existen zonas donadoras suficientes para implantar las regiones dañadas (Loss, Wedler, Kunzi, MeuliSimmen y Meyer, 2000).
Los autoinjertos pueden ser de piel natural o de piel cultivada in vitro. Los autoinjertos cultivados in vitro tampoco presentan riesgo de rechazo pero son frágiles y deben ser manejados con cuidado y experticia, ya que las lesiones son susceptibles a reaperturas y contracciones de las cicatrices (Barret, Wolf, Desai y Herndon, 2000). La fragilidad durante los primeros días de trasplante se asocia principalmente al epitelio no cornificado y a la unión dermoepidérmica (lámina basal) incipiente, factores que hacen que esta alternativa sea más susceptible a la infección bacteriana y daño mecánico que los injertos mallados de piel natural (Reinhart et al., 2007).
Sin embargo, los autoinjertos cultivados in vitro han sido utilizados clínicamente desde 1981 como cobertura permanente, y permiten cubrir lesiones de una gran área superficial a partir de una pequeña biopsia obtenida del mismo paciente, aunque la producción de suficiente material para injertar puede tomar de 3 a 4 semanas (Loss et al., 2000 y Barret et al., 2000). Las experiencias con estos injertos son diversas, pero mayoritariamente se reportan resultados cosméticos superiores y disminución en las tasas de mortalidad. Las principales limitaciones incluyen estadías hospitalarias más prolongadas y costos hospitalarios elevados, así como la desincronización entre los requerimientos del paciente y el tiempo que toma cultivar el autoinjerto, lo que ha restringido su uso generalizado (Barret et al., 2000 y Hernon et al., 2006).
Aloimplantes (aloinjertos)
Se trata de injertos en los que el donador y el receptor son individuos diferentes pero de la misma especie, de manera que su principal ventaja consiste en su mayor disponibilidad. Los aloinjertos pueden ser obtenidos a partir de donantes vivos o fallecidos. La piel cadavérica, por ejemplo, se obtiene a partir de bancos de piel sin fines de lucro (Jones, Lachlan y Robin, 2002). Al igual que los xenoinjertos, los aloinjertos estimulan la formación de tejido de granulación, lo que facilita implantes posteriores; sin embargo, debido a que la piel es altamente inmunogénica, los aloimplantes son rechazados en aproximadamente 10 días, por lo que su carácter temporal constituye su principal limitación. En pacientes con quemaduras extensas, este período de rechazo suele prolongarse (Wysocki y Dorsett-Martin, 2008). Al igual que los autoinjertos, los aloimplantes pueden ser de piel natural o piel cultivada in vitro.
Los aloinjertos cultivados in vitro pueden obtenerse y prepararse previamente a partir de donantes vivos o piel cadavérica; además, pueden utilizarse en fresco, criopreservados o liofilizados. La liofilización permite almacenarlos convenientemente a temperatura ambiente; además, gracias a la criopreservación, se han establecido bancos de aloinjertos que presentan una funcionalidad comparable a la de los aloinjertos frescos (Kamolz, Lumenta, Kitzinger y Frey, 2008 y Chern et al., 2009). Todos los aloinjertos requieren un estricto control, mediante análisis serológicos y microbiológicos, para evaluar la presencia de enfermedades infecciosas en el material (Chern et al., 2009); cualquier tejido contaminado debe ser descartado. Al igual que los autoinjertos cultivados in vitro, los aloinjertos cultivados se limitan al tratamiento de lesiones de profundidad parcial (Wysocki y Dorsett-Martin, 2008), aunque en nuestra experiencia se han obtenido resultados exitosos en lesiones de gran profundidad, incluso con músculo y hueso expuestos.
Por otro lado, aunque se ha demostrado que existe tolerancia inmunológica a largo plazo a los fibroblastos alogénicos, para la incorporación adecuada y permanente del injerto al tejido basal de la lesión es esencial el uso de queratinocitos autólogos. Además, estudios recientes han señalado que el uso de fibroblastos autólogos resulta en mejoras funcionales y estéticas (Atiyeh y Costagliola, 2007).
Cabe mencionar que cuando se hace referencia a los implantes o injertos de piel natural (de donante vivo o cadavérico), existen diferencias estructurales, funcionales y aplicadas respecto a si se trata de tejido de espesor total o parcial. Los injertos de espesor parcial, que incluyen la epidermis completa y parte de la dermis, se recomiendan para lesiones de textura irregular, y suelen presentar mayor éxito en la toma del injerto, aunque pueden contraerse; pueden ser mallados para cubrir mayor superficie y permitir el intercambio de exudados y el flujo de sangre a través de la lesión. No obstante, esta alternativa produce resultados estéticos inferiores, ya que puede producir hipopigmentación o hiperpigmentación (Wysocki y Dorsett-Martin, 2008), así como cicatrización hipertrófica o queloide, la cual puede causar severas discapacidades y desfiguraciones (Böttcher-Haberzeth et al., 2010).
Por su parte, los injertos de espesor completo, que incluyen la dermis y la epidermis completas, se utilizan en lesiones pequeñas y profundas (usualmente en zonas anatómicas como articulaciones y palmas de las manos y pies), confieren mayor elasticidad, mejor protección, mejores resultados cosméticos, son más resistentes, presentan mejor compatibilidad (Wysocki & Dorsett-Martin, 2008) y usualmente no causan cicatrización anómala (Böttcher-Haberzeth et al., 2010).
Xenoimplantes (xenoinjertos)
Estos son injertos en los que el donador es de una especie distinta a la del receptor (por ejemplo, implantes de piel de cerdo en humanos). Su principal limitante es el alto riesgo de rechazo. Aunque la utilización de tejido natural y fresco de este tipo no es común en los países occidentales, sí lo es en Oriente debido a creencias culturales que limitan el uso de aloimplantes (Wysocki y Dorsett-Martin, 2008). Sin embargo, existen diversos productos comerciales europeos y norteamericanos (Cuadro 2) que se utilizan como sustitutos de la piel que incluyen tejidos (normalmente acelulares) o proteínas de origen animal entre sus componentes.
Tipos de sustitutos de piel según el tejido que reemplazan
Sustitutos de la epidermis
Estos se refieren principalmente a queratinocitos autólogos, que a menudo se cultivan en presencia de una capa de células alimentadoras (feeder layer). La mayoría de estos sustitutos pertenece a la categoría de autoinjerto epidérmico cultivado, para lo cual los queratinocitos se cultivan en láminas de células estratificadas partiendo de una biopsia de piel del mismo paciente receptor y utilizando diferentes tipos de soportes. Otro enfoque para el reemplazo celular epidérmico es el uso de cultivos de queratinocitos autólogos en suspensión, que se pueden rociar sobre el lecho de la herida inmediatamente después de haber sido preparados a partir de una biopsia en la sala de operación. Aunque este método ha demostrado una epitelización algo más rápida en la maduración epidérmica en modelos de herida, la calidad y el beneficio para el paciente en la práctica clínica son todavía objeto de debate (BöttcherHaberzeth et al., 2010).
Sustitutos de la dermis
Se trata de preparaciones con diversa estructura, composición y costo. Algunos presentan disponibilidad inmediata y pueden ser procesados para ser inmunológicamente inertes, con una vida útil prolongada y fácil manipulación. Sin embargo, requieren de al menos un tratamiento subsecuente que cubra el tejido con células epidérmicas (Wysocki y Dorsett-Martin, 2008 y Chern et al., 2009). Se debe considerar que la calidad de adhesión y cicatrización de los sustitutos epidérmicos depende de las condiciones fisiológicas de la dermis sobre la que se aplican, de manera que los sustitutos dérmicos buscan restaurar el tejido dañado, promoviendo el crecimiento de nuevo tejido y la optimización de las condiciones de curación. Así, el objetivo primordial de los sustitutos de la dermis no es reepitelizar, sino aportar la secreción de factores de crecimiento y citoquinas y el depósito de proteínas típicas de la matriz dérmica (BöttcherHaberzeth et al., 2010).
Sustitutos dermoepidérmicos
Este tipo de injertos presenta una estructura análoga a la de las capas de la piel natural. En términos de resistencia mecánica y aspecto de la cicatriz, los resultados de la aplicación de estos injertos parecen ser superiores a las técnicas convencionales (Böttcher-Haberzeth et al., 2010). Además, se han reportado disminuciones en el tiempo de cicatrización y la hiperpigmentación e hipopigmentación, así como mejorías en la flexibilidad y la calidad de la cicatrización, sin reacciones inmunológicas adversas por parte del paciente receptor. Inicialmente, estos sustitutos fueron desarrollados como vendajes; recientemente se han diseñado para estimular la reepitelización y la formación de piel nueva, gracias a la secreción de factores de crecimiento (Nie et al., 2007). Los productos comerciales de este tipo (Apligraf® y OrCel®) no han reportado evidencia de rechazo inmunológico. No obstante, su costo es elevado, su vida útil no es tan prolongada y su manipulación debe ser cuidadosa (Chern et al., 2009). Además, dado que los productos comerciales desarrollados utilizan piel de donantes, esto ha suscitado un debate ético sobre el uso de piel cadavérica con fines comerciales (Wysocki y Dorsett-Martin, 2008).
Andamios para la reconstrucción de la piel
La ingeniería de tejidos se basa en el uso de células y materiales de soporte sintéticos o naturales, que pueden formar una estructura de tejido en la que se mantiene la comunicación célula-célula y las interacciones célula-matriz extracelular, en la que la matriz o andamio le da soporte y funcionalidad al tejido (Jiménez y Jiménez, 2004). Los materiales de soporte utilizados para este fin deben cumplir con características como: porosidad adecuada para favorecer la integración del tejido y la vascularización, biodegradabilidad controlada, compatibilidad histoquímica (Sachlos y Czernuszka, 2003), estabilidad a largo plazo, ausencia de inmunogenicidad y citotoxicidad, así como ser accesibles (en costo y disponibilidad) y fáciles de preparar, manipular y esterilizar.
El desarrollo de un modelo de piel in vitro que sea estructural y funcionalmente similar a la piel normal ha llevado al desarrollo y estudio de numerosos andamiajes poliméricos (de origen sintético o natural) que sirvan de soporte para el cultivo de las células epiteliales (Arvelo, Perez y Cotte, 2004). Los principales polímeros sintéticos biodegradables son poliésteres, polianhidros, policaprolactona, policarbonato y polifumarato, mientras que los polímeros de origen natural incluyen proteínas naturales de las matrices extracelulares como colágeno y glicosaminoglicano, ácido algínico, quitosano y otros polipéptidos (Chen, Ushida y Tateish, 2002).
En nuestro laboratorio se ha favorecido el uso de soportes tipo gel, desarrollados a base de las proteínas del plasma sanguíneo. Este tipo de geles se suelen obtener combinando la fracción del plasma sanguíneo, rico o pobre en plaquetas, con trombina calcificada, lo cual imita la reacción fisiológica que induce la polimerización de la fibrina y provoca la formación de un material biológico suave, parecido al gel (Burnouf, Radosevich y Goubran, 2004). Un factor importante en el uso de este tipo de geles es la relativamente fácil y amplia disponibilidad de plasma sanguíneo con calidad de banco de sangre.
Se ha observado que los geles basados en fibrina permiten un rápido crecimiento de los queratinocitos, brindando también una matriz ideal que permite un manejo fácil de la lámina de células para su trasplante, aparte de hacer posible cultivar grandes superficies sobre una base que sirve muy bien de equivalente dérmico (Arvelo et al., 2004).
Ventajas y desventajas de los implantes y/o sustitutos de la piel
La creación de sustitutos de la piel implica emular una serie de procesos que en el cuerpo humano suceden de manera autónoma, pero en el cultivo in vitro deben ser mediados de forma artificial. La ontogénesis de la piel, de ser posible, sería el método mediante el cual se lograría el desarrollo correcto de estructuras y funciones, mediado por los pasos secuenciales de citogénesis, morfogénesis, histogénesis y organogénesis. Dada la incapacidad actual de emular estos pasos, el fenotipo expresado por las células en cultivo se asemeja más al de un proceso de curación fisiológica, que incluye solo los pasos de citogénesis, morfogénesis e histogénesis, careciendo del proceso de organogénesis. Este último paso es crucial en la formación de estructuras anatómicas como las glándulas, los folículos y los nervios, y explica la inexistencia de estas estructuras en la curación postnatal (Boyce y Warden, 2002). Estos autores también mencionan una serie de limitaciones y consideraciones en el uso de sustitutos dérmicos. Entre las limitantes destacan la fragilidad mecánica, la susceptibilidad a la contaminación microbiana, bajas tasas de toma del injerto, así como un costo elevado. Por otro lado, en nuestra experiencia también ha sido relevante la necesidad de vendaje y cuidados especiales, incluyendo aplicaciones repetidas y la incapacidad de algunos pacientes de apegarse al seguimiento clínico y las recomendaciones.
En relación con los injertos cultivados in vitro, es importante considerar el tiempo que se requiere para alcanzar la confluencia necesaria para utilizar el cultivo de las células, lo cual debe estar sincronizado con los requerimientos de los pacientes. Además, se ha reportado que el autoinjerto debe ser utilizado en un periodo de 2 a 3 días, de lo contrario no se adhiere satisfactoriamente al lecho de la herida (Hernon et al., 2006). En este sentido, uno de los principales retos de la ingeniería de tejidos consiste en la disminución del tiempo requerido para alcanzar cultivos útiles, siendo que los esfuerzos se concentran en identificar queratinocitos con alta capacidad de multiplicación y fibroblastos con mayor capacidad para actuar como capas alimentadoras (Carsin et al., 2000).
Por otro lado, en los autoinjertos epiteliales cultivados obtenidos a partir de biopsias influyen factores como la asepsia de la muestra y las condiciones fisiológicas del paciente, tales como la edad y la historia clínica (si es fumador o ha sido sometido a tratamientos de quimioterapia o radioterapia); así como la secreción de exudados e infecciones en la herida. En este sentido, se ha observado que la toma del autoinjerto es más exitosa en pacientes jóvenes, debido al estado fisiológico de sus células y su mayor capacidad de respuesta para la toma del injerto (Carsin et al., 2000). Además, el éxito del tratamiento depende de la naturaleza de la herida; por ejemplo, cuando la dermis se encuentra totalmente destruida, se recomienda no utilizar sustitutos epidérmicos ya que se ha reportado que en este tipo de lesiones los injertos no presentan adherencia o funcionalidad satisfactoria dada la ausencia de células madre en la dermis residual (Böttcher-Haberzeth et al., 2010).
En términos funcionales, algunos problemas que no han sido resueltos en la elaboración de autoinjertos cultivados incluyen dudas respecto al nivel de diferenciación que debe tener el injerto al momento de ser trasplantado, de manera que pueda sostener la regeneración del tejido a largo plazo pero que exprese su función como barrera al ser aplicado; por otro lado, no se han podido elaborar injertos con una adecuada vascularización (Böttcher-Haberzeth et al., 2010).
Consideraciones finales
En términos económicos, las alternativas terapéuticas basadas en implantes epiteliales cultivados in vitro reportan costos más elevados que los tratamientos convencionales, en parte debido a que se requiere de reactivos y medios de cultivo de alto costo, personal capacitado y equipos especializados de alta tecnología. Sin embargo, los pacientes que reciben las células autólogas cultivadas tiene tasas de mortalidad mucho menores que aquellos que reciben tratamientos convencionales. Al mismo tiempo, se reporta que en estos pacientes se ha reducido la necesidad de intervenciones quirúrgicas y el dolor causado por las lesiones (CotoSegura et al., 2007; Carsin et al., 2000 y Wood, Kolybaba y Allen, 2006). Por otro lado, cuando las lesiones no son muy extensas ni profundas, este tipo de tratamiento sí puede representar una disminución de costos, asociados principalmente a la reducción del tiempo requerido para sanar, lo que implica menos gastos en personal médico, menos insumos y menor tiempo de internamiento.