Introducción
Una de las ramas de la investigación en ingeniería de tejidos consiste en la búsqueda, caracterización y análisis de la interacción que presentan los cultivos celulares con distintos biomateriales, los cuales funcionan como guía o soporte para una adecuada adhesión, migración, crecimiento y desarrollo de los sustitutos tisulares que se desean producir (Hutmacher, 2000).
Estos biomateriales pueden estar compuestos por una o varias sustancias, naturales o sintéticas. Comenzaron a utilizarse a inicios del siglo XX, cuando se usaron placas metálicas para insertarlas en huesos rotos o fracturados (Johnen et al., 2008). Después de la segunda guerra mundial, y a raíz de las investigaciones en Química, se disponía de novedosos polímeros, algunos de ellos empleados actualmente como biomateriales (Castro, 2009).
Las células de los tejidos suelen presentar un alto grado de organización y una interacción considerable con su matriz extracelular. Si un biomaterial permitiese que ambas circunstancias se recreasen en condiciones in vitro, entonces el resultado serían células que forman tejidos complejos y bastante parecidos a los naturales. De esta forma, el soporte o andamio tiene como función primaria ofrecer un espacio tridimensional de configuración para las células (Ohashi et al., 2007).
Un soporte ideal para el cultivo celular debe contener poros que aumenten el área de exposición y contacto con las células, permitiendo la migración celular. Además, debe presentar una composición y estructura que facilite la adhesión de las células para que ocurran los procesos de su proliferación y diferenciación. Otras propiedades de trascendencia a considerar son: la capacidad de promover o permitir eventuales procesos de vascularización, una nula toxicidad y reactividad con otros tejidos, una tasa de degradación que ocurra conforme se da la regeneración del tejido sustituto (en el caso de materiales biodegradables), una disposición que permita el crecimiento de células según la estructura tridimensional original, propiedades biomecánicas similares a las del sitio original en donde se ubicaría el tejido y, finalmente, que su utilización sea económicamente viable (Ikada, 2006).
De esta forma, se pretende que los biomateriales actuales constituyan elementos que guíen a las células que contienen para modelar y restituir un tejido específico. Algunos biomateriales pueden ser permanentes, principalmente en casos en que su remoción comprometa nuevamente la integridad y funcionalidad del tejido repuesto (Ohashi et al., 2007).
Matrices termosensibles
Uno de los aportes más importantes que ha puesto a disposición la ingeniería de materiales son los novedosos compuestos químicos que varían estructuralmente en función de las condiciones físicas a las que sean sometidos. Tal es el caso del polímero poli(N-isopropilacrilamida) - conocido como PIPAAm- cuya estructura se modifica en función de la temperatura. A 37 ºC, el PIPAAm es ligeramente hidrofóbico, permitiendo a las células adherirse a su superficie y crecer normalmente. Sin embargo, al disminuir la temperatura por debajo de los 32 ºC, el polímero se hidrata, ocasionando la liberación espontánea de las células en forma de una lámina uniforme e íntegra. Dado que el polímero se encuentra covalentemente inmovilizado a la placa de cultivo, el PIPAAm se mantiene unido luego de haber recolectado las láminas de células (Ohashi et al., 2007).
El uso de estas matrices termosensibles ha permitido la obtención de láminas tisulares íntegras, en donde las células mantienen las uniones que establecen entre sí y conservan la matriz extracelular, dado que no se emplean enzimas proteolíticas ni se ejecutan procesos mecánicos para la recolección de los tejidos. Además, al obtener láminas con estas características, es posible el diseño de tejidos tridimensionales sin recurrir a andamios entrelazados en las células (Harimoto et al., 2002; Kanzaki et al., 2006; Ohashi et al., 2007).
Membranas acelulares
Las membranas acelulares son membranas obtenidas de diversos tejidos, que son expuestos a varios procesos para la eliminación completa de sus células. Estas membranas biológicas presentan dos caras: por un lado, la membrana basal de aspecto brillante y cuya superficie permite la adhesión de células epiteliales y endoteliales; la cara opuesta, de apariencia opaca, es una túnica propria, constituida por tejido conectivo. Esta área es ideal para el contacto con el lecho de la lesión (Freytes, Stoner y Badylak, 2008).
Desde el punto de vista morfológico, las membranas acelulares poseen una serie de proteínas estructurales y funcionales organizadas tridimensionalmente. Están constituidas primordialmente por proteínas propias de la matriz extracelular de la dermis, es decir, colágeno tipo I, II, III, IV y VI, glucosaminoglicanos, sulfato de heparina, ácido hialurónico, sulfato de condroitina, fibronectina, lamininas y factores de crecimiento como TGF-β, PDGF, FGF-β y VEGF (Brown, Lindberg, Reing, Stolz y Badylak, 2006). Mecánicamente, son membranas muy fuertes, de fácil manipulación, capaces de atravesar suturas y actuar contra agentes bacterianos.
Ante la necesidad de brindar una mejor calidad de vida a aquellas personas con afecciones severas en la piel, el presente estudio se llevó a cabo con el fin de identificar la influencia de dos tipos de andamios en la creación de tejidos in vitro de epitelio humano.
Materiales y Métodos
El estudio se realizó en la Unidad de Traducción Clínica del Hospital Universitario Austral en Buenos Aires, Argentina. Se establecieron cultivos primarios y subcultivos de queratinocitos y fibroblastos humanos a partir de muestras de piel del área de la cara, la espalda o el abdomen y, para ello, se aplicó la metodología establecida por Lorenti (2009). Las células se cultivaron a 37 °C, 5% CO2 y en un ambiente de alta humedad. El medio de cultivo para los queratinocitos (Epilife ® Cascade Biologics, EE. UU.) se suplementó con rh-EGF y extracto de pituitaria bovina, pero sin suero fetal bovino (SFB). Los fibroblastos se cultivaron en el medio DMEM, con SFB, penicilina, estreptomicina y L-glutamina.
Para los ensayos de cultivo sobre un soporte artificial termosensible (UpCell, Japón) se emplearon placas multipozo, sobre las cuales se colocaron insertos que contenían en su base el polímero PIPAAm (figura 1). Sobre esta superficie se sembraron queratinocitos provenientes tanto de aislamientos primarios como de subcultivos. En la superficie de la placa multipozo (la cual no tiene contacto físico con el inserto), se sembró una capa alimentadora constituida por fibroblastos humanos; en algunas muestras no se hizo el cocultivo y se emplearon como control. Las condiciones de cultivo fueron las mismas que las aplicadas para el establecimiento de los cultivos primarios y subcultivos de queratinocitos y fibroblastos.
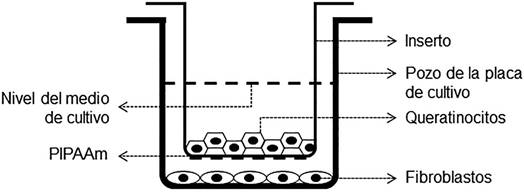
Figura 1 Modelo experimental empleado para el cultivo celular sobre un soporte artificial termosensible. Se puede apreciar la separación física entre los fibroblastos y los queratinocitos, así como la ubicación de la membrana polimérica artificial.
Finalmente, para los ensayos de cultivo sobre membranas acelulares (ACell, EE. UU.) se sembraron, de forma separada, queratinocitos y fibroblastos provenientes tanto de aislamientos primarios como de subcultivos. Los queratinocitos se colocaron sobre la lámina basal y los fibroblastos sobre la túnica propria. Además, se realizó un cultivo organotípico, para lo cual se sembraron fibroblastos sobre la túnica propria durante quince días, y luego se inocularon queratinocitos sobre la lámina basal de esta misma membrana durante siete días más. Las condiciones de cultivo fueron las mismas descritas para los otros ensayos.
Resultados
Desarrollo de un epitelio sobre un soporte artificial termosensible.
Se utilizaron queratinocitos humanos cultivados con y sin capa alimentadora. En el cultivo con capa alimentadora, las células comenzaron a anclarse a la placa a partir del segundo día de siembra y presentaron una morfología típica de células epiteliales. Posteriormente, cerca del día 10, las células cambiaron hasta presentar una morfología poligonal, característica de las células epiteliales en diferenciación, estimuladas por la alta confluencia. Al día 12 dio inicio la estratificación y para el día 21 el epitelio in vitro fue desprendido mediante la disminución de la temperatura (figura 2). De forma general, el cultivo presentó características normales, aunque se observó proliferación y diferenciación irregular en algunas zonas, con conjuntos de células aglomeradas y desprendimiento y retracción de fragmentos del epitelio en áreas confluentes. Por otro lado, en los cultivos de queratinocitos sin capa alimentadora, sus células presentaron una morfología estrellada y alargada, de tipo fibroblastoide, a partir del tercer día y hasta el final del tiempo de incubación (figura 3).
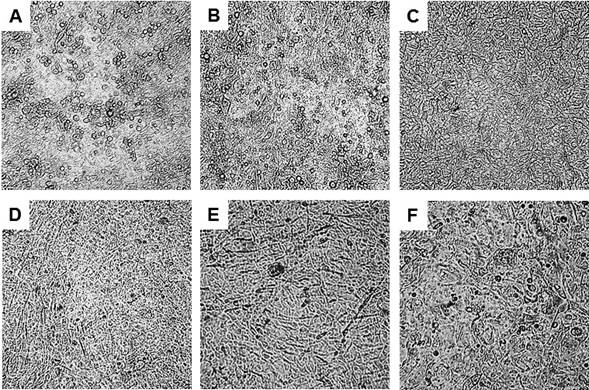
Figura 2 Cultivo de queratinocitos con capa alimentadora sobre un soporte artificial termosensible (PIPAAm).
Se muestran las células a los 6 (A), 9 (B), 12 (C), 15 (D), 18 (E) y 21 (F) días de incubación. Nótese la morfología poligonal típica de las células epiteliales, así como la formación de un epitelio estratificado a partir del día 12.
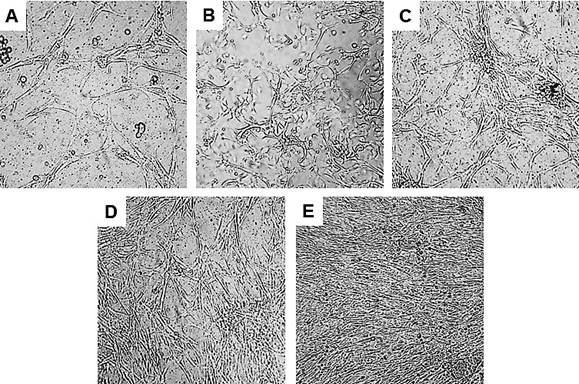
Figura 3 Cultivo de queratinocitos sin capa alimentadora sobre un soporte artificial termosensible (PIPAAm). Se muestran las células a los 3 (A), 6 (B), 9 (C), 12 (D) y 15 (E) días de incubación. Se observa una predominancia de células de morfología alargada y estrellada tipo fibroblastoide.
Los epitelios obtenidos de los cultivos en el soporte termosensible presentaron una morfología similar a la epidermis de una piel normal (figura 4), donde fue posible observar una hilera de células de tamaño grande, de forma esférica y con un núcleo grande, posiblemente correspondientes al estrato basal. Asimismo, se visualizaron, en promedio, de tres a cuatro capas de células con formas más alargadas y de tamaño reducido y, finalmente, se observó una capa superior donde hubo excreción de queratina, posiblemente análoga al estrato córneo.
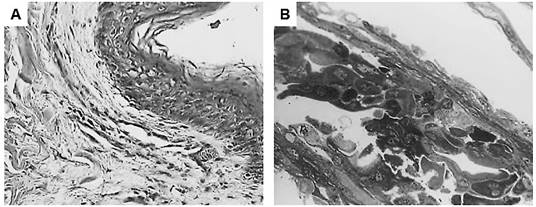
Figura 4 Tinción con hematoxilina-eosina de una muestra de piel normal (A, 400x) y una muestra de epitelio cultivado sobre el soporte artificial termosensible (PIPAAm) (B, 800x).
Desarrollo de un epitelio sobre una membrana acelular
La membrana acelular derivada de vejiga porcina sembrada con queratinocitos mostró que estos se desarrollaron sobre la lámina basal de la membrana hasta alcanzar una alta confluencia a los nueve días de incubación, presentando una morfología epitelioide o poligonal (figura 5A). Además, en el cultivo organotípico, en el cual se sembraron los queratinocitos sobre la lámina basal de una membrana acelular previamente inoculada con fibroblastos (sobre la túnica propria) con 15 días de antelación, el crecimiento de los queratinocitos no presentó una confluencia mayor al 80% y la morfología celular no fue la usual, sino que se formaron aglomerados (figura 5B).
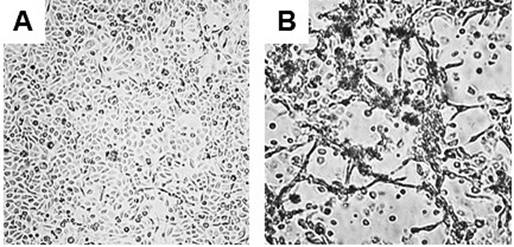
Figura 5 Cultivo de queratinocitos sobre una membrana acelular derivada de vejiga porcina. Se muestran las células cultivadas en ausencia de fibroblastos (A) y en cultivo organotípico (B). En este último, los fibroblastos se cultivaron sobre el lado opuesto de la membrana 15 días antes de agregar los queratinocitos.
Discusión
Desarrollo de un epitelio sobre un soporte artificial termosensible
Los queratinocitos son células dependientes de anclaje, lo que conlleva la necesidad de establecer una conexión con el soporte sobre el que potencialmente proliferarán. No todas las superficies son adecuadas para establecer esta interacción in vitro, dado que no siempre pueden generarse hemidesmosomas, que son los responsables del anclaje (Nerem, 1991).
La adhesión celular fue exitosa (aunque limitada) en ambos tipos de soportes evaluados; sin embargo, se observó mayor sobrevivencia y proliferación de los queratinocitos cultivados sobre el soporte polimérico artificial (figura 2) en comparación con la matriz acelular porcina (figura 5). Además, se obtuvieron mejores resultados cuando se utilizó capa alimentadora con respecto a los experimentos en los cuales los queratinocitos se cultivaron solos (figuras 2 y 3).
En este sentido, el polímero empleado (PIPAAm) no solo tiene la particularidad de ser termosensible, sino que también es semipermeable (Ohashi et al., 2007), permitiendo el intercambio de sustancias en el recipiente de cultivo celular. Así, aunque los fibroblastos de la capa alimentadora se encuentran físicamente separados de los queratinocitos (figuras 1), sin contacto directo entre ambos tipos celulares, los primeros aportan sustancias al medio de cultivo que podrían haber favorecido la sobrevivencia, proliferación y diferenciación de los queratinocitos, así como la formación de un epitelio estratificado. Este resultado está en concordancia con la interacción demostrada en numerosos trabajos científicos (Rheinwald y Green, 1975; Arvelo, Pérez y Cotte, 2004; Arvelo, 2007 y Arango, Chamorro, Restrepo, Correa y Henao, 2009)
Además, la separación física entre los dos tipos celulares permite a los queratinocitos proliferar sin ser afectados por el crecimiento de los fibroblastos, lo cual normalmente ocurre cuando se cultivan ambos tipos celulares en conjunto. Esto implica que no es necesario tratar física ni químicamente las células que componen la capa alimentadora para controlar su proliferación. Por ello, se pueden utilizar fibroblastos autólogos, evitándose el uso de células genéticamente transformadas, usualmente provenientes de animales, como es el caso de los fibroblastos murinos 3T3, que son las que habitualmente se usan para preparar la capa alimentadora.
Los resultados obtenidos en el ensayo testigo (figura 3) avalan estas observaciones, ya que se demostró que la ausencia de capa alimentadora derivó en la obtención de cultivos celulares menos confluentes y con una morfología fibroblastoide. Estas células podrían ser queratinocitos anormales o bien fibroblastos que permanecieron en estado quiescente al realizar el aislamiento primario y que, a causa del cambio de las condiciones al trasladar el cultivo a la membrana termosensible, hayan proliferado y anulado el desarrollo de los queratinocitos. En suma, estos resultados sugieren que, para el cultivo de células sobre el soporte artificial termosensible utilizado (PIPAAm), es necesario el uso de una capa alimentadora a fin de lograr buen anclaje inicial y el desarrollo y posterior estratificación de los queratinocitos. Esto sustenta la noción de que un óptimo desarrollo de los queratinocitos in vitro está basado en una combinación cruzada de tres factores: tipo de superficie, medio de cultivo y la presencia de una capa alimentadora.
Por otro lado, los cultivos celulares realizados sobre el soporte artificial termosensible (PIPAAm) que llegaron hasta los 21 días de incubación presentaron un buen desprendimiento; es decir, no fue necesario el uso de métodos mecánicos ni enzimáticos para desprender el tejido del frasco de cultivo. Esto podría prevenir daños a la integridad del epitelio, protegiendo especialmente las interconexiones entre las células y la matriz extracelular.
También se observó que, a partir del día 24 de siembra, la lámina inicia un proceso de autodesprendimiento. No es ideal que esto ocurra, puesto que la separación puede darse de forma dispareja, llegando a afectar la integridad de la membrana, lo que dificultaría la manipulación y aplicación del tejido en los pacientes. Debido a esto, se sugiere que el tiempo de cultivo y la decisión del momento del desprendimiento de las láminas deben ser estimados y programados para evitar que el tejido se separe espontáneamente.
Desarrollo de un epitelio sobre una membrana acelular derivada de vejiga porcina
El empleo de una membrana acelular al efectuar cultivos de tejido epidérmico podría facilitar su manipulación, e incluso permitir el desarrollo de láminas de cultivo organotípico, donde tanto queratinocitos como fibroblastos podrían ser aplicados al paciente en una organización semejante a la que existe en la piel normalmente.
En el presente trabajo, los queratinocitos primarios cultivados independientemente sobre la membrana (en ausencia de fibroblastos) tuvieron un crecimiento normal, aunque no se observó un proceso de diferenciación evidente (figura 4A). De igual forma, el desarrollo de un cultivo organotípico empleando la membrana acelular como soporte demostró que, aunque se alcanzó la confluencia, tampoco hubo diferenciación observable de los queratinocitos. En suma, en ninguno de los ensayos en los que se utilizó la matriz acelular se logró alcanzar el desarrollo de un epitelio estratificado exitoso. No obstante, esto no necesariamente es desfavorable, dado que los queratinocitos podrían completar su desarrollo y estratificación in vivo. Aun cuando un cultivo organotípico pueda demorar tiempo en desarrollarse, el hecho de que la membrana contenga tanto queratinocitos como fibroblastos, incluso cultivados diacrónicamente, muestra que este tipo de cultivos puede ser muy útil para fines terapéuticos, sobre todo cuando el tiempo es un factor determinante en la recuperación del paciente.
Conclusiones
El éxito de los cultivos celulares en el inserto polimérico termosensible fue determinado por la presencia de una capa alimentadora (feeder layer), evidenciando la importancia de las interacciones paracrinas célula-célula necesarias para que los queratinocitos se desarrollen. Por su parte, la membrana acelular derivada de vejiga porcina no resultó tan exitosa para el desarrollo de queratinocitos; sin embargo, se requerirá continuar en el desarrollo de cultivos organotípicos exitosos que permitan reproducir más exactamente la estructura natural de la piel.














