Introducción
El cultivo de la piña (Ananas comosus L.) con un área de siembra aproximada de 43 000 ha es uno de los principales productos de exportación en Costa Rica, especialmente a mercados en Estados Unidos y la Unión Europea, (CANAPEP 2019). En el 2022, la piña tuvo en el mercado exportador una participación del 17,6% y un valor de $1 021,3 millones, además el jugo de piña participo con 3,4% (SEPSA 2023).
Las enfermedades poscosecha son uno de los problemas de la industria piñera, debido a que causan en los frutos pudriciones durante el transporte y el almacenamiento, lo cual generan el rechazo de la piña en las plantas empacadoras y el mercado final (Barquero 2010). El moho en el pedúnculo de la piña es un complejo de hongos que generan deterioro en el corte de la fruta, entre las especies identificadas se pueden citar Penicillium purpureogenunm, Penicillium diversum, y Talaromyces calidicanius (Castro y Umaña 2015). Igualmente, se ha reportado un grupo de hongos de micelio blanco (Hgbl) relacionados a este moho, como lo son las especies P. daleae, Xylarai adscendens y Daldinia eschscholtzii (Castro y Umaña 2017).
Adicionalmente, se han identificado bacterias y levaduras que crecen tanto en el pedúnculo como en la cáscara de la fruta. Estos microorganismos se han reportado en crecimiento con mayor frecuencia en los pedúnculos de la piña, con valores entre 0,5 y 4,6 UFC.ml-1 antes del procesamiento comercial y entre 0 y 2,7 UFC.ml-1 después del procesamiento comercial (Castro y Umaña 2019).
Con respecto a las levaduras, estos microorganismos pueden causar problemas poscosecha al afectar la calidad de las frutas, pero algunas especies se han estudiado por su potencial como controladores biológicos de patógenos (Spadaro y Droby 2016). Las levaduras son hongos eucariotas, ubicuos, que pueden tener interacción del tipo simbiótico, mutualismo o parasitismo (Starmer y Lachance 2011). El crecimiento de estos organismos depende de factores como la temperatura, los nutrientes, el pH, la humedad, el oxígeno, el estrés oxidativo, entre otros (Sui et al. 2015).
Algunas levaduras como Rhodotorula mucilaginosa y Candida fukuyameensis se han estudiado por el potencial como controladores biológicos poscosecha en piña (Torres et al. 2006, Lassois et al. 2008, Li et al. 2011). Las levaduras Meyerozyma guilliermondii y M. caribbica se han utilizado para el control del moho gris causado por Botrytis sp, que se presenta en los frutos de kiwi (Cheng et al. 2023, Pan et al. 2022, Qiu et al. 2022).
En Costa Rica, se reportó la alta frecuencia de Wickerhamomyces anomalus en muestras de piñas (Castro y Umaña 2019). Esta levadura tiene la habilidad de colonizar las frutas y suprimir a otros microorganismos, lo que evidencia su papel como un potencial controlador biológico contra patógenos relacionados con el moho poscosecha de la piña (Aloui et al. 2015, Platania et al. 2012).
Asimismo, el uso de las levaduras Hanseniaspora uvarum, M. guilliermondii y Metschnikowia aff. pulcherrima en mezcla para el combate del moho verde poscosecha en mandarinas demostró un alto control del patógeno P. digitatum tanto in vivo como in vitro (Öztekin y Karbancioglu 2023).
También, las levaduras del género Candida podrían estar relacionadas con la maduración prematura y fermentación de los frutos de la piña, en conjunto con otras levaduras como Saccharomyces sp., y Kloeckera sp. y la bacteria Klebsiella sp. (Korres et al. 2010). También, en frutos y jugos procesados de piña se han identificado Pichia guilliermondii y Hanseniaspora uvarum asociadas al proceso de fermentación (Chanprasartsuk et al. 2010).
El objetivo de este trabajo fue caracterizar las levaduras asociadas al moho del pedúnculo de la piña (Ananas comosus L.) en poscosecha, y evaluar el efecto de diferentes temperaturas sobre el crecimiento de las levaduras durante el almacenamiento, esto con el fin de conocer si las especies identificadas presentan un papel potencial como agente beneficioso o perjudicial, en la calidad poscosecha de la fruta.
Materiales y métodos
Los trabajos se realizaron en el Laboratorio de Tecnología de Poscosecha del Centro de Investigaciones Agronómicas (CIA) de la Universidad de Costa Rica, en el 2019. Se trabajó con 24 aislamientos de levaduras obtenidos en investigaciones previas, del pedúnculo de la piña (MD-2 “Gold extra sweet”) con moho poscosecha. Las levaduras presentaron coloraciones pigmentadas (rosadas o anaranjadas) y no pigmentadas (blancas o cremas), y fueron recolectadas de fincas comerciales de piña, en los cantones de Río Cuarto, Sarapiquí, Pital y San Carlos. Los códigos utilizados no hacen referencia a ninguna especie en especial. La levadura Rhodotorula dairenensis fue identificada molecularmente en investigaciones previas a este trabajo.
Para la valoración macroscópica de los aislamientos, se consideraron los siguientes criterios: el color, la forma (redonda, ovalada, cilíndrica y apiculada), la consistencia (mantecosa, cremosa, mucoide), la textura (lisa o rugosa), la presencia de brillo y el relieve (plano o convexo) de las colonias de las levaduras (Ramírez et al. 2019). La consistencia mucoide se refiere a las levaduras con colonias con mayor viscosidad, la consistencia mantecosa se refiere a las levaduras con colonias grasosas, y la cremosa se refiere a colonias en estado semilíquido denso. Para la caracterización microscópica, se evaluaron mediante observaciones al microscopio la forma de las células de las levaduras (redonda, ovalada, cilíndrica, apiculada).
Para la identificación molecular, se seleccionaron 9 aislamientos representativos del total; para esto se utilizó el criterio de seleccionar las levaduras que morfológicamente presentaron aspectos más diferenciadoras o contrastantes entre sí, como el color, la consistencia, la textura y el relieve presentado por las colonias.
Las levaduras se caracterizaron molecularmente en el Laboratorio de Técnicas Moleculares de la Escuela de Agronomía y de Biotecnología del Centro de Investigaciones Agronómicas (CIA). Para esta caracterización, a las levaduras seleccionadas se les realizó la extracción de ADN mediante el método CTAB descrito por Rogers y Bendich (1988). Posteriormente, la identificación de las especies aisladas se realizó mediante la amplificación por PCR y secuenciación de la región ITS, con los imprimadores ITS-4 (5-TCCTCCGCTTATTGATATGC-3) e ITS-5 (5-GGAAGTAAAAGTCGTAACAAGG-3). El producto de PCR se envió a secuenciar, en ambas direcciones, a la compañía Macrogen en Corea del Sur. Una vez obtenidas las secuencias, se analizaron con el programa Bioedit y se realizó una búsqueda en Blastsearch, en la base de datos del Banco de Genes del National Center for Biotecnology Information (NCBI).
Para evaluar el crecimiento de las levaduras a diferentes temperaturas de almacenamiento, se realizaron rayados de los microorganismos, que se encontraban almacenados a 4°C, y se colocaron a crecer por 72 horas, en placas Petri con medio PDA, a una temperatura de 22°C. Luego de transcurrido el tiempo, se preparó una suspensión en la cámara de transferencia, donde se tomaron discos de 3 mm de levadura, se colocaron en 10 ml de agua estéril destilada y se agitaron por 10 minutos. A cada suspensión se le midió la densidad óptica (DO600) con un espectrofotómetro, y se realizó un conteo de células con un hemocitómetro o Cámara de Neubauer, para conocer la concentración de células de las levaduras.
A partir de esta suspensión madre, se realizaron diluciones hasta 10-6. De la suspensión de 10-6, se colocaron 100 µl en placas Petri previamente preparadas con PDA, y se esparció con un asa de vidrio Drigalski. Las placas se almacenaron en una cámara de enfriamiento, a las temperaturas: 4°C, 8°C, 12°C, 16°C, 20°C, y se evaluó el número de colonias durante 5 días. Para cada ensayo de temperatura, se utilizó un diseño completamente aleatorizado, con arreglo factorial de tratamientos, con 2 factores, las levaduras y los días de evaluación. Cada tratamiento contó con 10 repeticiones.
Para determinar el efecto de los tratamientos, en el ensayo de temperaturas sobre las variables de respuesta (número de colonias de levaduras), se realizó un análisis de varianza (ANOVA) con medidas repetidas en el tiempo bajo la teoría de los modelos lineales mixtos. Se comprobaron los supuestos del ANOVA con gráficos diagnósticos (cuantiles de los términos de error, gráficos de residuos y gráficos de residuos vs. predichos) y se seleccionó el mejor modelo en función de los criterios de Akaike (AIC) y de información Bayesiano (BIC). En las variables con diferencias estadísticas entre los tratamientos, se realizaron las comparaciones de medias por medio de la prueba de Prueba de Di Rienzo, Guzmán y Casanoves (DGC) (p ≤0,05) (Di Rienzo et al. 2002), lo que permitió la formación de grupos excluyentes y sin transición entre tratamientos. Los análisis de los ensayos se realizaron con el programa Infostat versión 2020 (Di Rienzo et al. 2020).
Res y discusión
Las levaduras presentaron 2 coloraciones predominantes, 17 pigmentadas (rosadas o anaranjadas), y 7 no pigmentadas (blancas o crema), por lo que estas 2 tonalidades son las más frecuentes en las zonas de donde proceden los aislamientos (Tabla 1 y Figura 1). En Colombia, se ha reportado que las colonias levaduriformes aisladas de la pulpa de la manzana de agua presentaron diferentes colores, entre estos blancas, salmón, coral, rosado, beige y marrón (Trujillo y Echeverry 2015). En otro estudio similar, las levaduras aisladas de la filosfera de la mora presentaron colonias de tonalidades blancas, cremas y rosadas (Uribe 2007). El predominio de la coloración de las levaduras está relacionado con las condiciones climáticas de la zona, en los climas nublados o con lluvias constantes puede existir una prevalencia de las levaduras no pigmentadas, mientras que en los climas calientes y con alta radiación solar dominan las levaduras pigmentadas (Uribe 2007).
Tabla 1 Características morfológicas de las colonias de las levaduras aisladas del moho del pedúnculo de la piña.
| Aislamiento | Color de colonia | Forma de colonia | Consistencia de colonia | |
| 1 | DM-1B | Crema | Redonda y ovalada | Mantecosa |
| 2 | DM-2B | Crema | Redonda | Mantecosa |
| 3 | DM-3B | Crema | Redonda | Mantecosa |
| 4 | DM-4B | Crema | Redonda | Mantecosa |
| 5 | DM-5B | Crema | Redonda | Mantecosa |
| 6 | NOR-1B | Blanca | Redonda | Cremosa |
| 7 | TRO-1B | Blanca | Redonda | Cremosa |
| 8 | DM-1R | Rosada y anaranjada | Redonda | Mucoide |
| 9 | DM-2R | Anaranjada fuerte | Redonda | Mantecosa |
| 10 | DM-3R | Rosada | Redonda | Mucoide |
| 11 | DM-4R | Rosada y anaranjada | Redonda y ovalada | Mucoide |
| 12 | MC-1R | Rosada y anaranjada | Redonda | Mucoide |
| 13 | MC-2R | Rosada y anaranjada | Redonda | Mucoide |
| 14 | MC-3R | Rosada y anaranjada | Redonda | Mucoide |
| 15 | MC-4R | Rosada | Redonda y ovalada | Mucoide |
| 16 | MC-5R | Rosada | Redonda y ovalada | Mucoide |
| 17 | NOR-1R | Anaranjada fuerte | Redonda | Mucoide |
| 18 | NOR-2R | Anaranjada fuerte | Redonda irregular | Cremosa |
| 19 | TRO-1R | Rosada | Redonda | Mucoide |
| 20 | TRO-2R | Rosada | Redonda | Mucoide |
| 21 | TRO-3R | Rosada y anaranjada | Redonda | Mucoide |
| 22 | TRO-4R | Rosada y anaranjada | Redonda y ovalada | Mucoide |
| 23 | TRO-5R | Rosada | Redonda | Mucoide |
| 24 | Rhodotorula dairenensis | Rosada y anaranjada | Ovalada | Mucoide |
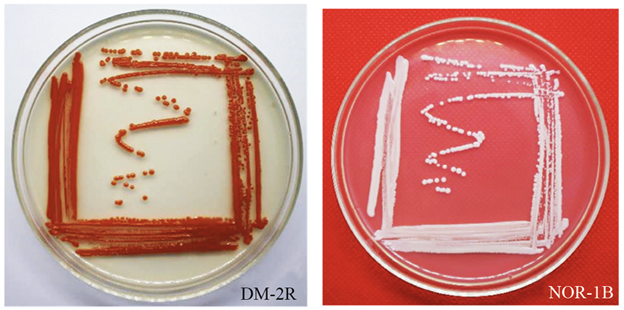
Figura 1 Coloración de las colonias de levaduras aisladas del pedúnculo de la piña. DM-2R: Rhodotorula mucilaginosa. NOR-1B: Meyerozyma guilliermondii.
Las formas de las colonias de ambos grupos fueron redondas y/o ovaladas. La consistencia de las colonias de las levaduras no pigmentadas fue mantecosa o cremosa, y las pigmentadas fueron mucoides. En la mayoría de los casos, solo la DM-2R fue mantecosa, y la NOR-2R cremosa (Tabla 1). El relieve de las levaduras, en la mayoría fue convexo y fue plano solo para las levaduras no pigmentadas NOR-1B, TRO-1B, y para las pigmentadas NOR-1R y NOR-2R. La textura de las colonias en su mayoría fue lisa, solo la NOR-2R presentó una textura rugosa. Las levaduras no pigmentadas no presentaron brillo, mientras que las pigmentadas si, a excepción de la NOR-2R.
La mayoría de las levaduras pigmentadas, de este trabajo, presentaron una consistencia mucoide, de relieve convexo y con presencia de brillo. La coloración pigmentada se relaciona con las levaduras productoras de carotenoides como Rhodotorula mucilaginosa, las cuales se caracterizan por presentar colonias mucoides en tonalidades de salmón y rosa (Guamán y Carvajal 2009). Existen otras especies de levaduras pigmentadas que han sido identificadas con características similares, dentro de los géneros Rhodosporidium y Sporobolomyces, lo que evidencia que existe una variabilidad genética entre las especies que presentan estas variables cualitativas (Guamán y Carvajal 2009).
Las levaduras no pigmentadas presentaron colonias de formas redondas, con consistencia mantecosa o cremosa y la mayoría con relieve convexo. Esto coincide con el estudio de levaduras aisladas de plantas de maíz y geranios, en el cual se encontró que las colonias de color blanco presentaron superficie suave, márgenes regulares y consistencia cremosa, además del olor característico (Buck y Burpee 2002).
En las observaciones microscópicas, se encontraron las formas típicas de las células de las levaduras, las redondas, ovaladas y cilíndricas. Uribe (2007) reportó características similares de las levaduras aisladas de la filosfera de la mora. Esto sugiere, la similitud de las células de las levaduras a nivel microscópico, en otra zona geográfica, como este caso de Colombia.
Es evidente que, para este tipo de microorganismos, la caracterización morfológica no genera la información suficiente para poder identificar las levaduras a nivel de género o especie, por las similitudes fenotípicas que presentan. Por tanto, la identificación molecular es una herramienta valiosa para demostrar la variabilidad genética presente en los aislamientos.
Las levaduras no pigmentadas, se identificaron molecularmente en 3 especies de la división Ascomycota: Candida intermedia, Meyerozyma guilliermondii, y M. caribbica (Tabla 2). En Costa Rica, en un trabajo previo en frutos de piña, provenientes de las zonas de Puntarenas y Sarapiquí, se reportó la levadura C. fukuyamaensis (Castro y Umaña 2019). El género Candida ha sido estudiado por su potencial como controlador biológico en diferentes enfermedades poscosecha, por ejemplo, en el cultivo de la manzana de agua (Trujillo y Echeverry 2015). Además, la levadura C. guilliermondii aislada de frutos de uchuva, ha sido utilizada como una alternativa para retardar la pudrición en el fruto del banano (Buitrago y Escobar 2009).
Tabla 2 Identificación molecular de las levaduras aisladas del moho del pedúnculo de la piña.
| Aislamiento | Especie | Primers | 16 S (F63/LR3) | |
| 1 | DM-3B | Candida intermedia | ITS1-ITS4 EXT | Candida intermedia |
| 2 | NOR-1B | Meyerozyma guilliermondii | ITS4-ITS5 | Meyerozyma guilliermondii |
| 3 | TRO-1B | Meyerozyma caribbica | ITS4-ITS5 | Meyerozyma caribbica |
| 4 | DM-2R | Rhodotorula pacifica | ITS1-ITS4 EXT | Rhodotorula mucilaginosa |
| Rhodotorula mucilaginosa | ||||
| 5 | MC-1R | Rhodotorula toruloides | ITS4-ITS5 | Rhodotorula toruloides |
| 6 | MC-2R | Rhodotorula diobovata | ITS4-ITS5 | Rhodotorula diobovata |
| 7 | NOR-1R | Sporobolomyces sp. | ITS4-ITS5 | Sporidiobolus pararoseus |
| Sporobolomyces carnicolor | ||||
| 8 | NOR-2R | Sporobolomyces sp. | ITS4-ITS5 | Sporobolomyces carnicolor |
| Sporobolomyces carnicolor | ||||
| 9 | TRO-4R | Rhodotorula toruloides | ITS4-ITS5 | Rhodotorula toruloides |
También, se ha estudiado la actividad antagónica de las levaduras C. inconspicua y Pichia kluyveri, para el control de Alternaria alternata en pitahaya amarilla, y la levadura C. inconspicua mostró mejor efectividad que P. kluyveri. Además, se utilizaron contra Colletotrichum musae en banano orgánico.
P. kluyveri demostró una mejor eficacia en reducir la antracnosis que C. inconspicua (Vilaplana et al. 2020).
Las especies M. guilliermondii y M. caribbica son ascomicetes muy relacionadas entre sí, que han sido estudiadas por sus atributos biotecnológicos asociados (Romi et al. 2014), así como ser microorganismos con potencial para el control biológico (Bautista et al. 2013). La especie M. caribbica ha sido exitosa para el control de antracnosis en mango, papaya y aguacate, por medio de la técnica de microencapsulados de microorganismos (Aguirre et al. 2022, González et al. 2021).
Asimismo, el uso de la aplicación de mezclas de microorganismos ha generado resultados positivos en el control de enfermedades por la sinergia que se deriva, por medio de la combinación de mecanismos presentes como la actividad antifúngica a través de compuestos orgánicos volátiles, la formación de biopelículas, la inducción de resistencia, competencia por espacio, entre otros (Öztekin y Karbancioglu 2023, Spadaro y Droby 2016).
Las levaduras pigmentadas, se identificaron molecularmente en 5 especies de la división Basidiomycota: R. mucilaginosa, R, toruloides, R. diodovata, S, carnicolor y S. pararoseus (Tabla 2). Estas levaduras se caracterizan por producir pigmentos carotenoides de colores rosados, que le confieren protección contra los efectos perjudiciales de la radiación UV (Guamán y Carvajal 2009, Moliné et al. 2010, Wirth y Goldani 2012). Los pigmentos son producidos, principalmente, durante la fase estacionaria de la curva de crecimiento, momento en que se sintetizan sustancias como metabolitos secundarios volátiles, compuestos aromáticos y quinonas, que pueden tener un efecto antibiótico (Dastager et al. 2006).
Rhodotorula ha sido reportada como una levadura biocontroladora de P. digitatum en frutos de naranjas (Ahima et al. 2019), como antagonista de B. cinerea (González et al. 2019), de igual forma, ha sido utilizada para controlar el moho gris en fresas, causado por Rhizopus (Zhang et al. 2014).
El género Sporobolomyces se caracteriza por ser polifilético, y los miembros presentan la capacidad de crecer en condiciones aeróbicas y microaerofílicas, además de ser tolerantes a la congelación y descongelación, y menos tolerantes a las temperaturas elevadas y a la desecación (Cobban et al. 2016). La especie S. pararoseus, se ha estudiado por su capacidad en la producción de carotenoides, durante la fermentación, en la cual, se mostró que la concentración máxima de carotenoides totales se alcanzó después de 102 horas (Serrão et al. 2011). Esta especie, se evaluó por su eficacia en el control del moho azul poscosecha en manzanas, causada por P. expansum, y se encontró que la incidencia de la enfermedad fue menor en las frutas tratadas con la levadura, en comparación con el tratamiento control. Además, en pruebas in vitro, la germinación de las esporas y la longitud del tubo germinal de P. expansum fueron inhibidas por esta levadura (Zhao et al. 2018).
En la caracterización de levaduras carotenogénicas de varias zonas de Ecuador, se identificó molecularmente a las especies R. toruloides, R. diobovata y S. carnicolor (Guamán y Carvajal 2009). En frutos de manzana de agua, se identificaron 20 levaduras que correspondieron a 6 géneros: Rhodotorula spp.; Hanseniaspora spp.; Brettanomyces spp.; Candida spp.; Kloekera spp.; Torulopsis spp (Trujillo y Echeverry 2015). Ante estos reportes, se denota que existe una diversidad de especies que coinciden con las de esta investigación, lo que sugiere que existe una gran variedad de levaduras desarrollándose tanto en la superficie de las plantas, de las frutas, y están presentes en diferentes especies de plantas.
En el ensayo de temperaturas, para la temperatura de 20°C, el análisis de varianza presentó diferencias significativas, para el número de colonias, entre la interacción de las levaduras y el día de evaluación (p<0,0001). Las levaduras a 20°C crecieron a los 2 días del establecimiento del ensayo (Figuras 2 y 3). Resultados similares encontró Uribe (2007), en la cual se midió el crecimiento de las levaduras a varias temperaturas (5°C, 10°C, 25°C, 30°C, 35°C, 37°C, 40°C, 42°C y 45°C), y se determinó que el mejor rango de crecimiento fue entre 25°C a 37°C, para la mayoría de las levaduras (Uribe 2007). Además, se presentó una relación directamente proporcional entre el crecimiento y la temperatura, hasta los 35°C, luego se observó una disminución del crecimiento en la mayoría de las levaduras (Uribe 2007).
Guamán y Carvajal (2009) reportó que para diferentes especies de levaduras, la temperatura que resultó más favorable para su crecimiento fue 20°C, con respecto a 30°C y 37°C. En la pulpa de la manzana de agua, se determinó que los aislamientos presentaron un mejor desarrollo a la temperatura ambiente entre 24°C a 27°C (Trujillo y Echeverry 2015).
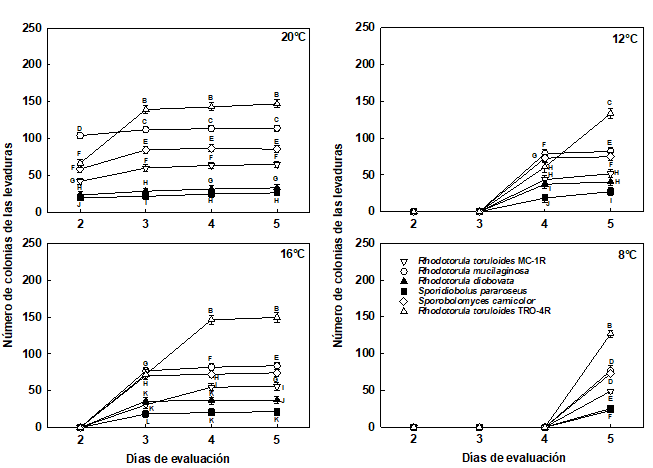
Figura 2 Número de las colonias de las levaduras pigmentadas almacenadas en cámara de refrigeración a 20°C, 16°C, 12°C y 8°C, durante 5 días.
Las barras corresponden al error estándar.
Medias con una letra común no son significativamente diferentes, de acuerdo con la prueba DGC (p>0,05).
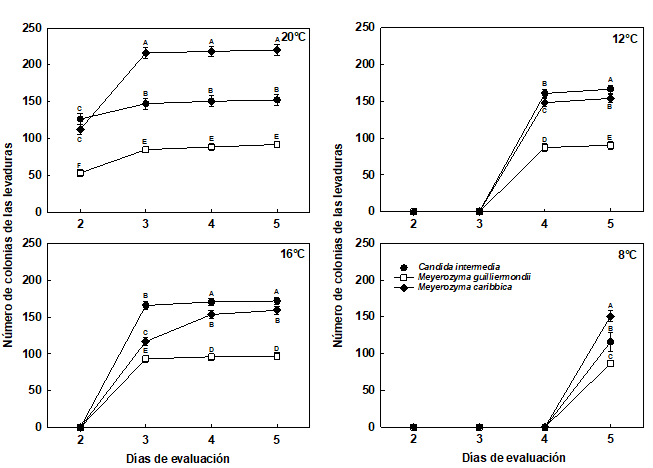
Figura 3 Número de las colonias de las levaduras no pigmentadas almacenadas en cámara de refrigeración a 20°C, 16°C, 12°C y 8°C, durante 5 días.
Las barras corresponden al error estándar.
Medias con una letra común no son significativamente diferentes, de acuerdo con la prueba DGC (p>0,05).
Para los 20°C, las levaduras que presentaron mayor número de colonias fueron las no pigmentas M. caribbica, C. intermedia y la pigmentada R. toruloides (TRO-4R), estas 2 últimas sin presentar diferencias significativas entre sí, a los 5 días de evaluación (Figuras 2 y 3). Las levaduras pigmentadas S. pararoseus, R. diobovata y R. toruloides (MC-1R) presentaron el menor número de colonias, respectivamente, estas 2 últimas sin presentar diferencias significativas entre sí, a los 5 días de evaluación (Figura 2).
Para la temperatura de 16°C, el análisis de varianza presentó diferencias significativas para el número de colonias, entre la interacción de las levaduras y el día de evaluación (p<0,0001). Las levaduras almacenadas a 16°C empezaron a crecer a los 3 días del establecimiento del ensayo (Figuras 2 y 3).
Las levaduras que presentaron mayor número de colonias fueron no pigmentadas C.intermedia, M. caribbica y pigmentada R. toruloides (TRO-4R), estas 2 últimas sin presentar diferencias significativas entre sí, a los 5 días de evaluación. Las de menor número de colonias fueron las pigmentadas S. pararoseus, R. diobovata y R. toruloides (MC-1R), respectivamente, todas presentaron diferencias significativas, en la evaluación del día 5 (p<0,0001) (Figura 2).
Para la temperatura de 12°C, el análisis de varianza presentó diferencias significativas, para el número de colonias, entre la interacción de las levaduras y los 4 y 5 días de evaluación (p<0,0001). Las levaduras almacenadas a 12°C empezaron a crecer a los 4 días del establecimiento del ensayo (Figuras 2 y 3).
Las levaduras que presentaron mayor número de colonias fueron C. intermedia, M. caribbica y R. toruloides (TRO-4R), respectivamente, todas presentaron diferencias significativas (p<0,0001) entre sí, a los 5 días de evaluación. Las levaduras que presentaron menor número de colonias fueron S. pararoseus, R. diobovata y R. toruloides (MC-1R), respectivamente, todas presentaron diferencias significativas entre sí, al día 5 de evaluación (Figura 2).
Para la temperatura de 8°C, el análisis de varianza presentó diferencias significativas para el número de colonias, entre las levaduras solamente, ya que, las levaduras empezaron a crecer a los 5 días del establecimiento del ensayo (Figuras 2 y 3). Los resultados mostraron que las levaduras almacenadas a 8°C fueron capaces de desarrollar colonias, a partir del día 4 de iniciado el experimento.
A 8°C, las levaduras con mayor cantidad de colonias fueron la M. caribbica, R. toruloides (TRO-4R) y C. intermedia, estas 2 últimas no presentaron diferencias significativas entre sí, en el día 5 de evaluación. Las levaduras que presentaron el menor número de colonias fueron R. diobovata, S. pararoseus y R. toruloides (MC-1R), respectivamente, respectivamente, estas 2 últimas no presentaron diferencias significativas entre sí, al día 5 de evaluación.
Los microorganismos son capaces de resistir los periodos de almacenamiento en frío a los que se somete a las piñas, en su etapa poscosecha. A temperaturas bajas, los microorganismos reducen su metabolismo, y esto retrasa los procesos de infección (Rivera 2018), no obstante, luego al ser sometidos a temperaturas más cálidas los microorganismos activan su crecimiento, y pueden generar lesiones visibles en los frutos.
Las levaduras almacenadas a 4°C no presentaron crecimiento durante los 5 días de almacenamiento. Durante el almacenamiento, se observó que, por cada 4°C de disminución en la temperatura desde los 20°C hasta los 4°C, las colonias de levaduras se mostraron visibles un día más tarde. Las bajas temperaturas afectan el crecimiento de los microorganismos, y este tiende a disminuir y ser más lento, ya que las células pueden experimentar periodos de latencia, y presentar afectaciones en el metabolismo microbiano, ya que la actividad de las enzimas involucradas en el metabolismo celular se encuentra entre 10°C y 50°C (Redón et al. 2011).
En el caso de la piña, durante el transporte y la distribución la fruta fue expuesta a temperaturas entre 7°C y 18°C, incluso en algunos casos puede ser sometida a temperaturas ambientales mayores. Estas condiciones que soporta la piña afectan también a los microorganismos presentes en la fruta, ya que el crecimiento de las levaduras a partir de temperaturas relativamente bajas, resulta negativo desde la perspectiva de la calidad de la piña, ya que si favorece el desarrollo de especies pigmentadas, aunque estas han sido catalogadas como controladores biológicos, afectan la apariencia del pedúnculo de la fruta, debido a las intensas coloraciones. Por otra parte, este efecto podría resultar positivo, en el caso de considerar para estudios a las especies no pigmentadas como C. intermedia, M. caribbica y M. guilliermondii, identificadas molecularmente en este trabajo, a las cuales se les atribuye un gran potencial como biocontroladores para el control de patógenos en enfermedades poscosecha.















