Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agronomía Costarricense
Print version ISSN 0377-9424
Agron. Costarricense vol.34 n.2 San Pedro de Montes de Oca Dec. 2010
Nota técnica
Efecto del ácido indolbutírico y tipo de estaquilla en el enraizamiento de Sacha Inchi (Plukenetia volubilis L.)
Henry Ruiz-Solsol*, Francisco Mesén1/**
1 Correo electrónico: fmesen@catie.ac.cr
* Instituto de Investigaciones de la Amazonía Peruana, San Martín, Perú.
** Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Turrialba, Costa Rica.
Dirección para correspondencia
Resumen
Plukenetia volubilis, conocida como sacha inchi (maní del Inca) es una planta trepadora, semileñosa y perenne, nativa de la Amazonía Peruana. Sus semillas son ricas en proteínas y aceite de alta calidad, importantes en alimentación humana, y aplicaciones en salud, cosmética y medicina. La ausencia de métodos confiables de propagación asexual ha limitado su plantación y uso a nivel industrial. El objetivo del estudio fue evaluar el efecto de 4 dosis de ácido indolbutírico (0,00; 0,10; 0,15 y 0,20%) y 3 tipos de estaquilla (basal, intermedia y apical) sobre el enraizamiento de sacha inchi, mediante cámaras de subirrigación. Se realizó en el vivero del Instituto de Investigaciones de la Amazonía Peruana (IIAP) en San Martín, Perú, a través de un diseño completamente al azar (DCA) con arreglo factorial 4 x 3, con 3 repeticiones y 9 estaquillas por unidad experimental. Al término de 30 días las estaquillas intermedias y basales mostraron mayor enraizamiento (78,70 y 77,78%), número de raíces (19,21 y 15,75) y longitud de raíz mayor (4,07 y 4,24 cm). Fue necesaria la aplicación de AIB para lograr un buen enraizamiento en estaquillasde esta especie. Al aplicar dosis de AIB a 0,15 y 0,20% se obtuvo el mayor porcentaje de enraizamiento (92,59 y 87,65%), número de raíces (25,94 y 20,05) y longitud de raíz mayor (4,25 y 4,57 cm). Se concluye que es posible propagar sacha inchi por estaquillas (más de 80% de enraizamiento) si se aplica la dosis adecuada de AIB a estaquillas intermedias y basales.
Palabras clave: Plukenetia volubilis, sacha inchi, propagación vegetativa, enraizamiento.
Abstract
Effect of 4 doses of Indole butyric acid and types of cutting on the rooting of sacha inchi (Plukenetia volubilis L.). Plukenetia volubilis, known as sacha inchi (Inca’s peanuts) is a climbing, perennial plant native to the Peruvian Amazon. Its seeds are rich in protein and high quality oil, important in human nutrition and applications in health, cosmetics and medicine. The lack of reliable methods for clonal propagation has limited the establishment of plantations and its use at industrial level. The objective of this study was to evaluate the effect of four doses of indole butyric acid (0.00; 0.10; 0.15 and 0.20%) and three types of cutting (basal, middle and apical) on the rooting of juvenile cuttings of sacha inchi using non-mist propagators. The trial was conducted in the nursery of the Peruvian Amazonian Research Institute (IIAP) in San Martin, Peru, using a completely randomized design (DCA) with 4 x 3 factorial arrangement with 3 replications and 9 cuttings per experimental unit. After 30 days, intermediate and basal cuttings rooting showed higher rooting (78.70 and 77.78%), root number (19.21 and 15.75) and major root length (4.07 and 4.24 cm). AIB application was essential to stimulate rooting in this species. The highest rooting percentage (92.59 and 87.65%), root number (25.94 and 20.05) and major root length (4.25 and 4.57 cm) were obtained when IBA at 0.15 and 0.20% was applied. We conclude that it is possible to propagate sacha inchi over (80% rooting) by cuttings if intermediate and basal cuttings are treated with 0.15-0.2% IBA.
Keywords: Plukenetia volubilis, sacha inchi, vegetative propagation, rooting.
Introducción
El sacha inchi o maní del inca, es una planta dioica, trepadora, semileñosa y perenne, de abundantes hojas y ramas que puede alcanzar alturas variables, aunque normalmente alcanza alturas menores de 2 m. Los frutos son cápsulas de 3 a 5 cm de diámetro, dehiscentes, de color verde que se tornan color marrón negruzco cuando maduran. Es una planta de la amazonía peruana conocida por los nativos desde hace miles de años; sin embargo la primera mención científica del sacha inchi fue hecha en 1980 como consecuencia de los análisis de contenido graso y proteico realizados por la Universidad de Cornell en Estados Unidos, que demostraron que las semillas del sacha inchi tienen un 33% de proteínas y aceite, que en promedio representa un 49% ya que puede llegar hasta 54% en algunas variedades seleccionadas. De todas las fuentes naturales conocidas, el aceite de sacha inchi tiene el mayor contenido de Omega 3, en comparación a los aceites de todas las semillas oleaginosas utilizadas en el mundo, el más rico en ácidos grasos insaturados, el de mayor contenido de polinsaturados, y el más bajo contenido de ácidos grasos saturados. Esto lo convierte en un producto de altísima calidad para la alimentación humana y con diversas aplicaciones en salud, cosmética y medicina (Manco 2006).
A pesar de la importancia de la especie, el aprovechamiento comercial es aún incipiente debido a la alta variabilidad genética, que determina una alta heterogeneidad en el rendimiento y contenido de Omega 3, lo que vuelve insostenible la producción.
Actualmente se emplea el método de propagación por semilla botánica que aprovecha sólo la porción aditiva de la varianza genética. Sin embargo este no es el más indicado para la propagación de plantas madres por estar en función de la recombinación genética, que genera una población heterogénea en la descendencia. Según Cachique (2006) la planta es de polinización cruzada.
Por su parte, la propagación vegetativa, permite mantener el genotipo intacto y asegurar la conservación de germoplasma valioso, además de multiplicar genotipos superiores y aumentar la ganancia genética en periodos muy cortos al utilizar tanto los componentes aditivos como los no aditivos de la varianza genética total (Zobel y Talbert 1988).
El éxito de enraizamiento de estaquillas depende de gran cantidad de factores, relacionados con la minimización del déficit hídrico en las estaquillas, la optimización de la fotosíntesis durante el proceso de propagación, así como la utilización de sustratos adecuados y reguladores de crecimiento que favorezcan la iniciación y desarrollo de las raíces (Loach 1988, Leakey et al. 1990, Mesén 1993). El aumento en la capacidad de enraizamiento de estaquillas tratadas con auxina se atribuye a los efectos positivos de estas sobre la división celular, unido al reconocido efecto de las auxinas de promover el transporte de carbohidratos y cofactores foliares hacia las regiones tratadas con auxinas (Phillips 1975). Otro efecto de las auxinas sobre la formación de raíces radica en su capacidad de estimular la síntesis de ADN, lo cual resulta en una mayor división celular (Gaspar y Hofinger 1988).
Al considerar la importancia nutricional y comercial de sacha inchi y el hecho que aun no se ha definido un método adecuado de propagación por estaquilla, se realizó la presente investigación con el objetivo de evaluar la influencia de 4 dosis de ácido indol-3-butírico y 3 tipos de estaquillas sobre el enraizamiento de esta especie, con el uso de cámaras de subirrigación.
Materiales y Métodos
El presente trabajo se realizó en el vivero del Instituto de Investigaciones de la Amazonía Peruana (IIAP), San Martín, Perú, el cual se encuentra a una altitud de 332 msnm; registra una temperatura y una precipitación promedio mensual de 22,5°C y 69,9 mm, respectivamente y una humedad relativa promedio mensual de 70,3% (SENAMHI 2008). El material vegetativo se obtuvo de una única planta, perteneciente a una colección de plantas madres superiores con características fenotípicas de alto rendimiento en grano seco, alto contenido de aceite y tolerancia al complejo nemátodo-hongo, localizadas en el Centro de Investigaciones “Pucayacu” del IIAP.
Las estaquillas fueron colectadas de brotes vigorosos de 30 a 50 cm de longitud en horas tempranas del día entre 5:30 am y 7:30 am con tijeras de podar desinfectadas con alcohol a 96% y trasladadas al área de propagación en cajas térmicas con cubos de hielo en el fondo seguidos por capas alternas de papel húmedo y brotes en condiciones entre 14-16°C para así evitar su deshidratación. Las estaquillas se procesaron en un solo día en un módulo bajo sombra y se prepararon con un corte oblicuo justo arriba de un nudo. De cada brote individual se obtuvieron los 3 tipos de estaquilla: apicales (2,4 mm diámetro y 8,0 cm de longitud) y las hojas completas ya que éstas son pequeñas: intermedias entre 3,9 mm diámetro y 8,0 cm de longitud y basales entre 4,2 mm diámetro y 8,0 cm de longitud; en estas 2 últimas se hizo poda de las hojas al 50% para dejar una superficie foliar aproximada de 50 cm2, similar a la de las estaquillas apicales.
Las estaquillas fueron tratadas con 1 de 4 dosis de ácido indol-3-butírico (AIB): 0; 0,10; 0,15 y 0,20%. Las soluciones hormonales se prepararon con la disolución precisa de AIB químicamente puro, en alcohol a 96%, para obtener la concentración deseada. El AIB fue aplicado a la base de las estaquillas en 10 μl de solución a través de una micropipeta, para asegurar que todas las estacas recibieran igual cantidad. Las estaquillas sin tratamiento hormonal recibieron una cantidad similar de alcohol únicamente. Inmediatamente después de la aplicación, se procedió a evaporar el alcohol, sometiendo la base de las estaquillas a una corriente de aire frío durante un minuto. Las estaquillas se colocaron en el medio respectivo dentro del propagador en hoyos de 2 cm de profundidad y una ligera presión al sustrato alrededor de la estaca a un espaciamiento entre estacas de 10 x 10 cm.
Para el enraizamiento se utilizaron cámaras de subirrigación basadas en el diseño de Howland (Leakey et al. 1990, Mesén 1993, Mesén et al. 1996); su estructura es básicamente un cajón de madera forrado con plástico transparente grueso, con una tapa también forrada con plástico; la base de la cámara se rellena de piedras grandes, medianas y grava sobre las cuales se coloca una capa de 5 cm de arena como sustrato de enraizamiento. Posteriormente se agrega agua hasta la base del sustrato, de manera que una vez cerrado el propagador, se crea un ambiente interior de alta humedad relativa, además de que el sustrato se humedece por efecto capilar. Todos los materiales utilizados para formar la cama de enraizamiento fueron previamente lavados y luego desinfectados con hipoclorito de sodio al 5,25%. Para proteger los propagadores de la luz directa del sol, se colocó sobre ellos una malla de 80% de sombra a 2 m del suelo. Las condiciones ambientales dentro de los propagadores fueron monitoreados con los equipos digitales: luxómetro, termohigrómetro y geotermómetro.
Se utilizó un diseño completamente al azar con arreglo factorial 4x3 (4 dosis de AIB x 3 tipos de estaca), con 3 repeticiones y 9 estaquillas por unidad experimental, que generó 27 estaquillas para obtener el promedio de cada combinación de tratamientos.
Se realizaron inspecciones cada 2 días para detectar y corregir problemas patológicos, eliminar hojas caídas o estaquillas con síntomas de necrosis que pudieran ser foco de infección, así como para observar y mantener el nivel de la tabla de agua y evaluar el avance en el proceso de enraizamiento. Siempre que se abrió la tapa del propagador para inspecciones, se rociaron con agua limpia las hojas de las estacas ayudándolas a mantenerse turgentes para favorecer el proceso de enraizamiento. Se realizó una evaluación final a los 20 días, para determinar mortalidad, número de raíces por estaquilla; longitud de la raíz más larga, medida con regla común en cm; número de estaquillas con nuevos rebrotes y número de estaquillas sin hojas; estos 2 últimos fueron transformados a porcentaje de estaquillas brotadas y porcentaje de estaquillas defoliadas por tratamiento. A partir de los datos de número de raíces por estaquilla se obtuvo el porcentaje de estaquillas enraizadas por tratamiento.
Los datos fueron analizados mediante el análisis de varianza y sometidos a la prueba de Tukey (p<0,05) para determinar la naturaleza de las diferencias entre tratamientos. Previo al análisis, los datos de porcentaje fueron transformados mediante la fórmula arcsen
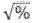 y los datos de conteo transformados a
y los datos de conteo transformados a 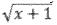 (Snedecor y Cochran 1980).
(Snedecor y Cochran 1980). En la primera semana de haber instalado el experimento al interior del ambiente de propagación, se registró un rango de humedad relativa de 66,20 a 89,14%; el promedio de la radiación solar fue de 75,09 lux y el promedio de la temperatura del aire fue de 27,12°C y la temperatura del sustrato de 28,21°C.
Resultados y Discusión
Ambiente de propagación
Leakey y Mesén (1991) indican que las temperaturas bajas son importantes por 2 razones: i) las tasas de evaporación son menores, y ii) la capacidad de retención de agua del aire (humedad) es dependiente de la temperatura, por lo cual las temperaturas bajas ayudan a evitar el estrés hídrico al mantener la humedad relativa alta. Experiencias con otras especies tropicales evidencian que la temperatura óptima del aire que favorece el enraizamiento es de 20 a 25ºC, aunque temperaturas hasta 30ºC son aceptables siempre y cuando se mantenga una humedad relativa cercana a 95%. Estas cifras están dentro de los rangos obtenidos en el presente ensayo, lo cual claramente contribuyó a los altos porcentajes de éxito obtenidos, como se discute más adelante.
Efectos de la dosis de AIB
El análisis de varianza (Cuadro 1) para dosis de AIB mostró diferencias altamente significativas para el porcentaje de enraizamiento, número de raíces y porcentaje de brotación; diferencias significativas para longitud de raíz mayor y ausencia de diferencias para el porcentaje de defoliación y mortalidad.
La prueba de Tukey (Cuadro 2) mostró que el mayor porcentaje de enraizamiento se obtuvo con la dosis de 0,15% de AIB (92,6%), aunque no difirió significativamente de las dosis de 0,20% y 0,10% (porcentajes de enraizamiento de 87,7% y 80,3%, respectivamente). Estos 3 tratamientos sí fueron estadísticamente superiores al tratamiento testigo, que mostró un porcentaje de enraizamiento de tan solo 45,7%. Este patrón de respuesta ha sido encontrado en gran cantidad de otras especies (Blazich 1988, Hartmann y Kester 1996, Mesén 1993), donde normalmente se da un aumento en la capacidad de enraizamiento al aumentar la dosis de auxina hasta alcanzar un óptimo, a partir del cual cualquier aumento en dosis de auxina resulta por el contrario en una disminución en el enraizamiento debido a los efectos tóxicos de la sobredosis. Como se ha indicado, los efectos positivos de las auxinas en el enraizamiento han sido asociados a sus efectos sobre la división celular, el aumento de transporte de carbohidratos y otros cofactores foliares a los sitios de aplicación, así como a la estimulación en la síntesis de ADN en las células tratadas.
El número promedio de raíces por estaquilla mostró la típica tendencia creciente al aumentar la dosis de AIB, como se ha observado en muchas otras especies tropicales (Mesén 1993, Mesén et al. 1996). El número de raíces producido por las estaquillas es altamente influenciado por la habilidad de la estaca a suplir carbohidratos, ya sea de reserva o producido mediante fotosíntesis, al área donde surgen las raíces (Lovell y White 1986, Moe y Andersen 1988, Veierskov y Andersen 1982). Por lo tanto, una vez que la estaquilla enraiza, las dosis crecientes de AIB, mediante sus reconocidos efectos sobre la división celular y el transporte de sustancias hacia la base de la estaquilla, permiten el desarrollo de un mayor número de raíces, como se presentó en el presente estudio.
Para longitud de raíz, la dosis 0,20% fue el que mejor efecto causó en la longitud con 4,57 cm en promedio de las dosis de AIB estudiadas, ya que superó estadísticamente al tratamiento sin aplicación de AIB la cual presentó menor longitud de raíz con 2,99 cm tal vez simplemente porque enraizó antes que el testigo.
En cuanto a brotación, no hubo diferencias estadísticas entre los tratamientos con aplicación de AIB, pero sí entre estos y el testigo. Al no aplicar auxinas en sacha inchi, el brote empezó a desarrollarse en la estaquilla antes que las raíces, un comportamiento que también ha sido observado en varias otras especies (Mesén 1993), y esto crea un punto de atracción de asimilados hacia los brotes en competencia con la base de la estaquilla, lo que reduce así la capacidad de esta para emitir raíces.
Asimismo la mayor caída foliar en sacha inchi correspondió a estaquillas que no fueron tratados con AIB. Dicho comportamiento se puede atribuir a que ante ausencia de raíces, las estaquillas no recuperaron el balance hídrico, ya que presentaron estrés hídrico y finalmente la caída foliar. Las hojas presentes en las estaquillas han sido correlacionadas con la producción de promotores auxínicos, auxinas sinergistas (cofactores) que son transportadas a la zona de enraizamiento en la base de la estaquilla, importantes para el enraizamiento (Wilson 1994). A su vez, las hojas permiten la producción de carbohidratos derivados de la fotosíntesis (Kamaluddin y Alli 1996, Hartmann y Kester 1996), los cuales funcionan como fuente de energía para el proceso rizogénico (Haissig 1986, Gutiérrez 1997). Por lo tanto, la caída de las hojas en estaquillas sin aplicación de AIB contribuyó aun más a reducir la capacidad de estas para formar raíces.
Efectos del tipo de estaquilla
El análisis de varianza (Cuadro 1) para tipo de estaquilla mostró diferencias altamente significativas en cuanto a número de raíces, porcentaje de brotación y mortalidad; diferencias significativas en porcentaje de defoliación y ausencia de diferencias para el porcentaje de enraizamiento y longitud de raíz mayor.
La prueba de Tukey (Cuadro 3) no encontró diferencias significativas entre tipos de estaquilla para el porcentaje de enraizamiento ni longitud de raíces, pero mostró la superioridad de las estaquillas intermedias y basales en cuanto a número de raíces y emisión de rebrotes. Igualmente, estos mismos tipos de estaquilla mostraron una tasa de mortalidad significativamente menor que las estaquillas apicales. Este comportamiento se ajusta a un modelo típico de enraizamiento en estaquillas suculentas, el cual supone al menos 2 fases en el proceso de enraizamiento: iniciación y crecimiento, y al parecer, los requerimientos asociados con la fase de iniciación no son los mismos que los asociados con el crecimiento de las raíces (Lovell y White 1986). Al parecer, la iniciación de primordios radiculares es controlada hormonalmente (Moe y Andersen 1988), y no se ve influenciada grandemente por excesos o deficiencias de nutrientes minerales (Haissig 1989). Los resultados sugieren que en esta especie no existen grandes diferencias en cuanto a concentración endógena de auxinas a lo largo de los primeros 25 cm del brote como para afectar diferencialmente la capacidad de iniciación de raíces entre los 3 tipos de estaquilla evaluados, o bien, las posibles diferencias hormonales fueron eliminadas por la aplicación exógena de AIB. Sin embargo, el número de raíces emitidas y la capacidad de reiniciación del crecimiento de la parte aérea sí son influenciados por la cantidad de reservas presentes en la estaquilla y la cantidad de asimilados producidos por las hojas. Veierskov (1988), por ejemplo, describe una relación positiva del contenido de carbohidratos con la capacidad de enraizado y el número de raíces formadas en estacas de diferentes especies leñosas y herbáceas, y agrega que es común que exista un gradiente en la concentración de carbohidratos desde el ápice hasta la base de los tallos. A su vez, Hartmann y Kester (1996) señalan que las estacas más gruesas provenientes de la porción basal de las ramas, acumulan un mayor contenido de carbohidratos de reserva y posiblemente bajo la influencia de sustancias promotoras del enraizamiento, presenten una mayor probabilidad de inducir raíces. Este patrón se ajusta y posiblemente explica los resultados obtenidos en el presente estudio.
Los resultados de defoliación son interesantes, la cual fue estadísticamente inferior en estaquillas apicales. Además de las lógicas diferencias en edad de las hojas y grado de incidencia de luz a lo largo de un brote, existe otra serie de gradientes en contenido de agua, vigor, reservas, y otros, que afectan diferencialmente a las hojas y son las responsables de las diferencias en cuanto a retención de la lámina foliar. En este caso, al parecer, la mayor edad de las hojas más viejas de las estaquillas intermedias y basales, y posiblemente una combinación de todos los demás factores mencionados, redujo su capacidad de permanencia en la estaquilla. Aún así, las estaquillas intermedias y basales retuvieron la hoja lo suficiente para afectar positivamente el enraizamiento de estas estaquillas, como fue discutido anteriormente.
Las estaquillas apicales, por su parte, presentaron el mayor porcentaje de mortalidad frente a las demás. Este comportamiento ha sido encontrado en muchas otras especies (Mesén 1993), debido a la mayor suculencia de este tipo de estaquillas y por lo tanto, una mayor propensión a la marchitez.
Interacción AIB con tipo de estaquilla
La interacción dosis de AIB por tipo de estaquilla no mostró diferencias significativas en cuanto a capacidad de enraizamiento ni mortalidad, pero sí para el porcentaje de brotación y defoliación (Cuadro 1). Esto indica que el patrón de respuesta en enraizamiento y número de raíces a las dosis de AIB se mantuvo constante para los diferentes tipos de estaquilla. Los resultados combinados en general reforzaron el efecto positivo del aumento en dosis de AIB sobre la capacidad de enraizamiento y calidad del sistema radicular de las estaquillas, así como el mejor comportamiento de las estaquillas intermedias y basales, en particular las primeras (Cuadros 2 y 3).
Con respecto al efecto del origen de la estaquilla, esta especie se ajustó a un patrón de comportamiento que sugiere que aun pequeños aumentos en la cantidad de reservas, indicado por el aumento en diámetro de las estaquillas en dirección basípeta en el tallo, fueron importantes en el enraizamiento. Es importante indicar, sin embargo, que en las especies que muestran este patrón, el gradiente de aumento se mantiene hasta cierto límite, cuando otros factores tales como la excesiva lignificación del tallo o envejecimiento y reducción en la capacidad fotosintética de la lámina foliar, pueden por el contrario afectar negativamente el enraizamiento (Hartmann y Kester 1996, Leakey 1983, Mesén 1993).
Conclusiones y Recomendaciones
La propagación vegetativa de sacha inchi resultó relativamente sencilla y exitosa, con estaquillas intermedias o basales de 8 cm de longitud, con áreas foliares de 50 cm2 y tratadas con ácido indolbutírico (AIB) en dosis de 0,15% o 0,20%.
Las estaquillas de esta especie fueron capaces de enraizar sin aplicación de AIB, pero los porcentajes de enraizamiento, el número de raíces por estaquilla y la longitud de raíces fueron pobres y significativamente inferiores a los de las estaquillas tratadas.
Fue necesaria la utilización de sombra para reducir la irradiación y en consecuencia, las temperaturas aéreas y del sustrato dentro de los propagadores, así como para mantener la humedad relativa interna tan alta como sea posible.
El uso de cámaras de subirrigación contribuyó al enraizamiento de estaquillas juveniles de Plukenetia volubilis, ya que las condiciones de humedad relativa, irradiación solar y temperatura en el interior, permitieron el mantenimiento de la turgencia en las hojas, obteniéndose un enraizamiento que en los mejores tratamientos alcanzó el 100%.
Agradecimiento
Al Ing. Danter Cachique, al Ing. M. Sc. Manuel Soudre (IIAP, Perú) y al Ing. Jaime Chávez (Universidad Nacional Agraria de la Selva-Perú), por sus orientaciones durante el desarrollo del trabajo y posteriores revisiones al presente documento. Al Dr. Dennis del Castillo (PROBOSQUE, Perú) y al Ing. M. Sc. Guillermo Vásquez (IIAP, Perú), por las facilidades físicas y financieras proporcionadas.
Literatura citada
Blazich F.A. 1988. Chemicals and formulations used to promote adventitious rooting, pp. 132-149. In: T.D. Davis, B.E. Haissig and N. Sankhla (eds). Adventitious Root Formation in Cuttings. B.E. Dioscorides Press, EE. UU. [ Links ]
Cachique D. 2006. Estudio de la biología floral y reproductiva en el cultivo de sacha inchi Plukenetia volubilis L. Tesis de ingeniero Agrónomo, Universidad Nacional de San Martín, Tarapoto,Perú. 70 p. [ Links ]
Gaspar T., Hofinger M. 1988. Auxin metabolism during adventitious rooting, pp. 117-131. In: T.D. Davis, B.E. Haissig and N. Sankhla (eds). Adventitious Root Formation in Cuttings. B.E. Dioscorides Press,EE. UU. [ Links ]
Gutiérrez B. 1997. Consideraciones sobre la fisiología y el estado de madurez en el enraizamiento de estacas de especies forestales. Santiago, Chile. Ciencia e Investigación Forestal. 9(2):261–277. [ Links ]
Haissig E. 1986. Metabolic processes in adventitious rooting, pp. 141-189. In: M.B. Jackson (ed). New root formation in plants and cuttings. Martinus Nijhoff Pub., Dordrecht. [ Links ]
Haissig E. 1989. Carbohydrate relations during propagation of cuttings from sexually mature Pinus banksiana trees. Tree Physiology 5(3):319-328. [ Links ]
Hartmann T., Kester E. 1996. Propagación de plantas: principios y prácticas. Editorial Continental S.A. México. 814 p. [ Links ]
Kamaluddin M., Ali M. 1996. Effects of leaf area and auxin on rooting and growth of rooted stem cuttings of neem. New Forest 12:11-18. [ Links ]
Leakey R.R.B. 1983. Stockplant factors affecting root initiation in cuttings of Triplochiton scleroxylon K. Schum., and indigenous hardwood of West Africa. Journal of Horticultural science 58(2):277-290. [ Links ]
Leakey R.R.B., Mesén F., Tchoundjeu Z., Longman A., Dick J., Newton A., Martin A., Grace J., Munro C., Muthoka N. 1990. Low technology techniques for the vegetative propagation of tropical trees. Commonwealth Forestry Review 69(3):247-257. [ Links ]
Leakey R.R.B., Mesén F. 1991. Métodos de propagación vegetativa en árboles tropicales: enraizamiento de estacas suculentas, pp. 135-153. In: J.P. Cornelius, F. Mesén y E. Corea (eds). Manual sobre mejoramiento genético forestal con referencia especial a América Central. CATIE, Turrialba, Costa Rica. [ Links ]
Loach K. 1988. Controlling environmental conditions to improve adventitious rooting, pp. 248-273. In: T.D. Davis, B.E. Haissig and N. Sankhla (eds). Adventitious Root Formation in Cuttings. BE Dioscorides Press, EE. UU. [ Links ]
Lovell P.H., White J. 1986. Anatomical changes during adventitious root formation, pp. 111-140. In: M.B. Lackson (ed). New root formation in plants and cuttings. Martinus Nijhoff Publisher, Dordrecht. [ Links ]
Manco C.E. 2006. Cultivo de sacha inchi. Subdirección de Recursos Genéticos y Biotecnología, Estación Experimental Agraria “El Porvenir”, Tarapoto, Perú. 11 p. [ Links ]
Mesen F. 1993. Vegetative propagation of Central American hardwoods. Thesis Ph.D. University of Edinburgh, Scotland. 231 p. [ Links ]
Mesen F., Leakey R.R.B., Newton A. 1996. Propagadores de subirrigación: un sistema simple y económico para la propagación vegetativa de especies forestales, pp. 101-110. In: R. Salazar (ed). Avances en la producción de semillas forestales en América Latina. CATIE. [ Links ]
Moe R., Andersen A.S. 1988. Stockplant environment and subsequent adventitious rooting, pp. 214-234. In: T.D. Davis, B.E. Haissig and N. Sankhla (eds). Adventitious Root Formation in Cuttings. Dioscorides Press, EE. UU. [ Links ]
Phillips J. 1975. Apical dominance. Annual Review of Plant Physiology 26:341-367. [ Links ]
Snedecor W., Cochran G. 1980. Statistical methods, 7ed. University Press, Iowa, EE. UU. [ Links ]
SENAMHI. 2008. Servicio Nacional de Meteorología e Hidrología, Estación Meteorológica de Tarapoto, datos 2008. [ Links ]
Veierskov B. 1988. Relations between carbohydrates and adventitious root formation, pp. 70-78. In: T.D. Davis, B.E. Haissig and N. Sankhla (eds). Adventitious Root Formation in Cuttings. Dioscorides Press, EE. UU. [ Links ]
Veierskov B., Andersen A.S. 1982. Dynamics of extractable carbohydrates in Pisum sativum. III. The effect of IAA and temperature on content and translocation of carbohydrates in pea cuttings during rooting. Physiologia Plantarum 55:179-182. [ Links ]
Wilson J., 1994. Contributions of the leaves and axillary shoots to rooting in Eucalyptus grandis Hill ex Maid stem cuttings. Journal of Horticultural Science 69(6):999-1007. [ Links ]
Zobel B., Talbert J. 1988. Técnicas de mejoramiento genético de árboles forestales. Ed. Limusa, México. 554 p. [ Links ]
Correspondencia a: Henry Ruiz-Solsol. Instituto de Investigaciones de la Amazonía Peruana, San Martín, Perú.
Francisco Mesén. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Turrialba, Costa Rica. Correo electrónico: fmesen@catie.ac.cr
Recibido: 19/04/10 Aceptado: 11/08/10













