Introducción
En las últimas décadas los arrecifes de coral han tenido un declive significativo en la cobertura, de coral a nivel mundial en 1998 se perdió alrededor del 8% debido al blanqueamiento de coral, mientras que en las décadas siguientes ha habido una pérdida del 14% (Hughes, Barnes et al., 2017; Hughes et al., 2018; Souter et al., 2021). Las principales causas de este deterioro se han atribuido principalmente a enfermedades, contaminación y el cambio climático (Alvarez-Filip et al., 2022; Hughes, Kerry et al., 2017). Por lo cual, la restauración se ha vuelto clave para mitigar este deterioro, a través de acciones pasivas como lo son la conservación y el manejo enfocadas en mitigar los factores de estrés, así como mediante acciones activas, las cuales ya involucran acciones directas como el trasplante de colonias de coral al arrecife, el uso de viveros de coral, y el uso de arrecifes artificiales (Rinkevich, 2005; Zimmer, 2006). Todas estas acciones favorecen el restablecimiento de los procesos ecológicos importantes para el arrecife como lo son la provisión de hábitat y la herbivoría (Bellwood et al., 2004; Rinkevich, 2014).
La restauración coralina representa un papel importante, en especial para aquellas especies constructoras que han reducido su distribución y abundancia. Particularmente en la región del Caribe, los esfuerzos se han centrado en las especies de coral ramificadas Acropora palmata, y Acropora cervicornis, los cuales se consideran entre las principales especies formadoras de arrecifes (Young et al., 2012). Ambas especies han tenido un declive significativo en su cobertura, desde la década de 1970, producto de la epizootia de banda blanca (Aronson & Precht, 2001; Gladfelter, 1982), y actualmente están catalogadas en peligro crítico de extinción dentro la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN), (IUCN, 2022). En especial A. palmata, al ser una de las principales especies constructoras del arrecife que conforma la mayoría de las crestas arrecifales de los arrecifes del Caribe, su pérdida representa una grave amenaza a la estructura y pérdida de hábitat del arrecife (Kuffner et al., 2020). Además de la pérdida de cobertura de coral, la remanente estructura arrecifal formada por los esqueletos de A. palmata se ha ido perdiendo producto de los huracanes y la bioerosión (Gardner et al., 2005; Glynn & Manzello, 2015), resultando en arrecifes menos complejos tridimensionalmente, lo que ocasiona una reducción en los servicios que proveen (Kuffner & Toth, 2016; Perry & Alvarez-Filip, 2019).
En las últimas décadas se han explorado diversas técnicas de restauración, las cuales pueden centrarse a pequeña escala enfocándose solamente en la restauración de colonias, mediante el trasplante o arrecifes artificiales, o a una escala ecológica más amplia, involucrando la restauración de la estructura tridimensional (3D) o el reclutamiento coralino (Zimmer, 2006). La mayoría de las técnicas utilizadas a nivel de colonia están basadas en métodos asexuales, tales como la poda, la microfragmentación y el trasplante directo (Bayraktarov et al., 2019). Siendo esta última, una de las primeras técnicas desarrolladas y la más utilizada, la cual consiste en la cosecha de pequeños fragmentos, realizada a partir de cortes en una colonia donadora, los cuales serán sembrados directamente en un sitio receptor, sin la necesidad de pasar por viveros marinos (Boström-Einarsson et al., 2018). Sin embargo, a pesar de ser una de las técnicas más comúnmente utilizadas en programas de restauración, debido su bajo costo, alta tasas de supervivencia y su simplicidad (Ferse et al., 2021; Forrester et al., 2019), la eficiencia del tejido utilizado de la colonia donadora en términos de crecimiento es poco conocida, así como los efectos que esta técnica tiene sobre la colonia donadora, como es el tiempo de recuperación del tejido vivo perdido.
Recientemente se ha empezado a considerar para el estudio de colonias de coral, es la técnica de fotogrametría como una herramienta invaluable para conseguir métodos estandarizados para la evaluación del proceso de restauración (Ferrari et al., 2021). (SfM; por sus siglas en inglés, ''Structure-from-Motion)” es un método fotogramétrico emergente de tecnología de bajo costo para la reconstrucción tridimensional de alta resolución que se basa en la captación de múltiples imágenes (fotogramas) de la estructura a modelar con base al movimiento del sensor óptico. Debido a que los modelos 3D ayudan a capturar en alta resolución toda el área intervenida, capturando tanto a escala amplia como fina todos los detalles, lo que permite la recopilación de información de manera rápida y a bajo costo (Lange & Perry, 2020). Al evaluar individualmente a los organismos, la fotogrametría nos ayuda a medir el crecimiento de los individuos trasplantados de forma no invasiva y con una alta precisión (Ferrari et al., 2021). Esto toma importancia especialmente para la medición de especies que se encuentran en gran riesgo.
Por tal motivo el objetivo de este estudio fue establecer los patrones de recuperación utilizando la técnica de dispersión asistida, mediante la evaluación del porcentaje de tejido vivo proveniente de las colonias donantes de A. palmata, así como la tasa de recuperación de las colonias y la ganancia de tejido vivo obtenido con los fragmentos sembrados, en cuatro tiempos de monitoreo a lo largo de 30 meses. De igual forma es una de las técnicas más utilizadas en las acciones de restauración, este estudio contribuye a la información existente y a establecer el límite de tejido que puede ser sustraído dependiendo del tamaño de la colonia sin afectar a la colonia donadora.
Materiales y métodos
Área de estudio: El presente estudio se realizó en el arrecife Manchones (21°11'56.5” N, 86°43'38.4''W), que se encuentra dentro del Parque Nacional Costa Occidental de Isla Mujeres, Punta Cancún y Punta Nizuc (PNCOIMPCPN) en la sección Norte del Caribe Mexicano. Este sitio forma parte del Sistema Arrecifal Mesoamericano, con una profundidad de entre 4.5-10 m, se caracteriza por tener una formación de macizos y canales discontinuos, los cuales tienen una mayor anchura y altura al centro de la estructura y se encuentran rodeados por arenales. Posee un bajo número de especies de coral, donde predominan las especies Porites astreoides, Orbicella spp., y Acropora spp., y una alta cobertura de macroalgas (Núñez-Lara et al., 2005; Perera-Valderrama et al., 2016), Este arrecife ha sido muy afectado por tormentas y huracanes, los cuales han dejado pedacería que con alguna marejada fuerte pueden fungir como proyectiles ocasionando un grave daño a la comunidad coralina circundante; además de los daños causados por tormentas, también se encuentra sometido a una alta afluencia turística, ya que recibe más de 100 visitantes al día para actividades de buceo y snorkeling (SEMARNAT-CONANP, 2016). Como parte de las acciones de recuperación de este arrecife, desde el 2000 se implementó el programa de rehabilitación y restauración arrecifal (SEMARNAT-CONANP, 2016).
El tiempo de estudio abarcó desde el 18 de abril de 2020 hasta el 12 de octubre de 2022, dividido en cuatro tiempos de monitoreo: (T1) previo a la poda (18 de abril de 2020); (T2) inmediatamente después de la poda (18 de abril de 2020); (T3) un mes después de la poda (18 de mayo de 2020), y (T4) 30 meses después de la siembra de fragmentos (12 de octubre de 2022). La intermitencia en el tiempo de monitoreo se debió a motivos logísticos, dado que por el inicio de la pandemia COVID-19 no se realizaron registros intermedios. Después de aproximadamente seis meses de la siembra realizada, la zona fue afectada por el paso de tres huracanes en octubre 2020 (Gamma, Delta, Zeta), y después de 16 meses de la siembra otro huracán impactó el área de estudio en agosto de 2021 con el huracán Grace. Estos fenómenos ocasionaron severos daños a las colonias donadoras, incluso ocasionando la pérdida total de la colonia A4.
Recolecta de corales: El 18 de abril de 2020 se realizó la colecta de fragmentos de la parte apical de las ramas de cuatro colonias de A. palmata en el arrecife Manchones. Esta práctica se denomina ''poda” y tiene la intención de obtener fragmentos de coral para efectuar las acciones de restauración a través de una técnica de propagación de reclutas asexuales, a la cual denominamos ''dispersión asistida”. Con dicha técnica se produjeron ramets o fragmentos que fueron fijados directamente al sustrato bentónico en áreas contiguas a la colonia donadora. Las colonias donadoras fueron seleccionadas con base en su tamaño (i.e. mayores a 1 m de diámetro) y su estado de salud (i.e. sin enfermedades aparentes, tejido vivo en buen estado y sin mortalidades). Todos los fragmentos (4 y 8 cm de diámetro máximo) fueron cortados con tijeras de jardinero, podando la parte apical de las ramas mediante cortes en forma de ''V” o con cortes rectos, dependiendo del tamaño de la rama, pero siempre tratando de no generar heridas muy grandes en el coral. Con esto se obtuvo un total de 438 fragmentos de las cuatro colonias de A. palmata: 200 de la colonia A1, 68 fragmentos de la colonia A2, 110 de la colonia 1A3 y 60 de la colonia A4. Durante la siembra, los fragmentos fueron adheridos al sustrato alrededor de la colonia donadora, a una distancia máxima de 1.5 m de la base, en grupos de dos a cinco fragmentos denominados ''clusters” (Fig. 1). Para la fijación de los fragmentos se utilizó una mezcla de cemento, arenisca y el aditivo antideslave MasterMatrix UW 450, diseñado especialmente para el uso de concreto bajo el agua. Cabe aclarar que, para los fragmentos sembrados, no se realizó ningún tipo de medida morfométrica, solo se evaluó la superficie de tejido.

Fig. 1 Fragmentos del coral Acropora palmata sembrados en ''clusters” en el arrecife de Manchones dentro del Parque Nacional Costa Occidental Isla Mujeres Punta Cancún y Punta Nizuc, el 18 de abril de 2020. / Fig. 1. Coral fragments (clusters) of Acropora palmata in Manchones reef in the Parque Nacional Costa Occidental Isla Mujeres Punta Cancún y Punta Nizuc, on April 18, 2020.
Para cada colonia se tomaron series fotográficas utilizando una cámara Nikon Coolpix W300 4.3 mm f/2.8, con los ajustes: modo bajo el agua, modo automático, sin flash. Para cada tiempo se emplearon cuatro reglas de calibración con una escala conocida, las cuales fueron colocadas en el sustrato circundante a las colonias. El patrón de barrido empleado para la obtención de las series fotogramétricas (215-275 fotos por colonia) fue en forma hemisférica, capturando fotos cada 1 o 2 segundos, rodeando la colonia por completo desde la base hasta la parte superior de las ramas y su sustrato adyacente a una distancia de ~1 m. El seguimiento de las colonias se realizó durante cuatro tiempos de monitoreo: (T1) previo a la poda, (T2) inmediatamente después de efectuar la poda y la siembra, (T3) un mes después y (T4) 30 meses después de las acciones de restauración, en octubre de 2022.
Procesamiento de imágenes y modelación 3D: Con la finalidad de identificar la cantidad de tejido vivo removido de las colonias donadoras, así como la tasa de recuperación y cicatrización de las ramas intervenidas, incluyendo el seguimiento en el tiempo del crecimiento en área de tejido y la supervivencia de los fragmentos, se realizó un modelo por colonia en cada fecha de monitoreo, con lo cual se obtuvieron 16 modelos. Los modelos se generaron mediante la herramienta fotogramétrica SfM y fueron procesados en el software Agisoft Metashape Professional Versión 1.83. Durante la elaboración de los modelos fue importante garantizar una superposición de las fotografías del 70% al 80% para evitar la pérdida de información dentro del área a modelar. Para el procesamiento fotogramétrico de los modelos, primero se eliminaron las fotografías de mala calidad (ej. problemas de iluminación y/o enfoque). La primera etapa de la modelación se obtuvo en calidad de procesamiento alta, de acuerdo con los parámetros del programa para tener una mejor resolución del producto, lo que corresponde a la alineación de las fotos y generación de la nube dispersa (Fig. 2a). Posteriormente, se agregaron marcadores en las fotografías donde mejor se apreciaban las escalas colocadas en el sustrato. Seguido a esto, se generaron mallas poligonales (modelos 3D, Fig. 2b), a partir de los mapas de profundidad, los cuales fueron procesados en calidad ultra alta, de acuerdo con los parámetros del programa; también se utilizó un recuento de caras en nivel alto y para la interpolación se utilizó el parámetro en extrapolado. Debido a la morfología ramosa y foliar de las colonias, se agregó un ajuste para incrementar la sensibilidad del procesamiento, donde se agregaron los siguientes parámetros: BuildModel/ooc_surface_blow_off = 0.95 y BuildModel/ooc_surface_blow_up = 0.95. Finalmente, se generaron las texturas de los modelos a partir de las fotografías y el tipo de textura fue definido como ''Mapa de RGB” (Fig. 2c).
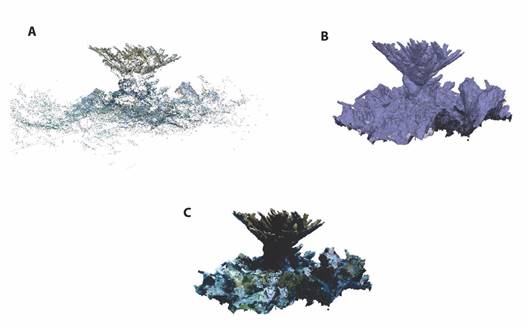
Fig. 2 Procesamiento de imágenes para la reconstrucción del modelo 3D. A. Nube dispersa de puntos, B. malla tridimensional y c) malla tridimensional texturizada. / Fig. 2. Stages of building a 3D model. A. sparse point cloud, B. tridimensional mesh, and c) tridimensional textured mesh.
Descripción los modelos 3D: Con la finalidad de describir los patrones de pérdida y ganancia de tejido de cada una de las colonias por unidad de tiempo, los modelos texturizados se importaron dentro del software CloudCompare v2.10.2. Los modelos provenientes de una misma colonia en diferentes tiempos se alinearon con la función ''alinear dos nubes”, para lo cual se seleccionó pares de puntos equivalentes, en donde mínimo cinco puntos equivalentes de cada colonia fueron elegidos. Para asegurar la alineación los modelos se rotaron ligeramente para identificar los puntos equivalentes desde distintos ángulos de la colonia. Para segmentar los modelos y eliminar el área circundante de la colonia, se utilizó como referencia de corte el modelo tomado antes de la poda (Lange & Perry, 2020). Por otra parte, las diferencias entre el tejido perdido y ganado de los modelos para cada uno de los tres tiempos de muestreo se calcularon con base a su área de superficie y al porcentaje de tejido. A partir de los modelos, también, se extrajeron los datos de diámetro máximo, diámetro mínimo y la altura de cada colonia con base en las dimensiones X, Y y Z del espacio de trabajo de los modelos de cada colonia. Finalmente, se extrajo el área de superficie del tejido vivo inicial de cada clúster, así como la ganancia de tejido vivo en los diferentes conjuntos de ''clusters” con fragmentos de poda provenientes de cada colonia (Tabla 1) para los tiempos de (T2) siembra, (T3) un mes posterior a la siembra y (T4) 30 meses después.
Tabla 1 Número total de clústers y fragmentos sembrados de A. palmata, junto con el porcentaje de clústers y fragmentos evaluados un mes después. / Table 1. Total number of outplanted fragments and clusters of A. palmata with the percentage of clusters and fragments evaluated one month later.
| ID Colonia | Clústers totales | Clústers evaluados | Clústers evaluados (%) | Fragmentos totales | Fragmentos evaluados | Fragmentos evaluados (%) |
| A1 | 39 | 15 | 38.46 | 200 | 66 | 33.0 |
| A2 | 19 | 10 | 52.63 | 68 | 35 | 51.47 |
| A3 | 26 | 10 | 38.46 | 110 | 38 | 34.55 |
| A4 | 14 | 10 | 71.43 | 60 | 47 | 78.33 |
| Total | 98 | 45 | 50.25 ± 7.81 | 438 | 186 | 49.34 ± 10.553 |
El porcentaje de los fragmentos vivos se estimó visualmente para cada uno de los ''clusters” un mes después de la siembra. Esta estimación no fue replicada en los modelos generados 30 meses después, en 2022, porque la estructura física del arrecife sufrió grandes cambios debido a la acción de los huracanes, por lo tanto, no se pudo realizar el sobrelapamiento del modelo 3D del 2022 con el resto de los modelos. De igual forma, muchos de los fragmentos sobrevivientes se fusionaron en una sola mancha de tejido, lo cual hace imposible su identificación y comparación con el tiempo inicial.
Relación entre el tamaño de la colonia y el número de fragmentos: Con la finalidad de identificar la medida morfométrica (altura, diámetro mínimo y diámetro máximo) que mejor explique la cantidad de fragmentos que se puede obtener de una colonia de A. palmata, se realizó una correlación entre el número total de fragmentos cortados por colonia y sus medidas morfométricas, esto es diámetro mayor, diámetro menor y altura.
Resultados
En promedio, las colonias seleccionadas tuvieron un área superficial inicial de 5.13 ± 1.47 m2 (error estándar), siendo la colonia A1 la de mayor tamaño con 9.3 m2 y la colonia A2 la colonia más pequeña con 2.2 m2 (Tabla 1). Después de la poda el área superficial fue de 11.80 ± 1.05% del total del tejido vivo removido. En términos del porcentaje total de la colonia, la poda representa entre un 9.09% y un 13.88% del tejido vivo disponible en la colonia donadora (Fig. 3a). Al observar las distintas métricas de las colonias (i.e. altura, diámetro menor y diámetro mayor), se registró que el número de fragmentos está ampliamente relacionado con el diámetro mayor de las colonias, esto significa que a colonias más grandes se les podría obtener un mayor número de fragmentos, cabe destacar que no se registraron signos de enfermedad o blanqueamiento en los tiempos posteriores a la siembra (Fig. 3b).
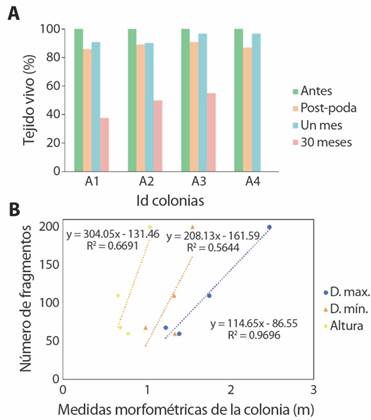
Fig. 3 A. Porcentaje de tejido vivo en cada tiempo de monitoreo para cuatro colonias de A. palmata. B. Correlación entre las medidas morfométricas de las colonias (diámetro mayor, diámetro menor y altura) con el número total de fragmentos cortados de cada colonia. / Fig. 3. A. Percentage of live tissue in each survey time for four colonies of A. palmata. B. Correlation between morphometric measurements of the colonies (major diameter, minor diameter, and height) with the total number of cut fragments from each colony.
Después de un mes se realizó la evaluación de la recuperación de las colonias podadas, en promedio se observó que todas las colonias tuvieron una recuperación de tejido, teniendo en promedio 5.53 ± 1.6% de tejido recuperado, respecto al de su tamaño inicial (Tabla 2). Después de la poda, la colonia A1 fue la que perdió más tejido (13.88%), siendo la colonia de mayor tamaño de la cual se obtuvo el mayor número de fragmentos (n = 200). Al mes recuperó un 4.75% de tejido, mientras que 30 meses después, la colonia presentó el 37.65% de tejido en comparación con el tejido inicial (Fig. 4a). La colonia A2 fue la más pequeña, de la cual sólo se obtuvieron 68 fragmentos, que representó el 11.30% de tejido del total de la colonia; después de un mes fue la colonia que mostró menor recuperación de tejido estimado en 1.74%; mientras que 30 meses después, la colonia presentó el 49.83% de tejido en comparación con el tejido inicial (Fig. 4b). La colonia A3 fue la que tuvo menor pérdida de tejido, con un 9.78% del total de la colonia; un mes después el 5.85% se había recuperado, pero 30 meses después la colonia presentó el 55.10% de su tejido inicial (Fig. 4c). Finalmente, la colonia A4, fue la segunda colonia con mayor porcentaje de poda, 11.80%, presentando una recuperación del tejido vivo total, del 9.78%, mientras que 30 meses después se encontró que se perdió todo el tejido de la colonia, así como la estructura (Fig. 4d). En el monitoreo realizado 30 meses después, se observó que el tejido vivo promedio de todas las colonias se redujo de un 4.82 ± 1.30 m2, considerando el tiempo post-poda a un 1.80 ± 0.77 m2 (Tabla 2).
Tabla 2 Valores de tejido vivo (m2 y %) para cada una de las colonias donadoras de Acropora palmata para cada uno de los tiempos de muestreo: antes de la poda, post-poda, un mes después y 30 meses después. / Table 2. Live coral tissue values (m2 y %) for each of the Acropora palmata donor colonies for each of the sampling times: before pruning, post-pruning, one month and 30 months after.
| ID Colonia | Tejido inicial (m2) | Tejido post-poda (m2) | Tejido un mes después (m2) | Tejido podado (m2) | Tejido post-poda (%) | Tejido un mes después (%) | Poda (%) | Recuperación (%) | Tejido 30 meses (m2) | Tejido 30 meses (%) |
| A1 | 9.22 | 7.94 | 8.38 | 1.28 | 86.12 | 90.87 | 13.88 | 4.75 | 3.48 | 37.65 |
| A2 | 2.35 | 2.08 | 2.12 | 0.27 | 88.70 | 90.44 | 11.30 | 1.74 | 1.12 | 47.65 |
| A3 | 4.75 | 4.32 | 4.60 | 0.43 | 90.91 | 96.76 | 9.09 | 5.85 | 2.67 | 55.10 |
| A4 | 4.32 | 3.76 | 4.19 | 0.56 | 87.05 | 96.84 | 12.95 | 9.78 | 0 | 0 |
| Promedio ± EE | 5.16 ± 1.455 | 4.53 ± 1.23 | 4.82 ± 1.30 | 0.63 ± 0.22 | 89.20 ± 1.05 | 93.75 ± 1.78 | 11.80 ± 1.05 | 5.53 ± 1.66 | 1.80 ± 0.77 | 24.47 ± 12.23 |
El tejido podado es la diferencia entre el tejido inicial y el tejido post-poda. / The pruned tissue is the difference between the initial tissue and the post-pruned tissue.
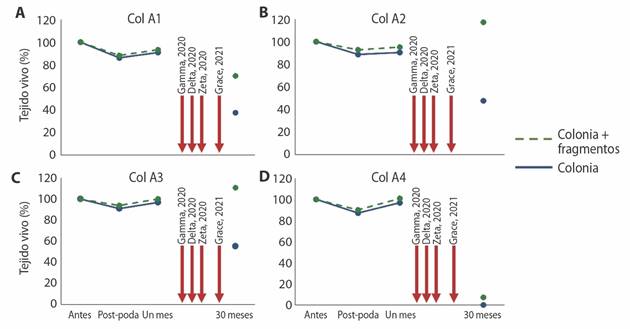
Fig. 4 Recuperación de las colonias donadoras de A. palmata en porcentaje respecto al tejido vivo inicial. La línea azul indica los valores de la colonia donadora, mientras que la línea punteada en color verde incluye los valores de la colonia donadora junto con el tejido de los fragmentos sembrados. Las flechas rojas señalan eventos de huracanes que impactaron el arrecife de Manchones en 2020 y 2021. / Fig. 4. The recovery percentage of the donor colonies of A. palmata with respect to the initial living tissue. The blue line indicates the values of the donor colony, while the green dotted line includes the values of the donor colony together with the tissue of the outplanted fragments. Red arrows indicate hurricane events that impacted the Manchones Reef in 2020 and 2021.
Para el análisis de los fragmentos sembrados solo fue posible evaluar el 49.34% del total de los fragmentos, por lo cual los resultados pudieran estar subestimados (Tabla 1). Un mes después se observó que el porcentaje de fragmentos vivos varió entre el 78% y 83%, donde la colonia A1 tuvo un mayor número de fragmentos vivos (Fig. 5). Al evaluar el área de tejido de los fragmentos, se observó que la colonia A1 tuvo un área de siembra de 0.20 m2, (Tabla 3). La colonia A2 representó la menor área de siembra, al ser la colonia más pequeña, con solo un 0.10 m2. Debido a que sólo se evaluó la mitad de los fragmentos, el área de siembra representa menos del 1% del total de la colonia. Al hacer una comparación del área de tejido podado de la colonia original, con respecto al área de siembra de cada colonia, se observa que durante este proceso ocurre una pérdida de tejido adicional por la fijación de los fragmentos al sustrato, donde en promedio se pierde el 73.38 ± 4.69% (Tabla 3). Después de un mes, los fragmentos sembrados mostraron un incremento en el área de tejido, que en promedio corresponde a un 20.61% de su tamaño original (Tabla 3). Treinta meses después, en 2022, el área de tejido superviviente de los fragmentos encontrados fue de 1.89 ± 0.60 m2, siendo la colonia A1 la que tuvo el mayor tejido superviviente (2.99 m2), en contraste con la colonia A4, la cual tuvo sólo 0.30 m2 (Tabla 3).
Tabla 3 Valores del tejido de los fragmentos podados para cada una de las colonias de A. palmata. Los valores están presentados en m2 y en porcentaje, con relación al total de la colonia para cada uno de los tiempos de muestreo. / Table 3. Tissue values of the pruned fragments for each of the A. palmata colonies. The values are in m2 and in percentage, in relation to the total colony for each of the sampling times.
| ID Colonia | Área siembra evaluada (m2) | Incremento de tejido (m2) | Incremento de tejido (%) | Tejido podado de la colonia donadora (m2) | Tejido sembrado (%) | Tejido perdido en la siembra (%) | Tejido superviviente de fragmentos 2022 (m2) | |
| Inicial | Al mes | |||||||
| A1 | 0.20 | 0.23 | 0.03 | 15.75 | 1.28 | 15.27 | 84.73 | 2.99 |
| A2 | 0.10 | 0.11 | 0.02 | 16.53 | 0.27 | 36.10 | 63.90 | 1.63 |
| A3 | 0.14 | 0.16 | 0.02 | 12.59 | 0.43 | 32.21 | 67.79 | 2.64 |
| A4 | 0.13 | 0.18 | 0.05 | 37.55 | 0.56 | 22.90 | 77.10 | 0.30 |
| Promedio ± EE | 0.14 ± 0.02 | 0.17 ± 0.02 | 0.0 6 ± 0.02 | 20.61 ± 5.71 | 0.63 ± 0.22 | 26.62 ± 4.69 | 73.38 ± 4.69 | 1.89 ± 0.60 |
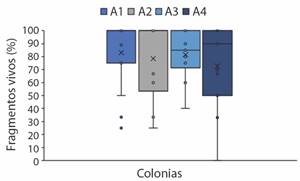
Fig. 5 Porcentaje de fragmentos vivos un mes después de la siembra. / Fig. 5. Percentage of live fragments, one month after the outplanting.
Al evaluar el área de tejido estimada 30 meses después, en 2022, se observa que existe una pérdida de tejido para todas las colonias donadoras, en comparación con su área inicial, debido al efecto de los huracanes (Fig. 5, Tabla 4); sin embargo, al incorporar tanto el área de tejido de los fragmentos como el área de las colonias, se observa que las colonias A2 y A3 tuvieron un área de tejido equivalente a 117.14% y 110.56% de su tamaño original, respectivamente (Fig. 5, Tabla 4); mientras que la colonia A1 representa el 70.11% de su tamaño original (Fig. 5, Tabla 4). Cabe destacar que la colonia A4 se perdió completamente, por lo que el tejido remanente corresponde únicamente a los fragmentos sembrados que lograron sobrevivir (7.02%) (Fig. 5, Tabla 4).
Tabla 4 Valores de tejido (m2 y %) tomando en cuenta las colonias donadoras de A. palmata y los fragmentos sembrados. / Table 4. Live coral tissue values (m m2 y %) considering the donor colonies of A. palmata and the outplanted fragments.
| ID Colonia | Tejido post-poda (m2) | Tejido un mes después (m2) | Tejido post-poda (%) | Tejido un mes después (%) | Tejido 2022 (m2) | Tejido 2022 (%) |
| A1 | 8.14 | 8.61 | 88.24 | 93.32 | 6.47 | 70.11 |
| A2 | 2.18 | 2.2 | 92.78 | 95.19 | 2.75 | 117.14 |
| A3 | 4.46 | 5.75 | 93.84 | 100.06 | 5.25 | 110.58 |
| A4 | 3.89 | 4.36 | 90.01 | 100.91 | 0.30 | 6.94 |
| Promedio ± EE | 4.67 ± 1.25 | 4.99 ± 1.33 | 91.22 ± 1.28 | 97.37 ± 1.85 | 3.69 ± 1.37 | 76.19 ± 25.32 |
Discusión
El método de dispersión asistida que se evaluó en este trabajo, a pesar de ser una primera fase, muestra que esta técnica de propagación clonal podría representar una alternativa viable de producción de colonias para acciones de restauración activa, pero es importante implementar mayores estudios para evaluar los efectos a nivel fisiológico, así como ampliar el número de muestra para poder determinar los criterios necesarios para que su práctica sea eficiente. La elección de las colonias donadoras es un punto crucial, debido al reducido número de colonias de nuestro estudio, no se pueden realizar afirmaciones certeras, pero con base en el aprendizaje en campo se debería evaluar su morfología, la densidad de su esqueleto, la intensidad de las corrientes y el oleaje, para determinar la factibilidad de obtención de los fragmentos de poda de la colonia donadora. Por otro lado, es importante evaluar la influencia que tiene la experiencia del restaurador para realizar los cortes a las colonias donadoras, ya que es importante que no generen daño adicional a las colonias, como pudieran ser fracturas indeseadas o astillas que representan tejido no útil para la siembra, así como la obtención de fragmentos de calidad, en cuanto a su tamaño y forma. Basado en los resultados y limitaciones de este estudio se recomienda: 1) seleccionar colonias donadoras grandes (> 1.5 m de diámetro mayor), y realizar más estudios con un mayor tamaño de muestra 2) recolectar únicamente la parte apical de las ramas con fragmentos entre 5 y 7 cm de longitud, 3) recolectar menos del 10% del total de la colonia donadora (Boström-Einarsson et al., 2018), 4) procurar que la longitud del corte sea menor de 5 cm de longitud, y 5) en ramas extendidas realizar cortes en ''v” para propiciar una mejor recuperación.
Durante la etapa de siembra, la sobrevivencia de los fragmentos puede depender del tamaño de los fragmentos, la técnica de fijación, de los materiales utilizados y de la disposición en la que se fijan los fragmentos (Boström-Einarsson et al., 2018; Unsworth et al., 2021). De acuerdo con las estimaciones realizadas en este estudio, durante el proceso de siembra se presenta la mayor pérdida de tejido (73%) asociada al proceso de fijación en el sustrato, y el porcentaje de fragmentos vivos se estimó en 78% después de un mes de la siembra; lo cual se considera un valor bajo en comparación a otros trabajos realizados en Florida en donde registraron valores mayores al 90% (Lohr et al., 2020; Mercado-Molina et al., 2014). Forrester et al., 2014, mencionan que los fragmentos de A. palmata de tallas medias y grandes tienen mejores tasas de supervivencia, por lo que en futuros estudios, para obtener mejores resultados durante la aplicación de esta técnica, se tendrían que obtener fragmentos mayores a 5 cm, con la intención de que tengan mayor tolerancia a la manipulación durante la siembra, a la sedimentación, al efecto de depredadores y al crecimiento de algas (Barton et al., 2017; Bruckner & Bruckner, 2001; Lirman et al., 2010; Okubo et al., 2005).
Sin embargo, a pesar del porcentaje de fragmentos vivos, los individuos remanentes presentaron una larga permanencia de al menos 30 meses con un incremento de tejido importante. El área de siembra inicial fue de 0.56 m2, lo que corresponde al 50% de los fragmentos sembrados, mientras que 30 meses después, el área fue de 1.89 m2, lo que indica un incremento de tejido vivo 3.38 veces más en comparación del tejido original. Debido a que inicialmente solo se evaluó el ~ 50% de los fragmentos, con el tiempo estos fragmentos evaluados, pudieron haberse fusionado con fragmentos sembrado no evaluados, por lo cual este aumento de tejido pudiera estar sobreestimado. El tipo de crecimiento incrustante observado es un comportamiento recurrente en colonias que han sufrido algún daño físico, como el paso de huracanes o tormentas (Gladfelter, 2007), como fue el caso de los fragmentos sembrados los cuales pudieran haberse visto influenciados por el paso de los huracanes de 2020. De igual forma las colonias creciendo sobre esqueletos presentan este tipo de crecimiento como una respuesta morfológica al sustrato (Jordán-Dahlgren, 1992).
Un enfoque emergente que recientemente se utiliza para estudiar las colonias de coral es la fotogrametría digital subacuática, por ello, a partir de esta experiencia se denota la necesidad de implementar un patrón de barrido fotogramétrico de tipo monumento en combinación con un patrón de barrido en corte de césped (Young et al., 2017), el cual ayuda a representar de mejor manera los espacios entre las ramas y la base de las colonias, las cual tienen poca iluminación debido a la orientación de las ramas (Gutiérrez-Heredia et al., 2015; Lavy et al., 2015). También es recomendable realizar el patrón de barrido desde la base de las colonias hasta la parte superior de las mismas para una óptima modelación. Adicionalmente, sería de mucha utilidad implementar un barrido individual para cada clúster, con el objetivo de captar de forma más precisa la estructura tridimensional de cada fragmento sembrado. Estas consideraciones permitirán tener estimaciones más precisas de los procesos de recuperación de las colonias donadoras y del crecimiento de los fragmentos sembrados.
Resulta interesante describir de manera cuantitativa lo que ocurre durante la primera etapa, en términos de la pérdida de tejido (poda en la colonia y siembra de los fragmentos) y su posterior ganancia (regeneración de la colonia donadora y el crecimiento de los fragmentos sembrados). Un mes después se logró una aparente recuperación de tejido en la colonia donadora, aunque sin llegar a su estado original; los fragmentos también presentaron un aumento en área de tejido vivo, aunque si bien otros estudios han observado que los primero dos años el crecimiento de los fragmentos es exponencial, con el tiempo la tasa disminuye (Ware et al., 2020). Un hecho importante a destacar es que a pesar de la pérdida de tejido en colonias después del paso de los huracanes, se pudo conservar el genotipo de la colonia gracias a los fragmentos sembrados. Las tormentas o huracanes con categoría menor a 3, en la escala de Saffir-Simpson, pueden funcionar como ''eventos reproductivos” en corales ramosos, lo cual depende ampliamente del número de fragmentos sobrevivientes, llamados ''corales de oportunidad” (Highsmith, 1982), lo que contribuye a la recuperación del arrecife en menor tiempo (Bowden-Kerby, 2001; Highsmith, 1982; Hughes, 1994). Siendo así, es claro que se requiere un entendimiento más preciso de estos procesos para determinar mejores criterios de manejo de esta técnica de restauración, que además consideren aspectos básicos de la dinámica poblacional de esta especie. En este sentido es importante reconocer que A. palmata es una especie con alta tasa de propagación asexual en el medio natural (Lirman, 2003), lo que contribuye a incrementar la biomasa de sus ramets.
La técnica de trasplante o dispersión directa es uno de los métodos más utilizados en restauración, principalmente por su viabilidad económica (Bayraktarov et al., 2020; Boström-Einarsson et al., 2018), lamentablemente los esfuerzos de monitoreo de estas acciones aún no son adecuados para evaluar el éxito a largo término (Ferse et al., 2021), ni la evaluación del efecto que estas intervenciones tienen sobre las colonias donadoras. Con la técnica propuesta en este estudio, se pretende dar una factibilidad a proyectos futuros de intervención que desemboquen en una restauración a gran escala, a través de un aprovechamiento sustentable en la producción de fragmentos. En este sentido resulta crucial considerar la diversidad genética de los sitios de restauración para orientar una estrategia combinada que también incluya la siembra de reclutas sexuales para introducir nuevos genotipos en la población (Banaszak et al., 2019; Baums et al., 2019; Schopmeyer et al., 2017). De igual forma es imperante que los proyectos de restauración incluyan indicadores específicos para rastrear el éxito, así como implementar monitoreos posteriores a las intervenciones para constatar la autosuficiencia de los corales trasplantados (Baums et al., 2019; Bayraktarov et al., 2020).
Con base en los patrones de recuperación observados en esta primera fase de nuestro estudio, donde un mes después se puede observar un inicio de recuperación en la colonia donadora, sin ningún tipo de afectaciones como blanqueamiento, enfermedades o mortalidad reciente, pudiera indicar que es posible aprovechar hasta un 10% del total de la colonia, acorde a lo recomendado por Boström-Einarsson et al., (2018). Sin embargo, es necesario realizar estudios más amplios a futuro que contemplen un mayor número de muestra y una evaluación de su efecto sobre distintos factores fisiológicos de la colonia. Siendo así, es evidente que se requiere un entendimiento más amplio de este proceso a nivel poblacional para definir los términos en los que sería factible un aprovechamiento consciente y sustentable de las colonias donadoras, que debe de ir más allá de solamente la recomendación de un porcentaje de poda que la recuperación del tejido perdido. Por otro lado, es importante avanzar en el mejoramiento de esta técnica de dispersión asistida para establecer de manera más precisa el tamaño mínimo óptimo de los fragmentos para garantizar una buena sobrevivencia, así como el efecto del número de fragmentos que se siembran por clúster; su distribución para evaluar su proceso de fusión y crecimiento y un mejor seguimiento de las colonias donadoras para evaluar su condición a largo plazo.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


