Introducción
Los briófitos son uno de los grupos de plantas más diversos y antiguos del mundo, considerados la transición entre las plantas acuáticas y terrestres, debido a sus adaptaciones morfológicas, fisiológicas y evolutivas (Harris et al., 2022), son importantes para el funcionamiento y la estructura de los ecosistemas de alta montaña y páramo (Díaz-Acevedo et al., 2020; Churchill & Linares, 1995). Cumplen un papel fundamental en procesos de colonización de nuevos hábitats y sustratos, ayudan a la estabilidad del suelo, y generan sitios para el establecimiento de epífitas vasculares (Glime, 2021).
La diversidad de briófitos a nivel mundial se estima en ~12 800 especies de musgos, 7 270 de hepáticas y 215 de antocerotes (Wang et al., 2022), distribuidos en todos los ambientes, desde zonas cálidas (desiertos) a frías (polos) (Glime, 2021). La región Neotropical, específicamente la cordillera de los Andes, presenta la mayor diversidad de briófitos como resultado de la evolución y distribución de estos en Suramérica (Díaz-Acevedo et al., 2020; Díaz-Acevedo et al., 2020), igualmente, el levantamiento andino produjo profundos cambios en la topografía y condiciones climáticas del norte del continente, generando condiciones ecológicas que proporcionaron múltiples oportunidades para la adaptación y especiación de los briófitos (Gil-Novoa et al., 2020; Gradstein et al., 1989).
Condiciones de alta precipitación y bajas temperaturas favorecen el establecimiento de los briófitos en los bosques andinos (>2 350 - 3 500 m) (Estébanez et al., 2011). En este sentido, estos ecosistemas han sido estudiados en términos de diversidad y biogeografía; dichos trabajos muestran que la mayor frecuencia de sustratos habitados por los briófitos son las cortezas de los árboles y el suelo en gruesas alfombras (Gil-Novoa, 2017; Martínez et al., 2019; Porras-López & Morales-Puentes, 2020).
La formación de los Andes ha propiciado diferentes ecosistemas, favorables para el establecimiento y diversificación de los briófitos, ambientes más fríos que los bosques andinos (Díaz-Acevedo et al., 2020). Un ejemplo de estos son los páramos, ecosistemas únicos presentes en Centro y Suramérica (Costa Rica, Venezuela, Ecuador, Perú y Colombia) (Díaz-Granados et al., 2005; Díaz-Acevedo et al., 2020). Principalmente son fríos y húmedos, con niebla durante gran parte del día van sobre el límite superior del bosque a 2 800 m hasta las nieves a 5 000 m (Díaz-Granados et al., 2005), con temperaturas que oscilan entre 0-12 ºC y precipitaciones, de 600 a 3 000 mm anuales (Díaz-Granados et al., 2005; Garavito, 2015).
Dichos páramos corresponden a zonas con aislamiento en las partes altas de las montañas (Díaz-Acevedo et al., 2020), por lo que han guardado una historia (eventos ecológicos, geológicos y evolutivos) evolutiva importante para los Andes, considerándose así, como centros de endemismos y diversidad biológica (Gil-Novoa et al., 2020). Colombia cuenta con el 49 % de las áreas del páramo del planeta, y el 18.3 % de estas, se hallan en el departamento de Boyacá (Díaz-Granados et al., 2005), y se encuentran divididos en seis complejos (Sierra Nevada del Cocuy, Guantiva-La Rusia, Iguaque-Merchán, Pisba, Rabanal-Río Bogotá y Tota-Bijagual-Mamapacha ''TBM'') (Morales et al., 2007). Sin embargo, pese a que, se han realizado estudios sobre diversidad y biogeografía de briófitos en algunos de estos páramos (Martínez et al., 2019; Gil-Novoa et al., 2020; Porras-López & Morales-Puentes, 2020), se desconoce la estructura de las comunidades de briófitos en ellos; de hecho, no se ha reportado cuál de estos complejos de páramos presenta mayor diversidad de especies, o si los briófitos que aquí habitan presentan un patrón similar al de los bosques andinos; es decir, sus taxones ocurren en diferentes sustratos. Según lo anterior, el presente estudio tiene como objetivo analizar la estructura y composición de las comunidades de briófitos de los complejos de páramos de Boyacá.
Materiales y métodos
Área de estudio: Colombia tiene cerca del 49 % de las áreas paramunas del planeta, y están distribuidas en 34 complejos de páramo, seis de ellos se encuentran en el departamento de Boyacá (Fig. 1) 1. Sierra Nevada del Cocuy con una precipitación promedio de 889 mm/año, temperatura de 5 ºC y un rango altitudinal de 2 719 - 4 869 m; 2. Guantiva-La Rusia (1 026 mm/año, 9 ºC y 2 789 - 3 888 m) 3. Iguaque-Merchán (955 mm/año, 10 ºC y 2 667 - 3 632 m); 4. Pisba (1 909 mm/año, 7 ºC y 2 730 - 3 805 m); 5. Rabanal-Río Bogotá (977 mm/año, 9 ºC y 3 146 - 3 422 m), y 6. Tota-Bijagual-Mamapacha (TBM) (1 522 mm/año, 10 ºC y 2 757 - 3 845 m) (Morales et al., 2007; WorldClim, 2023).
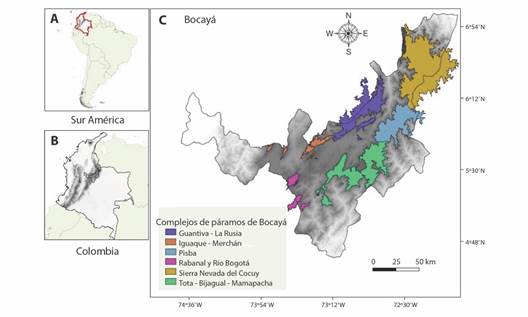
Fig. 1 Localización de los complejos de páramos en Boyacá, Colombia. A. Ubicación de Colombia en Suramérica; B. Departamento de Boyacá en Colombia; C. Complejos de páramos en el departamento de Boyacá. / Fig. 1. Location of páramo complexes in Boyacá, Colombia. A. Location of Colombia in South America; B. Department of Boyacá in Colombia; C. Páramo complexes in the department of Boyacá.
Procesamiento de datos: con el fin de conocer la diversidad de especies de briófitos en los páramos de Boyacá se realizó una búsqueda minuciosa de colecciones de los herbarios UPTC y COL (Thiers, 2018). De igual forma, se revisaron bases de datos en GBIF (2022), Missouri Botanical Garden (2022) y SibColombia (2022; Sistema de Información sobre la biodiversidad de Colombia). Posteriormente, se depuraron los datos (coordenadas geográficas, resolución taxonómica y datos dudosos) para reducir sesgos Linneanos y Wallaceanos, siguiendo el protocolo de tratamiento de datos de Escobar et al. (2015).
Determinación de material: teniendo en cuenta que parte de los ejemplares depositados en la colección de referencia del herbario UPTC no se encontraban identificados a nivel de especie, fue necesario realizar un proceso de determinación taxonómica, con el uso de equipos ópticos como microscopio (LEICA Dm750) y estereoscopio (LEICA EZ4 HD con Software LAS EZ v3.0 2013), con el empleo de claves para la determinación taxonómica clásica y especializada (Churchill & Linares, 1995; Gradstein, 2021). Adicionalmente, se realizaron comparaciones con material de referencia de la colección del Herbario UPTC; ademas en colecciones virtuales del herbario COL (Herbario Nacional Colombiano) y Missouri Botanical Garden (MO). Para efecto de clasificación taxonómica se siguieron las propuestas de Goffinet et al. (2009) para musgos, Söderström et al. (2016) para hepáticas, y Renzaglia et al. (2009) para antocerotes. Para la revisión nomenclatural y procesos de sinonimización de especies se empleó el Catálogo de Plantas y Líquenes de Colombia (Bernal et al., 2019).
Análisis de la estructura de comunidades (representatividad del muestreo): para establecer si los muestreos fueron representativos, fue calculado el número esperado de especies en cada uno de los complejos a través de curvas de rarefacción y extrapolación-interpolación. Este método usa el doble de la muestra de referencia más pequeña y la curva de completitud con un intervalo de confianza de 95 % obtenida del remuestreo de 100 pseudoréplicas de Bootstrap (Chao & Jost, 2012; Chao et al., 2014). Estas curvas fueron realizadas con el paquete de R iNEXT (Hsieh et al., 2016) para lenguaje de programación R en Rstudio (v.1.4.1106) (R Core Team, 2021), siguiendo los parámetros de Chao et al. (2014) y Colwell et al. (2012).
Análisis de la diversidad alfa y beta: para calcular la diversidad alfa y beta de los complejos de páramos, así como para los diferentes sustratos encontrados, se emplearon en primer lugar, índices para medir la diversidad alfa (números de ''Hill'') expresada en el número efectivo de especies (Jost 2006), mediante el paquete de R, Entropart (Marcon & Hérault 2015). Los números efectivos presentan tres niveles: la diversidad del orden cero (0D) ''riqueza de especies'', la diversidad del orden uno (1D) ''abundancia relativa'' y la diversidad del orden dos (2D) ''especies abundantes'' (Jost, 2006; Chao et al., 2014).
Asimismo, se calculó la disimilitud total en todos los complejos de páramos (b SOR ) con el índice de Sorensen y, por lo tanto, la diversidad beta, junto con sus componentes de variación equilibrada (b SOR.BAL ) y gradientes de abundancia (b SOR.GR ) en el paquete Betapart de R (Baselga & Orme, 2012; Baselga et al., 2021). Estos componentes de similitud, permiten establecer si las comunidades en el área de estudio se configuraron a través del recambio de especies (b SIM ) o el anidamiento (b SNE ).
Resultados
Composición florística: se revisaron 5 132 ejemplares, distribuidos en 601 especies, 220 géneros y 80 familias. Los musgos presentaron la mayor abundancia con 2 804 muestras, la mayor riqueza con 343 especies, correspondiente al 57.07 %, seguidos de las hepáticas con 2 313 especímenes (256 taxa) equivalente al 42.60 %, y finalmente, los antocerotes con 15 ejemplares (2 especies) que representan el 0.33 % de la revisión efectuada, Nothoceros vincentianus (Lehm. & Lindenb.) J.C. Villarreal (en este estudio) y Anthoceros tristanianus J.C. Villarreal, J.J. Engel & Váňa (Peñaloza-Bojacá et al., 2020). A continuación, se ilustra a través de la Tabla 1, la diversidad en número de familias, géneros y especies presentes en el área de estudio.
Tabla 1 Número de familias, géneros y especies por cada grupo de briófitos. / Table 1. Number of families, genera and species for each group of bryophytes.
| Grupos | Clase | Orden | Familias | Géneros | Especies | N.º de registros |
| Antocerotes | 1 | 2 | 2 | 2 | 2 | 15 |
| Musgos | 4 | 20 | 48 | 149 | 343 | 2 804 |
| Hepáticas | 2 | 11 | 30 | 69 | 256 | 2 313 |
Se destacan las especies con mayor número de registros, las cuales fueron: Herbertus juniperoideus (Sw.) Grolle con 91 muestras, Syzygiella rubricaulis (Nees) Steph (84), Thuidium peruvianum Mitt (81), Leptodontium viticulosoides (P. Beauv.) Wijk & Margad (81), Hypnum amabile (Mitt.) Hampe (70), Polytrichum juniperinum Hedw (61), Lepicolea pruinosa (Taylor) Spruce (60), Frullania convoluta Lindenb. & Hampe (56), y Sphagnum magellanicum Brid (54).
Finalmente, Nothoceros vincentianus (Lehm. & Lindenb.) J.C. Villarreal que fue la única especie de antocerote encontrada en los complejos de páramos de Boyacá y Anthoceros tristanianus J.C. Villarreal, J.J. Engel & Váňa para el complejo de Sierra Nevada del Cocuy (Peñaloza-Bojacá et al., 2020).
La preferencia de sustratos mostró que, el mayor porcentaje de especies fue para el terrícola con un 33.47 % (Tabla 2), seguido del cortícola (27.91 %), saxícola (13.67 %), madera en descomposición (11.78 %), epífito (4.66 %) y reófilo (3.03 %). Asimismo, se identificaron especies, en los sustratos turberas (0.90 %), epífilas (0.82 %) y raíz aflorante (0.49 %). Finalmente, el 3.27 % de las muestras revisadas en las colecciones, no fue posible asociarla a ningún sustrato, ya que al revisar su etiqueta y/o bases de datos, no registraba o no fue posible determinar el tipo de sustrato al que pertenecía la muestra/especie.
Tabla 2 Número de especies y registros de briófitos por tipo de sustrato. / Table 2. Number of species and records of bryophytes by type of substrate.
| Sustrato | N° de registro | N° de especies |
| Terrícola | 2 529 | 409 |
| Cortícola | 1 544 | 341 |
| Saxícola | 443 | 167 |
| Madera en descomposición | 308 | 144 |
| Epífito | 96 | 57 |
| Reófilo | 90 | 37 |
| No registra/No encontradas | 75 | 40 |
| Turbera | 17 | 11 |
| Epífila | 13 | 10 |
| Raíz Aflorante | 17 | 6 |
Análisis de la estructura de las comunidades (representatividad del muestreo): la completitud del muestreo en los complejos de páramo de Boyacá fue del 98 %, lo cual significa que el muestreo es representativo, registró el 99 % de taxa para el complejo TBM (Fig. 2), 98.7 % Rabanal- Río Bogotá, 99 % en Guantiva-La Rusia, 99 % para Iguaque-Merchán, 98.6 % Sierra Nevada del Cocuy y Pisba 98.4 %.
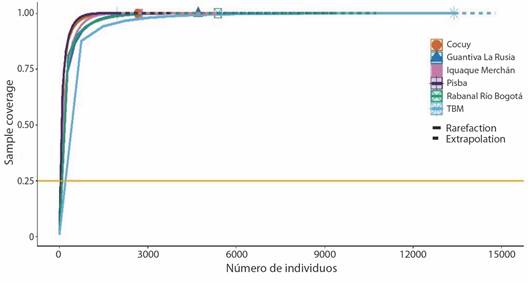
Fig. 2 Curva de completitud de muestreo (número de individuos) de briófitos en los complejos de páramos de Boyacá. Línea sólida ''rarefacción'' (número de especies observadas) y línea punteada ''extrapolación'' (número de especies esperadas). / Fig. 2. Sampling completeness curve (number of individuals) of bryophytes in Boyacá páramo complexes. Solid line ''rarefaction'' (number of species observed) and dotted line ''extrapolation'' (number of species expected).
Para cada complejo de páramos se observó que al duplicar el tamaño de muestra de referencia (5 132 muestras) en términos de individuos (TBM (2 231), Rabanal-Río Bogotá (896), Guantiva-La Rusia (785), Iquaque-Merchán (452), Sierra Nevada del Cocuy (441) y Pisba (327)), la completitud de muestreo será la misma con un intervalo de confianza del 95 %, y la riqueza seguiría siendo superior en TBM que, en Pisba, aun cuando todas las especies existentes fuesen registradas (Fig. 3).
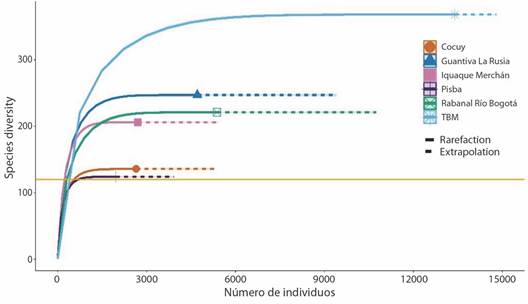
Fig. 3 Número de individuos en cada uno de los complejos de páramos de Boyacá. / Fig. 3. Number of individuals in each of the Boyacá páramo complexes.
Estructura ecológica de comunidades: el complejo TBM presentó el mayor número de especies efectivas (0D) con 368 especies (213 musgos, 154 hepáticas y un antocerote), seguido por el complejo Guantiva-La Rusia con 247 taxa (182/64/1), Rabanal-Río Bogotá 221 (121/100), Iguaque-Merchán 207 (95/112), Sierra Nevada del Cocuy 135 (104/30/1), y Pisba 124 (90/34) taxa, siendo este el complejo con menor diversidad (Fig. 4).
Por otro lado, el orden 1D mostró que el complejo TBM presentó el mayor valor de especies efectivas (abundancias relativas) con 178, Guantiva-La Rusia (162), Iguaque-Merchán (162), Rabanal-Río Bogotá (125), Sierra Nevada del Cocuy (97), y Pisba (92) que registró la menor cantidad de especies comunes (Fig. 4). Es así como, TBM presentó 16 especies más que Guantiva-La Rusia, que es el segundo más diverso y 86 taxa más con relación a Pisba, siendo el complejo menos diverso.
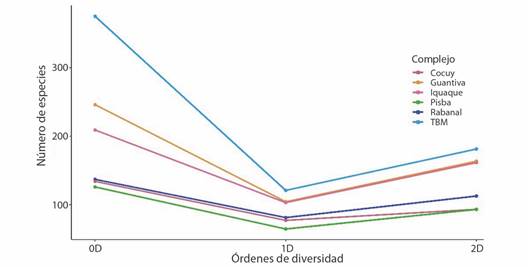
Fig. 4 Perfil de diversidad de los órdenes cero (0D), uno (1D) y dos (2D) de los briófitos en los complejos de páramos. / Fig. 4. Diversity profile of orders zero (0D), one (1D) and two (2D) of the bryophytes in the páramo complexes.
Para el orden 2D, se determinó que los complejos TBM, Guantiva-La Rusia y Iguaque-Merchán, presentaron mayor número de especies dominantes efectivas (181, 164 y 161 respectivamente), seguido por Rabanal-Río Bogotá (113), y finalmente, Sierra Nevada del Cocuy y Pisba con menor dominancia de especies (93) cada uno (Fig. 4).
Por otro lado, el orden 0D (el mayor número de especies efectivas) y 1D (el mayor valor de especies efectivas (abundancias relativas), mostraron que el sustrato terrícola presentó el mayor valor con 401 especies y 220 especies efectivas respectivamente, cortícola (241/186), saxícola (167/101), madera en descomposición (144/105), epífito (57/46), no registra (40/33), reófilo (37722), epífila (10/9), la menor cantidad de especies efectivas fueron halladas en los sustratos turbera y raíz aflotante (6/4). El sustrato terrícola presentó 160 taxa más con respecto al cortícola y con relación al sustrato menos diverso (raíz aflorante) se presentaron 395 especies más.
Para el orden 2D, se determinó que los sustratos terrícola y cortícola presentaron mayor número especies dominantes efectivas (141 y 107 respectivamente), seguido de madera en descomposición (73), saxícola (58), epífito (35), reófilo (14), epífila (9), y turbera (7). Finalmente, la raíz aflorante, con menos especies (4).
Diversidad beta: los resultados indican que los páramos presentan alrededor del 73 % (b SOR = 0.7313) de la disimilitud en la composición de especies (Fig. 5); en este sentido, dicha disimilitud es el resultado tanto del anidamiento (b SNE= 0.1144) como del recambio de especies (b SIM= 0.6169). El análisis clúster mostró dos grandes grupos, el primero con un 55 % de disimilitud que se encuentra constituido por Iguaque-Merchán, Rabanal-Río Bogotá, Guantiva-La Rusia, TBM, y el otro con un 60 % de disimilitud que está conformado por Cocuy y Pisba. A su vez, dentro del primer grupo, los páramos Guantiva-La Rusia y TBM mantienen mayor relación con un 45 % de disimilitud.
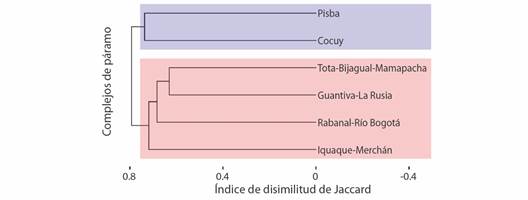
Fig. 5 Dendrograma de la disimilitud de Jaccard entre los seis complejos de páramos de Boyacá, se destaca la formación de dos grandes grupos (rojo y azul). / Fig. 5. Dendrogram of the Jaccard dissimilarity between the six Boyacá páramo complexes, the formation of two large groups (red and blue) stands out.
La diversidad beta para la composición de las especies por sustratos fue cercana al 86 % (b SOR= 0.8587) (Fig. 6), el 35 % (b SNE= 0.3469) corresponde al anidamiento de las especies en los sustratos, y el 51 % (b SIM= 0.5117) por el recambio de especie. El análisis de clúster estableció tres agrupaciones: un primer grupo formado por reófilo (6) y turbera (9), difieren en un 41 %; el segundo grupo conformado por epífila (2) y terrícola (8) que no difieren entre sí, pero se contrasta en un 27 % con el sustrato madera en descomposición (4), y el tercer grupo, formado por cortícola (1) y epífito (3) difieren en un 17 % entre ellos, y se relacionan en un 25 % con raíz aflorante (5) y saxícola (7) que no discrepan entre sí.
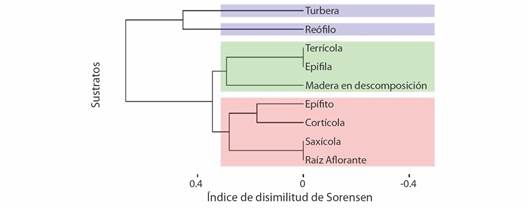
Fig. 6 Dendrograma de la disimilitud de Sorensen de los diferentes sustratos en los páramos. Se destaca la formación de tres grandes grupos (azul, verde y rojo). / Fig. 6. Dendrogram of the Sorensen dissimilarity of the different substrates in the páramos. The formation of three large groups (blue, green and red) stands out.
La diversidad beta basada en las medias de disimilitud, mostró un 51 % de la discrepancia de la composición de especies en los sustratos, y se debe al reemplazo de especies entre zonas con mayor o menor cercanía, es así como 98 especies (por ejemplo, Herbertus juniperoideus (Sw.) Grolle, Syzygiella rubricaulis (Nees) Steph., Thuidium peruvianum Mitt., Leptodontium viticulosoides (P. Beauv.) Wijk & Margad., Hypnum amabile (Mitt.) Hampe., Polytrichum juniperinum Hedw y Lepicolea pruinosa (Taylor) Spruce) se comparten en los sustratos terrícola, cortícola y saxícola, mientras que, cinco taxones (por ejemplo, Riccardia poeppigiana (Lehm. & Lindenb.) Hässel y Lophocolea fragmentissima R. M. Schust.) están únicamente en el sustrato epífilo; también fueron halladas, cuatro taxa en zonas reófilas (tales como, Fontinalis bogotensis Hampe y Isotachis lacustris Herzog).
Discusión
Este trabajo genera información en torno a la diversidad de los briófitos en los complejos de páramos de Boyacá, con 601 especies para el departamento, que representa el 36.05 % de la diversidad colombiana, y un 2.96 % a nivel mundial. Lo anterior, indica una alta representatividad del muestreo (> 98 % de cobertura) en estas áreas, con presencia de algunas especies restringidas a dichos ecosistemas como Bazzania placophylla (Taylor) Grolle, Isotachis lopezii (R. M. Schust.) Gradst, Jensenia florschuetzii Gronde, Lophonardia jamesonii (Mont.) L. Söderstr. & Vana, Pleurochaete luteola (Besch.) Thér, Sphagnum boyacanum H. A. Crum, Sphagnum cuspidatum Hoffm y Sphagnum cleefii H. A. Crum. Además, la similitud de las especies se da por el recambio entre complejos de páramos.
Las familias más diversas en este estudio (Lejeuneaceae, Lepidoziaceae, Pottiaceae, Plagiochilaceae, Bartramiaceae, Dicranaceae, Frullaniaceae, Metzgeriaceae, Amblystegiaceae, Hypnaceae, Sphagnaceae, Aneuraceae y Pallaviciniaceae) también son representativas de los páramos (Hallingbäck & Hodgetts, 2000); no obstante, estas taxa son igualmente diversas en otros hábitats (bosques altoandinos) (Churchill & Linares, 1995), al igual que en otras regiones del Neotrópico (Gradstein et al., 2001). La abundancia de las familias indicadas anteriormente en los complejos de páramos se debe a la heterogeneidad de hábitats y sustratos; al igual que características específicas de estos grupos como las formas de crecimiento reptantes, tapetes y cojines que pueden ser gruesos o laxos, del mismo modo, células de las hojas con paredes gruesas, que pueden actuar como adaptaciones para sobrevivir a estos ecosistemas (Churchill & Linares, 1995; Gradstein, 2021).
Para el complejo Guantiva-La Rusia se encontraron 247 taxa en este trabajo, mientras que, Martínez et al. (2019) hallaron 128 especies de musgos, es así que, aumentó el registro de la brioflora en un 48 % para el complejo, por la vinculación no solo de hepáticas, sino de nuevos registros de musgos. En el complejo de Rabanal-Río Bogotá se encontraron 221 especies de briófitos, mientras que, Moreno et al. (2018) halló 121 taxa, y Acosta y Sanabria (2021) registraron 106 taxones epífitos con mayor representatividad de hepáticas (58.5 %). Con este estudio se aumenta en 87 especies la brioflora en el complejo, pese a que la zona presenta ~ 45 % de sus áreas naturales con afectación por parte del hombre (Morales et al., 2007).
A partir de este trabajo se presenta para la Sierra Nevada del Cocuy 136 especies de briófitos (30 hepáticas, 105 musgos y un antocerote), no obstante, Mejía y Castro (2018) recolectaron 80 taxa de musgos, en sustratos epífitos y rupícolas entre los 1 200 a 4 500 m; con este estudio se aumenta en 40.74 % el registro de flora de briófitos, gracias a la variabilidad de hábitats y sustratos evaluados (Mejía & Castro, 2018). Con relación al complejo de Iguaque-Merchán se amplían los datos en un 38.4 % para el área, con la inclusión de hepáticas y nuevos datos de musgos, en 209 especies (Morales et al., 2007).
En este estudio fueron hallados 368 taxones para el complejo TBM, que contrastan con los datos de Gil-Novoa (2017) que encontró 261 especies, lo cual muestra un incremento significativo (29.5 %) en la riqueza de especies; probablemente esta disminución en la diversidad de este grupo de plantas en los páramos, se deba a los procesos asociados al cambio climático (aumento de la temperatura y estacionalidad climática), así como intensificaciones de actividades de agricultura, ganadería y minería (Garavito, 2015; Peyre, 2018).
La mayor preferencia de las especies por un sustrato se presenta en el terrícola con 409 registros, le sigue cortícola (341) y saxícola (167), evidenciado en los estudios de Gil-Novoa (2017) en el complejo TBM, con briófitos en sustratos terrestres y cortícolas, y esta misma tendencia se observó en los estudios de Martínez et al. (2019), y Porras-López y Morales-Puentes (2020) para Guantiva-La Rusia, que trabajaron en varios sustratos en dicho complejo. Aunque existen estudios en Colombia, no hay un referente que permita cotejar de una manera precisa y actual, los musgos, hepáticas y antocerotes versus los sustratos en dichas zonas.
El análisis de diversidad de los órdenes 0D y 1D mostraron que el complejo TBM es el más rico, diverso y dominante, y donde se halla el 60 % de las especies, todas ellas de origen Neotropical (Gil-Novoa et al., 2020), esto debido a las variaciones climáticas y altitudinales de esta región (Glime, 2021), que se ve reflejada en la temperatura (10 ºC) y precipitaciones (1 522 mm/año), además, de una de mayor humedad (~90 % en el flanco oriental), lo cual puede ser consecuencia de la presencia de bosques altoandinos conservados (Gil-Novoa, 2017), y puede generar disponibilidad de agua y por lo tanto, un mayor número de especies.
En el caso del complejo de Pisba, que presenta la menor riqueza (124 especies), diversidad y dominancia, causada por el grado de perturbación generado por actividades como la minería, extensión de tierras para ganadería y cultivos que se presenta en esta área, lo cual disminuye no solo las coberturas de briófitos, sino también los hábitats potenciales donde estas ocurren (Amaya & Duran, 2017).
El análisis de diversidad beta explica que el 62 % de disimilitud total entre complejos se debe al recambio de especies (Fig. 4); de esta manera, el análisis clúster mostró una agrupación formada por los complejos Pisba y TBM, que a su vez se relacionan con Guantiva-La Rusia, y divergen de Sierra Nevada del Cocuy, Rabanal-Río Bogotá e Iguaque-Merchán. Lo que es soportado por el grado de conectividad que existe o existió entre dichos complejos, como resultado de la variabilidad topográfica y las oscilaciones climáticas que se presentaron en los páramos del norte de los Andes desde el Plioceno; es así que, en los períodos fríos y secos, estas zonas de páramo aumentaron su extensión y no alcanzaban altitudes considerables, lo que permitió una mayor conectividad con otras zonas del norte de los Andes; mientras que, en los periodos cálidos se presenta un aislamiento en las zonas altas y una reducción en su área (Hofstede et al., 2014; Flantua et al., 2019).
La diversidad beta se basa en las medias de disimilitud y mostró un 51 % de la discrepancia de la composición de especies en los sustratos, y se debe al reemplazo de especies entre zonas con mayor o menor cercanía. Lo anterior, probablemente se debe a la influencia de las condiciones climáticas dadas por el levantamiento de los Andes, al cambio de temperatura en el gradiente altitudinal (0.6-0.7 ºC/100 m), al igual que la humedad ambiental (0.6-0.8 %) que regula las fluctuaciones térmicas diarias en zonas de páramo (Cuesta et al., 2012). Dichas variaciones generan nichos ambientales colonizados por briófitos, gracias al desarrollo de adaptaciones fisiológicas y ecológicas que soportan estas condiciones (capacidad de dispersión por esporas, presencia de eláteres y pseudoeláteres, peristoma y setas altas) (Hofstede et al., 2014; Patiño & Vanderpoorten, 2018).
Sin embargo, el bajo recambio de especies, como resultado de un filtro ecológico juega un papel limitante en la diversificación, relacionado con el conservadurismo del nicho en el Neotrópico para este grupo, lo que deja la idea que no necesariamente la riqueza de especies de briófitos es baja en áreas pequeñas o que el número de especies disminuye con el gradiente altitudinal (Peña-Retes & Delgadillo-Moya, 2020).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


