Introducción
Los peces son el grupo de vertebrados que presenta mayor diversidad morfológica y ecológica, lo que se refleja principalmente en la variedad de estrategias reproductivas altamente desarrolladas (Rodao, 2015). Los miembros de la familia Sciaenidae, son comúnmente conocidos como peces tambores o roncadores, nombre que proviene de los sonidos que producen usando su desarrollada vejiga natatoria (VN) como cámara de resonancia, que se originan gracias a vibraciones de músculos especiales insertados en sus paredes, y a su vez permite localizar bancos de corvinas a grandes distancias (Lagardére & Mariani, 2006; Prista et al., 2007) principalmente en los momentos reproductivos donde se ha registrado mayor actividad y diferenciación en la frecuencia de los sonidos, lo que implica gran importancia en su ecología reproductiva (Cárdenas, 2012).
El género Plagioscion es un representante de la familia Sciaenidae, con especies distribuidas en América del Sur. Por su parte, Colombia cuenta con dos especies del género, siendo Plagioscion magdalenae (Steindachner, 1878), comúnmente llamada Pácora, la que se distribuye en la cuenca del Magdalena-Cauca (García-Alzate et al., 2020). Estudios previos han descrito histológicamente el ciclo ovárico de la especie (Bayuelo & Sanz, 2003), además su categoría de amenaza de Vulnerabilidad en la cuenca del Magdalena y de Casi Amenazada en toda Colombia (Álvarez-León & Jiménez-Segura, 2012), aspectos sobre su ecología reproductiva (Rojas-Luna & García-Alzate, 2022) y la variabilidad fenotípica de sus poblaciones en el bajo Magdalena (Hernandez et al., 2023). De igual forma, en Brasil, Souza-Costa et al. (2019) definieron algunas características morfológicas asociadas a la vejiga natatoria de la especie, con el fin de construir relaciones filogenéticas dentro del género, teniendo en cuenta la revisión taxonómica del género hecha por Casatti (2005) quien estableció caracteres morfológicos de la vejiga como sinapomorfías para identificación de las especies de Plagioscion.
P. magdalenae es una especie que se encuentra principalmente distribuida en la cuenca baja y media del Magdalena-Cauca, predomina en ciénagas por debajo de los 100 m.s.n.m. y es considerada rara en la zona media debido a su baja abundancia; aunque es una especie migratoria de Colombia con desplazamientos entre 100 y 500 km, no ha sido registrado un movimiento más allá del Magdalena medio (Mojica et al., 2006; Ortega-Lara et al., 2011). No tiene distribución en la cuenca alta del Magdalena-Cauca ni en la cuenca del río Amazonas perteneciente a Colombia (DoNascimiento et al., 2021; García-Alzate et al., 2020). Era una especie considerada endémica de Colombia hasta que su rango de distribución se amplió a la cuenca del Amazonas en Brasil (Casatti, 2005) e indica una gran desconexión entre las poblaciones distribuidas de ambos países. Por lo tanto, es pertinente en Plagioscion magdalenae conocer las estructuras que desarrollan un rol importante en su ecología y sean claves para su identificación taxonómica, como la vejiga natatoria a modo de órgano emisor de sonidos como se ha descrito para las especies de la familia Sciaenidae y el sistema reproductor masculino con el fin de aumentar el conocimiento de su biología básica para establecer estrategias de conservación y posterior reproducción en cautiverio. Generalmente, los sonidos producidos por peces son específicos de cada especie y están asociados con comportamientos y contextos particulares (Ladich, 2015), por lo que pueden usarse como una etiqueta natural a partir de sonidos para detectar, localizar y monitorear la presencia de distintas especies (Luczkovich et al., 2008; Martínez-Medina et al., 2021; Picciulin et al., 2013; Širović et al., 2009).
Asimismo, el conocimiento de los cambios morfológicos en las gónadas a través del tiempo, son de gran importancia ya que permiten comprender la biología reproductiva de la especie, su potencial reproductivo, talla del primer desove y talla media de madurez (Castro, 2011). Sin embargo, estos aspectos reproductivos no describen la forma en que se lleva a cabo la maduración de las células germinales, tampoco permiten determinar con exactitud el estado de madurez y menos aún la estructura y el desarrollo de la gónada. Por ello, se recomienda utilizar criterios anatómicos e histológicos, para describir con mayor precisión el tipo de estructura y ciclo gonadal, conocimiento que es limitado a pocos taxones (Schulz & Nóbrega, 2011).
Teniendo en cuenta que ya se conoce el desarrollo reproductivo de las hembras, algunos aspectos ecológicos de la reproducción de la especie y no se ha realizado un estudio histológico de las gónadas masculinas de la Pácora que permita determinar las fases del desarrollo gametogénico y las características de las células espermáticas, teniendo en cuenta los estadios de madurez gonadal; como también no se ha hecho una comparación entre las características morfológicas de la vejiga natatoria de las poblaciones de P. magdalenae en la cuenca del río Magdalena (localidad tipo) con las distribuidas en Brasil. Por ende, se hizo necesario realizar (i) un estudio histomorfológico del sistema reproductivo de los machos para analizar el desarrollo gonadal relacionado con la espermatogénesis y (ii) discutir sobre las implicaciones del estudio de la vejiga natatoria en la taxonomía y distribución geográfica válida de P. magdalenae.
Materiales y métodos
Área de estudio: El presente estudio se llevó a cabo en el embalse El Guájaro (10º25'-10º38' N & 75º00'-75º08' W; 3-13 m.s.n.m), el cual tiene un área de 13 000 ha y se encuentra ubicado en la ribera derecha del Canal del Dique del río Magdalena, al suroccidente del departamento del Atlántico, costa Caribe colombiana. Las aguas provenientes del centro y sur del Atlántico son recibidas por el embalse El Guájaro, cuya fuente principal es aguas de escorrentía y el Canal del Dique, el cual sirve de conector a través de un sistema de compuertas en el sur del embalse con el río Magdalena (Morales & García-Alzate, 2016; Rojas-Luna & García-Alzate, 2022).
El embalse El Guájaro es considerado el cuerpo de agua más grande e importante del departamento del Atlántico, sin embargo, posee problemas ambientales históricos asociados a componentes naturales y antrópicos: vertimiento de aguas residuales domésticas y agroindustriales sin tratamiento previo, contaminación por residuos sólidos, afección por la prolongación de los períodos de lluvias y sequías (La Niña y El Niño), deforestación, erosión, sedimentación y una pobre gestión de normativas pesqueras lo que provoca problemas para las poblaciones de las especies de peces (García-Alzate et al., 2016).
Fase de campo: Se realizaron siete muestreos de recolecta, comprendidos en dos momentos: muestreos bimensuales entre octubre de 2019 y febrero de 2020, y muestreos mensuales entre octubre 2020 y enero 2021, con el fin de abarcar los momentos del pulso de inundación del embalse: aguas subiendo, aguas altas, aguas bajando (Fig. 1A). Las épocas establecidas del pulso de inundación del embalse se basaron en García-Alzate et al. (2016), el nivel del agua de El Guájaro mediante el promedio de estación AcuaCultivos (2019-2021) y los datos del nivel del agua del río Magdalena (Fig. 1B) fueron extraídos de los datos históricos de la estación Calamar (CORMAGDALENA, desde 2019 a 2021). Se colectaron 142 muestras en los siete eventos de muestreo; para los métodos de recolecta y preservación de las gónadas con formalina tamponada al 10 % véase en Rojas-Luna & García-Alzate (2022).
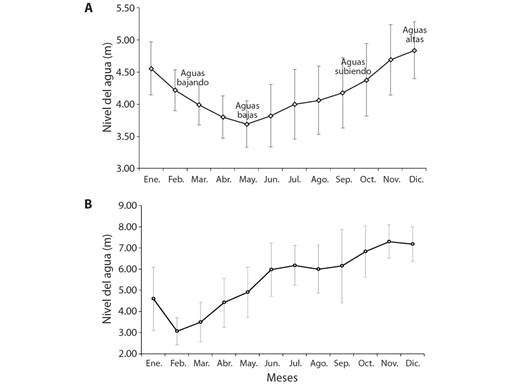
Fig. 1 A. Promedio histórico ± DE del nivel del agua del embalse El Guájaro, de la estación AcuaCultivos (2019-2021), y pulso de inundación modificado de García-Alzate et al. (2016). B. Promedio histórico ± DE del nivel del agua del río Magdalena a la altura de Calamar-Atlántico (2019-2021) tomado de Cormagdalena con apoyo de IDEAM. / Fig. 1. A. Historical mean ± SD water level of El Guájaro reservoir, from AcuaCultivos station (2019-2021), and flood pulse modified from García-Alzate et al. (2016). B. Historical mean ± SD Magdalena river water level at Calamar-Atlántico (2019-2021) taken from Cormagdalena with assistance from IDEAM.
La investigación contó con un permiso otorgado por la Autoridad Nacional de Licencias Ambientales (ANLA, resolución 949 del 2016) en el marco de recolección de especímenes de especies silvestres con fines de investigación científica no comercial concedido a la Universidad del Atlántico, con la aprobación del Ministerio de Educación Nacional (SNIES). Además, al momento de la colecta de organismos, se tuvo en cuenta todas las consideraciones éticas determinadas en el Estatuto Nacional de Protección de los Animales (Ley 84 de 1989), ya que P. magdalenae es una especie en categoría Vulnerable en la cuenca del Magdalena y en categoría Casi Amenazada a nivel nacional según el Libro Rojo de peces dulceacuícolas de Colombia (Mojica et al., 2012).
Para evaluar el periodo de maduración de las gónadas, se determinó el sexo y los estados de maduración gonadal a nivel macroscópico de cada individuo de manera in situ y se realizaron comparaciones con parámetros establecidos en escalas de maduración sexual propuesta Brown-Peterson et al. (2011) y contrastado con lo descrito por Vazzoler (1996) y Bayuelo y Sanz (2003). Posteriormente, los estados fueron corroborados mediante histología.
Fase de laboratorio: Se calculó la relación peso de gónada/peso total, mediante una gráfica a partir de una ecuación de regresión potencial. El total de ejemplares se distribuyeron en tallas según su longitud estándar. Para estimar los aspectos reproductivos se estableció la proporción de sexos (Wenner, 1972) global, en el tiempo y por clase de tallas, a partir de la siguiente ecuación:
% Machos = 100 × (Nm/Nt)
Donde Nm es el número de machos y Nt el número total de individuos.
Además, se realizó un histograma de frecuencia de los estados de madurez sexual en el tiempo, para determinar las épocas de madurez de los machos de la especie.
i) Histología del testículo: Después de la preservación con formalina, se lavaron las muestras en etanol al 70 %, luego se procedió a deshidratar y aclarar los tejidos en una batería de alcoholes y xiloles (Vazzoler, 1996). Posteriormente, se incluyó la muestra en parafina y se realizaron los cortes histológicos de más o menos 5 µm con la ayuda de un micrótomo de rotación Leitz Wetzlar. Estos cortes fueron coloreados con la tinción histológica de Hematoxilina-Eosina según los parámetros propuestos por Bravo-García (2011). Las placas histológicas fueron analizadas en el Laboratorio de Histología de la Universidad del Atlántico, usando para su observación el microscopio óptico Leica DM500, con cámara incorporada Leica ICC50 HD.
ii) Morfometría de la vejiga natatoria: Para el análisis de las medidas morfométricas con implicaciones taxonómicas se tuvo en cuenta 29 especímenes no tipos depositados en la Colección Científica de la Universidad del Atlántico Región Caribe-UARC-IC, con el fin de abarcar la mayor variación de las medidas de la especie en diferentes cuerpos de agua de la cuenca del río Magdalena. Localidad tipo de la especie (Cuenca del río Magdalena): Colombia, departamento del Atlántico, cuenca baja del río Magdalena, embalse El Guájaro, municipio de Sabanalarga, corregimiento de La Peña UARC-433-IC (un espécimen), UARC-441-IC (un espécimen), UARC-444-IC (dos especímenes), UARC-447-IC (dos especímenes; Fig. 2), septiembre 2014; embalse El Guájaro, municipio de Repelón UARC-645-IC (cuatro especímenes, 140-190 mm SL, Diciembre 2014), UARC-655-IC (dos especímenes, abril 2015), UARC-784-IC (cinco especímenes, 124-195 mm SL, febrero 2016), UARC-804-IC (dos especímenes, abril 2018). Departamento del Atlántico, cuenca del río Magdalena, Canal del Dique, municipio de Santa Lucía, 10°23'04.4'' N & 75°03'48.9'' O, UARC-554-IC (un espécimen, noviembre 2014). UARC-418-IC (un espécimen), departamento de Bolívar, cuenca del río Magdalena, ciénaga El Tupe, municipio Higueretal, 10°21'49'' N & 75°05'33.9'' O, marzo 2014. UARC-518-IC (dos especímenes, noviembre 2014, 10°20'56.6'' N & 75°00'20'' W), UARC-634 (un espécimen, diciembre 2014), UARC-751-IC (tres especímenes, 125-150 mm SL, julio 2015), 10°18'33.9'' N & 75°02'13.9'' W, departamento de Bolívar, cuenca del río Magdalena, ciénaga El Jobo, municipio de Calamar, corregimiento de Hato Viejo. UARC-321-IC (dos especímenes), departamento del Atlántico, cuenca baja del río Magdalena, municipio de Ponedera, ciénaga El Uvero, 10°34'41.8'' N & 74°44.51'1.7'' W, febrero 2013.

Fig. 2 Plagioscion magdalenae, capturado en el embalse El Guájaro, La Peña en el departamento del Atlántico, Cuenca baja del río Magdalena, Colombia. Escala: 4 cm. Macho. / Fig. 2. Plagioscion magdalenae, captured in El Guájaro reservoir, La Peña in the department of Atlántico, lower Magdalena River Basin, Colombia. Scale: 4 cm. Male.
Se analizaron los caracteres diagnósticos para la identificación de las especies de Plagioscion propuestos por Casatti (2005) como: la forma de la vejiga natatoria, su ubicación dentro de la cavidad abdominal, longitud estándar del individuo (SL), longitud de la aleta pectoral, longitud de la cabeza (HL), distancia del ano a la aleta anal, diámetro horizontal de la órbita del ojo, ancho interorbital y longitud de la segunda espina de la aleta anal. Además, se tuvieron en cuenta los caracteres descritos por Souza-Costa et al. (2019) para los individuos de P. magdalenae distribuidos en Brasil: presencia o ausencia de apéndices con forma de cuernos en la VN (carácter 20 en el artículo mencionado), longitud de los apéndices anteriores de la VN (carácter 21), forma de dichos apéndices (carácter 22) y los apéndices de la VN forman estructuras tubulares desde el extremo anterior hasta el extremo posterior (carácter 23). De igual forma, se midió la longitud y el ancho de las bandas musculares asociadas a la VN de las muestras recolectadas en campo.
Análisis de datos: Para estimar la normalidad de los datos morfométricos se utilizó la prueba de Shapiro-Wilk; para evaluar el grado de asociación entre el peso de la gónada-peso total, se recurrió al coeficiente de correlación de Spearman al tratarse de datos no paramétricos. Por otro lado, una vez se determinó la proporción sexual se aplicó una prueba chi-cuadrado con el fin de establecer si había diferencias estadísticamente significativas para cada estimación (población, tiempo y tallas).
Resultados
Aspectos ecológicos: Se recolectaron 142 ejemplares, 66 machos (46.5 %), 73 hembras (51.4 %) y tres individuos juveniles que no se les pudo determinar el sexo (2.1 %), se observó una relación 1.1:0.9 hembra-macho sin diferencias significativas (Chi2: 8.54, P = 0.2). Los machos fueron más abundantes principalmente en los meses de febrero (aguas bajando), diciembre (2019; aguas altas) y octubre (2020; aguas subiendo) con 16 (11.3 %), 12 (8.4 %) y 12 (8.4 %) ejemplares, respectivamente (Fig. 3). Es importante mencionar que se evidencia una distribución de sexos equilibrada por parte de los individuos capturados durante ambas campañas de muestreo, excepto en el momento de aguas subiendo donde se observa predominio de las hembras con respecto a los machos, soportada por diferencias significativas (Chi2: 5.11, P-valor = 0.02).
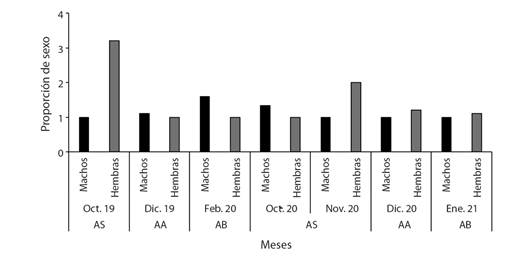
Fig. 3 Número de individuos por meses para machos y hembras de Plagioscion magdalenae en el embalse El Guájaro, bajo Magdalena, Colombia. AS: aguas subiendo, AA: aguas altas, AB: aguas bajando. / Fig. 3. Number of individuals per month for males and females of Plagioscion magdalenae in El Guájaro reservoir, lower Magdalena, Colombia. AS: rising water, AA: high water, AB: waters going down.
Se estimaron cuatro intervalos de tallas (I a IV), los individuos presentaron longitudes estándar entre los 14.5 y 57.5 cm, donde la mayoría presentaron longitudes entre 21.9 y 29.1 cm (talla II) con 55 individuos (39.6 %), seguido de la talla I (14.5-21.8 cm) con 43 individuos (30.9 %) y la talla III (29.2-36.5 cm) con el 23.7 % (33 individuos); por otro lado, el menor número de ejemplares (8, 5.8 %) se vio reflejado en la talla IV (36.6-58.5 cm; Fig. 4). La longitud máxima registrada fue de una hembra (68 cm de longitud total, 57.5 cm de longitud estándar y 4.5 kg de peso), lo que guarda relación con que en las tres tallas de individuos más grandes predominó el sexo femenino, a diferencia de la talla más pequeña (I) donde fue mayor la presencia de individuos machos; sin embargo, no se registraron diferencias estadísticamente significativas (Chi2: 6,73, P-valor: 0.08).
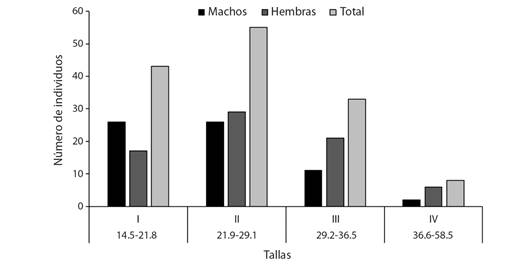
Fig. 4 Distribución de frecuencias relativas por clase de longitudes para machos y hembras de Plagioscion magdalenae en el embalse El Guájaro, bajo Magdalena, Colombia. / Fig. 4. Relative frequency distribution by length class for males and females of Plagioscion magdalenae in El Guájaro reservoir, lower Magdalena, Colombia.
En los machos el incremento del peso del testículo y el peso total del cuerpo fue ajustada a un modelo potencial, sin embargo, debido a la baja variación en el peso del testículo, el coeficiente de determinación fue bajo (R2 = 0.55). Sin embargo, se refleja una alta relación entre estas métricas, donde el peso del cuerpo en los machos va a estar ligado al estado de maduración de sus gónadas como se reflejó en el coeficiente de correlación de Spearman (R= 0.79, P < 0.05; Fig. 5). Se corrobora el asincronismo característico de las especies pertenecientes a la familia Sciaenidae, ya que durante todos los meses de muestreo (excepto octubre-20) el estado de madurez sexual que predominó fue el estado maduro (III) para ambos sexos (Fig. 6). Esto indica que la especie está permanentemente madurando individuos para realizar eventos reproductivos secundarios o desoves parcelados como estrategia reproductiva para el mantenimiento poblacional de la misma. Además, en cinco de los siete eventos de muestreo se registraron individuos juveniles (algunos sin llegar a la diferenciación gonadal).
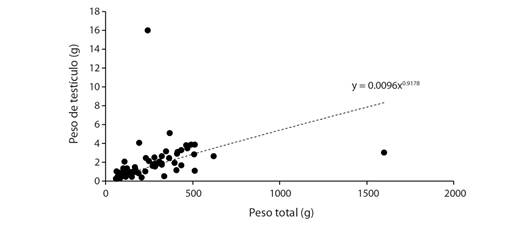
Fig. 5 Relación de peso total y peso de la gónada para machos de Plagioscion magdalenae en el embalse El Guájaro, bajo Magdalena, Colombia. / Fig. 5. Ratio of total weight and gonad weight for males of Plagioscion magdalenae in El Guájaro reservoir, lower Magdalena, Colombia.
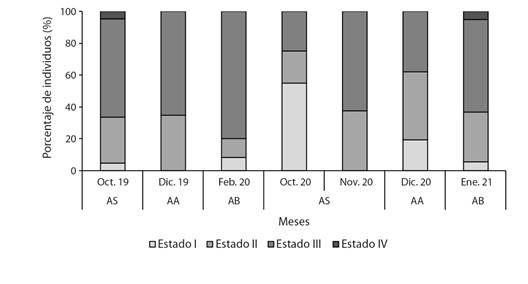
Fig. 6 Frecuencia relativa (%) de estados de madurez sexual para sexos agrupados de Plagioscion magdalenae en el embalse El Guájaro, bajo Magdalena, Colombia. / Fig. 6. Relative frequency (%) of sexual maturity stages for grouped sexes of Plagioscion magdalenae in El Guájaro reservoir, lower Magdalena, Colombia.
Morfología de la vejiga natatoria: La vejiga natatoria de P. magdalenae tiene la forma gruesa y alargada similar a un cono (o forma de zanahoria), sin ningún tipo de apéndices, con la región anterior redondeada y la posterior se reduce, termina en punta aguda (Fig. 7). Está situada en la zona dorsal de la cavidad celómica, es unicameral y en los machos posee una banda de músculos intrínsecos ubicados a cada lado de la misma, unidos a la aponeurosis, membrana fibrosa que fija la vejiga natatoria a la pared abdominal (Fig. 8A).

Fig. 7 A. Vista dorsal. B. Ventral de la vejiga natatoria de Plagioscion magdalenae, UARC-751-IC, macho, Cuenca baja del río Magdalena, Colombia. / Fig. 7. A. Dorsal. B. Ventral view of the swimbladder of Plagioscion magdalenae, UARC-751-IC, male, lower Magdalena River Basin, Colombia.
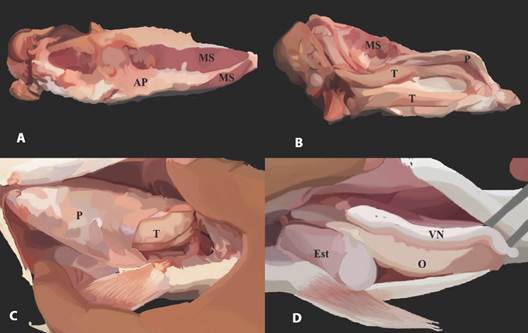
Fig. 8 Vejiga natatoria de Plagioscion magdalenae de la Cuenca del río Magdalena, Colombia. A. Vista dorsal. B. Ventral de la musculatura asociada a la vejiga natatoria y ubicación con respecto a los testículos. C. Vista de los testículos recubiertos por el peritoneo en individuos machos. D. Vista de la vejiga natatoria con ausencia de músculos en individuos hembras. MS: Músculo sónico, AP: Aponeurosis, T: Testículos, P: Peritoneo, VN: Vejiga natatoria, O: Ovarios, Est: Estómago. / Fig. 8. Swim bladder of Plagioscion magdalenae from the Magdalena River Basin, Colombia. A. Dorsal view. B. Ventral view of the musculature associated with the swimbladder and its location with respect to the testes. C. View of the testes covered by the peritoneum in male individuals. D. View of the swimbladder with absence of muscles in female individuals. MS: Sonic muscle, AP: Aponeurosis, T: Testes, P: Peritoneum, VN: Swimbladder, O: Ovaries, Est: Stomach.
El órgano del sonido de P. magdalenae solo está presente en los machos, lo que indica un dimorfismo sexual interno fácilmente reconocible por los pescadores de la zona. Está compuesto por dos franjas musculares derivados de la musculatura dorsal del cuerpo y poseen una coloración fuerte de rojo rosáceo asociado al alto grado de vascularización. La musculatura sónica en P. magdalenae aparece cuando el individuo avanza en su maduración, alcanza una longitud promedio de 6.75 cm (4.35-11.31 cm) y un ancho de 1.48 cm (1.01-1.86 cm) en machos en estado maduro. La longitud y la coloración de las bandas musculares aumenta conforme el ejemplar se acerca a la madurez sexual. Dichos músculos que rodean la VN, permiten que funcione como una cámara de resonancia, mediante la generación de sonidos. Además, el sistema vejiga natatoria - músculos intrínsecos recubren la membrana que envuelve los órganos (peritoneo), incluidos los testículos y que no se observa en las hembras (Fig. 8C y Fig. 8D).
Adicionalmente, se observó ampliación de los rangos de las medidas morfométricas que en conjunto con las características de la vejiga natatoria tienen importancia en la diagnosis de la especie propuesta en la revisión del género como en las métricas: longitud de la aleta pectoral y el ancho interorbital. Se registró diferencias principalmente en la longitud de la cabeza, siendo mayor (3.5-5.2) en los especímenes analizados en este estudio y por fuera del rango (3.1-3.5) en los ejemplares utilizados en Brasil (Tabla 1).
Tabla 1 Rango de las medidas morfométricas (con ) de los 45 especímenes de Plagioscion magdalenae utilizados en Casatti (2005) y el de los 29 especímenes de P. magdalenae con distribución en la Cuenca del río Magdalena de UARC-IC registrados en este estudio. / Table 1. Morphometric range (with ) of 45 specimens of Plagioscion magdalenae used in Casatti (2005) and that of 29 specimens of P. magdalenae with distribution in the Magdalena River Basin from UARC-IC recorded in this study.
| Medidas | Casatti (2005) | Presente estudio |
| Longitud estándar (mm) | 51.6-246.4 | 124-233 (163) |
| Proporcional a la longitud estándar | ||
| Longitud de aleta pectoral | 3.6-4.2 | 3.5-4.8 (4.1) |
| Longitud de cabeza | 3.1-3.5 | 3.5-5.2 (4.3)* |
| Proporcional a la longitud de la cabeza | ||
| Distancia del ano a la aleta anal | 2.4-2.8 | 1.4-4.3 (2.6) |
| Diámetro horizontal de la órbita | 3.1-4.6 | 3.3-5.6 (4.2) |
| Ancho inter-orbital | 5.0-6.5 | 3.3-6.3 (4.1) |
| Longitud de la 2da espina anal | 1.5-2.8 | 0.6-2 (1.5) |
*Diferencias. / *Differences.
Histomorfología de los testículos: En P. magdalenae, los testículos son órganos alargados y pareados, unidos entre ambos y a su vez, unidos a la pared dorsal del cuerpo por un mesorquio (Fig. 8B). En la cavidad celómica, los testículos se ubican en la parte ventral (debajo) de la vejiga natatoria y dorsal (encima) del intestino. El conducto eferente surge de la superficie final de cada testículo, y continúa a través del conducto espermático que es un segmento corto y único, antes de abrirse en el poro urogenital. Microscópicamente, el testículo tiene una organización de tipo lobular irrestricto, con maduración de la línea germinal en cistos que va desde la zona de la periferia del lóbulo hacia la zona central, donde se encuentra el lumen. Las espermatogonias (EG) se ubican aglomeradas entre ellas a la pared de los lóbulos seminíferos (LS), los espermatocitos (EC) se desarrollan en la zona media pero ligados a la periferia cercanos a las EG, junto a las espermátidas (ES) llevando su maduración en cistos y los espermatozoides (EZ) se concentran en la luz de los LS envueltos en líquido seminal que se observa con una coloración acidófila.
En su periferia, el testículo posee una densa túnica albugínea que se observa en forma de tejido muscular liso con irrigación sanguínea definida por la presencia de vasos sanguíneos (VS); Dicha túnica rodea el tejido intersticial (TI) que es tejido conectivo denso, el cual se internaliza y en éste se encuentran las células de Leydig (LE), generalmente cercanas a los VS. Hacia la zona central del testículo, se encuentra la membrana basal (MB) con células mioides (MI) de actividad contráctil rodeando los lóbulos seminíferos. En los LS, se ubica el tejido germinal (TG), el cual presenta células de Sertoli (SE) y células germinales tales como las EG en diferente grado de desarrollo, EC, ES y EZ que son liberados al lumen.
Se determinaron cuatro estados de maduración: En reposo o inactivo (I), En maduración (II), Maduro (III) y espermeado o en regresión (IV). En el estado I, poseen forma filiforme, son traslúcidos, presentan poca irrigación sanguínea y son de color blanco rosáceo pálido. Histológicamente, solo se observan EG, con muy pocos espermatocitos organizados en cistos y pocos EZ residuales en el lumen (Fig. 9A). En el II, los testículos son más grandes en tamaño en comparación con el estado anterior, y microscópicamente, se observan espermatogonias y espermatocitos en los lóbulos seminíferos, espermátidas en desarrollo tardío y no hay presencia de espermatozoides en el lumen (Fig. 9B).
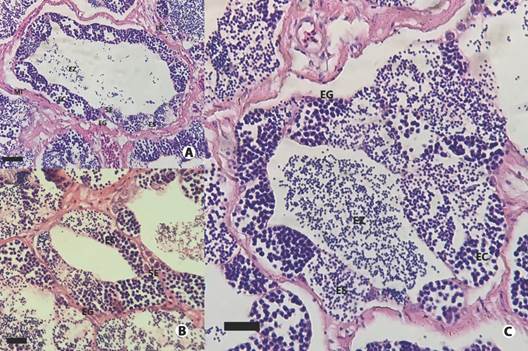
Fig. 9 Testículo lobular irrescricto de Plagioscion magdalenae. A. Testículo en estado de maduración tardía, se observan espermatogonias (EG), espermatocitos (EC) y espermátidas (ES) en cistos prontas a liberación, pocos espermatozoides (EZ) en el lumen. Además se observan células de Sertolli (SE) en el tejido germinal, células de Leydig (LE) y vasos sanguíneos (VS) en el tejido interticial y células mioides (MI) en la membrana basal. B. Lóbulo seminífero en inicio de maduración, se observan espermatogonias y espermatocitos acompañados de células de Sertoli. C. Se observan todas las fases de la espermatogénesis: espermatogonias, espermatocitos, espermátidas y espermatozoides. Escala: A. 30 µm, B. 30 µm, C. 20 µm. / Fig. 9. Unrestricted lobular testis of Plagioscion magdalenae. A. Late maturing testis, spermatogonia (SG), spermatocytes (EC) and spermatids (ES) in cysts close to be released, few spermatozoa (EZ) in the lumen. In addition, Sertolli cells (SE) are observed in the germinal compartment, Leydig cells (LE) and blood vessels (VS) in the interstitial compartment and myoid cells (MI) in the basement membrane. B. Seminiferous lobule at the beginning of maturation, spermatogonia and spermatocytes accompanied by Sertoli cells are observed. C. All phases of spermatogenesis are observed: spermatogonia, spermatocytes, spermatids, and spermatozoa. Scale: A. 30 µm, B. 30 µm, C. 20 µm.
En el estado III, la túnica albugínea que los recubre se encuentra tensa, la irrigación sanguínea no se observa en vasos ramificados como en los estados anteriores, sino en pocos y gruesos vasos sanguíneos, además su color es blanco lechoso y se observa presencia de semen al apretar la cavidad abdominal. Histológicamente, hay poca cantidad de espermatogonias en los lóbulos, sin embargo, se puede diferenciar las fases de la espermatogénesis; además, hay una alta presencia de espermatocitos y espermátidas en cistos, la luz de los LS está lleno de espermatozoides (Fig. 9C), y en algunos casos se observó lóbulos con el lumen vacío (característica expulsante). Por último, en el estado IV, los testículos se observan como sacos vacíos y flácidos, con partes grises y moradas, con un aspecto sanguinolento. Microscópicamente, se observan lóbulos vacíos, pero con presencia de EZ residual en la luz de los lóbulos y en conductos espermáticos asociados generalmente al centro del testículo.
Discusión
Aspectos ecológicos: El crecimiento en peso en función del tamaño de los machos, sobre todo en las etapas de madurez, guarda relación con el peso de la gónada y peso del cuerpo, donde se denota la correspondencia en una mayor velocidad del crecimiento del testículo con respecto al resto del cuerpo, con el fin de estar aptos para reproducirse (Rojas-Luna & García-Alzate, 2022), lo que puede estar relacionado con que en machos el grosor de las capas musculares sónicas aumenta conforme a la madurez sexual y a su vez, al peso del organismo.
Los datos de longitudes por clase de tallas mostraron una distribución normal, predominando en número de individuos la talla media II (21.9-29.1 cm). Por otro lado, es importante resaltar que hay un mayor número de individuos de ambos sexos capturados en etapas tempranas del desarrollo (I y II) en comparación con las tallas más grandes (III y IV) que, en términos de ordenamiento pesquero y conservación de la especie, son las que se deben priorizar en la pesca, permitiendo que se den de forma natural los procesos de repoblamiento y evitar la presión sobre los juveniles causando que no lleguen a la madurez sexual. Asimismo, se demuestra la captura de individuos por debajo de la talla media de captura (30 cm) por parte de los pescadores del embalse para su subsistencia y comercio, reflejando un déficit de la reglamentación colombiana. Los efectos de la pesca excesiva se suman a otros como lo son la pérdida de hábitats debido al represamiento de los ríos de la cuenca Magdalena-Cauca, la deforestación, la contaminación del agua, las malas prácticas agrícolas o las prácticas de gestión inadecuadas (Barletta et al., 2010), situaciones que son frecuentes en las cercanías al embalse El Guájaro y son comunes en la cuenca.
Se evidenció en el estudio, la predominancia de machos en la talla más pequeña (I) y la alta proporción de hembras sobre los machos en las tallas de longitudes más grandes (III y VI) que se estima entre tres y cuatro hembras por cada macho, está relacionado con que las hembras presentan mayores tasas de crecimiento y alcanzan mayores longitudes en un grupo de edad determinado (Vazzoler, 1996); lo que sentaría las bases de una posible poliandria (una hembra grande con una alta fecundidad y varios machos más pequeños que garanticen la fertilización de los ovocitos), siendo necesario realizar otros estudios para la generación de evidencia necesaria. Se registraron individuos con diferente grado de desarrollo gonadal en todos los meses de muestreo junto con lóbulos seminíferos en diferente grado de gametogénesis, sumado a dos especímenes en estado IV, una hembra (octubre 2019) y un macho (enero 2021), lo que podría indicar que la especie lleva a cabo todo su ciclo de vida en el embalse, pero debe ser corroborado con estudios de ictioplancton.
Histomorfología de los testículos: Los testículos de P. magdalenae morfológicamente son de tipo tubular, alargados y en par, unidos entre ellos por un mesorquio y a su vez, éste los une a la vejiga natatoria desarrollada y la pared dorsal de la cavidad celómica del pez; por ende, la pacora mantiene una organización testicular relativamente conservada en los teleósteos, en la cual los testículos son generalmente pares ubicados en posición dorsal en la cavidad peritoneal y recubiertos por una envoltura fibrosa conocida como túnica albugínea (Rodao, 2015). Histológicamente, los testículos de la Pácora tienen una organización de tipo lobular irrestricto, que se caracteriza porque el tejido germinal está formado por lóbulos que se extienden hasta la periferia del testículo, caracterizándose por la presencia de espermatogonias a lo largo de los LS; los lóbulos tienen abundantes cistos con células germinales sincrónicas que se observan en diferentes etapas de desarrollo y no realizan migración. Durante la espermiación, los espermatozoides son liberados al lumen lobular que está en continuidad con los conductos eferentes siendo característico de los teleósteos superiores como Sciaenops ocellatus (Linnaeus, 1766) de la familia Sciaenidae (Rodao, 2015; Uribe et al., 2014).
Morfología de la vejiga natatoria: La vejiga natatoria de los machos posee dos bandas gruesas de músculos intrínsecos (unidos a ambos lados de la vejiga) ubicados lateralmente. La ubicación y forma de la VN de P. magdalenae coincide con la información descrita para las especies de Sciaenidae, una vejiga natatoria desarrollada y que ocupa toda la longitud de la cavidad abdominal, pero no se extiende más allá de los primeros pterigióforos anales (Souza-Costa et al., 2019). Los músculos intrínsecos de la vejiga natatoria de P. magdalenae difieren de lo reportado para el órgano del sonido de los miembros de la familia Sciaenidae como Micropogonias furnieri (Desmarest, 1823), Cynoscion regalis (Bloch & Schneider, 1801) y Kathala axillaris (Cuvier, 1830), que cuentan con una vejiga natatoria separada de un par de músculos extrínsecos unidos a la pared dorsal del cuerpo (Connaughton et al., 1997; Devincenti et al., 2012; Veerappan et al., 2009). Por otro lado, la Pácora tiene una vejiga natatoria con músculos que están directamente unidos a ella, al igual que ha sido descrito para Prionotus nudigula (Ginsburg, 1950), Opsanus tau (Linnaeus, 1766), Porichthys notatus (Girard, 1854) y Pogonias cromis (Fine et al., 1993; Lindholm & Bass, 1993; Locascio et al., 2007; Pons, 2006; Tellechea et al., 2011). Al momento se desconoce la estrategia específica que le brinda a los machos de la Pácora poseer esa vejiga natatoria que le permite generar sonidos mediante los músculos especializados asociados a ella, pero como se ha descrito para otras especies de Sciaenidae, posiblemente están relacionados con el comportamiento reproductivo (Locascio & Mann, 2005), probablemente utilizado para la comunicación y cortejo con las hembras para migrar a las zonas de desoves (Connaughton & Taylor, 1995; Connaughton & Taylor, 1996; Fish & Mowbray, 1970; Luczkovich et al., 1999; Mok & Gilmore, 1983). Asimismo, les permite competir con otros machos para el acceso a las hembras por la presencia y desarrollo de la vejiga en cuanto el individuo macho se acerca a la madurez sexual y aumenta de tamaño, como método de defensa o agresión, para la ecolocalización en el medio o para la formación de banco de peces (Devincenti et al., 2012).
Implicaciones taxonómicas: Se resalta que no se observaron estructuras accesorias en la región anterior ni posterior de la vejiga natatoria en los especímenes registrados en este estudio (N = 142) ni los depositados en colección (N = 29), lo cual difiere a lo que ha sido descrito para individuos identificados como P. magdalenae (en Brasil) y otras especies de Plagioscion, Cynoscion, Macrodon e Isopisthus como es la presencia de apéndices en la vejiga natatoria (Chao, 1978). De igual forma, es diferente a lo reportado en la revisión del género por Casatti (2005) quien menciona que la vejiga natatoria de esta especie es fusiforme, con un par de apéndices en forma de cuernos en la zona anterior, y estipula rangos de medidas morfométricas en su diagnosis donde encontramos diferencias principalmente en la longitud de la cabeza.
Asimismo, la hipótesis de relaciones filogenéticas de Souza-Costa et al. (2019) indican caracteres asociados a la presencia de apéndices con apariencia de cuernos, longitud y forma de estos y la presencia de estructuras tubulares desde el extremo anterior al posterior, como sinapomorfías (caracteres 20 a 23, páginas 49 a 51 en su estudio) de las especies de Plagioscion e incluyen a P. magdalenae como la especie más derivada del género. Consideramos que es fundamental revisar los caracteres diagnósticos de las especies de Plagioscion en ejemplares colectados en sus localidades tipo, toda vez es evidente que los especímenes analizados en estos trabajos pertenecen a otra especie del género y no a P. magdalenae. Por lo tanto, la ampliación de la distribución de esta especie a la cuenca del río Amazonas en Brasil descrita por Casatti (2003) y Casatti (2005) donde se distribuyen otras tres de las cinco especies válidas del género como P. squamosissimus (Heckel, 1840), P. auratus (Castelnau, 1855), P. montei (Soares & Casatti, 2000) y que fueron incluidas también por Souza-Costa et al. (2019) se deben desestimar. Incluso, la Pácora no se encuentra distribuida en la cuenca Amazónica Colombiana (DoNascimiento et al., 2021). Plagioscion magdalenae está restringida y es endémica de la cuenca del Magdalena-Cauca en Colombia.
Sasaki (1989) consideró que una vejiga simple, con forma alargada y sin apéndices es un carácter plesiomórfico de los Sciaenidae; y coincide con la descripción de individuos P. magdalenae del río Magdalena en este estudio, como la segunda especie existente más basal del género y que posee la morfología de la vejiga gaseosa menos derivada (Cooke et al., 2011). Por lo tanto, la descripción de la vejiga natatoria simple y con forma de zanahoria, concuerda con la historia filogenética y la biogeografía de la colonización y radiación de las especies de Plagioscion en sentido norte a sur en Sudamérica como producto de las incursiones marinas durante el Oligoceno tardío (Cooke et al., 2011) y el aislamiento del río Magdalena del resto de cuencas norteñas de América del Sur desde el Mioceno tardío (Lundberg et al., 1998).
En conclusión, en los testículos de Plagioscion magdalenae se presenta la espermatogénesis en cistos dentro de los lóbulos seminíferos y morfológicamente se encuentran protegidos por el peritoneo. Esta membrana, a su vez está recubierta por la musculatura sónica de la vejiga natatoria, la cual solo se encuentra en los machos de la especie en estado de maduración. La musculatura está conformada por dos bandas de músculos intrínsecos unidos por la aponeurosis y que por su diferenciación en presencia/ausencia en los sexos de la Pácora, posiblemente está relacionado con la actividad reproductiva. Por tal motivo, se recomienda realizar análisis de bioacústica y de histoquímica para determinar la estructura de la vejiga y su función como estrategia reproductiva mediante la generación de sonidos, para así seguir ampliando el conocimiento de la ecología de esta especie representativa de Colombia con fines de conservación. Asimismo, la Pácora tiene una vejiga natatoria simple, sin estructuras accesorias ni apéndices; se corrobora la importancia taxonómica de este órgano tanto en la especie como en el género. Plagioscion magdalenae es una especie endémica de la cuenca del río Magdalena en Colombia.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


