Introducción
En Honduras, la tortuga golfina ha estado protegida desde 1975, cuando el gobierno estableció un proyecto de conservación para la protección de esta especie con la prohibición de la recolección y comercialización de huevos entre el 1 y 25 de septiembre de cada año, establecido para las costas del Golfo de Fonseca (Minarik, 1985). Actualmente, la Comisión de Verificación y Control Ambiental del Golfo de Fonseca (CVC-GOLF); integrada por la Municipalidad, organizaciones gubernamentales, comités comunitarios tortugueros, empresa privada, ONG´s y los comités locales de los campamentos tortugueros son los encargados de realizar el proceso de conservación de L. olivacea en el Golfo de Fonseca, específicamente en las playas de Cedeño, Boca de Río Viejo, El Venado, Guapinol, Carretales, Punta Ratón localizadas en la región Sur del Pacifico hondureño (Morales et al., 2003).
Una de las estrategias de conservación que tienen muchos países es el establecimiento de criaderos artificiales, en el que, los huevos son recolectados y se entierran nuevamente para ser incubados (Morales-Mérida et al., 2021). Esto, debido a que permite condiciones ambientales similares a condiciones naturales que permiten escenarios óptimos de desarrollo de crías, dado a que cuenta con protección física y temperaturas moderadas (Ríos-Huerta et al., 2021; Sandoval-Ramírez et al., 2021). Esta práctica ha sido realizada en el Golfo de Fonseca específicamente en las playas de Punta Ratón, El Venado, Guapinol, Boca de Río Viejo y Cedeño. Punta Ratón ha sido la zona más investigada siendo la principal playa de anidación en el sur del país, con un estimado de 400-500 nidos por temporada (Dunbar et al., 2010; Dunbar et al., 2011; Dunbar et al., 2012, Dunbar et al., 2020; Dunbar & Salinas, 2008; Duran et al., 2015), en contraste con Cedeño; esta zona ha sido la menos estudiada en donde L. olivacea anida con un promedio de 80-140 nidos por temporada (Duran et al., 2015). Por esto, el objetivo de esta investigación consistió en evaluar la anidación de la tortuga Golfina (Lepidochelys olivacea) durante la temporada de veda entre el 2011 y 2021 en Campamento Tortuguero Cedeño, Choluteca, Honduras.
Materiales y métodos
Área de estudio: El campamento Tortuguero se instala entre Las Iguanas Punta Condega y Los Delgaditos, ambos lugares son áreas protegidas dentro de la categoría área de manejo de hábitat por especie del Golfo de Fonseca (Flores & Soto, 2006; Instituto Nacional de Conservación y Desarrollo Forestal, 2015; Instituto Nacional de Conservación y Desarrollo Forestal, 2022). El clima es cálido con las características del bosque seco tropical (Holdridge, 1978), según datos de la Agencia Hondureña de Aeronáutica Civil presenta temperaturas promedio anual mínimos y máximos de 22.1 y 36.6 °C, y una precipitación anual de 370.6 mm. El 90 % de los suelos al costado de las playas son pantanos y marismas (Secretaría de Recursos Naturales y Ambiente, 2015). La playa, en donde se realizan los patrullajes comprende una longitud total de 7.7 km y se distinguen tres sitios (Fig. 1), Playa Las Doradas; presenta una longitud de 1.39 km (13º09'05.74'' N & 87º25'45.82'' W), no cuenta con intervención humana y se identifica por presentar fondo arenoso o limoso sin ninguna estructura de sustrato duro (Duran & Dunbar, 2015), caracterizada por dunas y el crecimiento de vegetación de las familias Convolvulaceae, Fabaceae, Apocynaceae y Poaceae. 2) Playa Cedeño con 2.63 km de longitud (13º10'28.63'' N & 87º26'02.28'' W), es una zona costera con presencia de luminarias artificiales relativamente abundantes (viviendas y negocios de ventas de alimento y bebidas). 3) Playa Los Delgaditos, con una longitud de 3.68 km, (13º11'28.66'' N & 87º26'24.63'' W). Al igual que Cedeño es una zona que contiene luminarias artificiales provenientes de viviendas, laboratorios de larvas de camaricultura y algas. Esta playa, se distingue por presentar en la zona intermareal rocas y restos de infraestructura. Las playas Cedeño y Los Delgaditos se caracterizan por la presencia frecuente de animales domésticos (perros y cerdos) durante los recorridos.
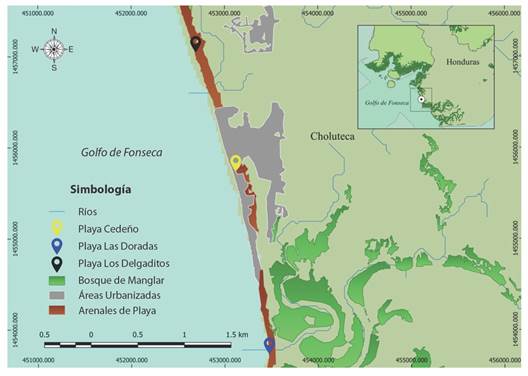
Fig. 1 Localización de Playa Las Doradas, Cedeño y Los Delgaditos del Campamento Tortuguero Cedeño, sitios de anidación de la tortuga golfina en el Golfo de Fonseca. / Fig. 1. Location of Las Doradas, Cedeño and Los Delgaditos beaches of Cedeño Turtle Camp, nesting sites for olive ridley turtles in the Gulf of Fonseca.
Metodología de campo: Para el estudio se consideró los registros de recolección de la anidación de cada temporada de veda entre el 2011 y 2021 mediante el proceso de monitoreo, recolecta de huevos, transporte, reubicación de nidos y liberación de neonatos. La temporada inicia al comenzar el período de veda correspondiente del 1 al 25 de septiembre y finaliza en la última semana del mes de noviembre con la eclosión de los últimos nidos recolectados.
Viveros artificiales: la ubicación de los nidos para la incubación se realizó mediante el modelo de vivero cerrado en donde se usan las defensas en los cuatro costados para impedir el ingreso de humanos y animales. (Chacón et al., 2007) Los sitios de instalación de los viveros consideraron zonas que permitió reducir la distancia, tiempos de relocalización, realizar vigilancia y protección de los nidos. (Chacón et al., 2007) Los viveros, se construyeron en un espacio rectangular con las dimensiones de 60 m2 y ubicado a 200 m de la línea de costa, tomando en consideración 1.2 m de altura sobre la superficie de la arena y debe estar al menos 30 cm por debajo de la arena. Durante cada temporada, cada vivero se ubicó en sitios diferentes, a excepción del 2015 al 2016 que no se roto el sitio. Treinta días antes de iniciar la temporada de veda en la anidación, se hizo el desbrozado y tamizado de la arena, y después se cercó con postes de madera y malla galvanizada, para proteger a los nidos de los depredadores. Se colocaron sacos de nylon llenos con arena alrededor del cerco para evitar la erosión. Todo lo anterior considerando los criterios citados en Chacón et al. (2007).
Patrullajes: Mientras la veda estuvo vigente, se desarrollaron patrullajes diurnos entre las 6:00 y 18:00 h, y patrullajes nocturnos entre las 18:00 y 5:00 h, recorriendo 7.7 km de la longitud de las playas Las Doradas, Cedeño y los Delgaditos. La distribución y recorridos se realizaron mediante caminatas al azar, en las tres playas. Las personas encargadas de los patrullajes portaban baldes, focos de mano e impermeables. Los recorridos fueron realizados por población local, integrado por mujeres y hombres. Estos últimos en su mayoría, siendo tortugueros, pescadores y curileros. Cada año, presentó variaciones en las participaciones entre recolectores y sembradores que oscilaron entre 8 a 17 recolectores del 2011 al 2013. El año 2016, la participación fue de 16 pobladores. Mientras que, en el 2014, 2015, 2017 al 2021 se incorporaron a las labores de patrullaje entre 27 hasta 51 personas.
Recolecta y transporte de nidos: Después del anidamiento de las tortugas localizadas, se registró la hora de la colecta del nido y la playa de procedencia. Los huevos se colocaban con la arena del nido del desove en baldes plásticos, siendo trasladados cuidadosamente hacia el campamento. Esta actividad se realizó en un período inferior a las cinco horas, para evitar la mortalidad embrionaria provocada por la manipulación y el movimiento (Chacón et al., 2007). Cada nido fue sembrado a una profundidad entre 45 a 50 cm y a 60 cm de distancia entre ellos. Al momento de la siembra se registró la hora, la fecha, colector, sembrador y la cantidad de huevos que fue sembrado en el nido. Los nidos dentro del vivero fueron rotulados e identificados con un código y la fecha de siembra. También se registró la fecha de eclosión de los neonatos y los huevos con mortalidad embrionaria, todo lo anterior siguiendo la metodología de Muccio (2015). Los datos de temperaturas máximas, mínimas, precipitación y humedad relativa fueron obtenidos de la base de datos de la Agencia Hondureña de Aeronáutica Civil, quienes cuentan con una base meteorológica en el Departamento de Choluteca.
Análisis de datos: Para el análisis de datos se aplicó estadística descriptiva para observar el promedio anual de nidos registrados por playa, frecuencia de anidación y tasa de eclosión. Los datos obtenidos de las variables se les realizó una prueba de normalidad mediante el estadístico de prueba de Shapiro-Wilk, con el fin de observar si los datos de cada una de las variables del estudio provienen de una distribución normal. En caso de no cumplir con los supuestos de normalidad, estos fueron transformados usando arcsin(√π). Una vez efectuadas las pruebas, se realizó un análisis de varianza para probar la hipótesis de las diferencias de promedios entre dos o más grupos, con la finalidad de detectar posibles diferencias entre las medias del tamaño de parámetros ambientales (temperatura máxima, mínima, precipitación y humedad relativa) entre años y del tamaño de nidadas, frecuencia de anidación y tasa de eclosión entre playas y años. Se realizó una regresión lineal y una prueba de chi cuadrado para determinar si la cantidad de personas están asociadas a la cantidad de nidos detectados por playa. Todos los análisis fueron realizados utilizando el software RStudio® (RStudio Team, 2023).
Resultados
Durante las temporadas de anidación 2011-2021 en los periodos de veda se hicieron patrullajes por 275 días consecutivos, registrando 1 065 nidos que fueron reubicados en los viveros artificiales del campamento, instalados en diferentes zonas para cada temporada. Las zonas donde los huevos fueron incubados no presentaron inundaciones durante los 11 años del estudio.
Parámetros ambientales: Según datos históricos, se registraron temperaturas máximas entre 36.1 ± 2.62 y 32.4 ± 1.20 °C con un promedio general de 33.85 ± 1.15 °C siendo el 2015 el que presenta las temperaturas más altas. La temperatura mínima osciló entre 24.9 ± 0.90 y 23.2 ± 0.89 °C con promedio general de 23.85 ± 0.49 °C siendo el 2018 el de temperaturas más bajas. La precipitación interanual fluctuó entre 20.7 ± 25.40 y 7.7 ± 9.66 mm con promedios de 12.45 ± 3.70 mm en el que el 2014 tuvo las precipitaciones más altas y el 2018 las más bajas. La humedad relativa varió entre 82.7 ± 5.24 y 60.2 ± 7.3 % con promedio de 71.23 ± 7.01 % donde el 2020 tuvo la humedad relativa más alta y el 2011 las más bajas (Tabla 1). El análisis de varianza mostró diferencias en las temperaturas máximas (P < 0.000), mínimas (P < 0.000), y humedad relativa por año (P < 0.000), pero no hubo contrastes en la precipitación interanual (P > 0.206).
Tabla 1 Parámetros ambientales obtenidos para la veda de la tortuga Lepidochelys olivacea entre el 2011 y 2021 en Campamento Tortuguero Cedeño, Choluteca, Honduras. / Table 1. Environmental parameters obtained for the olive ridley turtle (Lepidochelys olivacea) closure from 2011 to 2021 in Campamento Tortuguero Cedeño, Choluteca, Honduras.
| Año | Temperatura ambiental Máx. (°C) | Temperatura ambiental Min. (°C) | Precipitación (mm) | Humedad relativa (%) |
| 2011 | 33.1 ± 1.41 | 23.6 ± 0.72 | 14.9 ± 17.99 | 70.2 ± 7.3 |
| 2012 | 33.7 ± 1.19 | 23.4 ± 1.26 | 11.4 ± 15.24 | 68.6 ± 6.45 |
| 2013 | 32.4 ± 1.20 | 23.8 ± 0.85 | 13.9 ± 19.30 | 72.7 ± 6.4 |
| 2014 | 32.9 ± 1.69 | 23.2 ± 0.89 | 20.7 ± 25.40 | 80.7 ± 6.95 |
| 2015 | 36.1 ± 2.62 | 24.4 ± 1.04 | 9.2 ± 15.92 | 62.1 ± 10.09 |
| 2016 | 34.7 ± 1.65 | 24.0 ± 1.17 | 10.5 ± 17.24 | 70.3 ± 7.32 |
| 2017 | 33.1 ± 1.64 | 23.6 ± 0.81 | 13.5 ± 16.28 | 75.4 ± 6.03 |
| 2018 | 34.8 ± 0.97 | 24.9 ± 0.90 | 7.7 ± 9.66 | 65.5 ± 4.41 |
| 2019 | 35.1 ± 1.99 | 24.2 ± 1.06 | 9.4 ± 15.50 | 71.9 ± 8.20 |
| 2020 | 33.2 ± 1.19 | 23.5 ± 1.32 | 14.9 ± 19.86 | 82.7 ± 5.24 |
| 2021 | 33.2 ± 1.12 | 23.8 ± 0.80 | 10 ± 16.37 | 73.4 ± 5.92 |
Promedio ± desviación estándar son mostradas. / Mean ± standard deviation is shown.
Tamaño de la nidada: Se recolectaron 95 051 huevos en los 11 años de monitoreo. En cada temporada se recogieron e incubaron 8 641 ± 3 351 huevos en promedio. No fueron encontradas evidencia de diferencias en las cantidades de huevos recolectados de cada año registrado (P > 0.2145), sin embargo, el 2021 fue la temporada con la mayor cantidad de huevos recolectados con 14 490 huevos y el más bajo en el 2016 con 3 181 huevos. Se encontró diferencia en la cantidad de huevos recolectados por playas por año (P < 0.001), recolectando 6 076 ± 2 892 huevos en playa Las Doradas, 1 793 ± 591 unidades en Los Delgaditos, y en la playa de Cedeño con 773 ± 232 huevos.
Se encontró que las mayores nidadas se dieron en la playa de Cedeño con valores promedio de 105 (DE = 11.25) en 2020 y 101 huevos en los años 2012 (DE = 13.13). También, las menores nidadas se encontraron en esta misma playa en el 2014 y 2015 con 71 (DE = 10.19) y 72 (DE = 27.38) huevos por nido. Al comparar el tamaño de la nidada entre playas no se encontraron evidencias de disparidades (P > 0.9529), pero entre años si hubo contraste en el tamaño de la nidada (P < 0.0322), registrándose en la temporada del 2020 las nidadas más grandes con 96 ± 7.6 huevos por nido en promedio. Las nidadas con el menor tamaño se reportaron en el 2014 con 80 ± 3.2 huevos por nido en promedio (Fig. 2).
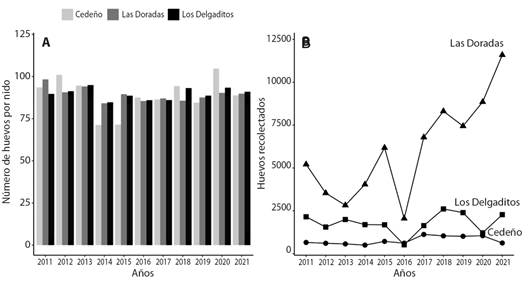
Fig. 2 A. Tamaño promedio de la nidada en el Campamento Tortuguero procedente de las playas de Las Doradas, Cedeño y Los Delgaditos a lo largo de 11 temporadas durante el período de veda. B. Cantidad de huevos recolectados del 2011 a 2021 en el Campamento Tortuguero de Cedeño procedente de las playas de Las Doradas, Cedeño y Los Delgaditos. / Fig. 2. A. Average clutch size at the turtle camp from Las Doradas, Cedeño and Los Delgaditos beaches over 11 seasons during the closed season. B. Number of eggs collected from 2011 to 2021 at the Cedeño turtle camp from Las Doradas, Cedeño and Los Delgaditos beaches.
Frecuencia de anidación: Se encontró que en la playa Las Doradas llegaron 750 hembras a anidar en 11 años de estudio seguido de la playa Los Delgaditos con 219 y por último Cedeño con 96 tortugas en total. Los nidos recolectados en promedio por año fueron de 68.2 ± 32.7 en playa Las Doradas, 20 ± 6.4 en playa Los Delgaditos y 8.7 ± 2.5 en playa de Cedeño (Fig. 3). En general se recolectó por temporada un promedio de 96 nidos que fueron trasladados al campamento para incubar y después liberar los neonatos. El año más exitoso fue 2021 con la anidación de 161 hembras en las tres playas, en el 2016 fue donde se reportó la menor cantidad de tortugas anidadas con 37 posturas.
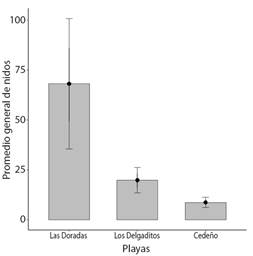
Fig. 3 Promedio anual de nidos de Lepidochelys olivacea por playa entre 2011 y 2021 en el campamento Tortuguero de Cedeño durante la temporada de veda que corresponde del 1 al 25 de septiembre. / Fig. 3. Average annual number of olive ridley nests (Lepidochelys olivacea) per beach from 2011 to 2021 at the Cedeño Turtle Camp during the closed season corresponding to September 1 to 25.
Frecuencia de anidación diaria y por hora: En promedio, llegaron a desovar 3.8 hembras por día en cada uno de los 11 años de monitoreo a las tres playas. A lo largo de la veda, se observó la llegada de una tortuga por cada 2.9 km de playa. Del día 1 al 25, se observó que en los días 13 y 21 la cantidad promedio de hembras que llegaron anidar fue hasta 4.8, en cambio, los días 19 y 25 fueron reportados con las anidaciones más bajas entre 2.8 y 1.7 nidos en promedio. En los eventos registrados de anidación según la distribución del horario, se observó que las tortugas tienen preferencia por desovar en la noche. Se encontró que el 52 % de todas las anidaciones se presentaron entre las 20:00-00:00 h y el 30 % entre las 00:00-04:00 h. Durante las horas del día la tasa anidación fue menor al 1.5 %.
Tasa de eclosión: En general se logró eclosión exitosa de 62 747 neonatos de 95 051 huevos incubados en los 11 años de monitoreo, lo que representó una tasa global de eclosión del 66.4 %. La diferencia correspondió a huevos que no pudieron eclosionar por mortalidad embrionaria, huevos sin desarrollo aparente y neonatos muertos. Los años con la mayor población de neonatos que nacieron exitosamente fue en el 2020 con la eclosión de 9 581 y 2021 con 11 698 tortugas, lo que representó una tasa de nacimientos de 86 y 81 % respectivamente.
Los años donde se tuvo la tasa de eclosión más favorable fue en el 2013 (91 %) con los nacimientos de 4 895 y 2014 (93 %) con 5 769 tortugas. Así mismo, los años donde se obtuvieron los menores índices de eclosión fueron en el 2015 con 699 nacimientos, representando el 8 % de los neonatos y 2016 que correspondió al nacimiento de 573 neonatos con un 16 % (Fig. 4). A nivel de playa, no se encontró diferencia en los porcentajes de eclosión (P > 0.0981). En la playa de Cedeño se obtuvo el porcentaje de eclosión más bajo con un 62 %, y en las playas de las Doradas y Los Delgaditos el porcentaje de eclosión fue del 66 %.
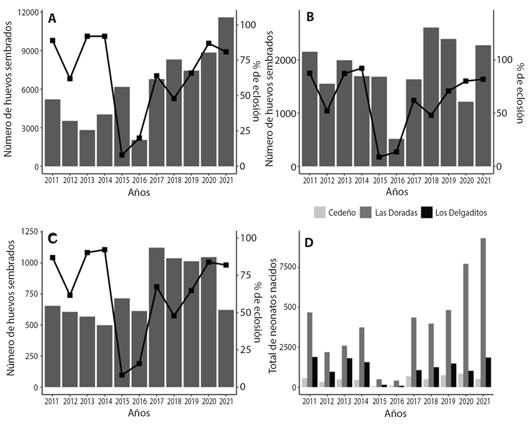
Fig. 4 Porcentaje de eclosión y número de huevos sembrados entre 2011 y 2021 en las playas de A. Las Doradas, B. Los Delgaditos y C. Cedeño. D. Población de neonatos nacidos exitosamente en once temporadas en tres playas del campamento Tortuguero Cedeño. / Fig. 4. Hatching percentage and number of eggs sown from 2011 to 2021 at A. Las Doradas, B. Los Delgaditos, C. Cedeño beaches. D. The population of hatchlings successfully hatched in eleven seasons at the Cedeño turtle camp.
Trabajo de patrullaje: La prueba de chi cuadrada evidenció una asociación entre la cantidad de personas que acompañaron en el trabajo de patrullaje en las playas y la cantidad de nidos detectados (X2 = 36.95, P = 0.000, g.l. = 10). Por lo que, a medida que incrementa el número de personas en los patrullajes por año, también aumentó la cantidad de nidos detectados en la zona de estudio y por ende el número de huevos recolectados (Fig. 5).
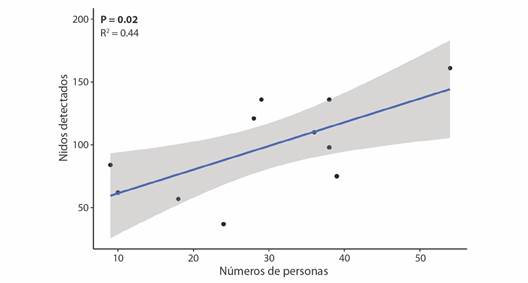
Fig. 5 Relación entre la cantidad de personas que participaron en los patrullajes y la cantidad de nidos detectados en la veda de la tortuga Lepidochelys olivacea entre 2011 y 2021 en Campamento Tortuguero Cedeño, Choluteca, Honduras. La zona sombreada corresponde al intervalo de confianza del 95 % para la regresión. / Fig. 5. Relationship between the number of people who participated in patrols and the number of nests detected during the olive ridley turtle (Lepidochelys olivacea) closed season between 2011 and 2021 in Campamento Tortuguero Cedeño, Choluteca, Honduras. The shaded area corresponds to the 95 % confidence interval for the regression.
Discusión
La tortuga golfina es considerada la de mayor población que anida en las costas del Pacífico hondureño (Dunbar et al., 2020) y pese a las condiciones de playa, la presión de captura y la amenaza permanente por las actividades humanas, esta especie mantiene una periódica anidación en esta zona, especialmente entre la mitad del mes de agosto a septiembre (Cruz et al., 1987; Dunbar et al., 2020; Minarik, 1985). En ese sentido, durante los 11 años de monitoreo el promedio de la nidada fue de 89 huevos y el total de huevos recolectados fueron de 95 091 que produjeron 62 747 neonatos en las tres playas de estudio. Sin embargo, este promedio fue menor que lo registrado en México, Guatemala, y Costa Rica (Brenes-Arias et al., 2015; Chacón et al., 2007; Contreras-Mérida & Morales-Mérida, 2020; James & Melero, 2015; Viejobueno-Muñoz & Arauz, 2015).
Los resultados de este estudio muestran un patrón general en la anidación de la tortuga golfina con tendencia ascendente en las tres playas, pero con fluctuaciones interanuales mayores en playa Las Doradas en contraste con las playas Cedeño y Los Delgaditos. El estudio de Heppell et al. (2003) encontró una marcada variabilidad interanual en el número de nidos en algunas poblaciones de tortugas marinas y varios estudios recientes en el Golfo de Fonseca han documentado incrementos regionales en nidos y hembras anidadoras (Dunbar & Salinas, 2008; Dunbar et al., 2010, Dunbar et al., 2011; Dunbar et al., 2020; Duran & Dunbar, 2015). En general, las actividades realizadas durante la veda por parte de las organizaciones y comunidades en el campamento Cedeño indican que las nidadas de L. olivacea se mantiene ascendente en Las Doradas, y estables en Cedeño y Los Delgaditos, que también incrementa el número de tortugas anidadoras a lo largo del tiempo.
No obstante, la respuesta en la tendencia del tamaño de las nidadas puede atribuirse a las características que presentan las tres playas en estudio; ya que Playa Las Doradas no cuenta con actividades antrópicas como Cedeño y Los Delgaditos; estas últimas presentan depredación de huevos por cerdos y en mayor medida por perros. Los perros en general pueden localizar los huevos en todo momento durante la incubación (Fowler, 1979), en ese sentido, los nidos no son seguros mientras los perros deambulan libremente por la playa. Estudios realizados en otras playas de anidación de tortugas presentan altos porcentajes de depredación por estos animales (Barquero-Edge, 2013; Behera & Kaiser, 2020; Whiting et al., 2007). Por lo que, es probable que un gran número de huevos se pierdan en ambas playas debido a este tipo de depredación, ya que, esto conduce a una reducción significativa de la cantidad de nidos de tortugas, puesta de huevos y crías (Behera & Kaiser, 2020).
Así mismo, las diferencias en la comparación de los huevos recolectados por playas por año y la evidencia de contraste en el tamaño de la nidada, con mayor cantidad en Playa Las Doradas se explica porque en estas zonas no se llevan a cabo actividades antropogénicas a diferencia de la playa Cedeño y Los Delgaditos. En estas playas reside la Aldea de Cedeño (Arias et al., 2021), ambas playas son de uso recreativo con afluencia de turistas, que, sumado a la erosión y acreción, depredación, iluminación artificial, destrucción del hábitat, plásticos y otros desechos marinos constituye una amenaza durante el período reproductivo en hembras anidadoras (del Cid Gómez & Cáceres, 2018; Flores-Monter et al., 2015; Fujisaki & Lamont, 2016; Mathenge et al., 2012). Además, la pesca constituye una de las actividades más importantes como ingresos de la comunidad (Departamento de los Estados Unidos para el Desarrollo Internacional, 2016; Soto et al., 2012), por lo que, la pesca incidental debida a artes poco selectivas realizada en ambas playas, ejercen una presión difícil de cuantificar que podría constituir una amenaza en la anidación de L. olivacea.
El pico más alto de anidación fue en el 2021 y el 2016 con la menor cantidad de tortugas, así mismo, el esfuerzo de recolección de los nidos aumentó en un 91.6 %, pasando de 84 a 161 nidos, siendo playa Las Doradas con la mayor frecuencia de anidación y Cedeño y los Delgaditos con el menor número de tortugas. En ambas playas la presencia de locales de servicio de bebidas y diversión nocturna en la arena conlleva a la presencia de luminarias artificiales relativamente abundantes. Por lo que este factor podría ser una probable causa que impacte negativamente la anidación de la tortuga. Ante lo mencionado, algunos estudios indican que el aumento de la iluminación artificial perturba el proceso de anidación de las tortugas, reportando una drástica reducción en los intentos de anidación (Arízaga Medina & Cárdenas Pasato, 2020; Deem et al., 2007; Médicci et al., 2009; Witherington, 1992).
Ahora bien, en el campamento Tortuguero se contratan servicios de los miembros de la comunidad como monitores de playa, los cuales, son personas entrenadas y asesoradas para tener una mayor efectividad en la detectabilidad de los nidos en la temporada de veda. Desde 2011 a 2021, la cantidad de miembros que participaron en los patrullajes fue incrementando, por lo que, hubo variabilidad inherente en la cantidad de personas que acompañaron el trabajo de patrullaje. Ante lo mencionado, la prueba de chi cuadrada fue significativa al asociar el número de personas patrullando con la cantidad de nidos detectados en las playas (Fig. 5). Viejobueno-Muñoz y Arauz (2015) enfatizan que el aumento en el número de personas durante la temporada de anidación de L. olivacea posibilita la mejora de los patrullajes y monitoreo en la playa. Brenes-Arias et al. (2015) recomiendan que en playas con poca extensión (como las playas del presente estudio), haya un mayor número de personas patrullando especialmente por la noche, ya que, debido a esto encontraron un aumento en la efectividad de localización de hembras y nidos. Por todo esto, el incremento interanual de los nidos detectados y un mayor número de huevos recolectados en Playa Las Doradas, Los Delgaditos y Cedeño, lo atribuimos al incremento ascendente de personal en los patrullajes.
Al respecto, la frecuencia diaria de anidación en las tres playas, durante los 25 días de patrullajes de las temporadas 2011-2021, tuvo un promedio diario entre 4.9 y 1.7, siendo en el día 25 donde se registró la menor cantidad de hembras anidando. Esto se explica porque en el último día del período de veda la cantidad de voluntarios abandonan los patrullajes y en otros casos no reportan los nidos recolectados. Con respecto a los eventos registrados de anidación según la distribución de horarios, se observó que las tortugas tienen preferencia por desovar en la noche. Esto es consistente con otros estudios donde han reportado que L. olivacea suele anidar por la noche con horarios similares de puesta (Ávila-Aguilar, 2015; Brenes-Arias et al., 2015; Chacón et al., 2007; del Cid Gómez & Cáceres, 2018; McClenachan et al., 2006; Soto et al., 2012).
La tasa de eclosión fue variable en todas las temporadas, ya que se registraron entre el 8 % en la temporada del 2015 al 93 % en el 2014, esta variabilidad también se encontró en Punta Banco, Costa Rica con el 47 y 87 % en 16 años de monitoreo (Viejobueno-Muñoz & Arauz, 2015), y en la playa Naranjo entre 1993 y 2010 (Hart et al., 2014). Así mismo, en Santuario Playa Ceuta y Playa Caimanero, México se encontró una variabilidad del 44 y 76 % que comprenden registros de 1976 a 2015. Por otro lado, 2015 y 2016, fueron los años más severos para el desempeño de las nidadas con variaciones en los porcentajes de eclosión de 8 a 20 % en las tres playas. Fueron estos años los que presentaron temperaturas altas; con 36.1 ± 2.62 (2015) y 34.7 ± 1.65 (2016), precipitaciones bajas 9.2 ± 15.92 (2015) y 10.5 ± 17.24 (2016) y humedades relativas bajas con 62.1 ± 10.09 (2015) y 70.3 ± 7.32 (2016). En ese sentido, se ha demostrado que la temperatura influye en gran medida en el éxito de eclosión (Bladow & Milton, 2019; Booth, 2018; Kobayashi et al., 2017; van Lohuizen et al., 2016), por lo que atribuimos a esta variable como una probable causa de las bajas tasas en el éxito de eclosión para el 2015 y 2016 en playas Las Doradas, Cedeño y Los Delgaditos.
Por otro lado, la tasa de eclosión global en las tres playas fue baja con el 66.4 % en comparación a lo registrado en otros estudios (Arzola-González et al., 2019; James & Melero, 2015; Sosa-Cornejo et al., 2021; Viejobueno-Muñoz & Arauz, 2015). No obstante, del 2011 al 2021, la cantidad de neonatos liberados se incrementó en promedio en un 30 %. Este factor se explica por los esfuerzos de conservación realizados a lo largo de los años durante la veda en el campamento Cedeño; escenario que comprueba la funcionalidad de la veda, debido al aumento en la anidación de L. olivacea en esta zona. En ese sentido, se espera un aumento en la anidación de esta especie en los próximos años, ya que los primeros neonatos liberados (2011-2012), fruto de dichos esfuerzos de protección, se espera visiten la playa, puesto que la tortuga lora alcanza la madurez sexual entre los 12 y 14 años (Plotkin, 2007).
En este estudio se encontró un incremento en la anidación de L. olivacea en las tres playas, anidando mayormente en Playa Las Doradas. Factores como la presencia de animales domésticos, afluencia de personas y actividades antrópicas en playa Cedeño y Los Delgaditos pueden ejercer un impacto negativo en el hábitat para la anidación de la tortuga golfina. Sin embargo, el incremento en el número de personas entrenadas para realizar patrullajes constituye una mejora en la protección de la especie, debido a esto, se detectó una mayor cantidad de nidos y huevos recolectados. En ese sentido, los esfuerzos de monitoreo y conservación para la especie por parte de la CVC-GOLF han indicado que ha habido un incremento en el número de nidos en las tres playas desde el establecimiento de los campamentos hasta la actualidad. Sugerimos que Playa Las Doradas, sea designada como área de anidación legalmente protegida y recomendamos realizar la concientización socioambiental de las comunidades y turistas, así como la articulación de las autoridades competentes, junto con las instituciones que son miembros de la CVC-GOLF. Además, es necesario realizar estudios relacionados con el impacto de los factores ambientales en el éxito de eclosión, la incidencia de mortalidad, malformaciones congénitas, depredación, caza furtiva y marcaje de tortugas en el Campamento Tortuguero Cedeño. A partir de estos datos y la evaluación en las variaciones interanuales de anidación, se podrán identificar indicadores y obtener una imagen más precisa de la situación de L. olivacea con relación a los programas de manejo y conservación, lo que permitirá tomar decisiones adecuadas para orientar dichos proyectos como en el Campamento Tortuguero Cedeño.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


