Introducción
La extracción de materiales aluviales: arena, grava y cantos rodados en el lecho superior de ríos afecta a las especies de fauna silvestre que ahí habitan, por la eliminación abrupta de vegetación y la cobertura del suelo (Valderrama, 1992). Al eliminar la vegetación y el suelo, se fragmenta y se modifica la estructura vegetal, situación que obliga a la fauna silvestre a moverse hacia otras áreas y los expone a cambios microambientales abruptos: microclima y propiedades físicas, químicas y biológicas del suelo (Peña-Becerril et al., 2005).
El filtro ambiental al cual las especies de fauna pueden ser más vulnerables es el microclima: temperatura, luz, velocidad del viento y humedad (Scheffers et al., 2014). Las especies que no toleran las condiciones microclimáticas nuevas creadas por el uso antropogénico son extirpadas del ensamblaje (Díaz et al., 2006). En climas cálidos, los cambios microambientales repercuten más en aquellos grupos de menor talla, con movilidad reducida y de desplazamiento lento, tal como los reptiles. La causa principal de la declinación de las poblaciones de reptiles es por cambios ambientales originados por la perdida y degradación de hábitats naturales (Böhm et al., 2013); así como la captura, sacrificio intencional, recolección de huevos, introducción de especies exóticas, contaminación y mortalidad accidental por tránsito vehicular (Gardner et al., 2007). De 1970 a 2012, por perturbación de hábitats, se ha estimado una disminución de hasta 55 % en poblaciones de reptiles, con una pérdida de hasta el 80 % para escuamatos (Saha et al., 2018). Es decir, los efectos de la fragmentación y pérdida del hábitat actúan de manera particular sobre cada especie (Pineda & Halffter, 2004). La respuesta depende de los atributos del taxón, como movilidad, ámbito hogareño, fisiología, microhábitat, alimentación y condiciones climáticas (Burke & Gibbons, 1995). Las respuestas identificadas ante la perturbación del hábitat pueden ser: positiva, negativa o neutra (Suazo-Ortuño et al., 2008). Se ha documentado que las serpientes de mayor tamaño son más vulnerables a la fragmentación (Luiselli & Capizzi, 1997). La respuesta negativa también se ha observado en lagartijas que emplean como microhábitat a la hojarasca (Suazo-Ortuño et al., 2008).
La cuenca baja del río Tehuantepec ubicado en el municipio de Santo Domingo Tehuantepec, Oaxaca, México, es un reservorio importante de recursos bióticos, porque conserva a lo largo de su cauce, márgenes y llanuras de inundación, diversos ecosistemas y fragmentos importantes de vegetación ribereña y de selva baja caducifolia (Gómez-Martínez, 2005), los cuales sirven de corredores biológicos y proporciona hábitats para una gran diversidad de fauna silvestre, con un elevado nivel de endemismo (García, 2010; Meave et al., 2012). En el caso de los reptiles, en la cuenca baja del rio Tehuantepec se ha registrado una gran riqueza y endemismo (Mata-Silva et al., 2021). No obstante, en los últimos años se han revalorizado económicamente los bancos de material aluvial en detrimento de los recursos biológicos, como resultado de la implementación de diversos programas de desarrollo para la región del Istmo de Tehuantepec, en donde se promueve la creación de infraestructura como supercarreteras, vía férrea transístmica, corredores comerciales, parques industriales y eólicos, modernización de los complejos industriales relacionados con el puerto petrolero de Salina Cruz (Torres-Fragoso, 2017). Debido a lo anterior, se incrementó la demanda de arena, grava y cantos rodados, como material primordial para la construcción. El aprovechamiento de los materiales aluviales podría ser una alternativa para el desarrollo de las comunidades de la cuenca baja del río Tehuantepec, comunidades en la que algunas familias registran un alto grado de marginación y pobreza (Cruz-Gonzáles & Hernández-García, 2014), sin embargo, es necesario contar con un plan sustentable de gestión del territorio en donde se contemple el manejo del hábitat de fauna silvestre, con la finalidad de evitar pérdidas irreversibles de ciertas especies. Actualmente México no cuenta con una legislación específica que norme la extracción de materiales aluviales en márgenes de ríos, por lo que los emprendimientos de extracción de material aluvial no contemplan la implementación de planes de manejo del hábitat, rehabilitación de graveras, o acciones de mitigación y compensación (Torres-Mura et al., 2014). Con el propósito de contar con bases objetivas para realizar propuestas de protección del hábitat en áreas de aprovechamiento de materiales aluviales, es necesario generar información sobre la riqueza y abundancia de las especies que ahí habitan, que son indicadores del impacto de las actividades humanas (Moreno et al., 2011). Para cuantificar el efecto de la extracción de materiales aluviales en la diversidad y estructura de las comunidades de reptiles, se comparó la diversidad alfa y beta, en sitios con y sin extracción de materiales aluviales.
Materiales y métodos
Área de estudio: El trabajo se realizó en una zona de aprovechamiento de materiales aluviales del río Tehuantepec, bajo la jurisdicción de la comunidad de Santa Cruz Tagolaba, Santo Domingo Tehuantepec, Oaxaca, México (Fig. 1). Se localiza entre las coordenadas 16°19'37''-16°17'10'' N & 95°13'54''-95°11'13'' W. Forma parte de la subprovincia fisiográfica Llanura del Istmo (Instituto Nacional de Estadística, Geografía e Informática, 2014). El área de estudio corresponde al lecho superior del río Tehuantepec, donde se depositan grandes cantidades de materiales aluviales cuando el lecho inferior se desborda e inunda el lecho superior formando una llanura de inundación, que tiene una superficie de 4.95 km2 (495 ha). El tipo de vegetación presente corresponde a matorral espinoso en grado de sucesión terciaria, selva mediana subcaducifolia y selva baja caducifolia en grado de sucesión secundaria (Torres-Colín, 2004). El clima que predomina en la zona es Awig según la clasificación de Köppen modificado por García (2004): cálido subhúmedo con lluvias en verano; el mes más caliente se presenta en mayo (30 °C), el más frio es enero (26.5 °C), con oscilación térmica anual de tipo isotermal (inferior a 5 °C). La precipitación promedio anual es de 884.7 mm3, la estación lluviosa generalmente se presenta en mayo y termina en octubre; mientras que la estación seca va de noviembre hasta abril (Instituto Nacional de Estadística, Geografía e Informática, 2010).
Trabajo de campo: Se realizaron cuatro muestreos, dos en la época seca (abril y junio), y otros dos en la época lluviosa (agosto y octubre) de 2014 (Comisión Nacional del Agua, 2014). El muestreo se realizó con una combinación de dos técnicas complementarias, parcelas de búsqueda activa y trampas de caída.
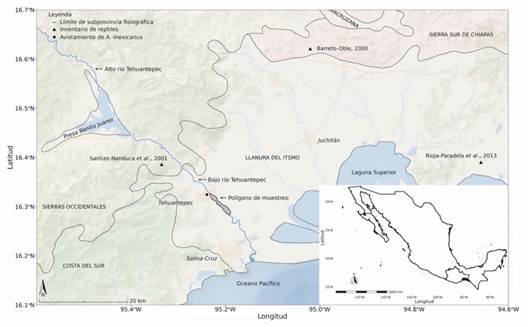
Fig. 1 Área de estudio, subprovincias fisiográficas y otros estudios sobre diversidad de reptiles y ocurrencia de A. mexicanus. / Fig. 1. Study area, Physiographic subprovinces and other studies on reptile diversity and occurrence of A. mexicanus.
Las parcelas de búsqueda activa tuvieron una longitud de 300 x 25 m (0.75 ha). Tres parcelas se ubicaron en hábitats sin actividades de extracción (sin marcas de perturbación reciente) y tres en hábitats con extracción de materiales aluviales, cada parcela se muestreó una sola vez de 8:00 a 12:00 h, en cada fecha de muestreo. La búsqueda de los individuos se realizó con el método de encuentro visual con captura manual y búsqueda activa removiendo la hojarasca, debajo de piedras grandes, encima, dentro y debajo de troncos caídos, sobre las ramas y troncos de árboles (Urbina-Cardona et al., 2015). Los individuos encontrados se capturaron con gancho herpetológico y red de golpeo. En cada parcela se colocó en línea seis trampas de caída con una separación de 50 m entre ellas y se disimularon con ramas y hojas. Estas trampas consistieron en un cilindro de plástico de 20 cm de profundidad por 10 cm de diámetro, se fabricaron con envases de refrescos. Se colocaron durante el día previo al muestreo de cada parcela, se destaparon en la tarde y se revisaron al finalizar el muestreo de la parcela correspondiente. Los individuos capturados se fotografiaron y se identificaron hasta el nivel de especie, se empleó la recopilación de claves de anfibios y reptiles de México (Flores-Villela et al., 1995) y la guía de reptiles de Centro América (Köhler, 2008). Cuando no fue posible identificarlo en campo, se trasladaron en bolsas de tela al campamento para su identificación y se liberaron al día siguiente en la parcela donde fueron capturados. La actualización de los cambios taxonómicos se realizó en gabinete siguiendo el trabajo de Mata-Silva et al. (2021), excepto el cambio de Mabuya brachypoda a Marisora syntoma sp. nov. (McCranie et al., 2020), y Coleonyx elegans a Coleonyx nemoralis (Butler et al., 2023). Para cada individuo se registró el microhábitat en donde fue avistado antes de que se desplazara (hojarasca, tronco caído, tronco erguido, vegetación ribereña, arborícola o saxícola), el sustrato predominante (arcilla, limo, arena, grava, canto rodado), la presencia de señales de quema, el porcentaje de superficie expuesta al sol, distancia a cuerpos de agua, la estructura de la vegetación (arbórea, arbustiva, herbácea), el pH y la humedad del suelo en porcentaje.
Completitud del inventario y diversidad alfa: Para evaluar la completitud del muestreo y estimar la riqueza de especies en cada hábitat se utilizaron curvas de acumulación de especies (CAE) y el estimador Chao. La diversidad en cada hábitat se midió utilizando el índice de Shannon-Wiener (H') y el número efectivo de especies de orden uno (1D) (García-Morales et al., 2011). Las posibles diferencias en la magnitud de los índices se establecieron por superposición de intervalos del 95 % estimado con 500 remuestreos Bootstrap (Chao et al., 2015). Las especies que determinaron los patrones de abundancia se identificaron con un análisis ordenamiento por escalamiento multidimensional no métrico (EMNM). Las especies retenidas fueron aquellas con una correlación significativa (P < 0.05). Todos los análisis se realizaron con el software R (R Core Team, 2014) y empleando la librería SpadeR (Chao et al., 2015).
Diversidad beta: La estructura de la comunidad de reptiles entre los sitios con y sin actividades de extracción de materiales aluviales se comparó con la disimilitud beta (bcc), en sus componentes de reemplazo (b-3) y la diferencia en riqueza (brich), en su versión aditiva bcc = b-3 + brich (Carvalho et al., 2013). La interpretación de las tasas de recambio fue complementada con la prueba de asociación no paramétrica de Olmstead-Tukey que integra la abundancia y la prevalencia de cada especie en un hábitat particular: común (abundante y frecuente), ocasional (poco abundante y frecuente), frecuente (abundante y poco frecuente) y rara (poco abundante y poco frecuente). Este índice es un indicador razonable del nivel de sinantropismo para una especie (Desales-Lara et al., 2013).
Los factores del hábitat correlacionados con las abundancias se identificaron con un análisis de correspondencias canónicas (ACC) entre la matriz de abundancias de los reptiles como variable de respuesta y la matriz las variables del hábitat como variables explicativas. Se incluyeron factores ambientales no correlacionados entre sí (VIF < 10), y se realizó la prueba de significancia de permutaciones (ANOVA) para determinar los factores del hábitat correlacionados con la abundancia y composición de reptiles. Los análisis se realizaron con la librería vegan (Oksanen et al., 2015).
Especies en alguna categoría de riesgo: Las especies avistadas en alguna categoría de riesgo se identificó revisando la NOM-059-ECOL-2001 (Secretaría de Medio Ambiente y Recursos Naturales, 2010) y la lista roja de especies amenazadas (Unión Internacional para la Conservación de la Naturaleza, 2015).
Resultados
Completitud del inventario y diversidad alfa: Con un esfuerzo de muestro de 576 h, se registraron 27 especies pertenecientes a diez familias y una abundancia de 1 595 individuos (Tabla 1). Se registró el 87 % de las 31 especies predichas por la curva de acumulación de especies (Tabla 2). Asimismo, se observaron 20 especies (estación seca: cuatros serpientes y 16 lagartijas; estación lluviosa: cinco serpientes y 15 lagartijas), aunque la abundancia de éstas fue mayor en la estación seca (1 054 individuos) que en estación lluviosa (541 individuos). En los sitios sin actividades de extracción se observó el 84 % de las especies estimadas con la curva de acumulación de especies (CAE), y en los sitios con extracción se registró el 82 % (Tabla 2). En los sitios sin extracción se encontró una mayor riqueza (26 especies) y abundancia (1 205 individuos) que en los sitios con extracción (14 especies y 390 individuos). La especie más abundante en ambos tipos de sitios fue A. deppii.
Se estimó una mayor diversidad en los sitios sin extracción de materiales aluviales con respecto a los sitios con extracción (P < 5.623631e-05), que representó una reducción del 26.73 % (Tabla 3).
Tabla 1 Especies observadas en una zona de aprovechamiento de materiales aluviales en la cuenca baja del Rio Tehuantepec, Oaxaca, México. Table 1. Observed species in a zone of gravel pit installation in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
| Familia | Nombre científico | Extracción en el sitio | Temporada del año | |||
| Si | No | Lluviosa | Seca | |||
| Boidae | ||||||
| Boa imperator | 0 | 1 | 1 | 0 | ||
| Colubridae | ||||||
| Drymobius margaritiferus | 0 | 1 | 1 | 0 | ||
| Leptophis diplotropis | 1 | 1 | 2 | 0 | ||
| Masticophis mentovarius | 0 | 2 | 0 | 2 | ||
| Oxybelis fulgidus | 0 | 1 | 0 | 1 | ||
| Oxybelis miccrophthalmus | 0 | 1 | 1 | 0 | ||
| Salvadora lemniscata | 1 | 1 | 1 | 1 | ||
| Trimorphodon biscutatus | 0 | 1 | 0 | 1 | ||
| Corytophanidae | ||||||
| Basiliscus vittatus | 76 | 69 | 57 | 88 | ||
| Dactyloidae | ||||||
| Norops boulengerianus | 0 | 2 | 0 | 2 | ||
| Norops lemurinus | 3 | 2 | 0 | 5 | ||
| Noropis sericeus | 0 | 7 | 0 | 7 | ||
| Eublepharidae | ||||||
| Coleonyx nemoralis | 0 | 1 | 0 | 1 | ||
| Gekkonidae | ||||||
| Hemidactylus frenatus | 4 | 26 | 24 | 6 | ||
| Iguanidae | ||||||
| Ctenosaura oaxacana | 0 | 1 | 1 | 0 | ||
| Ctenosaura pectinata | 3 | 2 | 3 | 2 | ||
| Iguana iguana | 3 | 1 | 3 | 1 | ||
| Phrynosomatidae | ||||||
| Sceloporus edwardtaylori | 0 | 37 | 23 | 14 | ||
| Sceloporus siniferus | 0 | 121 | 25 | 96 | ||
| Sceloporus variabilis | 1 | 14 | 5 | 10 | ||
| Urosaurus bicarinatus | 4 | 68 | 47 | 25 | ||
| Scincidae | ||||||
| Marisora sintoma | 0 | 3 | 3 | 0 | ||
| Teiidae | ||||||
| Aspidoscelis deppii | 255 | 763 | 302 | 716 | ||
| Aspidoscelis guttata | 1 | 5 | 5 | 1 | ||
| Aspidoscelis mexicanus | 1 | 0 | 1 | 0 | ||
| Aspidoscelis motaguae | 10 | 27 | 9 | 28 | ||
| Holocosus undulatus | 27 | 47 | 27 | 47 | ||
| Especies | 14 | 26 | 20 | 20 | ||
| Abundancia | 1 205 | 390 | 541 | 1 054 | ||
Tabla 2 Abundancia, riqueza observada y estimada en la comunidad de reptiles en una zona de aprovechamiento de materiales aluviales en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Table 2. / Abundance, Observed and estimated richness of the reptile community in a zone of gravel pit installation in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
| N | S | Asíntota (a,b) | Cobertura | Chao 1 | |
| Comunidad | 1 595 | 27 | 31 (1.085, 0.035) | 87.1 | 32.6 ± 5.34 |
| Temporada del año | |||||
| Lluviosa | 541 | 20 | 23 (1.752, 0.077) | 86.9 | 27.5 ± 8.12 |
| Seca | 1 054 | 20 | 23 (1.581, 0.068) | 86.9 | 23.7 ± 4.19 |
| Condición del sitio | |||||
| Con extracción | 390 | 14 | 17 (0.865, 0.051) | 82.3 | 24.0 ± 10.23 |
| Sin extracción | 1 205 | 26 | 31 (1.682, 0.055) | 83.9 | 35.0 ± 7.60 |
N= número de individuos; S= riqueza observada, Asíntota: número esperado de especies estimado como a/b. / N= Number of individuals, S= Observed richness, Asymptote: expected number of species estimated as a/b.
Tabla 3 Diversidad de las comunidades de reptiles en una zona de aprovechamiento de materiales aluviales en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Table 3. / Diversity of the reptile community in a gravel pit installation in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
| Shannon | Equidad | 0D | 1D | |
| Comunidad | 1.454 ± 0.042 | 0.441 | 35.2 ± 6.2 | 4.28 ± 0.18 |
| Temporada del año* | ||||
| Lluviosa | 1.671 ± 0.060a | 0.558 | 27.2 ± 6.3a | 5.31 ± 0.31a |
| Seca | 1.277 ± 0.043b | 0.426 | 28.2 ± 7.1a | 3.59 ± 0.16b |
| Condición del sitio* | ||||
| Con extracción | 1.158 ± 0.062b | 0.438 | 20.4 ± 6.00a | 3.18 ± 0.18b |
| Sin extracción | 1.468 ± 0.042a | 0.450 | 44.2 ± 12.8a | 4.34 ± 0.17a |
0D= Riqueza de especies, 1D= exponencial del índice de entropía de Shannon. *Los índices seguidos de la misma literal indican superposición en sus intervalos de confianza, por lo que se consideran iguales. / 0D= Species richness, 1D= Exponential of Shannon's Entropy Index. *Indices followed by the same literal indicate overlapping in their confidence intervals, so they are considered equal.
En los sitios sin actividades de extracción y en estación lluviosa se observó la misma diversidad que en toda la comunidad. Los patrones de abundancia fueron diferentes en cada tipo de hábitat (Fig. 2). En la temporada seca estuvo determinado por S. siniferus en los sitios sin extracción, mientras que en los sitios con extracción estuvo determinado por A. deppii y B. vittatus. En contraste, las abundancias en la temporada de lluvia en el área sin extracción estuvieron determinado por A. deppii y U. bicarinatus (Fig. 2).
Diversidad beta: El impacto de la extracción de materiales aluviales tuvo un efecto significativo en la diversidad de la comunidad de reptiles, ocasionando una disimilitud del 48.1 % con respecto a los sitios donde no se realiza la extracción, de la cuales el 40.7 % corresponde a diferencia en riqueza y apenas el 7.4 % al recambio. El efecto fue mayor en las serpientes que en las lagartijas, pues la disimilitud fue prácticamente el doble en las primeras y se debió a diferencias en riqueza (Tabla 4). El efecto negativo de la extracción de materiales aluviales fue mayor en la estación seca que en la estación lluviosa, pues en la primera la disimilitud corresponde a diferencias en la riqueza, mientras que, en la segunda, aproximadamente la mitad de la disimilitud corresponde a diferencias en la riqueza y la otra mitad al recambio de especies (Tabla 4).
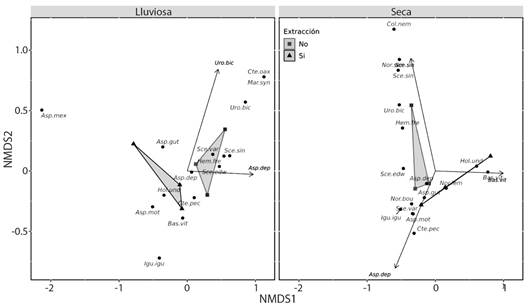
Fig. 2 Escalamiento multidimensional no métrico (EMNM) de las abundancias de especies de reptiles avistados en un área con y sin extracción de materiales aluviales, en la estación lluviosa y seca en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Fig. 2. Non-Metric Multidimensional Scaling (nMDS) of the abundance of reptile species observed in an area with and without gravel pit, in the rainy and dry seasons in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
Tabla 4 efecto de la extracción de materiales aluviales en la diversidad de reptiles por temporada lluviosa y seca, en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Table 4. / Impact of the gravel pit installation on the diversity of the reptile community by rainy and dry season, in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
| bcc | b-3 | brich | |
| Comunidad | 0.481 | 0.074 | 0.407 |
| Lluviosa | 0.500 | 0.300 | 0.200 |
| Seca | 0.550 | 0.000 | 0.550 |
| Sauria | 0.421 | 0.105 | 0.316 |
| Lluviosa | 0.467 | 0.267 | 0.200 |
| Seca | 0.437 | 0.000 | 0.437 |
| Serpentes | 0.75 | 0.00 | 0.75 |
| Lluviosa | 0.8 | 0.4 | 0.4 |
| Seca | 1.0 | 0.0 | 1.0 |
Las más afectadas fueron las especies del género Sceloporus y N. sericeus que son comunes y desaparecieron en las áreas con actividades de extracción (Fig. 3). Lo mismo ocurre con las especies listadas en la NOM-059-SEMARNAT-2010, con excepción de C. pectinata y L. diplotropis, que son especies que pueden vivir en ambientes antropizados. Los saurios A. deppii, H. undulatus y B. vittatus pueden considerarse especies sinantrópicas.
Factores del hábitat relevantes para los reptiles: En la zona sin extracción de materiales aluviales se identificaron dos factores ambientales significativos: distancia a los cuerpos de agua (Distag) y el sustrato de tipo arenoso-gravoso (Sargr), sin embargo, ambas variables estuvieron correlacionadas entre sí. La distancia a los cuerpos de agua explicó el 95.34 % la estructura y abundancia de reptiles (P = 0.006944). El primer ACC incluyó los factores ambientales relacionado con el agua (distancia a cuerpos de agua: Distag, r2 = 0.989, P = 0.002778), el tipo de cobertura vegetal (vegetación arbórea: Var, r2 = 0.843, P = 0.03888) y microhábitats terrestres (microhábitats en troncos caídos: Mtca y microhábitats en troncos erguidos: Mter) (Fig. 4). El segundo ACC incluyó las variables ambientales: sustrato arcillo-gravoso, vegetación arbórea, micro hábitat troncos erguido (Sargr, Var, Mtca y Mter) (Fig. 4).
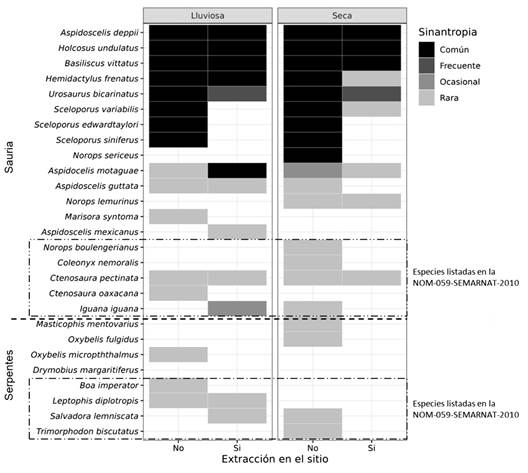
Fig. 3 Patrones de presencia de las especies de reptiles avistados en un área de extracción de materiales aluviales en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Fig. 3. Reptile species presence patterns of observed in a gravel pit installation in the lower basin of the Tehuantepec River, Oaxaca, México.
Este análisis explicó el 95.27 % la abundancia y composición de reptiles (P = 0.008333). Aunque solo las variables sustrato arcillo-gravoso (r2 = 0.882, P = 0.008333) y vegetación arbórea (r2 = 0.836, P = 0.05) mostraron correlaciones significativas. En los sitios con extracción de materiales aluviales, el análisis que mejor explicó la abundancia y composición de reptiles incluyó las variables: exposición al sol (Sol, r2 = 0.951, P = 0.008333), vegetación herbácea (Vhe, r2 = 0.940, P = 0.034722) y altura de los árboles (Alar), que explicaron el 72.32 % (P = 0.0375) de la abundancia y estructura de reptiles (Fig. 4).
Especies con alguna categoría de riesgo: Se avistaron nueve especies listadas en la NOM-059-SEMARNAT-2010, en la categoría de amenazadas: B. imperator, L. diplotropis, C. pectinata, C. nemoralis, C. oaxacana y con protección especial a S. lemniscata, T. biscutatus, A. boulengerianus e I. iguana. La lista roja de la IUCN incluye a C. oaxacana en peligro crítico y en peligro a B. imperator, T. biscutatus, C. nemoralis, C. pectinata e I. iguana.
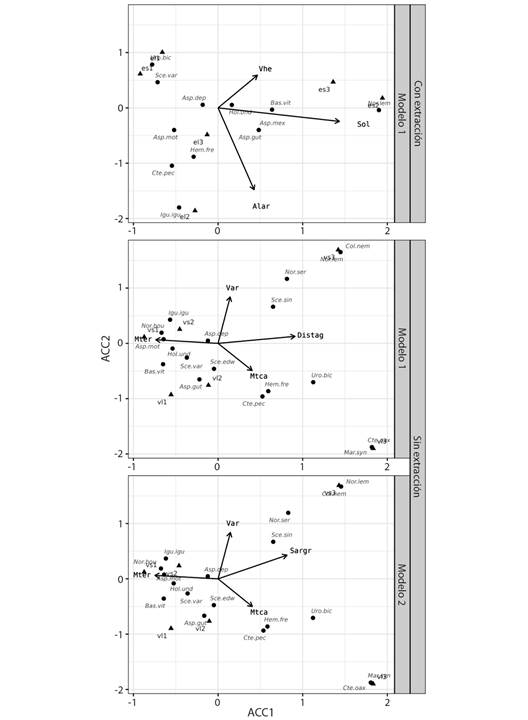
Fig. 4 Análisis de Correspondencias Canónicas (ACC) entre la comunidad de reptiles y variables ambientales en una zona de aprovechamiento de materiales aluviales en la cuenca baja del Rio Tehuantepec, Oaxaca, México. / Fig. 4. Canonical Correspondence Analysis (CCA) between the reptile community and environmental variables in a gravel pit installation in the lower basin of the Tehuantepec River, Oaxaca, Mexico.
Discusión
Se registraron 27 especies, lo que representó una completitud del inventario del 87 %. En el 55 % de las especies registradas se avistaron uno o dos individuos. Es posible que puedan avistarse más especies empleando métodos diseñados para especies raras (Boback et al., 2020) y para especies que debido a sus hábitos son difíciles de observar, como las especies fosoriales o las arborícolas (Henderson et al., 2016). Sin embargo, considerando la historia natural de las especies registradas y potenciales en una zona altamente perturbada, el número de especies registradas en este estudio fue representativo de la comunidad de reptiles que viven en áreas de aprovechamiento de materiales aluviales de la cuenca baja del río Tehuantepec (Fig. 1). La completitud del inventario observada en los sitios con extracción (82 %) fue similar al observado en los sitios sin extracción (84 %). Resultados similares se han observado en perturbaciones catastróficas naturales de la vegetación en un bosque tropical seco: después del huracán Jova la completitud fue del 81-90 % y después del huracán Patricia fue del 85-89 % (Marroquín-Páramo et al., 2021).
Los resultados muestran que las actividades de extracción de materiales aluviales han modificado notablemente la estructura de la comunidad de reptiles, en comparación con la riqueza registrada en otras áreas de bosque seco del Istmo de Tehuantepec con menor perturbación humana, mayor cobertura vegetal y sin actividades de extracción de materiales aluviales : diez especies menos que en una zona con cobertura vegetal (Rioja-Paradela et al., 2013), 17 especies menos que en Nizanda (Barreto-Oble, 2000) y siete especies menos que en el cerro Guiengola (Martín-Regalado et al., 2011). Lo anterior sugiere que las actividades de extracción de material aluvial disminuyen considerablemente la diversidad de especies porque se ven expuestos a microambientes hostiles (Díaz et al., 2006), también incrementa la abundancia de especies generalistas, modificándose así la riqueza y abundancia (Suazo-Ortuño, Benítez-Malvido, et al., 2018).
El impacto de las actividades de extracción de materiales aluviales fue diferencial en lagartijas y serpientes, como se ha reportado con la perturbación de otros hábitats: bosque tropical a potrero (Urbina-Cardona & Reynoso, 2005) y bosque tropical seco a campos agrícolas (Suazo-Ortuño et al., 2008). En el grupo de las lagartijas se observó un recambio de aproximadamente la mitad de las especies. En contraste, en el grupo de las serpientes, la extracción de materiales aluviales ocasionó el remplazo de todas las especies en la temporada seca.
Las lagartijas de la familia Teiidae (A. deppii y H. undulatus) y Corytophanidae (B. vittatus) mostraron tolerancia a la perturbación del hábitat. La modificación de las condiciones del hábitat en ocasiones favorece y provee de hábitats exitosos para algunas especies de lagartijas de dimensiones pequeñas por el aumento de espacios para termorregular (Suazo-Ortuño et al., 2008). En cambio, las lagartijas del género Sceloporus fueron sensibles a las actividades de extracción de materiales aluviales. Estas especies estuvieron asociadas con microhábitat: troncos erguidos (Mter), sustratos areno-gravoso (Sargr) y cobertura vegetal de tipo arbórea-herbácea (Varbhe). Esto corresponde con los microhabitats reportados para S. siniferus, que son suelo, rocas y troncos (Ansell et al., 2014).
Las especies de serpientes fueron sensibles a la extracción de materiales aluviales, pues todas desaparecieron en los sitios donde se realiza esta actividad. Como ocurre con perturbaciones fuertes como los huracanes, las especies arborícolas son las más sensibles a los cambios súbitos del paisaje en los bosques secos (Suazo-Ortuño, Urbina-Cardona, et al., 2018). En bosques secos, se ha documentado que en áreas perturbadas por actividades agrícolas aledañas a la vegetación ribereña se registra mayor riqueza y abundancia de serpientes que la vegetación ribereña misma, porque en el área perturbada encuentran mayor disponibilidad de alimento (Suazo-Ortuño, Benítez-Malvido, et al., 2018a). Para la serpiente terrestre L. diplotropis que emplea la hojarasca del suelo como microhábitats se ha documentado una respuesta neutra a la perturbación en bosques secos (Suazo-Ortuño et al., 2008). En el presente trabajo, esta serpiente se observó también en los sitios con actividades de extracción de materiales aluviales, en la vegetación herbácea que se regenera en la estación lluviosa, mientras que en la estación seca se observó en pequeñas manchas de vegetación herbácea que se presentaban cerca de cuerpos de agua.
La correlación entre la distancia a los cuerpos de agua (Distag), con algunas variables del microhábitats: sustrato de tipo areno-gravoso (Sargr), altura de la vegetación herbácea (Alhe), asociación de vegetación arbórea-herbácea (Varbhe), microhábitats de troncos caídos (Mtca), y microhábitats troncos erguidos (Mter), se debe al proceso de sedimentación de materiales sólidos en un fluido (ley de Stokes). Durante la crecida de un río, los materiales aluviales de mayor masa (cantos rodados, troncos grandes, grava y arena), se precipitan rápidamente y en cualquier lugar en el lecho superior, en cambio los materiales de menor masa (limos y arcillas) quedan en suspensión durante más tiempo y precipitan en aguas tranquilas que se acumulan en las depresiones del paisaje del lecho superior, que después forman pequeños cuerpos de agua, en donde a partir de las orillas surge abundante vegetación herbácea y algunas especies arbóreas oportunistas. Es decir, existe una correlación entre la distancia de los cuerpos de agua con la ubicación de los bancos de arena-grava, la deposición de troncos transportados por crecidas de ríos y la ubicación de manchas de vegetación herbácea. En la cuenca baja del río Tehuantepec, la instalación de una gravera por lo general es en el lecho superior del rio, donde primero se podan hierbas y arbustos para poder cortar los árboles, después con retro excavadora arrancan y retiran las raíces de los árboles, y para acceder a los depósitos aluviales de interés económico (arena y grava) retinaran el suelo incipiente. Por esta razón, la actividad de extracción sí ocasiona la pérdida de microhábitats para especies terrestres y arborícolas.
De las seis especies de saurios listados en la NOM-059-ECOL-2001, solo la iguana negra (C. pectinata) estuvo correlacionado con microhábitat de troncos caídos y altura de la cobertura arbórea (Mtca y Alarb); en los sitios con extracción esta especie fue observada principalmente en grandes troncos que no fueron retirados y en ramas de árboles aislados que los trabajadores dejaron como refugio para sombra (principalmente Pithecellobium dulce y Prosopis laevigata). En el manejo de hábitats de reptiles la presencia de árboles es importante, ya que presentan tanto espacios con insolación como espacios sombreados y frescos que los reptiles usan para controlar la temperatura corporal (Dubois et al., 2009).
Las actividades de extracción de materiales aluviales también han modificado la equidad en la abundancia de las especies. En los sitios sin actividades de extracción se observó una mayor equidad que en los sitios con extracción de materiales aluviales. En los hábitats con extracción las condiciones adversas favorecieron la presencia de la lagartija B. vittatus. Esta especie considerada semi-arborícola-acuática (Savage, 2002), se vio favorecida por el establecimiento de las graveras, ya que aprovechan los cuerpos de agua que se forman cuando la extracción de material aluvial alcanza una profundidad igual al del nivel del manto freático. En el presente trabajo esta lagartija también se avistó en la parcela adyacente a la corriente de agua, tanto en los árboles como en vegetación herbácea, también se han reportado en la vegetación ribereña a lo largo del río Tehuantepec (Martín-Regalado et al., 2011), y en pastizales y vegetación anual de la región (Rioja-Paradela et al., 2013)
Los cambios estacionales de temperatura y humedad por las estaciones del año, generó un recambio del 60 % de las especies. Se observaron siete especies exclusivas en la estación lluviosa y una en la estación seca. La riqueza observada en la estación lluviosa fue mayor que en la estación seca, sin embargo, la abundancia fue mayor en la estación seca. Esto podría deberse a que en algunos casos ocurre una explosión demográfica antes de iniciar las lluvias (Duellman, 2005). Pero también podría estar relacionado con la facilidad de detección, ya que las condiciones de la explosión vegetativa producidas por la estación lluviosa dificultan la detección (Brambila-Navarrete, 2006). En este estudio, durante la estación lluviosa, el suelo se cubrió de abundante vegetación herbácea que dificultó el avistamiento de los reptiles. La mayor diversidad en la estación de lluvias también ha sido reportada en un bosque tropical seco de la cuenca baja del rio Verde, Oaxaca (Martínez-Salazar, 2011) y para el cerro Guiengola (Martín-Regalado et al., 2011). En ambos estudios también se ha reportado menos especies dominantes que en la estación seca.
La presencia de A. mexicana en parcelas con matorral xerofito en la cuenca baja del río Tehuantepec, se explica por la función de corredor biológico que cumplen los ríos (Gómez-Martínez, 2005; Meave et al., 2012). Es decir, existe más reportes de esta especie en las subprovincias de Valles Centrales y Sierras Occidentales (Fig. 1) que en que la región del Istmo de Tehuantepec (Mata-Silva et al., 2021). Lo que se debe tomar en cuenta, es que la cuenca alta del río Tehuantepec se inicia en cotas superiores de 700 m.s.n.m., en la subprovincia Sierras Occidentales, en los municipios de San Pedro Totolapam, San Dionicio Ocotepec y Santa María Zoquitlán, en donde también predominan vegetación tipo matorral xerofita, y se debe remarcar que estos municipios están en cabalgamiento entre las montañas de Sierras Occidentales y los Valles Centrales (Acosta et al., 2003). Por otro lado, la base de datos ''enciclo vida'' de la CONABIO iniciado en 1998 por Flores-Villela (2023), sí reporta la presencia de A. mexicana en la localidad de Santo Domingo Tehuantepec, en vegetación selva baja espinosa.
Se avistaron once especies con alguna categoría de riesgo o endémicas de la región. Aun cuando algunas especies de iguana (C. pectinata, I. iguana) o serpientes como L. diplotropis y S. lemniscata se observaron tanto en sitios con y sin actividades de extracción en la época lluviosa, las especies endémicas de la región como la lagartija N. boulengerianus y T. biscutatus, la iguana C. oaxacana, la lagartija espinosa S. edwardtaylori y los reptiles de gran tamaño como B. imperator solo se observaron en sitios con vegetación. La disimilitud del 48 % entre los sitios con y sin actividades de extracción, que representa un recambio de 13 especies exclusivas de los sitios sin actividades de extracción y solo una en los sitios con extracción, sugiere que las graveras son incompatibles con la preservación de niveles altos de biodiversidad de la herpetofauna, y posiblemente, de la fauna silvestre en general. Dado que el aprovechamiento de los materiales aluviales es parte del desarrollo económico de las comunidades que poseen estos recursos, es necesario encontrar un modo de aprovechamiento compatible con el manejo y conservación del hábitat para los reptiles y de la fauna silvestre en general. Una gestión de territorio que considere áreas mínimas de conservación de hábitats de reptiles durante la extracción y un manejo que considere la restauración de graveras abandonadas como parte del valor ecológico y cultural del río Tehuantepec, es urgente y necesario.
Ethical statement: the authors declare that they all agree with this publication and made significant contributions; that there is no conflict of interest of any kind; and that we followed all pertinent ethical and legal procedures and requirements. All financial sources are fully and clearly stated in the acknowledgments section. A signed document has been filed in the journal archives.












 uBio
uBio 


