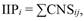Introducción
La frugivoría, así como los procesos ecológicos derivados como la dispersión y depredación de semillas son de vital importancia en los bosques tropicales, debido a que entre el 70 y el 90 % de las plantas leñosas dependen de un animal para dispersar efectivamente sus semillas (Farwig & Berens, 2012; Jordano, 2014). Debido a la alta diversidad tanto de plantas como de animales frugívoros en el trópico, las relaciones entre ellos suelen ser complejas, donde cada especie involucrada desempeña un papel diferencial en el resultado neto del proceso a nivel comunitario (Fricke et al., 2018; Lázaro et al., 2019; Messeder et al., 2020); mientras que a nivel ecosistémico la categorización de estas especies de acuerdo a su papel funcional, puede ser importante para establecer prioridades de conservación a nivel específico para el mantenimiento de los procesos ecológicos (Whittaker & Cottee-Jones, 2012).
En las últimas décadas, la complejidad de las relaciones interespecíficas, como la frugivoría, a nivel comunitario ha sido estudiada utilizando redes complejas (Bascompte & Jordano, 2007; García et al., 2018). Dos patrones de organización de las interacciones pueden ser detectados en estas redes. Por un lado, el anidamiento, que se caracteriza por presentar un núcleo de especies generalistas que interactúan entre sí y un grupo de especies especialistas que también interactúan con generalistas (Bascompte et al., 2003; Tylianakis et al., 2010); y, por otro lado, la modularidad que representa una red dividida en módulos de especies que interactúan más entre sí, que con el resto de las especies de otros módulos o de la comunidad (Olesen et al., 2007).
Ambos patrones de organización están relacionados con propiedades de resistencia y robustez a extinciones secundarias de especies y la promoción de la coexistencia de las especies que conforman estos sistemas a largo plazo (Bastolla et al., 2009; Rohr et al., 2014; Tylianakis et al., 2010). Asimismo, es posible cuantificar el aporte que tiene cada especie en el mantenimiento de los patrones estructurales de las redes, en términos del número de interacciones de cada nodo (Mello et al., 2015), la contribución al anidamiento (Saavedra et al., 2011), y el mantenimiento del patrón modular (Olesen et al., 2007). Particularmente, el aporte que tiene cada especie sobre el patrón estructural en las redes de frugivoría es de suma relevancia, ya que se relaciona de manera directa con el papel funcional que cumple cada una de ellas en términos de su potencialidad como dispersor efectivo de semillas (Acevedo-Quintero et al., 2020).
La dispersión de semillas representa un proceso ecológico importante para la configuración de los patrones de diversidad, la distribución espacial y los procesos de reclutamiento de las especies de plantas, promoviendo y asegurando el mantenimiento de la estructura y funcionalidad de los bosques (Traveset & Richardson, 2014). En este sentido, el papel funcional que cumple cada especie en la red de interacción ha sido estudiado mucho más frecuentemente desde la perspectiva de los animales (Donoso et al., 2016; Fricke et al., 2018; Naniwadekar et al., 2019), mientras que las plantas han sido evaluadas de acuerdo a su aporte a los patrones estructurales de las redes (Messeder et al., 2020; Ramos-Robles et al., 2018; Sebastián-González et al., 2017). Sin embargo, en términos de la interacción mutualista planta-frugívoro el beneficio que recibe una especie (p.e. animal) repercute en la disminución de la competencia que su par interactuante (planta) tiene con otras plantas por dispersores de semillas. Así, este beneficio indirecto será mayor cuantas más plantas beneficien al animal (Bastolla et al., 2009). Por lo tanto, la importancia funcional de las especies de plantas sobre los procesos ecológicos puede ser determinada por el tipo de animales a los cuales beneficia, en términos de su participación como dispersores efectivos de semillas a nivel comunitario.
Dado que las características morfológicas de los frutos actúan como señales atractivas para los animales y se relacionan con la obtención de recompensas alimenticias (Schaefer & Schmidt, 2004), es de esperar que la relevancia funcional de las especies de plantas esté ligada a la configuración de los rasgos de sus frutos (Ramos-Robles et al., 2018). Por ejemplo, el color, el tamaño, la forma, el tipo de pulpa, o la posición en el estrato vertical, puede determinar la diversidad o el tipo de frugívoros consumidores (Herrera, 1987; Rodríguez-Godínez et al., 2022; Valido et al., 2011; Wheelwright, 1985). Por ello, nuestra investigación pretende responder las siguientes preguntas: i) ¿Cuáles son las especies de plantas ecológicamente más importantes en redes de interacción planta-frugívoro del bosque seco tropical (bs-T)? y ii) ¿Cuáles son los atributos de los rasgos funcionales de los frutos que determinan dicha importancia? Esta información podría ser de gran utilidad en programas de restauración ecológica mediante la selección de especies de plantas que ayuden a recuperar de manera efectiva la funcionalidad del bs-T, el cual se encuentra altamente amenazado en Colombia y toda la región neotropical (Etter et al., 2020).
Materiales y métodos
Área de estudio: Este estudio se llevó a cabo en el departamento de Córdoba al norte de Colombia. Esta región del Caribe colombiano corresponde a la zona de vida bosque seco tropical (bs-T), con un clima cálido y temperatura promedio de 28 °C, precipitación de 1 300 mm/año en distribución unimodal, con una época seca de diciembre a marzo y una época de lluvias de abril a noviembre (Ballesteros-Correa & Linares-Arias, 2015). Los muestreos incluyeron las épocas lluviosa y seca completas en dos localidades: (1) la hacienda Guacamayas (8º11'72'' N & 75º32'78'' W) que se compone de fragmentos de bs-T estructuralmente conectados por corredores en una matriz de pastizales donde se practica ganadería silvopastoril; y (2) la hacienda El Pino (8°25'11.33'' N & 76°03'24.43'' W), donde los muestreos se limitaron a un fragmento aislado de otras formaciones boscosas e inmerso en una matriz de ganadería extensiva que han sido destinado a la conservación del bosque nativo. En ambas localidades las áreas de muestreo abarcaron 150 ha aproximadamente.
Registro de interacciones: En cada localidad realizamos ocho sesiones de muestreo de cinco días de duración cada una, a intervalos de dos meses entre abril 2017 y junio 2018. Se establecieron cuatro transectos de 1 km de longitud con un promedio de separación entre ellos de 1 300 m para Guacamayas y 850 m El Pino. Los transectos incluyeron los diferentes hábitats (borde e interior de bosque fragmentado, bosque de galería, áreas abiertas y pastos arbolados), dos observadores con experiencia en la fauna de la región recorrieron de manera simultánea dos transectos separados y se registraron todos los eventos de frugivoría observados con ayuda de binoculares sin restringir las observaciones a un grupo taxonómico particular (p.e., aves y mamíferos). En cada planta (arbusto, árbol, liana o palma) donde se observó consumo de frutos se realizó un muestreo focal de 5 minutos, si durante el último minuto de observación fue registraba una nueva interacción, la observación focal se extendía un minuto más, esto con el fin de optimizar el tiempo de muestreo y obtener la mayor cantidad de interacciones posible. Un evento de frugivoría fue definido como una visita donde un organismo consume un fruto, o parte del fruto de la planta observada. De cada observación se tuvo en cuenta la especie de planta, la especie de frugívoro y el número de individuos que se observó consumiendo frutos. Las plantas que no pudieron ser identificadas in situ, fueron muestreadas y transportadas al herbario de la Universidad de Córdoba (HUC) para su posterior identificación. Los datos fueron complementados con la instalación de 7 cámaras automáticas (Bushnell® Trophy Cam) por localidad, ubicadas a 50 cm del suelo cerca de cúmulos de frutos caídos, o en el dosel, a una altura de 10 a 15 m, cerca de racimos de frutos maduros. Las cámaras fueron programadas para capturar videos de 30 segundos con intervalos entre grabaciones de 20 segundos y estuvieron activas de manera continua (24 h). La localización y cantidad de las cámaras varió durante el estudio en función de la disponibilidad de frutos.
Rasgos funcionales de los frutos: Con el fin de caracterizar los frutos de las especies de plantas consumidos por los frugívoros, se realizó la medición cualitativa y cuantitativa de los atributos de cuatro rasgos funcionales: color, tipo de pulpa, estrato y tamaño (Tabla 1). Para esto se recolectaron 10 frutos por individuo en 10 individuos de cada especie que fue consumida por los frugívoros. En todos los casos se prefirieron los frutos en el estado seleccionado por los animales y plantas en buenas condiciones fitosanitarias (Ordano et al., 2017). En los casos donde no había suficientes frutos, o no estaban accesibles, los rasgos fueron tomados a partir de literatura especializada y guías de campo (p.e., http://legacy.tropicos.org/Project/FM; Galeano & Bernal, 2010). Finalmente, el grado de similitud entre las especies de plantas usadas por los frugívoros en cada localidad fue comparada usando el índice Jaccard (Villareal et al., 2004).
Tabla 1 Rasgos funcionales de los frutos, justificación y atributos de las especies de plantas consumidas por frugívoros en un bosque seco del Caribe colombiano. / Table 1. Fruits functional traits, justification and attributes from plants species consumed by frugivores in a Colombian Caribbean Tropical dry forest.
| Rasgo | Justificación | Atributo |
| Color | El color y el contraste son importantes en el reconocimiento de una recompensa nutritiva por parte de los frugívoros (Ordano et al., 2017; Sinnott-Armstrong et al., 2018) | Los frutos fueron clasificados en categorías de manera visual. Dada la subjetividad de la información se conformaron cuatro categorías generales: i) verde; ii) amarillo/naranja; iii) morado/negro/café; y, iv) rojo. |
| Tipo de pulpa | El tipo de pulpa está asociado al síndrome de dispersión de las semillas. En el trópico más del 80 % de las plantas con frutos carnosos sus semillas se dispersan a través de vectores animales (Farwig & Berens, 2012; Jordano, 2014) | Se establecieron cuatro categorías según el tipo de pulpa. i) arilo: donde la parte carnosa corresponde a partes distintas al pericarpio; ii) carnosa: en los que el pericarpio es jugoso, carnoso y rodea a las semillas; iii) fibrosa: con abundantes estructuras fibrosas en el pericarpio; iv) seca: con poco contenido de agua en el pericarpio (< 50 %) |
| Estrato | El estrato vertical en el cual se ofertan y consumen los frutos tiene influencia en la posición de las especies y las preferencias de forrajeo en las redes de interacción (Almazán-Núñez et al., 2021; Schleuning et al., 2011) | Según la posición de la disponibilidad de los frutos se establecieron tres categorías: i) bajo (< 4.9 m); ii) medio (5.0 - 20.9 m); y, iii) alto (> 21 m) |
| Tamaño | El tamaño del fruto puede generar restricciones de tipo mecánico que impiden o facilitan las interacciones con algunos grupos de animales (Herrera, 1987; Muñoz et al., 2017) | Diámetro del fruto (milímetros) |
Redes de interacción y determinación de la importancia de las plantas: Para ambas localidades se determinaron los patrones de organización estructural de las redes en términos del anidamiento, utilizando la métrica NODF propuesta por Almeida-Neto et al. (2008); y la modularidad (Q), siguiendo el algoritmo QuanBiMo (Dormann & Strauss, 2014). En ambos casos se evaluó si la métrica calculada difiere de lo esperado por el azar. Para ello se construyó un modelo nulo Patefield con 1 000 matrices del mismo tamaño sobre las cuales se calculó la métrica correspondiente y luego se comparó con el valor de la matriz original. El valor de ''P'' corresponde a la fracción de matrices nulas con un valor de NODF o Q igual o mayor que la de la matriz observada. A nivel específico se calculó el aporte de cada especie al mantenimiento del anidamiento y la modularidad utilizando cuatro métricas: grado, que cuantifica el número de enlaces que tiene cada especie en la red y representa una medida básica de generalización de cada especie (Mello et al., 2015); la contribución al anidamiento, que cuantifica la contribución de cada especie al mantenimiento del anidamiento de la red (Saavedra et al., 2011); y las métricas c y z, que miden el nivel en el que una especie actúa como conector de diferentes módulos o del mismo módulo, respectivamente (Olesen et al., 2007).
Con las métricas a nivel específico se construyó un análisis de componentes principales (ACP) para determinar la variación entre especies en los parámetros topológicos de cada red (Estrada, 2007; Vidal et al., 2014) (AT1A, AT1B). Para esto utilizamos el primer eje del ACP como un estimador de la relevancia estructural de las especies en cada red (contribución a la estructura de la red, CNS; Acevedo-Quintero et al., 2020; Dáttilo et al., 2016; AT2). Todos los cálculos de redes fueron hechos utilizando el paquete bipartite (Dormann et al., 2009) en el software R.
Para identificar la importancia que tiene cada especie de planta sobre los procesos ecológicos a nivel comunitario, se utilizó una medida de su relevancia con base en la cantidad e identidad de los frugívoros que se alimentan de ella. Para esto, se empleó la CNS de cada especie de frugívoro en cada localidad (AT2), teniendo en cuenta que esta medida se relaciona de manera directa con el papel potencial que cada frugívoro desempeña como dispersor efectivo de semillas a nivel comunitario (Acevedo-Quintero et al., 2020). De esta manera, el índice de importancia de las especies de plantas (IIP) corresponde a la sumatoria de los valores de CNS del conjunto de frugívoros que interactúa con cada especie de planta como se muestra en la siguiente ecuación:
Donde, IIP es el índice de importancia de las plantas, CNS es la contribución a la estructura de la red de las especies de frugívoros, i son las especies de plantas, y j son las especies de frugívoros que interactúan con la planta i.
Relación entre la importancia de las plantas y sus rasgos funcionales: Para probar la relación entre la relevancia de las plantas y sus rasgos funcionales se ajustaron modelos lineales generalizados (MLG), con el IIP como variable respuesta considerando una distribución gaussiana, con los datos de las especies de plantas de ambas localidades en conjunto y de manera independiente. Los valores de los cuatro rasgos funcionales fueron incorporados como variables predictoras. Finalmente, como prueba de bondad de ajuste para los modelos se utilizó el valor de Pseudo-R2 propuesto por McFadden (1973), el cual compara un modelo sin ningún predictor con un modelo que incluye todas las covariables. Los cálculos fueron hechos utilizando el paquete DescTools (Signorell et al., 2019) en el software R. Las especies de plantas sin una identificación clara a nivel específico, o sin datos sobre sus rasgos funcionales no fueron incluidas en este análisis.
Resultados
Se registraron interacciones de frugivoría entre 57 especies de animales y 53 especies de plantas (AT2). Las especies de frugívoros están compuestas por cinco mamíferos y 52 aves (78.5 % Orden Passeriformes). En la localidad Guacamayas se destacan las especies Psarocolius decumanus, Ramphocelus dimidiatus, Thraupis episcopus y T. palmarum; mientras que para El Pino resaltan Melanerpes rubricapillus T. episcopus, Pitangus sulphuratus y P. decumanus. Las redes en ambas localidades mostraron valores de anidamiento (NODF Guacamayas 27.52, NODF El Pino 25.56) y modularidad (Q Guacamayas 0.37, Q El Pino 0.47) significativos (P < 0.001, indicando que los valores obtenidos son mayores que lo esperado por el azar). Las especies de plantas usadas por los frugívoros en ambas localidades varió considerablemente (Índice de Jaccard = 0.19). Los valores del IIP muestran una importante variabilidad entre las especies (Fig. 1, AT3), indicando que, según las interacciones establecidas cada planta tiene un papel diferencial sobre las especies de frugívoros a los cuales ofrecen una recompensa alimenticia a cambio del servicio de dispersión de semillas.
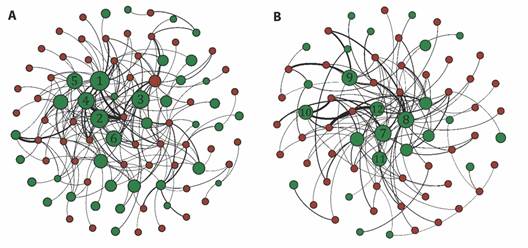
Fig. 1 Redes de interacción planta-frugívoro en las localidades A. Guacamayas y B. El Pino. Los círculos verdes corresponden a las especies de plantas y los rojos a las especies de frugívoros. El grueso de las líneas ilustra la fuerza de la interacción. El tamaño de los círculos verdes representa el valor del índice de importancia de las plantas (IIP). Los números dentro de los círculos corresponden a las plantas más importantes en cada localidad: 1. Miconia albicans, 2. Doliocarpus dentatus, 3. Myrcia falla, 4. Ficus sp2, 5. Miconia impetiolaris, 6. Vitex capitata, 7. Acacia mangium, 8. Ficus dendrocida, 9. Cecropia peltata. 10. Casearia corymbosa, 11. Trichilia hirta, 12. Bursera simaruba. / Fig. 1. Plant-frugivore interaction networks in A. Guacamayas and B. El Pino localities. Green circles correspond to plant species and red circles to frugivore species. The thickness of the lines illustrates the strength of the interaction. The green circles size represents the plant importance index (PII). The numbers inside the circles correspond to the most important plants in each locality: 1. Miconia albicans, 2. Doliocarpus dentatus, 3. Myrcia falla, 4. Ficus sp2, 5. Miconia impetiolaris, 6. Vitex capitata, 7. Acacia mangium, 8. Ficus dendrocida, 9. Cecropia peltata. 10. Casearia corymbosa, 11. Trichilia hirta, 12. Bursera simaruba.
Los atributos de los rasgos de los frutos consumidos por los animales presentan una gran variabilidad en relación con la importancia de las plantas en cada una de las localidades (Fig. 2, AT3). Sin embargo, algunas tendencias se pueden identificar, por ejemplo, se presentan mayores valores del IIP para los frutos rojos y las pulpas carnosas (Fig. 2A, Fig. 2B), mientras que los frutos de mayor tamaño (diámetro) pertenecen a las especies con menores valores del IIP (Fig. 2D). Estas tendencias son verificadas con el MLG conjunto, que revela efectos estadísticamente significativos positivos del IIP con los frutos rojos y las pulpas carnosas, y negativos con el tamaño de los frutos (Tabla 2). Los modelos discriminados por localidad muestran que para Guacamayas el IIP se relaciona con los frutos rojos y las pulpas carnosas, mientras que para El Pino solo el tamaño de los frutos presenta una relación negativa y significativa (Tabla 3).
Tabla 2 Modelos lineales generalizados entre el índice de importancia de las plantas y los rasgos funcionales de los frutos (ambas localidades). / Table 2. Generalized linear models between the plant importance index and the fruits functional traits (both locations).
| Pseudo- R2 = 0.11 | ||||
| Est. | Error est. | t | P | |
| (Intercepto) | 3.24 | 4.79 | 0.68 | 0.50 |
| Color | ||||
| Naranja/Amarillo | 1.58 | 3.00 | 0.53 | 0.60 |
| Morado/Negro/Café | 3.17 | 2.87 | 1.10 | 0.28 |
| Rojo | 8.43 | 3.34 | 2.53 | 0.02 |
| Tipo de pulpa | ||||
| Seca | -0.61 | 3.45 | -0.18 | 0.86 |
| Fibrosa | -0.15 | 2.81 | -0.05 | 0.96 |
| Carnosa | 5.17 | 2.37 | 2.18 | 0.04 |
| Estrato | ||||
| Bajo | 4.86 | 3.70 | 1.31 | 0.20 |
| Medio | 5.83 | 3.48 | 1.68 | 0.10 |
| Tamaño del fruto | ||||
| Diámetro | -6.28 | 1.96 | -3.20 | 0.00 |
Los valores significativos (P < 0.05) se muestran en negrita. / Significant values (P < 0.05) are shown in bold.
Tabla 3 Modelos lineales generalizados entre el índice de importancia de las plantas y los rasgos funcionales de los frutos discriminados por localidad. / Table 3. Generalized linear models between the plant importance index and the fruit functional traits discriminated by locality.
| Guacamayas. Pseudo- R2 = 0.11 | El Pino. Pseudo- R2 = 0.33 | |||||||
| Est. | Error est. | t | p | Est. | Error est. | t | P | |
| (Intercepto) | -1.88 | 7.04 | -0.27 | 0.79 | 8.46 | 4.85 | 1.75 | 0.12 |
| Color | ||||||||
| Naranja/Amarillo | 0.53 | 4.03 | 0.13 | 0.90 | 4.40 | 3.68 | 1.20 | 0.27 |
| Morado/Negro/Café | 3.54 | 4.05 | 0.87 | 0.39 | -0.51 | 3.83 | -0.13 | 0.90 |
| Rojo | 9.76 | 4.45 | 2.19 | 0.04 | 7.25 | 4.11 | 1.76 | 0.12 |
| Tipo de pulpa | ||||||||
| Seca | -1.02 | 5.29 | -0.19 | 0.85 | 2.70 | 4.31 | 0.63 | 0.55 |
| Fibrosa | 1.60 | 4.29 | 0.37 | 0.71 | -0.04 | 3.55 | -0.01 | 0.99 |
| Carnosa | 7.36 | 3.57 | 2.06 | 0.05 | -0.95 | 2.57 | -0.37 | 0.72 |
| Estrato | ||||||||
| Bajo | 6.46 | 5.11 | 1.26 | 0.22 | 4.32 | 3.99 | 1.08 | 0.31 |
| Medio | 7.73 | 4.92 | 1.57 | 0.13 | 5.71 | 3.68 | 1.55 | 0.16 |
| Tamaño del fruto | ||||||||
| Diámetro | -4.22 | 2.94 | -1.44 | 0.16 | -9.57 | 2.15 | -4.45 | 0.00 |
Los valores significativos (P < 0.05) se muestran en negrita. / Significant value (P < 0.05) is shown in bold.
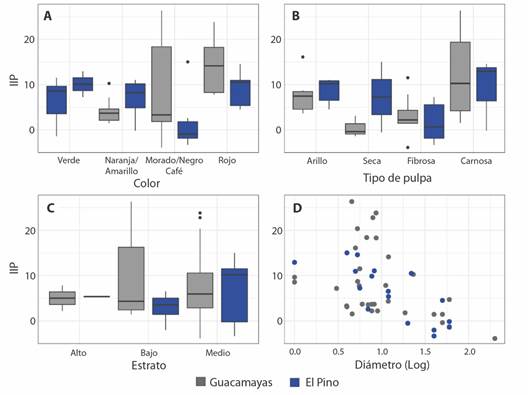
Fig. 2 Relación entre el índice de importancia de las plantas y los diferentes rasgos evaluados para cada localidad. A. color; B. tipo de pulpa; C. estrato; D. tamaño del fruto (diámetro). / Fig. 2. Relationship between the plant importance index and the fruits functional traits for each locality. A. Color; B. Pulp type; C. Stratum; D. fruit size (diameter).
Discusión
En este trabajo evaluamos el valor de importancia funcional de las especies de plantas en dos redes de interacción planta-frugívoro, el cual está determinado por la calidad de los frugívoros como potenciales dispersores de semillas de las especies de plantas con las cuales interactúan. Además, identificamos que las plantas con frutos carnosos y rojos, en la localidad Guacamayas, y pequeños, en la localidad El Pino, presentan los mayores valores de importancia funcional en el bosque seco tropical evaluado.
Aquí utilizamos un método novedoso, para la evaluación de especies clave, que se fundamenta en los resultados recíprocos de la relación mutualista entre interactuantes más que en la posición estructural de las especies de un solo grupo. Nuestros resultados muestran una gran variación en los valores del IIP, lo que sugiere que el conjunto de especies de frugívoros beneficiados por cada especie de planta tiene un aporte diferencial en los procesos ecológicos derivados de la dispersión de semillas. Por lo tanto, la presencia de las especies con altos valores del IIP favorece el desarrollo de relaciones mutualistas fuertes y beneficiosas para el mantenimiento y la regeneración del bosque seco tropical en las localidades estudiadas.
Entre las plantas identificadas con un papel funcional preponderante en la localidad Guacamayas se destacan algunas especies pertenecientes a los géneros Miconia (Melastomataceae) y Ficus (Moraceae), mientras que para El Pino los géneros Cecropia (Urticaceae) y Bursera (Burseraceae) son importantes. Estudios previos han mostrado que estos grupos de especies son determinantes en la estructuración de las redes de interacción planta-frugívoro y han sido registradas estableciendo relaciones con una mayor cantidad de frugívoros que otras especies (Messeder et al., 2020; Messeder et al., 2022; Moermond & Denslow, 1985; Ramos-Robles et al., 2018; Snow, 1981). Este resultado puede estar determinado por los patrones fenológicos, que garantizan un recurso constante y confiable a lo largo del año (Blendinger et al., 2008; Kessler-Rios & Kattan, 2012), sumado a características de los frutos y los contenidos nutricionales (principalmente azúcares no estructurales) (Baker et al., 1998; Maruyama et al., 2019) que convierten a estas especies en recursos clave para la fauna que los consume (Messeder et al., 2021).
Sin embargo, para la localidad El Pino, otro tipo de plantas pertenecientes a los géneros Casearia (Salicaceae) y Trichilia (Meliaceae) presentan también altos valores de IIP. Estas especies producen recompensas abundantes, ricas en lípidos, con una o unas pocas semillas grandes y establecen relaciones con un pequeño número de frugívoros especializados (McKey 1975; Messeder et al., 2021). En las localidades evaluadas el consumo de estos frutos está relacionado con especies de aves tradicionalmente consideradas insectívoras de las familias Tyranidae (atrapamoscas) y Picidae (carpinteros), que en el bosque seco tropical pueden consumir una importante cantidad de frutos (Acevedo-Quintero et al., 2020; Rodríguez-Godínez et al., 2022). Para Guacamayas, otras especies de plantas como Doliocarpus dentatus y Vitex capitata que presentan frutos de tamaño medio (~ 1.0 cm diámetro), alto contenido de agua y semillas grandes (Peres, 2011) se destacan en sus valores del IIP por ser consumidas, entre otros, por especies de frugívoros grandes (p.e. Cyanocorax affinis, Psarocolius decumanus y Pteroglossus torquatus) con una importante participación como dispersores de semillas (Acevedo-Quintero et al., 2020).
La presencia de plantaciones dispersas de la especie exótica Acacia mangium (Fabaceae) en la localidad El Pino, actúa como un atrayente de una importante riqueza de frugívoros altamente generalistas (p.e. Thraupis episcopus, Melanerpes rubricapillus, Tyrannus melancholicus, Pitangus sulphuratus). Esta especie al ser un recurso abundante localmente y por sus características relacionadas con una cosecha abundante, frutos aceitosos y con un funículo carnoso atractivo para las aves, la convierte en un recurso importante para la fauna (Francis, 2002). Sin embargo, sus características ecológicas la pueden convertir en una especie potencialmente invasora, aunque es necesaria una mayor investigación al respecto en ambientes particulares (Aguiar Jr et al., 2014).
Con relación a los rasgos funcionales que determinan la importancia ecológica de las plantas nuestros resultados indican que no se encontró ninguna relación de la IIP con estrato donde se ofertan los frutos, lo que indica que los frugívoros no seleccionan algún estrato vertical específico para la obtención de los frutos de consumen. Sin embargo, las especies de plantas con frutos rojos, pulpa carnosa y pequeños tienden a presentar mayores valores del IIP. Este patrón indica que esta configuración de los rasgos atrae a frugívoros que se desempeñan como buenos dispersores de semillas. Sin embargo, se presentan diferencias entre las localidades en la respuesta del IIP frente a los rasgos evaluados. Este resultado puede estar fundamentado en la diferencia en la composición taxonómica de las especies de plantas que consecuentemente modifica la composición de los frugívoros visitantes.
De manera particular, las especies con frutos rojos presentan valores significativamente mayores de IIP en la localidad Guacamayas, lo cual podría estar relacionado con el contraste con el fondo del follaje. Este es un patrón común como lo señala Schaefer (2011), quien indica que entre el 26 y el 45 % de los frutos que utilizan los frugívoros como recurso alimenticio corresponden a colores contrastantes con el fondo en varias regiones del mundo. De igual forma, esta selección ha sido relacionada con la capacidad visual y tetracromática en el caso de las aves, las cuales les permite ubicar los frutos, incluso desde la distancia (Ordano et al., 2017; Schaefer, 2011; Stournaras et al., 2013; Voigt et al., 2004). También, la selección de este tipo de coloración garantiza el aumento en la calidad de la recompensa para los frugívoros, ya que la biosíntesis de las moléculas que determinan las coloraciones de rojos a naranjas (antocianinas y carotenos) está regulada por carbohidratos y lípidos (Camara & Brangeon, 1981; Solfanelli et al., 2006). Adicionalmente, las frutas con pulpas carnosas son importantes en la dieta de muchas aves, en particular en ecosistemas secos tropicales con una producción altamente variable y dependiente de las condiciones climáticas (de Oliveira et al., 2020). De esta manera, la covarianza entre los rasgos perceptibles (color) y los no perceptibles (valor nutricional) permite utilizar señales visuales como indicadores de mejores recompensas (Valido et al., 2011).
El tamaño del fruto se relacionó negativamente con el IIP en la localidad El Pino, lo que indica que los frugívoros prefieren consumir frutos pequeños. Teniendo en cuenta que existen restricciones de tipo morfológico que impiden ciertas interacciones (animales pequeños tienden a no consumir grandes frutos) (Wheelwright, 1985), la composición de la comunidad de frugívoros puede explicar en parte este patrón. Aunque los muestreos no se restringieron a un grupo taxonómico particular, la mayoría de los frugívoros registrados corresponde a aves del Orden Passeriformes (78.5 % de las especies) el cual se caracteriza por agrupar aves de un tamaño relativamente pequeño con roles funcionales importantes en la dispersión de semillas. Sin embargo, el grado de intervención antrópica histórica en la región puede, en cierta medida, explicar la ausencia de especies de mayor tamaño debido a procesos de defaunación que puede ser más pronunciada en esta localidad debido al aislamiento del fragmento de bosque evaluado. Aun así, la selección de alimentos por este grupo particular de frugívoros depende de los requerimientos dietéticos y factores como la habilidad del consumidor, el comportamiento de forrajeo, la distribución espacio-temporal de los frutos (Moran & Catterall 2010; Wheelwright, 1988).
En el caso particular de ecosistemas de bosque seco tropical, con períodos altamente contrastantes de sequía y humedad, impone restricciones constantes a las plantas sobre la producción cantidad/calidad de frutos. Por ejemplo, se sabe que fuertes restricciones hídricas no afectan drásticamente la producción de frutos, pero sí afecta el tamaño y con ello la cantidad/calidad de la pulpa de los frutos (Clark, 2012; Wien, 1997). En ese sentido, los rasgos de los frutos transmiten información sobre la calidad de la recompensa y el estado de madurez, además determinan cuáles interacciones son más probables de ocurrir en el ecosistema. Este ajuste, desde un punto de vista evolutivo, puede haber influenciado sobre la capacidad de los frugívoros de explotar un recurso fundamental, y desde el punto de vista de las plantas sobre atraer a los dispersores de semillas más efectivos. Esta relación se sustenta y permanece estable siempre y cuando el beneficio sea mutuo y actúe sobre rasgos involucrados en las tasas vitales de las especies (crecimiento, supervivencia y reproducción). Por lo tanto, la estimación del IIP está soportada en la interacción mutualista planta-frugívoro, a través de la relevancia directa de las plantas como recurso alimenticio (beneficio exclusivo sobre los animales) y la importancia de los animales como mejores dispersores de semillas (beneficio exclusivo sobre las plantas) del conjunto de frugívoros.
El IIP recoge la variabilidad del aporte de cada planta a los procesos ecológicos derivados de la frugivoría a nivel comunitario. Además, permite identificar las especies más relevantes y los atributos de los rasgos que determinan dicha importancia. Aunque en las localidades evaluadas en esta investigación el color, el tamaño y el tipo de pulpa explican parcialmente la importancia de las plantas, otros rasgos que cuantifiquen de manera directa el contenido nutricional y la disponibilidad de recurso (abundancia de las plantas con frutos y el tamaño de la cosecha) podrían mejorar la capacidad predictiva de los modelos (Blendinger et al., 2016). Sin embargo, la información generada puede ser útil en el desarrollo de programas de reforestación y restauración ecológica mucho más efectivos, ayudando en la selección de especies que tengan un mayor impacto en la recuperación funcional del bosque seco tropical que se encuentra en un estado crítico de amenaza en la región Neotropical.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio