Introducción
Las charcas temporales, son ecosistemas acuáticos variables en su tamaño, volumen, profundidad, propiedades fisicoquímicas, biodiversidad; origen geológico, influencia antropogénica y régimen climático (Bazzanti et al., 2010; Williams, 2006), lo que implica importantes variaciones en la fisicoquímica del cuerpo de agua. Son considerados de gran importancia por los múltiples bienes y servicios ecosistémicos que ofrecen, entre los que se destacan: ser sumideros de carbono, reguladores del clima local, áreas de recarga de acuíferos y hábitat de una gran variedad de comunidades biológicas. Los procesos de vaciado y llenado de estos ambientes acuáticos se encuentran asociados con los periodos de precipitaciones propios de cada región, y en Colombia, suelen ocurrir por lo menos una vez durante el año (Almonacid & Molinero, 2012; Serna-Macías et al., 2011; Serna-Macías et al., 2019; Wedler, 1998; Williams, 2006). Estos sistemas se destacan por proporcionar una variedad de microhábitats que permiten el establecimiento de una gran y particular diversidad de organismos cuyas estrategias de vida y reproducción están ligadas a las características y condiciones propias de dichos microhábitats presentes en cada una de las charcas temporales (Pires et al., 2021). Su importancia en los últimos años se ha incrementado, debido a que son considerados puntos calientes (Hotspots) de biodiversidad por que sirven de refugio a una gran variedad de comunidades biológicas (Céréghino et al., 2014; Chaves et al., 2008; De Meester et al., 2005).
Una de las comunidades bióticas más representativas en estos ecosistemas son los estadios juveniles (como huevo o larva) de macroinvertebrados acuáticos (Roldán-Pérez, 2016; Roldán, 2020; Williams, 2006), principalmente de insectos, gasterópos y crustáceos braquiópodos (Alonso, 1996; Ladrera, 2012; Tamaris-Turizo et al., 2020). Estos organismos son un componente fundamental en la dinámica trófica y flujo de la materia y la energía (Domínguez & Fernández, 2009), debido a que son fuente directa e indirecta de alimento para otras comunidades dentro y fuera del ecosistema. Además, han sido ampliamente usados como indicadores de calidad ecológica en sistemas lóticos (Roldán, 2003; Roldán-Pérez, 2016) y lénticos (Castellanos et al., 2017). Estos trabajos se han realizado ampliamente en el neotrópico, especialmente, en aspectos relacionados con su biología, ecología, taxonomía y potencialidades como modelos biológicos de perturbación del hábitat (Roldán-Pérez, 2016). No obstante, la mayoría de los estudios han sido realizados en ambientes lóticos, (García et al., 2009; Merritt et al., 2008; Roldán, 2003; Serna et al., 2015; Springer, 2008; Tamaris-Turizo et al., 2013) en menor escala en los ambientes lénticos (Domínguez & Fernández, 2009; Serna-Macías et al., 2019; Tamaris-Turizo et al., 2020) y en menor proporción los temporales (Abraham et al., 2021; Tamaris-Turizo et al., 2020).
Los estudios sobre charcas temporales se viene adelantando en desde hace algún tiempo en otras latitudes (Camacho et al., 2009; Latron et al., 2022; Prunier et al., 2011; Rodríguez et al., 2011; Sahuquillo & Miracle, 2011); sin embargo, en Colombia se destacan las investigaciones realizadas por Cohen et al. (2014) quienes registraron por primera vez para Colombia la especie Dendrocephalus affinis (Anostraca: Thamnocephalidae); por otro lado, Serna-Macías et al. (2019) estudiaron la biodiversidad de una charca estacional en la Guajira colombiana, encontrando representantes de siete órdenes y 28 géneros; Tamaris-Turizo et al. (2020) caracterizaron la diversidad biológica de cinco charcas temporales en la Guajira Colombiana; y Oliveros-Villanueva et al. (2021a), Oliveros-Villanueva et al. (2021b) registraron por primera vez para Colombia del ''camarón hada'' Thamnocephalus venezuelensis (Anostraca: Thamnocephalidae) y del ''camarón almeja'' Leptestheria venezuelica (Crustacea: Brachiopoda: Spinicaudata). Investigaciones relacionadas con el estudio zooplancton en ambientes temporales fueron publicadas por Fuentes-Reinés et al. (2019) y Fuentes Reines et al. (2021), quienes reportaron dieciocho especies de cladóceros en una charca temporal poco profunda en la Guajira colombiana y registró por primera vez para Colombia la presencia del copépodo planctónico de agua dulce Notodiaptomus maracaibensis.
Lo anterior, deja en evidencia el vacío de información que existe sobre la dinámica que pueden presentar las comunidades de macroinvertebrados acuáticos a nivel espacial (local y regional) y temporal (épocas climáticas) en charcas estacionales del norte de Colombia, además del poco entendimiento de la relación entre las variables ambientales de las charcas y sus comunidades biológicas. Por ello, este trabajo tuvo como propósito evaluar la diversidad alfa (composición) y beta (composición entre charcas y entre microhábitats) de las comunidades de macroinvertebrados acuáticos asociadas a seis charcas temporales del departamento del Magdalena durante las épocas de sequía y lluvias. Debido a que estos ecosistemas se encuentran estrechamente ligados a los periodos hidrológicos y considerando su particularidad en la generación de microhábitats, se esperaría que las comunidades biológicas presenten alta riqueza en los periodos de estiaje y en los microhábitats más heterogéneos (i.e. macrófitas). Asimismo, teniendo en cuenta las distancias considerables entre las charcas analizadas (escala regional), se esperaría que la composición de sus comunidades difiera.
Materiales y métodos
Área de estudio: El estudio se desarrolló en seis charcas temporales ubicadas en el departamento del Magdalena, Colombia (Fig. 1, Tabla 1), el clima de esta región es seco con una temperatura media de 29 °C, la vegetación está dominada por la presencia de pastizales; no obstante, en los alrededores de las charcas se encuentran algunos árboles como la Ceiba - Ceiba pentadra (L), el camajón - Sterculia apelata (Jacq.) Karst y el samán - Samanea saman (jacq.) Merr. entre otros.
Tabla 1 Ubicación de las charcas estacionales del departamento del Magdalena, Colombia. / Table 1. Temporary ponds location in the department of Magdalena, Colombia.
| Estación | Sitio | Municipio | Coordenadas geográficas | ||
| Latitud | Longitud | ||||
| 1 | Villa Leidy (C1) | Pivijay | 10°30'30.56'' N | 74°29'43.04'' W | |
| 2 | Los Trillizos (C2) | Pivijay | 10°27'52.15'' N | 74°25'52.63'' W | |
| 3 | El Paraíso (C3) | Pivijay | 10°27'10.93'' N | 74°23'33.16'' W | |
| 4 | El Miquito (C4) | Nueva Granada | 9°49'3.22'' N | 74°25'52.82'' W | |
| 5 | Los Campanos (C5) | Nueva Granada | 9°47'11.51'' N | 74°19'20.96'' W | |
| 6 | La Dicha (C6) | Ariguaní | 9°54'6.36'' N | 74°7'30.90'' W | |
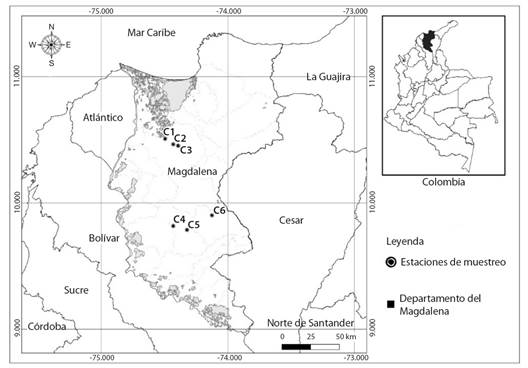
Fig. 1 Ubicación de las charcas temporales evaluadas, C1: Villa Leidy, C2: Los Trillizos C3: El Paraíso, C4: El Miquito, C5: Los Campanos y C6: La Dicha. / Fig. 1. Location of the temporary ponds evaluated, C1: Villa Leidy, C2: Los Trillizos, C3: El Paraíso, C4: El Miquito, C5: Los Campanos and C6: La Dicha.
De acuerdo con el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM, 2021), de1972 a 2021, el régimen de precipitación es de carácter monomodal biestacional, con picos de lluvias en mayo y octubre, seguido de un periodo de sequía desde diciembre hasta marzo. La precipitación promedio multianual es de 1 446 mm (Fig. 2).
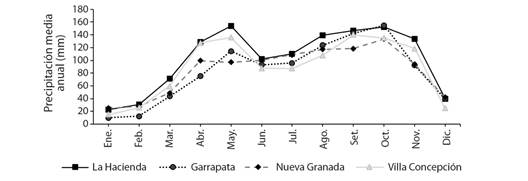
Fig. 2 Precipitación promedio de cuatro estaciones pluviométricas ubicadas cerca de las charcas temporales evaluadas (1972-2021). Fuente: IDEAM (2021). / Fig. 2. Average precipitation of four pluviometric stations located near the temporary ponds evaluated (1972-2021). Source: IDEAM (2021).
Variables ambientales: En cada charca se realizaron dos muestreos, el primero durante el mes de noviembre del 2020, correspondiente a la época de altas precipitaciones y el segundo en el mes de febrero del 2021, correspondiente a la época de bajas precipitaciones. Durante las salidas de campo se midieron in situ las siguientes variables ambientales: temperatura del agua (°C), pH, sólidos suspendidos totales (mg/l), conductividad (µS/cm), oxígeno disuelto (mg/l) y saturación del oxígeno (%), con un multiparámetro HANNA HI9829. Además, se tomaron muestras del centro de la columna de agua y se depositaron en botellas de poliuretano de 600 ml, las cuales se mantuvieron refrigeradas hasta su traslado al laboratorio para la determinación de turbidez (UFN: Unidad de Formacina Nefelométrica), fosfatos (PO4-P mg/l), amonio (NH4 mg/l), nitritos (NO2 mg/l) y dureza total (mg/l) de agua, empleando un kit de colorimetría Spectroquant Move 100 de Merck.
Recolecta e identificación de macroinvertebrados acuáticos: En cada campaña se tomaron muestras en los microhábitats presentes en las charcas: zona litoral, comprendida entre la franja límite superior del espejo de agua y el inicio de la vegetación; zona lacustre, definida como área que comprende la columna de agua y sedimento (bentos), localizada en el fondo del cuerpo de agua (Roldán & Ramírez, 2008). En la zona litoral, se hicieron seis arrastres aleatorios en el sector de la ribera que presentaba mayor vegetación, empleando una red de mano con ojo de malla de 500 µm. En la zona lacustre se hicieron seis arrastres en zig zag durante 20 minutos en la columna de agua, utilizando una red tipo D de 30 × 40 cm y ojo de malla de 500 µm. Finalmente, para la toma de muestras de la macrofauna asociada al sedimento se utilizó una draga tipo Ekman (266 cm2) realizando tres lances aleatorios. El material recolectado en cada microhábitat se depositó en bolsas plásticas de alta densidad, debidamente rotuladas. Las muestras se preservaron con etanol al 95 %.
Los organismos se identificaron hasta género con la ayuda de un estereomicroscopio ZEISS stemi-3050 y empleando las claves y guías taxonómicas de Domínguez & Fernández (2009), Laython (2017), Merritt et al. (2008), Roldán (2003) y Springer (2008).
Análisis de datos: La diversidad alfa de macroinvertebrados acuáticos se comparó por medio de la diversidad de orden q (qD) (Jost, 2006, Jost, 2010), la cual se basa en el número efectivo de especies. Se usaron tres valores: q= 0 (riqueza de especies, 0D), q= 1 (exponencial del índice de Shannon, 1D) y q= 2 (recíproco del índice de Simpson, 2D) (Moreno et al., 2011). La estimación y comparación de qD se basa en la comparación de la diversidad bajo el mismo nivel de cobertura de muestreo entre comunidades (Chao et al., 2014). A pesar de que la conversión del número efectivo está diseñada para especies, también se ha empleado a nivel de géneros (Barragán et al., 2016; Oliveros-Villanueva et al., 2020), con el fin de hacer una interpretación más adecuada de los datos de abundancia, respondiendo al concepto de diversidad a partir de la conversión de los índices de diversidad a número efectivo de especies (géneros en este caso). Para evaluar el recambio de taxones (diversidad beta) entre las charcas en cada época climática, se usaron los estimadores propuestos por Baselga et al., (2022), los cuales consisten en la división de la diversidad beta en sus componentes (bsor= bsim + bsne), donde bsor: es la diversidad beta (disimilitud de Sorensen); bsim: diversidad beta de Simpson (disimilitud debida a reemplazo); bnes: diversidad beta resultante (disimilitud debida a anidamiento), lo que permite una mejor comprensión de posibles causas de diferencias entre sitios (Moreno et al., 2011). Para conocer la similitud de la composición de los taxones (basados en incidencia) entre charcas en cada época como también entre microhábitats, se realizó un análisis de conglomerados, construido mediante el coeficiente de disimilitud de Sørensen y método de aglomeración UPGMA. Para probar la existencia de diferencias significativas en la composición de los organismos entre las charcas y las épocas climáticas se realizó un ANOVA multivariado no paramétrico (PERMANOVA) con 999 permutaciones, aplicando también el coeficiente de similitud de Sørensen, previa verificación de la normalidad multivariante, usando como nivel de significancia del 95 %. Para conocer cómo los taxones de macroinvertebrados se asociaron con las épocas climáticas se realizó un análisis de escalamiento multidimensional no métrico (nMDS) basado en la incidencia de los organismos, para lo cual se aplicó el coeficiente de similitud de Sørensen. El recambio se realizó usando el paquete betapart 1.5.6 (Baselga et al., 2022) y los análisis de conglomerados y PERMANOVA con el paquete vegan 2.5-7 (Oksanen et al., 2020) y ejecutados en el programa R versión 4.1.3 (R Core Team, 2022).
Resultados
Variables ambientales: El pH fue modernamente ácido en todas las charcas, con excepción de La Dicha en la época seca (7.15). La temperatura del agua osciló entre 27.1 y 33.6 ºC. El oxígeno disuelto (OD) y el porcentaje de saturación (% sat.) presentaron valores muy bajos durante las dos épocas (menores a 3mg/l y 40 % respectivamente). La conductividad (promedio: 2 208 µS/cm) y los sólidos totales (1 104 mg/l) tuvieron valores máximos en Villa Leidy durante la época seca, mientras que el valor mínimo de conductividad (3.9 µS/cm) correspondió a La Dicha en la misma época y el valor más bajo de solidos totales disueltos (42 mg/l) en El Miquito durante la época lluviosa. La turbidez osciló entre 6 y 103 UFN, siendo la más baja en el Miquito durante la misma época y la más alta en La Dicha durante la seca. La concentración total de fosfatos osciló entre 30 y 410 µg/l, siendo la concentración más baja en las charcas Villa Leidy y los Trillizos y la más alta en Los Campanos durante la época lluviosa. Las concentraciones más bajas de nitrato se presentaron en El Miquito y Los Trillizos y las más altas (4.40 mg/l) en Villa Leidy durante las lluvias (Tabla 2).
Tabla 2 Valor de los parámetros fisicoquímicos de seis charcas temporales del departamento del Magdalena (Colombia), medidos en las épocas de lluvia y sequía. / Table 2. Physicochemical parameter values of six temporary ponds in the department of Magdalena (Colombia) measured during rainy and dry seasons.
| Época climática | Estación | pH | Temp (°C) | O2 (mg/l) | O2 (%) | Conductividad (µS/cm) | Sólidos totales disueltos (mg/l) | Turbidéz (UFN) | NH4 (mg/l) | PO4-P (µg/l) | NO2 (mg/l) | Dureza total (mg/l) |
| Lluvias | Villa Leidy | 5.81 | 33.6 | 2.5 | 35.5 | 683.0 | 342.0 | 25.60 | 0.01 | 30.0 | 4.40 | 18,0 |
| Los Trillizos | 6.40 | 30.7 | 0.9 | 11.3 | 87.0 | 43.0 | 18.60 | 0.02 | 30.0 | 0.00 | 4,0 | |
| El Paraíso | 6.30 | 28.8 | 0.6 | 8.4 | 95.0 | 44.0 | 25.50 | 0.02 | 350.0 | 0.50 | 28,0 | |
| El Miquito | 6.65 | 28.7 | 1.6 | 21.0 | 92.0 | 42.0 | 6.00 | 0.01 | 30.0 | 0.00 | 3,0 | |
| Los Campanos | 6.80 | 28.0 | 2.2 | 28.4 | 124.0 | 62.0 | 9.40 | 0.02 | 410.0 | 1.80 | 4,0 | |
| La Dicha | 6.61 | 27.1 | 0.7 | 9.1 | 208.0 | 104.0 | 29.70 | 0.02 | 150.0 | 1.80 | 4,0 | |
| Seca | Villa Leidy | 6.03 | 27.7 | 0.5 | 5.1 | 2208.0 | 1104.0 | 99.90 | 0.03 | 70.0 | 3.10 | 92,0 |
| Los Trillizos | 6.34 | 29.1 | 1.9 | 22.7 | 157.0 | 72.0 | 35.80 | 0.23 | 30.0 | 1.60 | 73,0 | |
| El Paraíso | 6.93 | 31.8 | 2.8 | 36.7 | 210.0 | 105.0 | 6.10 | 0.26 | 10.0 | 0.80 | 3,0 | |
| El Miquito | 6.41 | 27.1 | 1.2 | 19.0 | 110.0 | 55.0 | 90.10 | 0.11 | 20.0 | 1.30 | 4,0 | |
| La Dicha | 7.15 | 28.4 | 1.8 | 1.2 | 3.9 | 193.0 | 103.00 | 0.31 | 130.0 | 2.30 | 4,0 | |
| Valor máximo época de lluvias | 6.80 | 33.6 | 2.5 | 35.5 | 683.0 | 342.0 | 29.70 | 0.02 | 410.0 | 4.40 | 28,0 | |
| Valor mínimo época de lluvias | 5.81 | 27.1 | 0.6 | 8.4 | 87.0 | 42.0 | 6.00 | 0.01 | 30.0 | 0.00 | 3,0 | |
| Valor máximo época seca | 7.15 | 31.8 | 2.8 | 36.7 | 2208.0 | 1104.0 | 103.00 | 0.31 | 130.0 | 3.10 | 92,0 | |
| Valor mínimo época seca | 6.03 | 27.1 | 0.5 | 1.2 | 3.9 | 55.0 | 6.10 | 0.03 | 10.0 | 0.80 | 3,0 | |
Se recolectó un total de 3 358 individuos, 1 778 en la época seca y 1 580 en la época lluviosa (AT1, AF1), agrupados en 13 órdenes, 39 familias y 68 géneros. Durante la época de lluvias, en Los Campanos (C5) se presentó la mayor abundancia y riqueza (N= 485, 0D= 32), mientras que el humedal con menor número de taxones fue Los Trillizos (C2) (N= 142, 0D= 22). El Miquito (C4) presentó el mayor número de taxones comunes y dominantes, en contraste a Los Campanos (C5) (1D= 11.6, 2D= 6.1) (Tabla 3).
Durante la época de sequía, Los Trillizos (C2) obtuvo la mayor abundancia y riqueza (N= 533, 0D= 43); mientras que la menos abundante y rica fue El Miquito (C4) (N= 209, 0D= 28). En Los Trillizos (C2) se observó la mayor abundancia de taxones comunes (1D= 21.7). En Villa Leidy (C1) y El Miquito (C4) presentaron la mayoría de los taxones dominantes (2D= 16). Contrario a esto, La Dicha (C6) obtuvo el menor número de taxones comunes (1D= 11) y dominantes en ambas épocas climáticas (Tabla 3).
Tabla 3 Abundancia y número efectivo de taxones de seis charcas temporales del Magdalena (Colombia), durante la época seca y lluviosa. / Table 3. Abundance and effective number of taxa of six temporary ponds of the Magdalena (Colombia), during rainy and dry seasons. Magdalena (Colombia).
| Humedal | N | 0D | 1D | 2D | |||||
| Ll | S | Ll | S | Ll | S | Ll | S | ||
| C1 | 293 | 264 | 31 | 29 | 18.7 | 20.6 | 14.1 | 16.1 | |
| C2 | 142 | 533 | 22 | 43 | 12.8 | 21.7 | 9.14 | 11.2 | |
| C3 | 302 | 413 | 23 | 33 | 11.9 | 17.1 | 7.7 | 10.6 | |
| C4 | 193 | 209 | 30 | 28 | 20.3 | 20.3 | 16.4 | 16.1 | |
| C5 | 485 | ND | 32 | ND | 11.6 | ND | 6.2 | ND | |
| C6 | 165 | 359 | 23 | 28 | 11.7 | 11.1 | 6.8 | 5.9 | |
C1: Villa Leidy, C2: Los Trillizos, C3: El Paraíso, C4: El Miquito, C5: Los Campanos y C6: La Dicha. S: época seca, Ll: época lluviosa, ND: no determinado porque la charca no tenía agua, N: abundancia, 0D: riqueza, 1D: taxones comunes, 2D: taxones dominantes. / C1: Villa Leidy, C2: Los Trillizos C3: El Paraíso, C4: El Miquito, C5: Los Campanos and C6: La Dicha. S: Season Dry, Ll: Season Rainy. ND: Not determined because the pond haven't water. N: abundance, 0D: richness, 1D: common taxa, 2D: dominant taxa.
Durante la época de lluvias, la diversidad beta presentó su mayor valor entre las charcas Los Trillizos (C2) y Los Campanos (C5) (bsor= 0.52) y el más bajo entre C5 y La Dicha (C6) (bsor= 0.27). Para la época seca se estimó el mayor valor de la diversidad beta entre C2 y El Miquito (C4) (bsor= 0.30) y el más bajo entre C2 y El Paraíso (C3) (bsor= 0.18). Pero el mayor valor de recambio en época de lluvia se dio entre C2 y C6 (bsim= 0.45) y el menor entre C5 y C6 (bsim= 0.13). Mientras que en la época seca fue entre C4 y C6 (bsim= 0.29) y la mayor pérdida de taxones durante la época de lluvia ocurrió entre C5 y C6 (bnes= 0.14) y durante la época seca fue entre C2 y C6 (bnes= 0.20) (Tabla 4; Fig. 3). El análisis de conglomerado realizado en cada época climática mostró que la composición de los macroinvertebrados acuáticos durante la época seca fue muy diferente entre las charcas, siendo Los Trillizos (C2) y El Paraíso (C3) las charcas que conformaron un grupo mayor disimilitud (18 %), seguido de Villa Leidy (C1), mientras que C2 y El Miquito (C4) fueron las menos disímiles. La composición durante la época de lluvias fue muy también difirió al compararla con los grupos conformados en la época seca y entre charcas. En esta época, se observó un grupo conformado por La Dicha (C6), Los Campanos (C5) y El Paraíso (C3) con cerca del 35 % de disimilitud; en este análisis Los Trillizos (C2) se separó de las demás charcas (Fig. 3).
Tabla 4 Recambio de géneros estimados con el índice de diversidad beta de Sorensen para las charcas estacionales durante las épocas lluviosa y seca. / Table 4. Turnover estimated with the Sorensen index in the ponds temporary for rainy and dry season.
| Época | C1 | C2 | C3 | C4 | C5 | C6 | |
| Lluvias | C1 | 0 | 0.43 | 0.41 | 0.38 | 0.37 | 0.37 |
| C2 | 0 | 0.42 | 0.50 | 0.52 | 0.47 | ||
| C3 | 0 | 0.43 | 0.45 | 0.30 | |||
| C4 | 0 | 0.45 | 0.40 | ||||
| C5 | 0 | 0.27 | |||||
| C6 | 0 | ||||||
| C1 | C2 | C3 | C4 | C5 | C6 | ||
| Seca | C1 | 0 | 0.19 | 0.26 | 0.26 | - | 0.23 |
| C2 | 0 | 0.18 | 0.30 | - | 0.24 | ||
| C3 | 0 | 0.25 | - | 0.25 | |||
| C4 | 0 | - | 0.29 | ||||
| C5 | - | - | - | - | - | - | |
| C6 | 0 |
C1: Villa Leidy, C2: Los Trillizos C3: El Paraíso, C4: El Miquito, C5: Los Campanos y C6: La Dicha. / C1: Villa Leidy, C2: Los Trillizos, C3: El Paraíso, C4: El Miquito, C5: Los Campanos and C6: La Dicha.
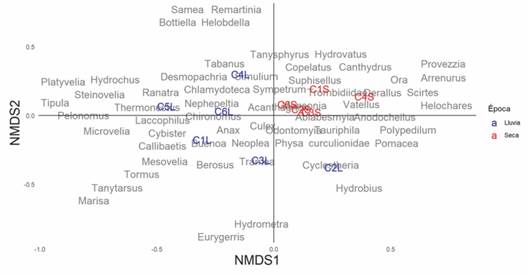
Fig. 3 Análisis de escalamiento multidimensional no métrico (nMDS) realizado con la presencia y ausencia de los macroinvertebrados de las charcas en las temporadas de lluvias (L) y seca (S). C1: Villa Leidy, C2: Los Trillizos C3: El Paraíso, C4: El Miquito, C5: Los Campanos y C6: La Dicha. Stress: 0.14. / Fig. 3. No metric multidimentional scaling (nMDS) based on incidence data of aquatic macroinvertebrates of ponds in rainy (L) and dry (S) season. C1: Villa Leidy, C2: Los Trillizos C3: El Paraíso, C4: El Miquito, C5: Los Campanos and C6: La Dicha. Stress: 0.14.
El análisis de agrupamiento en el microhábitat litoral evidenció una composición similar en las dos épocas climáticas, donde Villa Leidy (C1), Los Trillizos (C2), El Paraíso (C3) y La Dicha (C6) conformaron un grupo, mientras que El Miquito (C4) y Los Campanos (C5) conformaron otro en el periodo de lluvias. El arreglo fue similar durante la sequía con la excepción de que no se presentaron datos en Los Campanos por no estar seca. Durante ambas épocas los grupos difirieron cerca del 60 % de la composición de las comunidades. En cuento a los microhábitats lacustre y sedimento, no se evidenció una clara agrupación al compararlas por épocas climáticas (AF1). La zona litoral presentó la mayor riqueza y abundancia, con excepción de C1, C5 y C6 en lluvias y C4 en seca, donde las mayores abundancias se observaron en la zona lacustre (AT2).
La prueba PERMANOVA mostró que existen diferencias significativas en la composición de los macroinvertebrados acuáticos entre épocas climáticas, pero no entre charcas (Tabla 5, Fig. 3). Lo cual se puede confirmar visualmente en el nMDS, donde se exhiben los taxones que ponderaron a dichas diferencias, es así como los coleópteros Ora, Derallus, Helochares, Hydrovatus, Canthidrus y Scirtes, el ostrácodo Arrenurus y el díptero Provezzia solo estuvieron presente durante la época seca; mientras que en la época lluviosa los coleópteros Pelomnus, Cybester, Thermonectus e Hydrochus, el efemeróptero Callibetis y el hirudíneo Helopdella fueron algunos de los taxones característicos durante las lluvias (Fig. 3 y Fig. 4).
Tabla 5 Análisis multivariado permutacional de la varianza (PERMANOVA) basado en los macroinvertebrados acuáticos según la charca y época climática. / Table 5. Multivariate permutational multivariate analysis of variance (PERMANOVA) based on aquatic macroinvertebrates according to ponds and climatic period.
| Fuente | gl | Suma cuadrados | R2 | F | Pr (>F) 0.05 |
| Época | 1 | 0.416 | 0.262 | 3.746 | 0.002 * |
| Charca | 5 | 0.727 | 0.458 | 1.309 | 0.115 |
| Residual | 4 | 0.444 | 0.279 | ||
| Total | 10 | 1.588 | 1 |
gl= grados de libertad. * indica diferencias significativas (valores de p < 0.05). / gl= degree freedom. * Indicate significative differences (p value < 0.05).
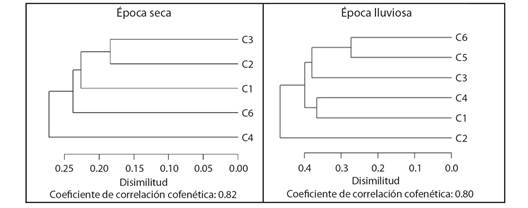
Fig. 4 Análisis de similitud Sorensen (cualitativo) de las charcas durante la época y seca y lluvias, C1: Villa Leidy, C2: Los Trillizos, C3: El Paraíso, C4: El Miquito, C5: Los Campanos y C6: La Dicha. / Fig. 4. Sorensen similarity analysis (qualitative) of temporary ponds in dry and rainy periods. C1: Villa Leidy, C2: Los Trillizos, C3: El Paraíso, C4: El Miquito, C5: Los Campanos and C6: La Dicha.
Discusión
Los resultados evidenciaron que existe un alto recambio y bajo anidamiento de la composición de las comunidades de macroinvertebrados acuáticos al compararlas entre las seis charcas. Sin embargo, la composición de las comunidades difirió entre las dos épocas climáticas, lo cual se evidenció en la presencia de algunos taxones exclusivos en cada periodo. Con relación a los microhábitats, se evidenció que solo el litoral exhibió un importante agrupamiento consistente entre charcas.
Los valores de las variables fisicoquímicas presentaron un comportamiento típico de ecosistemas mesotróficos temporales tropicales (Díaz et al., 2007), cuyas variaciones responden al régimen hidrológico, la geología y a los efectos del lavado de los suelos por acción de actividades agropecuarias y antropogénicas, los cuales se ven reflejados en el incremento de los nutrientes durante el periodo de precipitaciones por la resuspención producida por las lluvias y la escorrentía (López-Lambraño et al., 2017; Serna-Macías et al., 2019). A pesar de que las charcas temporales estudiadas se encuentran en una región con un régimen de precipitaciones monomodal biestacional (IDEAM, 2021), difiere de otras zonas del país (como en el departamento de La Guajira), donde los periodos de sequía son más extensos, lo que expone a estos ecosistemas a un prolongado periodo de precipitaciones, variable que puede influir en los ciclos de vida de los organismos que la habiten; consecuentemente, la variabilidad en las épocas climáticas pueden influir sobre la composición de las comunidades locales de macroinvertebrados acuáticos.
Las diferencias en la composición de las comunidades entre épocas climáticas están relacionadas con las estrategias de vida de los organismos. En este sentido, se observó que los representantes de la familia Scirtidae (Coleoptera) y el género Callibaetis (Ephemeroptera) solo se presentaron durante la época seca y que el odonato Remartinia y el díptero Tipula durante la época de lluvias, puede deberse a que los sirtidos pueden encontrarse en ambientes semiacuáticos, mientras que los odonatos y tipúlidos son organismos netamente acuáticos; en cuanto Callibaetis tienen una estrategia de maduración de los huevos interna y eclosionan recién son depositados en el agua, por ellos pueden ser encontrados en ambas épocas climáticas (Johnson et al., 2012). No obstante, análisis de los rasgos funcionales y otros aspectos de las historias de vida que involucren aspectos morfológicos y/o fisiológicas de los organismos podrían contribuir a esta justificación. Trabajos realizados en charcas temporales mediterráneas (Bazzanti et al., 2009, Bazzanti et al., 2010; Della Bella et al., 2005) y de Argentina (Abraham et al., 2021) han evidenciado que durante los hidroperíodos más largos, un mayor número de especies son capaces de completar su desarrollo y mantener poblaciones viables, especialmente aquellas que presentan dispersión activa, ya que la permanencia del agua proporciona mayor tiempo disponible para la colonización (Fontanarrosa et al., 2013), lo que deja en evidencia que la duración de la lámina de agua durante el periodo anual puede considerarse como el factor más importante que incrementa la riqueza de especies en estos sistemas. La clase Insecta fue la dominante en todas las charcas analizadas, dentro de este grupo los órdenes más abundantes y diversos fueron Coleoptera, Hemiptera, Diptera, Odonata y Ephemeroptera, similar a lo registrado en otros ecosistemas temporales del norte de Colombia por Serna-Macías et al., (2019), por García (1997) en Venezuela, por Boutin et al. (1982) y Sancho & Lacomba (2012) en España y por Abraham et al. (2021) en Argentina.
La marcada disociación que muestran las épocas de muestreo en el análisis de agrupamiento puede estar relacionada con uno de los factores más importantes como lo es la presencia y mayor disponibilidad de sustratos producto de la época de lluvias, en comparación con la sequía, lo cual impacta en la composición y estructura de la comunidad de macroinvertebrados tal como lo menciona Fontanarrosa et al. (2013). Sin embargo, se requieren de estudios experimentales para confirmar este postulado.
El recambio de taxones entre humedales en la época húmeda en contraste con la época seca demuestra que las actividades de migración y/o dispersión son más activas en la época de alta precipitación, una de las causas ambientales que más afectan a este recambio es la aparición de arroyos efímeros e intermitentes que se interconectan con los sistemas lénticos (como las charcas), lo cual favorece las migraciones pasivas de organismos acuáticos (Vellend, 2001) o que provienen de sistemas lóticos. Evidencia de esto, es la aparición de Simulium (Diptera), organismo que habita exclusivamente de sistemas lóticos y que seguramente fue arrastrado por escorrentía superficial a la charca Los Trillizos durante la época de lluvias.
Las diferencias en la composición y abundancia de macroinvertebrados encontradas en los microhábitats, deja en evidencia la preferencia que tienen muchos organismos por las macrófitas, resultados similares se han observado en otros sistemas lénticos temporales (Abraham et al., 2021) y permanentes (Hernández et al., 2016; Rivera-Usme et al., 2008; Rivera et al, 2015), por ejemplo: los órdenes Coleoptera, Odonata y algunos Hemiptera suelen encontrarse en mayor medida en el litoral; Los Hemiptera y Heteroptera que son organismos depredadores estrechamente relacionados con las macrófitas que les proveen refugio y alimento (Jara et al., 2013); larvas de Diptera que suelen alimentarse de la materia en descomposición que se encuentra en el sedimento o bien algunos moluscos gasterópodos que se encuentran en mayor medida en el mismo sustrato o asociados estructuras sumergidas de las macrófitas. Lo anterior, evidencia lo propuesto por Solimini et al. (2005) y Bazzanti et al. (2010), que algunos sustratos tal como los ambientes vegetados incrementan la heterogeneidad del hábitat influyendo en el aumento de la composición de los grupos biológicos de macroinvertebrados.
La composición de las comunidades de macroinvertebrados acuáticos de las charcas temporales son muy diversas y presentan alto recambio tanto espacial como temporal, reflejando altos valores de reemplazamiento de taxones entre épocas climáticas. El análisis de los microhábitats mostró que el litoral mantuvo una composición similar durante las dos épocas.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


