Introducción
Theobroma cacao L. es una planta ampliamente cultivada y distribuida en las zonas tropicales del mundo. Actualmente se encuentra en la familia Malvaceae (Bayer et al., 1999; Bayer & Kubitzki, 2003; Bhattacharjee, 2018; Richardson et al., 2015) y circunscrita a la subfamilia Byttnerioidea (Bayer et al., 1999; Bayer & Kubitzki, 2003). T. cacao es un cultivo tropical de importancia económica dado que los cotiledones de sus semillas son la materia prima para la industria de chocolates, la producción de manteca y cacao en polvo; las cuales son industrias multimillonarias que consumen el grueso de la producción mundial (Squicciarini & Swinnen, 2016; Wickramasuriya & Dunwell, 2018).
A pesar de la importancia económica de T. cacao, son escasos los trabajos relacionados con la comprensión de su biología reproductiva; algunos de estos tienen en cuenta el desarrollo y la morfología floral, viabilidad del polen, polinizadores y mecanismos de compatibilidad (Bayer & Kubitzki, 2003; Bridgemohan et al., 2017; de Jesus-Branco, et al., 2018; Ford & Wilkinson, 2012; Lanaud et al., 2017; López et al., 2018; Narayanapur et al., 2018; N'Zi, et al., 2017; Rangel et al., 2012; Rincón-Barón et al., 2021a; Swanson et al., 2008). Si bien es cierto que se han hecho esfuerzos en la descripción de la microsporogénesis en algunas Malvaceae (Galati & Rosenfeldt, 1998; Lattar et al., 2012; Lattar et al., 2014; Rincón-Barón et al., 2021a; Tang et al., 2006; Tang et al., 2009) en T. cacao es poco lo que se conoce y la mayoría de los estudios solo documentan brevemente algunos aspectos de este proceso, por lo cual los eventos que marcan la formación de los granos de polen en esta especie permanecen aún sin resolver (Rincón-Barón et al., 2021b; Sivachandran et al., 2017). Es importante indicar que conocer y entender los procesos de microsporogénesis en plantas ayudan en la comprensión de los procesos evolutivos y relaciones filogenéticas de este grupo de organismos (Furness et al., 2002; Nadot et al., 2008). Así mismo, es importante conocer a cabalidad la biología reproductiva de plantas como T. cacao dada su importancia económica que la ha llevado a convertirse en el sustento económico de muchas familias en las regiones tropicales (Abbott et al., 2018; Antolinez et al., 2020; Beg et al., 2017; Osorio et al., 2017; Sánchez et al., 2019; Squicciarini & Swinnen, 2016; Wickramasuriya & Dunwell, 2018). Atendiendo a estas razones, en este trabajo de investigación se realiza una descripción pormenorizada de los mecanismos ontogenéticos de la formación de los granos de polen de T. cacao, haciendo énfasis en la arquitectura y morfología de las células arquesporiales, células madre de las microsporas, formación y estructura de la pared de las anteras, descripción del patrón de microsporogénesis, formación de la esporodermis, estructura y función del tapete, micromorfología y ultraestructura de los granos de polen.
Materiales y métodos
Se tomaron más de 30 flores por cada etapa del desarrollo floral empleando el genotipo CCN 51 (Colección Castro-Naranjal) por ser ampliamente cultivado. Las muestras fueron obtenidas del banco de germoplasma ex situ del Centro de Investigaciones La Suiza de la Corporación Colombiana de Investigación Agropecuaria (Agrosavia) ubicado en el Municipio de Rionegro, Santander-Colombia a 540 m de altitud (7°22'12'' N & 73°11'39'' W) durante los meses de junio-julio del 2021. Las flores se fijaron en una mezcla de formol, etanol y ácido acético (FAA) por 24-48 horas a 6 °C. Posteriormente, se deshidrataron en una serie gradual de etanol y dos pasos de aclaramiento en Xilol (Ruzin, 1999) y se incluyeron en Paraplast plus (McCormick®) durante 12 horas a 55 °C. Se obtuvieron secciones transversales y longitudinales con micrótomo rotatorio LEICA RM® 2125, entre 4-5 µm de grosor. Se procedió a la tinción de las muestras con Safranina-azul de Alcian para distinguir estructuras con paredes primarias y secundarias y de manera no específica presencia de polifenoles totales. Adicionalmente, muestras de las flores con anteras maduras también fueron teñidas con la técnica de PAS (ácido peryódico de Schiff-Amidoblack) para discriminar entre polisacáridos estructurales y de reserva, además de la presencia de proteínas. Se utilizó Lacmoid para teñir calosa y determinar el patrón de microsporogénesis. Para todas las tinciones se procedió de acuerdo a literatura especializada (Demarco, 2017; Ramming et al., 1973; Rincón-Barón et al., 2020; Rincón-Barón et al., 2021a; Ruzin, 1999; Soukup, 2014). Muestras adicionales en los diferentes momentos del desarrollo floral fueron fijadas en Glutaraldehído al 2.5 % en buffer fosfato 0.2 M pH 7.2 durante 24-48 horas a 6 °C. Luego de la fijación, las muestras se lavaron en el mismo buffer seguido de agua destilada para posteriormente postfijarlas con Tetróxido de Osmio al 2 % por 2 horas a 6 °C en oscuridad y agitación constante. Finalmente, las muestras se deshidrataron durante una hora en una serie gradual de etanol y durante 12 horas etanol al 100 %. Las muestras se embebieron en mezclas progresivas de óxido de propileno-resina Spurr, por una semana a temperatura ambiente. Se hicieron varios cambios de resina pura durante seis días en agitación constante. La resina fue polimerizada a 60 °C por 48 horas. Se obtuvieron secciones de 0.5-0.7 µm de grosor con cuchillas de vidrio en un Ultramicrótomo Leica Ultracut UCT®; las cuales se tiñeron con azul de Toluidina (TBO) en bórax al 1 %, pH 3.6 por 30-60 segundos que además de permitir la descripción entre tejidos de pared primaria y secundaria, permite diferenciar esporopolenina y de manera no especifica polifenoles totales (Rincón-Barón et al., 2020; Rincón-Barón et al., 2021a). Tanto las secciones en parafina como las de resina se examinaron con un microscopio fotónico Nikon eclipse Ni equipado con el sistema de contraste diferencial de interferencia (CDI). Muestras de las anteras maduras procesadas en parafina y teñidas con Safranina Azul de Alcian fueron examinadas empleando el filtro de triple banda de excitación DAPI-FITC-Texas, el cual incorpora un filtro de excitación con ventanas de paso de banda angostas en las regiones espectrales violeta (395-410 nm), azul (490-505 nm) y verde (560-580 nm). Las fotografías se obtuvieron con cámara digital Nikon DS-Fi1® utilizando el programa NIS Elements versión 4.30.02 de Nikon.
Así mismo y aplicando el procesamiento descrito anteriormente se hicieron secciones ultrafinas de 70 a 90 nm de grosor con cuchilla de diamante para microscopía electrónica de transmisión (MET) con el fin de detallar la pared de los granos de polen maduros. Estas secciones se contrastaron con acetato de uranilo y citrato de plomo durante 10 min y 5 min respectivamente y se observaron con un microscopio de transmisión JEOL JEM 1200EX.
Para llevar a cabo las descripciones morfológicas de los granos de polen con microscopía electrónica de barrido (MEB), se tomaron las anteras de la colección de germoplasma, las cuales se deshidrataron en 2.2 Dimetoxipropano acidificado por 2 a 3 días, realizando un cambio del solvente durante este tiempo (Halbritter et al., 2018). Finalmente, se hicieron dos cambios en etanol absoluto durante 30 minutos cada uno y se procedió a desecar al punto crítico con un desecador SAMDRI®-795. Las muestras se montaron sobre cinta conductiva de carbono de doble cara y se recubrieron con oro en una ionizadora DENTON VACUUM DESK IV durante 10 minutos. Las observaciones y registro fotográfico se realizaron en un microscopio electrónico de barrido JEOL JSM-6490LV. Para las descripciones en general se utilizaron los términos sensuHalbritter et al. (2018), Punt et al. (2007) y Crang et al. (2018). Las medidas de los granos de polen maduros están representadas por la medida mínima, media y medida máxima utilizando un N = 30.
Resultados
En T. cacao se lograron diferenciar siete estadios del desarrollo floral que se correlacionan perfectamente con los principales eventos del proceso de microsporogénesis (Fig. 1A). Las secciones del estadio más inmaduro estudiado revelan la presencia y formación de filamentos estaminales en cuyo extremo se aprecia una masa celular diferenciada, constituida por el tejido arquespórico, formado por células con abundante citoplasma de aspecto vacuolado y granular, un núcleo voluminoso en posición central y en éste se puede apreciar por lo general un nucleolo (Fig. 1B). A partir de esta masa de tejido arquespórico también se formará la pared de las anteras que para este momento del desarrollo floral está constituida por una capa de varios estratos celulares (Fig. 1B). Las capas celulares más internas que delimitan al tejido arquespórico son de contorno entre cuadrado a rectangular, con la presencia de una vacuola que ocupa la mayor parte del citoplasma y un núcleo en posición excéntrica en el cual se aprecia un nucléolo (Fig. 1B). El siguiente estrato celular de esta pared está formado por una capa de dos o tres células de grosor, muy similares en sus características citológicas a las células anteriormente descritas, pero con contorno más aplanado (Fig. 1B). La capa más externa de células epidérmicas que recubre el primordio de la antera posee contorno cuadrado, con una vacuola grande que ocupa la mayor parte del citoplasma y un núcleo en posición excéntrica; en esta capa es posible observar abundante acumulación de polifenoles almacenados principalmente en el citoplasma (Fig. 1B). A medida que las anteras crecen y se desarrollan a partir del tejido arquespórico se forman las células madre de las microsporas, y las paredes de las anteras se encuentran formadas por la capa uniestratificada epidérmica claramente diferenciada con abundantes polifenoles y una capa interna de dos o tres estratos celulares parietales de contorno cuadrado a rectangular (Fig. 1C); a partir de este estrato de células más interna se diferenciará el tapete. Las células madre de las microsporas se encuentran densamente empaquetadas en el lóculo microsporangial (Fig. 1C); estas células son de contorno globoso con una pared gruesa y el citoplasma se aprecia granular. Después de experimentar citocinesis meiótica simultánea las células madre de las microsporas forman tétrades de microsporas en disposición tetraédrica (Fig. 1D, Fig. 1E). Estas células se caracterizan por su contorno ovalado con un núcleo voluminoso en posición central, con uno o dos nucleolos y citoplasma de aspecto vacuolado y granular (Fig. 1E). Las microsporas en la tétrade están cubiertas por una gruesa capa de calosa que se aprecia en color azul claro al teñir con Lacmoid (Fig. 1D). Así mismo, para este momento del desarrollo floral en la pared de las anteras se aprecia el estrato epidérmico, una capa celular inmediatamente yuxtapuesta interna de contorno entre cuadrado y rectangular que se diferenciará posteriormente en el endotecio, una capa de células aplanadas que delimita internamente con el tapete secretor que a su vez está formado por una capa uniestratificada de células de contorno rectangular que limitan internamente con las tétrades de microsporas (Fig. 1E). Las microsporas dentro del lóculo microsporangial forman primero la exina, la cual adquiere un patrón de ornamentación reticulado que se tiñe de azul turquesa con Azul de Toluidina (Fig. 1F), se observa un núcleo por cada microspora y el citoplasma es de aspecto granular. Asociado al tapete secretor, se aprecia una granulación fina que corresponde a las orbículas que comparten las características de tinción de la exina con azul de Toluidina (Fig. 1F). Con la maduración de las microsporas, se forma la intina, la cual se aprecia más engrosada en la zona de las aberturas de las microsporas y se tiñe de color azul oscuro o violeta con la misma tinción (Fig. 1G); en tanto que en la pared de la antera para este momento del desarrollo se aprecian cuatro estratos celulares uniestratificados: la epidermis con abundantes depósitos de polifenoles (Fig. 1F). Debajo de la epidermis, se localiza el endotecio que corresponde a una capa uniestratificada de células cuadradas altas con engrosamientos fibrilares lignificados, posteriormente se observa una capa de células aplanadas y finalmente recubriendo el lóculo del microsporangio el tapete secretor se hace más conspicuo y sus células adquieren un contorno entre rectangular y globoso con abundantes orbículas (Fig. 1F, Fig. 1 G). Para el momento de la liberación de los granos de polen la exina e intina han completado su formación, y el tapete ha degenerado por completo (Fig. 1H).
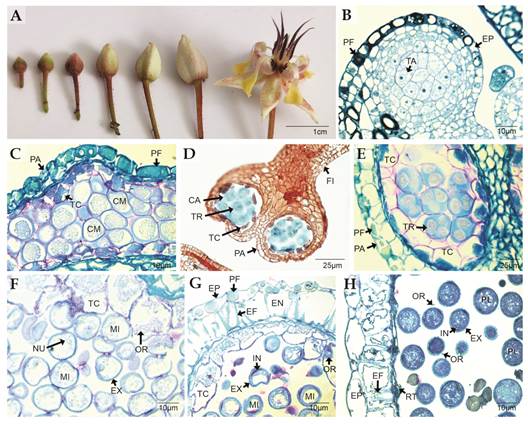
Fig. 1 Microsporogénesis de Theobroma cacao. A. Estadios del desarrollo floral. B. Región apical del filamento estaminal. Se aprecia el tejido arquespórico que formará a las células madre de las microsporas (TBO). C. Anteras diferenciadas. Se detallan las células madre de las microsporas (TBO). D. Tétrades tetraédricas de microsporas. Se aprecia el tapete celular y calosa alrededor de las microsporas y de las tétrades (Lacmoid) E. Detalles de las tétrades tetraédricas de microsporas, pared de la antera y tapete secretor (TBO). F-G. Microsporas en maduración (TBO). En F. se aprecia la exina y el tapete secretor con abundantes orbículas. En G. se distinguen la exina, la intina, el tapete secretor y en la pared de la antera la epidermis y el endotecio. H. Antera y granos de polen maduros. Se aprecian restos o remanentes del tapete. CA: calosa; CM: células madre de las microsporas; EF: engrosamientos fibrilares; EN: endotecio; EP: epidermis; EX: exina; FI: filamento estaminal; IN: intina; MI: microsporas; NU: núcleo de la microspora; OR: orbículas; PA: pared de la antera; PF: polifenoles; Pl: polen; RT: restos de las células del tapete; TA: tejido arquespórico; TC: tapete secretor; TR: tétrades polínicas tetraédricas. / Fig. 1. Theobroma cacao microsporogenesis. A. Stages of floral development. B. Apical region of staminal filament. The archesporic tissue that will form the mother cells of the microspores can be seen (TBO). C. Differentiated anthers. Microspore mother cells (TBO) are detailed. D. Tetrahedral tetrads of microspores. The secretory tapetum and callose around the microspores in the tetrads (Lacmoid) are appreciated. E. Details of the microspore tetrahedral tetrads, anther wall, and secretory tapetum (TBO). F-G. Mature microspores (TBO). In F., the exine and the secretory tapetum with abundant orbicules can be seen. In G. the exine, the intine, the secretory tapetum, the epidermis and the endothecium are distinguished. H. Anther and mature pollen grains. Remnants of the cell tapetum can be seen. CA: callose; CM: Microspore mother cells; EF: fibrillar thickenings; EN: endotecium; EP: epidermis; EX: exine; FI: staminal filament; IN: intine; MI: microspores; NU: microspore nucleus; OR: orbicules; PA: anther wall; PF: polyphenols; Pl: pollen; RT: remmants of the tapetal cells; TA: archesporic tissue; TC: secretory tapetum; TR: tetrahedral pollen tetrads.
Los granos de polen maduros presentan gran cantidad de gránulos de almidón (Fig. 2A) y sobre los restos de las paredes celulares del tapete secretor se observan depósitos masivos de orbículas que recubren toda la pared de los lóculos de los microsporangios (Fig. 2A). Las orbículas o cuerpos de Ubish de T. cacao se presentan en la pared de las anteras principalmente sobre los restos del tapete o sobre los granos de polen (Fig. 2B, Fig. 2D). Las orbículas presentan los mismos patrones de fluorescencia que la exina de los granos de polen cuando son observados utilizando la tinción de PAS-Amidoblack y el filtro de triple banda de excitación DAPI-FITC-Texas, estas estructuras y la pared de los granos de polen se ven de color azul-verdoso (Fig. 2C).
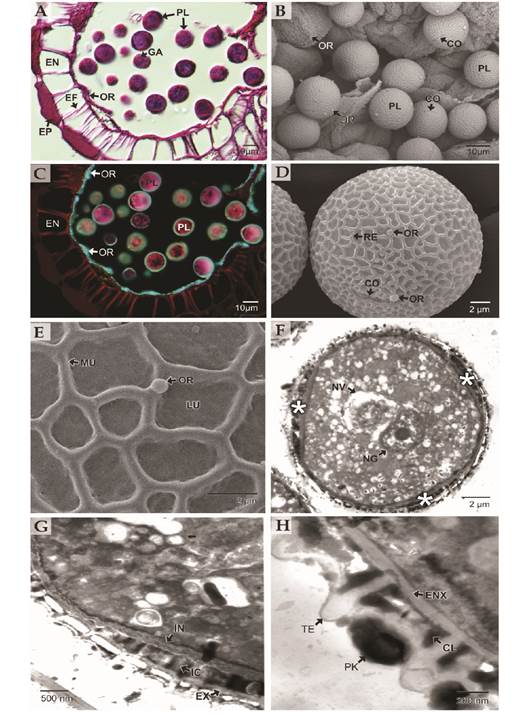
Fig. 2 Detalles morfológicos y ultraestructura de los granos de polen de Theobroma cacao. A. Sección trasversal de las anteras. Se aprecian las orbículas cubriendo la cavidad de los lóculos microsporangiales y abundantes gránulos de almidón en el citoplasma del polen (PAS-Amidoblack). B. Granos de polen y orbículas en las anteras (MEB). C. Sección trasversal de las anteras. Se aprecian las orbículas cubriendo la cavidad de los lóculos microsporangiales (Filtro DAPI-FITC-Texas, PAS-Amidoblack). D-E. Granos de polen observados con MEB. En D, vista subecuatorial. Se aprecian los colpos y las orbículas. En E, detalle del retículo con sus muros y lúmenes, se detallan las orbículas. F-H. Detalles ultraestructurales de los granos de polen con TEM. En F., se aprecian las zonas de las aberturas (asteriscos) y los núcleos generativo y vegetativo. En G., se detalla la estructura de la esporodermis en la zona interabertural, se observa la presencia de abundante polenkit. En H. se detalla la zona de las aberturas con una intina gruesa compacta y otra intina columelada. Cl: columelas; CO: colpos; EF: engrosamientos fibrilares; EN: endotecio; ENX: endexina; EP: epidermis; EX: exina; GA: gránulos de almidón; IC: intina columelada; IN: intina; LU: lumen: MU: muros; NG: núcleo generativo; NV: núcleo vegetativo; OR: orbículas; PF: polifenoles; PK: polenkit; Pl: polen; RE: retículo; TE: tectum. / Fig. 2. Morphological details and ultrastructure of Theobroma cacao pollen grains. A. Anthers cross section. Orbicules covering the microsporangial locules cavities and abundant starch granules in the pollen cytoplasm can be seen (PAS-Amidoblack). B. Pollen grains and orbicules in anthers (SEM). C. Anthers cross section. Orbicules covering the cavity of the microsporangial locules are seen (DAPI-FITC-Texas Filter, PAS-Amidoblack). D-E. Pollen grains under SEM. In D., subequatorial view. Colpus and orbicules are appreciated. In E., detail of the reticulum with its muri and lumens, the orbicules are notable. F-H. Ultrastructural details of pollen grains under TEM. In F., the areas of the apertures (asterisks) and the generative and vegetative nuclei can be seen. In G., the structure of the sporodermis and the pollen grains in the interapertural zone are detailed, the presence of abundant pollenkitt is observable. In H. the apertural area is detailed, a thick compact intine and a second columellate intine are observed. Cl: columella; CO: colpus; EF: fibrillar thickenings; EN: endothecium; ENX: endexine; EP: epidermis; EX: exine; GA: starch granules; IC: columellate intine; IN: intine; LU: lumen: MU: muri; NG: generative nucleus; NV: vegetative nucleus; OR: orbicules; PF: polyphenols; PK: pollenkitt; Pl: pollen; RE: reticulum; TE: tectum.
Los granos de polen son liberados en mónades, isopolares, pequeños (16.6) 18 (20.5) µm con amb circular, esferoidales (Fig. 2D), tricolpados con colpos breves de 5 µm, con membrana ornamentada. La estructura de la esporodermis es semitectada, con ornamentación reticulada, retículos heterobrochados, muros sin ornamentación, además el retículo disminuye de tamaño hacia las aberturas reduciendo el tamaño de los lúmenes aunque los muros mantienen el grosor (0.30 µm) (Fig. 2D, Fig. 2E). Los corpúsculos de Ubish son individuales, lisos y de diferentes tamaños (0.3 a 1 µm) (Fig. 2D, Fig. 2E).
Con TEM se observa una ultraestructura semitectada, la ectexina formada por tectum, columelas y capa basal que constituye la ornamentación reticulada y una endexina muy delgada y compacta (Fig. 2G). En el citoplasma se destacan los núcleos vegetativo y generativo, siendo en estadio binuclear la forma en que son liberados los granos de polen (Fig. 2F). El tectum presenta a la altura de algunas columelas una espina de ápice romo (Fig. 2G), en esta zona la ectexina alcanza el mayor espesor, 4.2 µm, entre espinas su espesor es de 2 µm, siendo las columelas simples; se observa además la endexina (Fig. 2G). El cemento polínico o polenkit se presenta en forma abundante sobre el tectum y entre las columelas (Fig. 2H).
La intina muy delgada en la zona interabertural se desarrolla ampliamente en las zonas de los colpos formando dos capas: una intina compacta interna y una intina externa que delimita con la exina de apariencia columelada o con canales electrónicamente densos (Fig. 2H).
Discusión
En el presente trabajo se describe por primera vez la microsporogénesis en T. cacao, se ha destallado el proceso de diferenciación de las anteras, la formación y estructura del tapete secretor y la secuencia centrípeta que conlleva a la formación de los granos de polen desde el depósito de la capa más externa de la pared polínica que corresponde a la exina, hasta la más interna, la intina; así mismo se detalla la ultraestructura de los granos de polen maduros.
En detalle, fue posible observar que en el extremo distal de los filamentos estaminales de T. cacao se localiza una masa de tejido arquespórico que se diferenciará para la formación de las células madre de las microsporas y los tejidos vegetativos que formaran la antera madura que para el momento de la dehiscencia solo persiste la epidermis y el endotecio; todo el patrón histológico observado, es similar en estructura y función al descrito previamente en Malvaceae y en la mayoría de las angiospermas, situación que muestra un amplio grado de uniformidad ontogenética de este proceso en plantas (Fernández et al., 2015; Lattar et al., 2012; Lattar et al., 2014; Rincón-Barón et al., 2021b; Scott et al., 2004; Tang et al., 2006; von Balthazar et al., 2006).
En algunas especies de Malvaceae se ha registrado la presencia de tapete invasivo no sincitial, además del plasmodial (Galati et al., 2007; Galati et al., 2011 ; Lattar et al., 2014 ; Rincón-Barón et al., 2021b; Strittmatter et al., 2000; Tang et al., 2009); aunque el tapete secretor es el más común en esta familia (Lattar et al., 2014; Tang et al., 2006) en ambos casos, el tapete degenera en el momento de la liberación de los granos de polen, situación que se pudo apreciar con el tapete secretor en esta investigación para T. cacao. Dado el estrecho contacto que se observó entre las células madre de las microsporas y el tapete secretor de T. cacao, se apoya la idea de que el tapete estaría facilitando su maduración y que posteriormente contribuye con el desarrollo de las microsporas, así como, proporciona materia prima para la formación de la esporodermis en especial de la exina (Fernández et al., 2015; Furness et al., 2002; Furness & Rudall 2004; Pacini, 2010; Rincón-Barón et al., 2021b).
En el estadio de células madre de las microsporas la pared primaria persiste mientras las conexiones citoplasmáticas permiten sincronizar la división de los microsporocitos y el avance del proceso en las células tapetales (Galati et al., 2007; Heslop-Harrison, 1974). La actividad metabólica en este momento es notoria por la presencia de diferentes moléculas y podría interpretarse como una etapa necesaria para la formación de calosa (Galati et al., 2007; Heslop-Harrison, 1966). En T. cacao la microsporogénesis es simultánea y se forman tétrades de microsporas en disposición tetraédrica con una gruesa capa de calosa, este proceso culmina con la formación de granos de polen triaberturados, lo cual es ampliamente conocido en eudicotiledóneas y se explica por depósitos de calosa y los puntos de contacto de las microsporas en la tétrade (Furness et al., 2002; Furness & Rudall, 2004). No obstante, en algunas especies se ha documentado la presencia de acumulaciones regulares de calosa durante la formación de las tétrades que culmina con la formación de granos de polen pantoporados (Prieu et al., 2019 ; Rincón-Barón et al., 2021b).
Se verificó que en T. cacao el depósito de la esporodermis es centrípeto, lo que implica, que primero se deposita la exina formada principalmente de esporopolenina y posteriormente se forma la intina que está formada por componentes de pared primaria, este patrón de depósito de la esporodermis es coincidente con el descrito habitualmente en plantas (Blackmore et al., 2007; Pacini & Hesse, 2012; Rincón-Barón et al., 2021b).
Adicionalmente, se observó que la exina toma una tinción azul-turquesa por la presencia de esporopolenina cuando se tiñe con TBO, en tanto que la intina se tiñe de color violeta por los componentes de pared primaria, lo cual es congruente con trabajos anteriores que indican la utilidad de esta tinción diferencial para detectar estos compuestos en los granos de polen e incluso en las esporas de plantas (Rincón-Barón et al., 2020; Rincón-Barón et al., 2021a).
En T. cacao se pudo evidenciar que en el estadio de microspora, los precursores de esporopolenina que se originan en el tapete se depositan sobre los granos de polen o sobre las paredes del lóculo microsporangial, por lo tanto, las orbículas se forman en el mismo momento que la pared de los granos y estarían constituidas por esporopolenina dado que presentan las mismas reacciones de tinción y autofluorescencia que la observada para la exina de la esporodermis, lo cual es similar a lo registrado previamente para otras especies e incluso T. cacao (Galati et al., 2007; Galati et al., 2011; Rincón-Barón et al., 2021a; Strittmatter & Galati, 2001). Las orbículas son consideradas primitivas por Verstraete et al. (2014) y han sido documentadas en la Familia Malvaceae (Galati & Rosenfeldt, 1998; Lattar et al., 2014; Rincón-Barón et al., 2021a; Strittmatter et al., 2000); su forma es muy variable, sin embargo, predominan las orbículas lisas que no mantienen la forma de la ornamentación de los granos de polen (Ruggiero & Bedini, 2020) algo que se observó también en las orbículas analizadas en T. cacao con una superficie lisa a microgranulada.
Durante la microsporogénesis de T. cacao se observó también una amplia producción de polifenoles, especialmente en los tejidos vegetativos de las anteras, un compuesto que predomina en especies de ambientes secos y permite resistir estas condiciones medio ambientales (Varela et al., 2016) y que en este caso en particular permitiría mantener la vitalidad de los granos de polen al momento de la liberación de la antera, cuando la deshidratación es severa; o también se podría relacionar como un mecanismos para evitar la herbivoría y el desarrollo de patógenos en especial hongos (Aime & Phillips-Mora, 2005; Aoun, 2017; Lattanzio et al., 2006; Rincón-Barón et al., 2020; Rincón-Barón et al., 2021a). Se ha registrado para T. cacao que los polifenoles se acumulan en las vacuolas principalmente de tejidos epidérmicos y parenquimatosos (Alean et al., 2020; García et al., 2014; Rincón-Barón, et al., 2021b) lo cual es congruente con las observaciones anatómicas realizadas en este trabajo.
En cuanto a los caracteres palinológicos, la Familia Malvaceae es euripalínica, presentando amplia diversidad en la morfología del polen principalmente en el tipo y número de aberturas junto a la ornamentación de la ectexina, propiedades que permiten la diferenciación de taxones (Bayer & Kubitzki, 2003; Bibi et al., 2010; Dias & Ribeiro, 2015; Hamdy & Shamso, 2010; Perveen & Qaiser, 2009; Rincón-Barón et al., 2021b). Según el APG et al. (2016) las antiguas Familias Bombacaceae, Sterculiaceae y Tiliaceae quedaron circunscritas al nivel de subfamilia como son Bombacoideae, Sterculioideae y Tilioideae. Malvaceae s.s. fue considerada estenopalínica, con polen habitualmente grande, pantoporado con una estructura suprareticulada, generalmente con espinas que pueden tener la base mamelonada (Abutilon spp., Hibiscus spp., Malva spp.; Christensen, 1986) o equinada sin base ensanchada (Alcea rosea L.; Rincón-Barón et al., 2021b). Actualmente T. cacao está circunscrito a la Subfamilia Byttnerioideae, Tribu Theobromateae junto a Glossotemon Desf., Guazuma Mill y Herrania Goudot. La morfología palinológica de los géneros de la subfamilia ha sido escasamente documentada y especialmente en T. cacao (Rincón-Barón et al., 2021a), por lo general, la atención ha sido puesta en la polinización y reproducción (López et al., 2018; Young et al., 1987).
En general los granos de polen de la subfamilia Byttnerioideae se caracterizan por la presencia de aberturas simples: poros, o compuestas: colporos, y por una ornamentación reticulada o equinada. Los granos son pequeños, reticulados, heterobrochados, colporados en Glossotemon bruguieri (Ali, 2020) y en Guazuma ulmifolia Lam. (Ali, 2020; Halbritter 2017). Los granos 3-colpados como los estudiados aquí en T. cacao son raros, sólo se han observado de acuerdo con la bibliografía consultada en una especie de la Familia Malvaceae, Ceiba pubiflora, Subfamilia Bombacoideae (Venancio et al., 2022). La estructura semitectada de la pared, remata en ornamentación supratectal con espinas ubicadas sobre las columelas, carácter frecuente en Malvaceae s.l. Es destacable la presencia en la zona abertural de la intina muy engrosada, con una capa compacta interna y una intina externa con canales. Esta particularidad ha sido mencionada previamente para la familia, en Waltheria cinerascens A. St.-Hil., especie que comparte la Subfamilia Byttneroideae con T. cacao, y único taxón del género Waltheria L. con una intina columelada (Dias & Ribeiro, 2015), esta inusual característica de la intina se aprecia en un trabajo posterior también en Waltheria, pero los autores no la mencionan (Amaral et al., 2017).
La intina columelada se ha documentado en investigaciones previas en la familia que abarca diferentes especies correspondientes a grupos no emparentados, en Abutilon hibridum Voss se destaca una subestructura microfibrilar en la intina de esta especie, considerado sitio de almacenamiento de proteínas y proponiendo la posible vinculación taxonómica del rasgo (Heslop-Harrison & Heslop-Harrison, 1982).
Al momento de la antesis el grano de polen maduro se encuentra en estadio dos nuclear, con la célula generativa libre en el citoplasma de la célula vegetativa. Brewbaker (1967) menciona a la Familia Malvaceae representada por Abutilon, Althea, Malva y Gossypium como polen dos-nuclear, coincidiendo con las observaciones realizadas aquí que aportan el dato de T. cacao por primera vez.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


