Introducción
En las últimas décadas, se ha observado una disminución significativa de la cobertura coralina en la región, con intervalos que oscilan entre un 10 y un 50 % de pérdida anual (Gardner et al., 2003). Estos patrones de cambio en la cobertura coralina son variables a lo largo de los períodos de tiempo, pero en gran medida son constantes en todas las subregiones; lo que sugiere que las causas locales han operado con cierto grado de sincronía que se refleja a escala regional. Esta situación se asocia a múltiples factores; uno de ellos, y que pudiera estar vinculado con el crecimiento acelerado de ciertas macroalgas en la zona de estudio, es la disminución del número de erizos negros. Esta problemática ha sido documentada por Alcolado et al. (2003) y por Caballero et al. (2007) para el Parque Nacional de Guanahacabibes. Vale puntualizar que, a nivel del Caribe, todavía hoy, no muestra señales de su recuperación (Lessios, 2016). Esto ha traído como consecuencia que las algas carnosas sofoquen a las colonias coralinas en varios sitios del Caribe, e impidan el asentamiento de larvas de Diadema antillarum (Rodríguez-Barreras et al., 2014).
En el Parque Nacional Guanahacabibes los estudios publicados sobre macroalgas se han centrado fundamentalmente en su distribución, atendiendo a los diferentes biotopos (Guardia et al., 2004). Por su parte, Torres-Conde y Martínez-Daranas (2017) registran las asociaciones de las algas con fanerógamas marinas, y otros autores como Ezquivel et al. (2010), Martínez-Daranas y Macías-Reyes (2013), y Valdivia et al. (2004) señalan la riqueza de especies en diferentes localidades. Ninguno de estos, sin embargo, considera la abundancia de los grupos morfofuncionales como indicadores del estado de conservación del arrecife. Por tanto, hay un vacío en el conocimiento sobre aquellos grupos de algas que pueden indicar una condición de perturbación en esta área aparentemente bien conservada.
El presente estudio está enfocado en determinar la variación temporal y espacial de los géneros de macroalgas predominantes en Yemayá y Laberito sitios ubicados en el Parque Nacional de Guanahacabibes, y a la vez, evaluar indirectamente la salud del arrecife de acuerdo con el porcentaje de cobertura de las macroalgas.
Materiales y métodos
Zona de estudio: El Parque Nacional de Guanahacabibes, tiene 15 950 hectáreas marinas, y se ubica al sur de la Península de Guanahacabibes; desde Jaimanitas, al este de Cabo Corrientes, hasta el Cabo de San Antonio (GORC, 2001). Como es un área marina protegida, está alejada de importantes fuentes de nutrientes y preservada de la pesca (Cobián-Rojas et al., 2013; Perera-Valderrama et al., 2013).
El relieve del área costera donde se ubican los dos arrecifes objeto de estudio es fundamentalmente cárstico, interrumpido por claros arenosos e influenciado por una fuerte escorrentía asociada a manantiales subterráneos (Cabrera et al., 2022). La amplia diversidad en la zona de estudio, tanto de corales pétreos como de peces, ha sido expuesta por Cobián-Rojas et al. (2011) y González-Ferrer et al. (2007), y obedece, en gran medida, a la ausencia de asentamientos humanos significativos. Solo el sector La Bajada-Uvero Quemado, ubicado hacia NW tiene un número muy reducido de pobladores que practican pesquerías sustentables, las que se realizan bajo estándares de conservación y preservación (Perera-Valderrama et al., 2016).
En el extremo de la península, se localizan estos dos arrecifes, los que se corresponden con los sitios de muestreo del presente estudio. Éstos se ubican en el Centro Internacional de Buceo: ''María La Gorda'' y son conocidos como: Yemayá (A) (21º50'05.90'' N, 84º29'27.20'' W) y Laberinto (B) (21°49'17.81'' N, 84°29'57.92'' W) (Fig. 1).
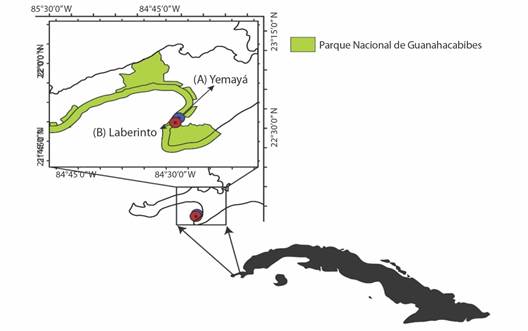
Fig. 1 Ubicación de los sitios de estudio. Yemayá (A). Laberinto (B). En María La Gorda Parque Nacional Guanahacabibes (Guanahacabibes), Cuba. / Fig. 1. Location of study sites. Yemayá (A). Laberinto (B). In María La Gorda Guanahacabibes National Park (Guanahacabibes), Cuba.
Métodos de muestreo: El estudio se realizó entre febrero del 2014 y marzo del 2017, con una frecuencia de muestreo cuatrimestral mediante buceo autónomo (SCUBA) a 10 m de profundidad.
Los registros de campo se llevaron a cabo sobre transectos de 20 m que sirvieron como referencia para anotar la presencia de organismos a un metro de distancia y proporcionaron así un área de muestreo de 20 m2, según la metodología descrita por AGRRA (2000) y Kramer et al., (2005). Para cada sitio de muestreo se usaron ocho transectos equidistantes, de acuerdo con las condiciones del arrecife y la forma del fondo (Díaz-Larrea, 2006). El transecto de 20 m sirvió de referencia para colocar un cuadrante de 25 x 25 cm a cada cinco metros del transecto, teniendo cinco cuadrantes por transecto. Cada cuadrante fue dividido en cuadros de 5 x 5 cm, que es la unidad mínima de muestreo, y se registró la siguiente información: número de cuadros de 5 x 5 que ocupa cada género por cuadrante, grupo morfofuncional presente i. e. carnosa, calcárea, coralina incrustante (costrosa), filamentosa, así como el tipo de sustrato que ocupa cada grupo morfofuncional y la altura promedio del dosel de las macroalgas presentes dentro de la cuadrícula. Se realizó además una estimación de la cobertura algal y de la abundancia específica de macroalgas. Adicionalmente, se midió la altura media de las algas carnosas y calcáreas con una regla para estimar el índice de macroalgas, según criterios de AGRRA (2000) y Cabrera et al., (2021a).
A diferencia de los grupos morfofuncionales; donde existe un registro completo en el periodo de estudio, la composición por género no fue posible obtenerla para el mes de febrero de 2014.
Procesamiento estadístico: Se calculó el porcentaje de cobertura por género, y por grupos morfofuncionales (GMF) que se deriva de la cobertura total encontrada en cada sitio de muestreo. Con los datos porcentuales de cobertura de géneros del 95 % de los más abundantes en orden descendente se realizó un análisis de varianza PERMANOVA (Anderson et al., 2008) con el factor (meses) para verificar diferencias significativas entre la abundancia específica (porcentaje de abundancia de cada género respecto del total) de los mismos entre sitios. El índice de Bray-Curtis se utilizó como medida de similitud para la matriz de datos multivariados (Anderson et al., 2008).
Los índices usados para algas carnosas y calcáreas (sustituto o proxy de biomasa) fueron calculados a partir del porcentaje de cubrimiento multiplicado por su respectiva altura promedio (AGRRA, 2000) utilizando el programa Microsoft Excel 2016. Para determinar la variación temporal del porcentaje de cobertura de las algas costrosas y los índices entre fechas de muestreo, se realizó un análisis de varianza univariado con un factor (meses) (Anderson et al., 2008). Como medida de similitud se usó la Distancia Euclidiana para las matrices univariadas, según recomiendan Anderson et al., (2008).
Los análisis estadísticos se hicieron a partir de 9999 permutaciones con un nivel de significación de 0.05 según Manly y Manly (2007).
Para la comparación múltiple a posteriori de las medias se utilizó la prueba de comparaciones pareadas (Pair-Wise test) realizadas por el PERMANOVA. La distribución de los datos no requirió ser transformados en ninguna de las matrices utilizadas.
Resultados
El número de géneros totales presentó sus valores máximos en junio 2015, y los mínimos en octubre del mismo año para Yemayá (Fig. 2A). Del total de géneros de macroalgas encontradas para ambos sitios, solo aportaron al 95 % de la cobertura total 10 géneros (Tabla 1).
Tabla 1 Cobertura en porcentaje de los géneros de macroalgas en dos sitios del sur de Guanahacabibes. / Table 1. Coverage in percent of macroalgal genera in two sites in southern Guanahacabibes.
| Fecha de muestreo | JUN 14 | OCT 14 | JUN 15 | OCT 15 | FEB 16 | SEP 16 | MAR 17 | |||||||||
| Géneros | Ye | La | Ye | La | Ye | La | Ye | La | Ye | La | Ye | La | Ye | La | ||
| Dictyota | 19.9 | 21.2 | 14.7 | 43.4 | 15.1 | 27.7 | 66.5 | 31.4 | 55.0 | 61.2 | 42.8 | 63.1 | 27.7 | 54.4 | ||
| Lobophora | 37.9 | 19.2 | 9.0 | 4.9 | 23.3 | 14.2 | 17.0 | 17.5 | 34.5 | 20.6 | 23.3 | 19.4 | 41.7 | 34.1 | ||
| Porolithon | 0 | 0 | 32.4 | 9.1 | 15.7 | 7.9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Halimeda | 10.5 | 8.0 | 9.5 | 6.8 | 4.9 | 4.8 | 16.5 | 7.7 | 8.4 | 6.3 | 20.4 | 16.2 | 10.5 | 9.3 | ||
| Cladophora | 0 | 0 | 9.2 | 7.5 | 9.2 | 13.7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Cladophoropsis | 13.4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 12.3 | 0 | 13.5 | 0 | ||
| Microdictyon | 0 | 42.8 | 2.2 | 7.3 | 11.5 | 26.0 | 0 | 32.6 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Amphiroa | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3.2 | 2.2 | ||
| Jania | 0 | 0 | 6.6 | 7.3 | 4.6 | 4.8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Turf | 16.7 | 5.3 | 8.6 | 5.8 | 10.1 | 0 | 0 | 4.6 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Otras | 1.5 | 3.5 | 7.8 | 7.9 | 5.7 | 0.8 | 0 | 6.2 | 2.0 | 11.8 | 1.1 | 1.3 | 3.4 | 0 | ||
| Total | 54.4 | 59.9 | 80.1 | 79.1 | 81.2 | 82.8 | 69.5 | 47.0 | 59.4 | 67.9 | 62.3 | 70.8 | 71.5 | 75.0 | ||
Ye: Yemaná. La: Laberinto.
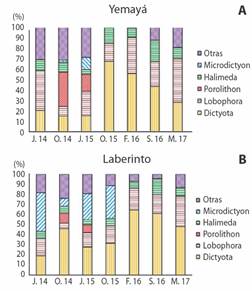
Fig. 2 Porcentaje de cobertura de los géneros de macroalgas predominantes durante el periodo de estudio en María La Gorda, sur de Guanahacabibes, Cuba. A. Yemayá, B. Laberinto. / Fig. 2. Percentage of coverage of the predominant macroalgae genera during the study period in María La Gorda, southern Guanahacabibes, Cuba. A. Yemayá, B. Laberinto.
Los géneros dominantes en ambos sitios de muestreo fueron: Dictyota, Lobophora y Halimeda (Fig. 2A, Fig. 2B). En octubre, los valores de cobertura del género Dictyota para el sitio Yemayá fueron muy elevados (66.5 %). Mientras que los valores más bajos correspondieron a junio (19.9 %) y a octubre 2014 con el 14.7 %. Sin embargo, en Laberinto, para junio 2014 es cuando se observaron los niveles más bajos de cubrimiento algal (21.2 %), mientras que los mayores valores correspondieron a febrero 2016 (63.1 %).
En septiembre 2016 (temporada lluviosa) se observó la mayor cobertura de Halimeda para ambos sitios, Yemayá con 20.4 % y Laberinto con 16.2 %. Los valores más bajos se hallaron en junio 2015 (temporada seca) en Yemayá y alcanzaron 4.9 %), y para el sitio de Laberinto fueron 4.8 % (Fig. 2A, Fig. 2B). Para Lobophora se encontró en mayor porcentaje de cubrimiento en febrero 2016 (34.5 %) y marzo 2017 (41.7 %) en Yemayá (Fig. 2A). Mientas que la menor cobertura se encontró en octubre 2014 (4.9 %) en Laberinto (Fig. 2B).
Los géneros Microdictyon y Porolithon presentaron niveles muy bajos de cubrimiento en ambos sitios de estudio. Porolithon alcanzó los niveles máximos de cubrimiento en Yemayá en octubre 2014 (32.4 %) y para junio 2015 (15.7 %). Por su parte, en el sitio de Laberinto alcanzaron niveles aún más bajos en el mismo período (9.1 %) en octubre, y 7.9 % para junio. En los meses posteriores no se registró su presencia en toda la zona de estudio (Fig. 2A, Fig. 2B). Microdictyon fue otro género que se observó con una moderada abundancia para Laberinto, fundamentalmente en junio 2014 (42.8 %) y junio 2015 (26.0 %). Estos niveles fueron aún más bajos para Yemayá cuyo valor más alto se observó en octubre 2016 (11.5 %) (Fig. 2A).
Estos resultados estuvieron apoyados por los obtenidos en el análisis de varianza multivariado para la estructura comunitaria algal, donde se encontraron diferencias significativas para cada sitio evaluado (Tabla 2).
Tabla 2 Resultados de PERMANOVA para los sitios de estudio. / Table 2. PERMANOVA Results for study sites.
| YEMAYÁ | Fuente | GL | Suma de cuadrados | MS | F | Probabilidad | permutaciones |
| Meses | 6 | 3.28410 | 85 487 | 12.405 | 0.0001 | 9 899 | |
| Res | 289 | 5.121400 | 2 098.3 | ||||
| Total | 295 | 7.09700 | |||||
| LABERINTO | Fuente | GL | Suma de cuadrados | MS | F | Probabilidad | permutaciones |
| Meses | 6 | 1.37990 | 2 299.8 | 12.27 | 0.0001 | 9 899 | |
| Res | 289 | 5.41700 | 1 874.4 | ||||
| Total | 295 | 6.79690 |
Pseudo-F = 12.405, P (perm) = 0.0001.
El porcentaje de cobertura de macroalgas carnosas y calcáreas fue superior en Laberinto con respecto a Yemayá, no siendo así la cobertura de coralinas costrosas (Tabla 3). Los valores de cobertura fluctuaron entre 50.9 y 67.7 % para las carnosas en Laberinto, y entre 33.6 y 59.7 % para Yemayá. Las macroalgas calcáreas no sobrepasaron el 12.6 % en Laberinto y en Yemayá alcanzaron solo un 13.5 %. Sin embargo, los registros de las costrosas presentaron un 17.8 % en Yemayá y sólo un 12.7 % en Laberinto. Estos resultados corresponden con los obtenidos en el análisis de varianza univariado de la cobertura de los GMF, donde se encontraron diferencias significativas para la cobertura de coralinas costrosas y el índice de macroalgas carnosas y calcáreas en cada sitio evaluado, excepto el índice de macroalgas calcáreas para Laberinto. Los resultados de cobertura que muestran las macroalgas carnosas en el sitio de Laberinto también son mayores que en Yemayá (Fig. 3). Para Yemayá en marzo 17 se alcanzaron los mayores valores de este índice, seguido de octubre 2015 y febrero 2016. Para ambas localidades, es octubre el periodo donde se registra la menor cobertura.
Tabla 3 Porcentaje de cobertura e índice de Abundancia Específica de macroalgas en Yemayá y Laberinto en el período de estudio. / Table 3. Percentage coverage and index of Specific Abundance of macroalgae in Yemayá and Laberinto in the study period.
| Sitios | Yemayá % cobertura | Cost | Laberinto % cobertura | Cost | |||
| Fechas | Car | Cal | Car | Cal | |||
| feb-14 | 33.6 ± 25.0 | 3.1 ± 4.7 | 25.9 ± 27.1 | 55.3 ± 23.5 | 12.6 ± 16.0 | 6.4 ± 12.4 | |
| jun-14 | 42.3 ± 23.8 | 6.0 ± 7.5 | 20.2 ± 18.4 | 52.3 ± 30.0 | 4.8 ± 6.4 | 7.0 ± 10.2 | |
| oct-14 | 30.5 ± 18.2 | 13.5 ± 10.5 | 25.6 ± 25.3 | 51.0 ± 17.6 | 11.2 ± 9.3 | 12.7 ± 11.9 | |
| jun-15 | 53.6 ± 21.4 | 9.1 ± 5.0 | 15.1 ± 14.0 | 67.7 ± 23.5 | 8.0 ± 8.6 | 9.7 ± 10.0 | |
| oct-15 | 55.0 ± 28.0 | 8.3 ± 11.3 | 17.8 ± 10.7 | 50.9 ± 29.8 | 5.2 ± 6.9 | 12.6 ± 17.6 | |
| feb-16 | 54.4 ± 25.4 | 5.2 ± 8.2 | 12.1 ± 18.3 | 58.8 ± 17.3 | 5.6 ± 8.6 | 6.3 ± 9.7 | |
| sep-16 | 49.6 ± 18.6 | 12.7 ± 12.2 | 0 | 59.1 ± 19.5 | 11.1 ± 10.2 | 4.5 ± 8.9 | |
| mar-17 | 59.7 ± 24.4 | 10.4 ± 15.1 | 13.4 ± 13.8 | 67.4 ± 25.4 | 7.6 ± 5.9 | 2.4 ± 4.0 | |
| Fechas | Ind. AE. Car | Ind. AE. Cal | Ind. AE. Car | Ind. AE. Cal | |||
| feb-14 | 95.3 ± 85.7 | 11.0 ± 20.0 | ** | 179.6 ± 107.5 | 38.6 ± 47.6 | ** | |
| jun-14 | 104.0 ± 80.0 | 15.5 ± 21.0 | ** | 247.8 ± 222.4 | 30.4 ± 81.0 | ** | |
| oct-14 | 49.9 ± 50.4 | 21.8 ± 23.6 | ** | 142.3 ± 78.5 | 16.0 ± 13.1 | ** | |
| jun-15 | 170.6 ± 103.4 | 21.5 ± 22.0 | ** | 237.3 ± 111.5 | 20.3 ± 25.5 | ** | |
| oct-15 | 192.8 ± 109.7 | 33.0 ± 45.1 | ** | 223.3 ± 183.7 | 34.9 ± 78.3 | ** | |
| feb-16 | 174.9 ± 130.7 | 21.0 ± 34.5 | ** | 265.0 ± 151.7 | 21.5 ± 36.5 | ** | |
| sep-16 | 150.3 ± 54.5 | 49.8 ± 54.9 | ** | 251.0 ± 102.5 | 40.1 ± 38.9 | ** | |
| mar-17 | 223.1 ± 119.5 | 45.3 ± 76.8 | ** | 258.7 ± 124.2 | 26.2 ± 21.8 | ** | |
Car = macroalgas carnosas, Cal = macroalgas calcáreas articuladas, Cost = macroalgas coralinas costrosas. AE= Abundancia Específica, Ind. AE. Car =Índice de macro-carnosas, Ind. AE. Cal=Índice de macro-calcáreas. ** La altura promedio e índice de macroalgas costrosas no se calculan. Se representa la media ± desviación estándar. / Car = fleshy macroalgae, Cal = articulated calcareous macroalgae, Cost = crustose coralline alga. AE= Specific Abundance, Ind. AE. Car = Macro-fleshy index, Ind. AE. Cal=Macro-calcareous index. ** Mean height and macroalgal crustose index are not calculated. The mean ± standard deviation is represented.
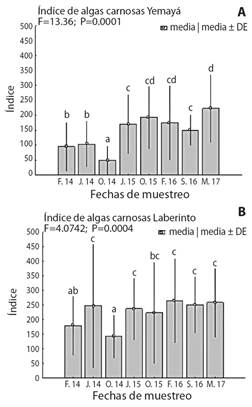
Fig. 3 Variación espacial del índice de algas carnosas para A. Yemayá, B. Laberinto (resultados del ANOVA unifactorial). Letras diferentes indican diferencias significativas según la prueba de comparaciones pareadas. / Fig. 3. Spatial variation of the fleshy algae index for A. Yemayá, B. Laberinto (results of the one-way ANOVA). Different letters indicate significant differences according to the paired comparisons test.
La presencia de macroalgas calcáreas es superior en el sitio Yemayá (Fig. 4), y aunque para la estación de Laberinto, se registran las mayores coberturas para septiembre 2016, febrero 2014 y octubre 2015, los análisis de varianza no detectaron diferencias significativas entre los meses. Por su parte, los menores valores de este índice se alcanzaron en febrero 2014 para Yemayá y octubre 2014 para Laberinto.
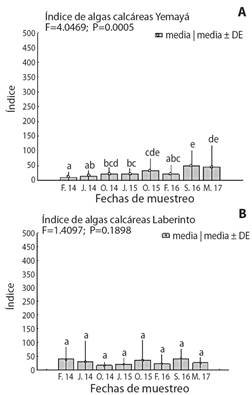
Fig. 4 Variación espacial del índice de algas calcáreas para A. Yemayá, B. Laberinto) (resultados del ANOVA unifactorial). Letras diferentes indican diferencias significativas según la prueba de comparaciones pareadas. / Fig. 4. Spatial variation of the calcareous algae index for A. Yemayá, B. Laberinto (results of the one-way ANOVA). Different letters indicate significant differences according to the paired comparisons test.
La cobertura de coralinas costrosas en Yemayá fue superior a la observada en Laberinto (Fig. 5). La mayor cobertura se observó en febrero y octubre 2014 en Yemayá, para octubre 2014 y 2015 en el sitio de Laberinto. Los niveles más bajos se obtuvieron en septiembre 2016 y marzo 2017 respectivamente.
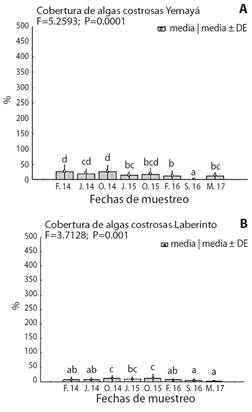
Fig. 5 Variación espacial de la cobertura de algas coralinas costrosas para A. Yemayá, B. Laberinto (resultados del ANOVA unifactorial). Letras diferentes indican diferencias significativas según la prueba de comparaciones pareadas. / Fig. 5. Spatial variation of the cover of crustose alga for A. Yemayá, B. Laberinto (results of the one-way ANOVA). Different letters indicate significant differences according to the paired comparisons test.
Discusión
De manera general, la abundancia algal presentó diferencias importantes en cuanto a sus variaciones temporales, y se obtuvieron los valores máximos en los meses de lluvia. Esto coincide con los resultados obtenidos por González-Sánchez (2016) quien atribuye gran parte de las diferencias halladas en la cobertura a la época del año.
De acuerdo con los resultados de Suárez (1989), de abril a junio se produce en la plataforma de Cuba un incremento en el número de especies, así como un crecimiento de las macroalgas marinas, al punto de registrarse, entre junio y agosto, un máximo de abundancia, lo que se asocia a una mayor escorrentía debido a las precipitaciones. Ello se traduce en un aumento de la concentración de nutrientes, principalmente de fosfatos y nitratos, lo que conlleva a un máximo crecimiento algal; mientras que en el periodo de seca la escorrentía disminuye, y con ésta, la concentración de nutrientes baja (Ventura & Suárez, 2013). Esta regularidad también se cumple para especies que han sido cultivadas en la plataforma de Cuba, donde los niveles de macronutrientes en el talo tienen una relación directa con su disponibilidad en el medio marino (Cabrera et al., 2021b).
Autores como Alfonso & Martínez-Daranas (2009), Lazcano (1995); Prado & Suárez (1996); Semidey (2013) y Ventura & Suárez (2013) encontraron máximos de abundancia entre junio y agosto, lo cual también corrobora nuestros resultados.
El menor número de géneros registrados en el mes de octubre concuerda con los resultados obtenidos por Suárez (1989), quien plantea que en marzo, septiembre y octubre se produce una disminución de especies de macroalgas, ya que son periodos de transición entre los máximos de abundancia.
La dominancia de los géneros Dictyota, Lobophora y Halimeda coincide con los resultados de otros estudios en arrecifes de Cuba y del Caribe (Bakker et al., 2017; Guardia et al., 2004; Martín et al., 2010; Vroom & Braun, 2010).
También fueron abundantes las especies de Halimeda en los Camellones y de Microdyction en los Cabezos. La moderada abundancia del género Microdictyon en Laberinto (Fig. 2B) corrobora los resultados obtenidos por Vroom & Braun (2010) quienes plantean que este género comúnmente forma praderas y cubre más del 10 % del sustrato. No se puede menospreciar tampoco el aporte del género Halimeda a la cobertura vegetal del sitio Yemayá para los meses muestreados entre 2016 y 2017 donde, seguramente, al igual que en los resultados de Ortegón-Aznar et al. (2017), es un importante contribuyente en el balance del carbono del ecosistema.
La ausencia de Porolithon en la mayor parte del periodo de estudio en ambos sitios, tiene implicaciones a considerar para la salud. Estos arrecifes, debido a su papel en el asentamiento y metamorfosis de las larvas de coral (Whitman et al., 2020). Estudios previos han revelado que los impactos fisiológicos del blanqueo en Porolithon, se asocian con cambios de temperaturas y radiación lumínica (Bessell-Browne et al., 2017; Yang et al., 2021). Evidenciando que este género es uno de los más vulnerables al cambio climático, y, por tanto, un indicador de alarma temprana (Ordoñez et al., 2019).
Otros autores como, Guardia et al. (2004) en su estudio sobre biotopos, obtuvieron resultados semejantes a los que se han expuesto previamente. Ellos plantean que en el biotopo de Cabezos (2-15 m) y Camellones (10 m) ubicados en la zona frontal del arrecife, los géneros Dictyota, Lobophora y Halimeda alcanzaron niveles máximos de cubrimiento, entre 10 y 25 %. Lo que es coherente con los resultados de Fabricius et al., (2023), quienes plantean que estos grupos son los mayores contribuyentes de biomasa en estos biotopos.
Al comparar con los estudios realizados en el 2001 por Guardia et al. (2004), las algas carnosas continúan siendo el morfo-tipo de algas dominantes, y se mantiene la casi total ausencia de erizos negros desde 1999 hasta la actualidad (Alcolado et al., 2003; Caballero et al., 2007). La significativa escasez de Diadema encontrada en los fondos arrecifales de Guanahacabibes pudiera ser un factor con influencia negativa sobre el arrecife, ya que ella ejerce un control hacia abajo en la abundancia de macroalgas y mantiene la estabilidad y diversidad de arrecifes tropicales altamente productivos (Martín et al., 2010; Rodríguez-Barreras et al., 2015).
Aunque los niveles de cobertura del morfo-tipo carnoso son predominantes en Yemayá, resultados de más de una década publicados por Guardia et al. (2004) indican que, desde el 2001, son el morfo-tipo dominante en toda el área. Lo que sí coincide con la ausencia de erizos negros desde fines de 1999. Y aunque las causas pueden ser muy diversas, el crecimiento desmesurado y preferencial de estas macroalgas sobre otros grupos muy bien pudiera atribuirse, en muy buena parte, a esta situación. Y si bien el efecto que tiene los herbívoros no fueron objetivos en la presente, las alarmas sobre el declive de sus poblaciones no cesan (Cramer et al., 2020).
Es conocido que la cobertura de macroalgas es utilizada como indicador de deterioro general del ecosistema (Areces et al., 2015; Hughes, 1994; Littler & Littler, 1984), y en algunos casos, como indicador de enriquecimiento de nutrientes (Endo & Gao, 2022; Lee & Kang, 2020). Por lo que se considera que una alta cobertura de algas carnosas y calcáreas tiene un efecto negativo sobre el desarrollo de corales, ya que estos últimos incrementan su vulnerabilidad y disminuyen el asentamiento de reclutas (Hughes, 1994). Esto no es un problema particular de la zona de estudio, sino que es una característica común a la gran mayoría de los arrecifes de Cuba y el Caribe (Kramer, 2003; Wilkinson, 2008; Williams, 2021).
Los elevados índices de macroalgas carnosas podrían deberse también a la dominancia durante el estudio de macroalgas pardas con gran altura en su dosel, la cual varía temporalmente en función de la especie de macroalga dominante (González-Ferrer et al., 2007). La zona este de la Península se encuentra resguardada de eventos generadores de oleaje, los cuales pueden ejercer control mecánico sobre el cubrimiento. Esta información puede corroborarse con los resultados obtenidos por Perera-Valderrama et al., (2016) quienes plantean que los arrecifes con mejores indicadores de condición (cubrimiento de coral vivo de 27.4 %) son precisamente los que se hallan protegidos del batimiento oceánico.
Los intervalos alcanzados de los índices de macroalgas carnosas y calcáreas en este estudio fueron menores que los obtenidos por Caballero et al., (2007) en septiembre de 2004, para Yemayá. Sin embargo, en el mencionado estudio, se observó un mayor porcentaje de cobertura de macroalgas costrosas para Yemayá.
Si bien, la sobrepesca puede prevenirse solo en aquellas zonas protegidas, e igualmente minimizar los efectos de la contaminación y el turismo masivo. El deterioro en las comunidades bentónicas en ambos arrecifes es evidente. Ello se apoya en niveles de cubrimiento, tanto de algas costrosas como de carnosas, así como en la proliferación diferencial de géneros focales como Dictyota y Lobophora, sobre otros como Porolithon.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

