Introducción
La contaminación de los ecosistemas acuáticos es constante y muchas de las sustancias más comunes que son vertidas a este medio son derivadas de la actividad humana (Dellafredad & Iannacone, 2021; Gunnarsson & Castillo, 2018; MINAM, 2016; Parada-Surubi & Iquize-Villca, 2020).
En los ecosistemas marinos, uno de los contaminantes de origen orgánico de mayor impacto en el mundo son los detergentes domésticos de uso cotidiano (Kogawa et al., 2017; Sobrino-Figueroa et al., 2020; Uzma et al., 2018), y su origen en el medio acuático es principalmente por las descargas de aguas residuales no tratadas de tipo industrial, agrícola o doméstico (Mousavi & Khodadoost, 2019; Sobrino-Figueroa, 2015; Sobrino-Figueroa, 2018).
Los detergentes domésticos tienen una estructura química muy compleja, formado por un agente surfactante que puede ser aniónico o catiónico; además contienen aditivos como suavizantes, agentes blanqueadores, conservantes, etc. (Rebello et al., 2013). Los detergentes son moléculas sintéticas compuestas, y químicamente pertenecen mayormente a cinco grupos de sustancias: tensioactivos, rellenos, enzimas, mejoradores y agentes blanqueadores. Además, estos detergentes tienen aditivos, por ejemplo, agentes secuestrantes orgánicos, blanqueadores ópticos, agentes azuladores, reguladores de espuma y agentes antideposición (Uzma et al., 2018). Uno de estos tipos de detergentes, los aniónicos LAS, se usan comúnmente en productos de limpieza y en polvo para ropa, los cuales contiene entre 3-22 % de este agente tensioactivo (HERA, 2012); sin embargo, causan una interacción nociva con el medio ambiente (Kundu et al., 2015).
Los detergentes provocan diversos impactos en el ambiente como eutrofización, y problemas de espuma en cuerpos de agua superficiales, lagos y oceános, lo que ocasiona una interferencia en la mezcla de oxígeno atmosférico con el agua (Polat & Akkan, 2016), e impactos negativos a los organismos acuáticos (Mousavi & Khodadoost, 2019; Nkpondion et al., 2016; Sobrino-Figueroa, 2018).
Los efectos de las sustancias potencialmente tóxicas como los detergentes en los ambientes acuáticos son determinados mediante el uso de bioensayos de toxicidad que pueden ser letales y subletales, los cuales se dan en condiciones controladas de laboratorio, además el uso de organismos modelo tienen características importantes para ser considerados modelos puesto que dichos organismos muestran amplia distribución y son susceptibles a los tóxicos (Caja-Molina & Iannacone, 2021; Kizek et al., 2017; Mousavi & Khodadoost, 2019; Tato & Beiras, 2019). Según Sobrino-Figueroa (2018) el riesgo ecológico es comúnmente juzgado en base al impacto que tiene sobre la comunidad de poblaciones u organismos, así como en los valores finales y la concentración letal media (CL50), que se calculan a partir de pruebas ecotoxicológicas.
Dentro de las comunidades marinas, los moluscos y poliquetos cumplen un rol a nivel trófico de importancia dentro del dinamismo de los ecosistemas, además de ser considerados como una herramienta biológica importante de evaluación en los ensayos con sustancias contaminantes o perturbadoras (Rodríguez & Mesa, 2015; Uc-Peraza & Delgado-Blas, 2012).
Semimytilus patagonicus (Gould, 1850) (Mytilidae) es un molusco, que se localiza en la zona intermareal inferior de la costa del Pacífico de América del Sur (Zeeman et al., 2020), este bivalvo es importante desde el punto de vista ecológico, debido que son filtradores que pueden absorber ciertas sustancias nocivas en su organismo (Gomez et al., 2021; de la Torre et al., 2020), y pueden jugar un papel importante en la estructura de la comunidad como bioingenieros y como presas para otras especies depredadoras (Brante et al., 2019). Asimismo, Pseudonereis gallapagensis (Lamarck, 1818) (Nereididae) es un gusano con comportamiento bentónico, abundante y es considerado un bioindicador de calidad ambiental marina (Rodríguez & Mesa, 2015; Tasso et al., 2018; Villalobos-Guerrero & Idris, 2020; Villalobos-Guerrero & Tovar-Hernández, 2013) y puede formar parte de la dieta de los cefalópodos como el calamar común Doryteuthis gahi (d’Orbigny, 1835) (Carrasco et al., 2021; Cisneros, 2019).
En Perú los estudios relacionados con detergentes comerciales en diferentes organismos son antiguos, escasos y sus efectos tóxicos solo se han evaluado en pocas especies acuáticas (Álvarez et al., 1999; Iannacone & Alvariño, 2002). Debido a los escases de investigaciones relacionadas a detergentes comerciales y el uso de especies nativas como bioindicador, el presente estudio tiene por objetivo principal emplear a S. patagonicus y P. gallapagensis como herramientas ecotoxicológicas para evaluar detergentes comerciales en el ambiente marino.
Materiales y métodos
Recolecta de material biológico: se obtuvieron individuos del bivalvo S. patagonicus de la playa Punta Roquitas, Miraflores, Lima (12°07´26” S & 77°02´29” W) y del poliqueto P. gallapagensis de la playa Los Yuyos, Barranco, Lima (12°09´07” S & 77°01´32” W), Perú (Fig. 1). La extracción de S. patagonicus y P. gallapagensis se hizo con una espátula de plástico para no dañar a los ejemplares, y se depositaron en envases de 1 l con agua mar del lugar de recolecta para evitar el estrés de los organismos. Posteriormente, el material biológico fue trasladado al Laboratorio de Ecología y Biodiversidad Animal (LEBA), Universidad Nacional Federico Villarreal, Lima, Perú para su aclimatación por siete días previos al bioensayo.
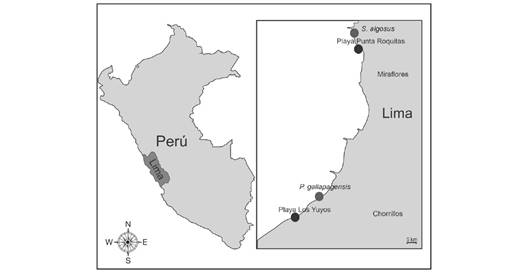
Fig. 1 Puntos de recolecta de los organismos evaluados: Playa Punta Roquitas-Miraflores (Semimitylus patagonicus) y playa Los Yuyos-Chorrillos (Pseudonereis gallapagensis). / Fig. 1. Colectin points of the evaluated organisms: Punta Roquita beach- Miraflores (Semimitylus patagonicus) and Los Yuyos beach- Chorrillos (Pseudonereis gallapagensis).
Aclimatación: se seleccionaron organismos en óptimas condiciones (sin fragmentación, con movimiento, valvas en buen estado). Posteriormente se colocaron en envases plásticos de 1 l con agua de mar, sedimento del sitio de muestreo y un sistema de aireación continua por siete días. Durante la aclimatación se les proporcionó alimento a base de microalgas Nannochloropsis sp. a S. patagonicus, y alimento para peces a P. gallapagensis a 19 a 22 ºC (Herrera-Perez & Méndez, 2019a; Herrera-Perez & Méndez, 2019b).
Preparación de detergentes: los detergentes comerciales utilizados en el estudio se compraron en un mercado local. Para los bioensayos se usaron dos marcas de detergentes Ariel Doble Poder® (90 %) y Caricia® (80 %), ambos detergentes presentan como ingrediente activo (ia) al compuesto Dodecilbencen Sulfonato de Sodio (SDBS), número CAS: 25155-30-0, donde la única diferencia radica en que Ariel Doble Poder® tiene una concentración del 90 % del compuesto activo, mientras que el detergente Caricia® presenta una concentración del ingrediente activo (SDBS) (80 %). En ambos ensayos se evaluaron pruebas de toxicidad aguda, es decir se determinó la mortalidad en cada tiempo de evaluación de cada bioensayo.
Bioensayos: Las condiciones físico-químicas del bioensayo para ambas especies fue pH 8.0 ± 0.2, temperatura de 17 a 18 ºC, y fotoperiodo 12 L:12 O.
Semimitylus patagonicus: se seleccionaron 120 individuos de S. patagonicus con una longitud valvar promedio de 3.23 ± 0.64 cm, los cuales fueron limpiados, quitando así, cualquier rastro de epibiontes para no alterar los resultados del experimento. El detergente usado para el ensayo fue Ariel Doble Poder® (90 %). A partir de la solución madre con una concentración de 280 mg·l-1, se obtuvieron concentraciones a un factor de dilución de 0.5 de 17.5, 35, 70 y 140 mg·l-1 para el ensayo. Para cada concentración se prepararon cuatro réplicas en envases de 1 l con 750 ml de las concentraciones del detergente. Asimismo, se colocaron cuatro envases como control. Fueron colocados en cada envase cinco individuos. Las lecturas de mortalidad se realizaron a las 48 y 72 h de exposición. Para este ensayo se utilizaron tres variables para determinar la mortalidad de S. patagonicus: 1) formación de biso el cual genera adherencia al fondo del envase; 2) movimiento de las valvas al ser extraídos o al movimiento, y finalmente 3) movimiento del pie. De estas tres variables se estandarizó que por lo menos se presentaran dos de tres para considerarlas como vivos (Iannacone & Alvariño, 2002).
Pseudonereis gallapagensis: se emplearon un total de 120 individuos con una longitud total de 20.4 ± 8.8 mm. Se usó el detergente en polvo (marca Caricia®), con el cual se obtuvo una solución madre de 3 000 mg·l-1 de agua de mar. A partir de esta solución madre se obtuvieron concentraciones a un factor de dilución de 0.5 de 62.5, 125, 250, 500 y 1 000 mg·l-1 para los tratamientos en el ensayo. Se prepararon cinco tratamientos, cada uno con cuatro réplicas, además se incluyó un control con cuatro réplicas para determinar la efectividad del ensayo. Se colocaron 750 ml de cada concentración preparada para cada tratamiento en envases de plástico de 1 l de capacidad. Posteriormente se agregaron cinco organismos de P. gallapagensis por cada unidad expermiental. Las lecturas de mortalidad se realizaron a las 24 h, 48 h y 72 h de exposición. Se consideraron organismos muertos a individuos con pigmentación pálida, cuerpo hinchado y sin movimiento.
Análisis de datos: La data obtenida en cada bioensayo con cada detergente se depositó en una base de datos de Microsoft Excel 2020. Posteriormente la data se analizó con el programa estadístico SPSS (IBM Corp., 2016), se realizó la prueba de Shapiro-Wilk para determinar si la distribución de los datos es normal y con la prueba de homogenidad de varianzas de Levene. En el caso de cumplir con los requerimientos paramétricos se empleó el ANOVA (F). Para determinar diferencias entre tratamientos y entre repeticiones se realizó la prueba de Tukey de comparación múltiple (a = 0.05), a partir del cual se obtuvieron los valores NOEC (Concentración más alta de efectos no observados), LOEC (Concentración más baja de efectos observados). Se calculó la CL50 (Concentración Letal media) a partir de los datos de supervivencia de cada bioensayo, para el cual se usó el método Probit, calculado por medio de una plantilla de Excel generado de forma libre por Raj (2016).
Toxicidad basada en unidades de toxicidad (UT): se siguió el protocolo de la Norma Mexicana (2010) y de Uc-Peraza y Delgado-Blas (2012) para calcular las unidades de toxicidad aguda (UT) en detergentes, el cual se determina a partir de la CL50, con la siguiente fórmula: UT = (1/CL50) x 100. La clasificación del grado de ecotoxicidad de los detergentes se muestra en la Tabla 1.
Tabla 1 Clasificación de la ecotoxicidad basada en unidades de toxicidad (UT) según el el protocolo de la Norma Mexicana (2010) y de Uc-Peraza & Delgado-Blas (2012). / Table 1. Classification of ecotoxicity based on toxicity units (TU) according to the protocol of Norma Mexicana (2010) and from Uc-Peraza & Delgado-Blas (2012)
| Clasificación | Unidades de Toxicidad (UT) |
| Muy tóxico | > 4 |
| Tóxico | 2 - 4 |
| Moderadamente tóxico | 1.33 - 1.99 |
| Ligeramente tóxico | < 1.33 |
Definición de puntaje de peligro: se evaluaron las puntuaciones de peligro de los detergentes estudiados de acuerdo con el reglamento 1907/2007/CE). Los productos químicos se clasificaron en cuatro clases (Tabla 2).
Tabla 2 Clasificación de riesgo y de puntuación del peligro para los detergentes DBSS en base a los valores CL50 según el reglamento 1907/2007/CE. / Table 2. Hazard score risk and classification for DBSS detergents based on LC50 values according to regulation 1907/2007/EC.
| CL50 (mg·l-1) | Clasificación del riesgo | puntuación del peligro |
| CL50 < 1 | Muy tóxico para los organismos acuáticos | 1 |
| 1 < CL50 < 10 | tóxico para los organismos acuáticos | 2 |
| 11 < CL50 < 100 | Nocivo para los organismos acuáticos | 3 |
| CL50 > 100 | No clasificable | 4 |
Resultados
Los valores toxicidad aguda en mg·l-1 con base a la CL50, CL50 (límite de confianza inferior al 95 %), CL50 (límite de confianza superior al 95 %), NOEC y LOEC del detergente SDBS sobre el molusco S. patagonicus y el poliqueto P. gallapagensis se encuentran en la Tabla 3 y Tabla 4. A 48 h de exposición al detergente SDBS, S. patagonicus fue 6.2 veces más tóxico en comparación a P. gallapagensis. A 72 h de exposición, S. patagonicus fue 2.9 veces más tóxico al detergente SDBS que P. gallapagensis (Tabla 3 y Tabla 4). P. gallapagensis presentó mayores valores de NOEC y LOEC a 48 y 72 h de exposición que S. patagonicus. Las catalogaciones ecotoxicológicas de los detergentes en base a las unidades tóxicas (UT) a 72 h de exposición, fue calificado como tóxico para S. patagonicus y ligeramente tóxico para P. gallapagensis. La clasificación del riesgo para los detergentes para S. patagonicus y para P. gallapagensis a 72 h de exposición fue calificado como nocivo para los organismos acuáticos y no clasificable, respectivamente (Tabla 3 y Tabla 4).
Tabla 3 Toxicidad del detergente a base a Dodecilbencen Sulfonato de Sodio (SDBS) sobre Semimytilus patagonicus a 48 h y 72 h de exposición en base a la CL50, NOEC y LOEC. / Table 3. Toxicity of the detergent based on Sodium Dodecylbenzene Sulfonate (SDBS) on Semimytilus patagonicus at 48 h and 72 h of exposure based on LC50, NOEC and LOEC.
| Concentración del SDBS (mg·l-1) | 48 h | 72 h |
| 0 | 0a | 0a |
| 17.5 | 30ab | 33.33b |
| 35 | 35b | 61.11b |
| 70 | 60c | 72.22b |
| 140 | 65c | 94.44c |
| 280 | 70c | 88.89c |
| CL50 | 61.98 | 34.95 |
| CL50 (límite de confianza inferior al 95 %) | 26.10 | 16.99 |
| CL50 (límite de confianza superior al 95 %) | 147.22 | 70.02 |
| NOEC | 17.5 | < 17.5 |
| LOEC | 35 | 17.5 |
| Shapiro-Wilk | 0.72 | 0.50 |
| Levene | 0.35 | 0.75 |
| Clasificación con base a las Unidades de Toxicidad (UT) | 1.61 | 2.86 |
| Clasificación según Norma Mexicana (2010) y de Uc-Peraza & Delgado-Blas (2012) | Moderadamente tóxico | Tóxico |
| Clasificación del riesgo según el reglamento 1907/2007/CE | Nocivo para los organismos acuáticos | Nocivo para los organismos acuáticos |
| Puntuación del peligro según el reglamento 1907/2007/CE | 3 | 3 |
*Letras minúsculas iguales en una misma columna según la prueba de Tukey indican que los promedios son estadísticamente igual (P > 0.05); (CL50) Concentración letal media; (NOEC) Concentración máxima hasta donde no se observan efectos negativos respecto al control; (LOEC) Concentración mínima donde se observan efectos negativos respecto al control; (Shapiro-Wilk) Valor de significancia para la prueba normalidad (P > 0.05); (Levene) Valor de significancia para la prueba de homogeneidad de varianzas (P > 0.05). / *Equal lowercase letters in the same column according to Tukey’s test indicate that the means are statistically equal (P > 0.05); (LC50) Median lethal concentration; (NOEC) Maximum concentration up to which no negative effects are observed with respect to the control; (LOEC) Minimum concentration where negative effects are observed with respect to the control; (Shapiro-Wilk) Significance value for the normality test (P > 0.05); (Levene) Significance value for the variance homogeneity test (P > 0.05).
Tabla 4 Toxicidad del detergente a base a Dodecilbencen Sulfonato de Sodio (SDBS) sobre Pseudonereis gallapagensis a 24 h, 48 h y 72 h de exposición en base a la CL50, NOEC y LOEC. / Table 4. Toxicity of the detergent based on Sodium Dodecylbenzene Sulfonate (SDBS) on Pseudonereis gallapagensis at 24 h, 48 h and 72 h of exposure based on LC50, NOEC and LOEC.
| Concentración del SDBS (mg·l-1) | 24h | 48h | 72h |
| 0 | 0a | 0a | 0a |
| 62.5 | 0a | 5a | 25b |
| 125 | 10ª | 20b | 55c |
| 250 | 30b | 45c | 75d |
| 500 | 40bc | 65d | 80d |
| 1 000 | 55c | 70d | 85d |
| CL50 | 744.45 | 384.38 | 102.48 |
| CL50 (límite de confianza inferior al 95 %) | 401.54 | 235.98 | 49.32 |
| CL50 (límite de confianza superior al 95 %) | 1 380.20 | 626.10 | 212.92 |
| NOEC | 125 | 62.5 | < 62.5 |
| LOEC | 250 | 125 | 62.5 |
| Shapiro - Wilk | 0.06 | 0.06 | 0.09 |
| Levene | 0.07 | 0.10 | 0.08 |
| Clasificación con base a las Unidades de Toxicidad (UT) | 0.13 | 0.26 | 0.97 |
| Clasificación según Norma Mexicana (2010) y de Uc-Peraza & Delgado-Blas (2012) | Ligeramente tóxico | Ligeramente tóxico | Ligeramente tóxico |
| Clasificación del riesgo según el reglamento 1907/2007/CE | No clasificable | No clasificable | No clasificable |
| Puntuación del peligro según el reglamento 1907/2007/CE | 4 | 4 | 4 |
*(ND) No determinado; letras minúsculas iguales en una misma columna según la prueba de Tukey indican que los promedios son estadísticamente igual (P > 0.05); (CL50) Concentración letal media; (NOEC) Concentración máxima hasta donde no se observan efectos negativos respecto al control; (LOEC) Concentración mínima donde se observan efectos negativos respecto al control; (Shapiro -Wilk) Valor de significancia para la prueba normalidad (P > 0.05); (Levene) Valor de significancia para la prueba de homogeneidad de varianzas (P > 0.05). / *(ND) Not determined; Equal lowercase letters in the same column according to Tukey’s test indicate that the means are statistically equal (P > 0.05); (LC50) Median lethal concentration; (NOEC) Maximum concentration up to which no negative effects are observed with respect to the control; (LOEC) Minimum concentration where negative effects are observed with respect to the control; (Shapiro-Wilk) Significance value for the normality test (P > 0.05); (Levene) Significance value for the variance homogeneity test (P > 0.05).
Discusión
Una de las sustancias xenobióticas que más afectan la calidad del agua son los detergentes (Kenconojati et al., 2020). En el Perú no se han realizado bioensayos de toxicidad con detergentes con las especies S. patagonicus y P. gallapagensis.
Semimytilus patagonicus a 48 h y 72 h de exposición en base a la CL50 a base del SDBS presentó valores entre 34.95 mg·L-1 a 61.98 mg·l-1. Se han realizado varios estudios de campo relacionados con esta familia Mytilidae, a la que pertenece S. patagonicus. Especies de la familia Mytilidae son ampliamente utilizadas como bioindicadoras en numerosos trabajos sobre los efectos de los xenobióticos en biomarcadores de estrés debido a su fisiología que es conocida (Swiacka et al., 2019). Otra ventaja de Mytilidae es su amplia distribución geográfica. Las especies pertenecientes a esta familia como S. patagonicus se pueden encontrar en las zonas costeras de casi todos los continentes y sus poblaciones locales suelen ser grandes y estables. Como resultado, los estudios que involucran a este grupo pueden llevarse a cabo en diferentes partes del mundo y pueden ser repetitivos (Swiacka et al., 2019). Otros estudios muestran que la familia Mytilidae, es muy usada para evaluar compuestos fenólicos de especial preocupación ambiental y para la salud humana utilizados en plásticos y productos para el hogar como bisfenol A (BPA), triclosán (TCS) y 4-nonilfenol (4-NP) (Tato et al., 2018). Al comparar los resultados de S. patagonicus con Iannacone y Alvariño (2002) se observó valores similares a la CL50 a 48 h de tres especies de caracoles dulceacuícolas, > 225 mg·l-1 para Melanoides tuberculata, 66.97 mg·l-1 para Physella venustula y 63.76 mgl-1 para Heleobia cumingii.
La literatura muestra pocas especies de poliquetos en la que se han realizado estudios ecotoxicológicos con detergentes como Sabellaria spinulosa, Ophryotrocha labronica y Capitella capitata (Fang et al., 2018; Reish, 1997). Para P. gallapagensis a 24 h, 48 h y 72 h de exposición se ha observado valores de CL50 entre 102.48 mg·l-1 a 744.45 mg·l-1. Uc-Peraza y Delgado-Blas (2008) estudió a Nereis oligohalina con dos marcas diferentes de detergentes, encontrando al detergente (Ariel) con un valor de CL50 a 48 h de 550 mg·l-1 y al detergente Foca® con 95 mg·l-1. Uc-Peraza y Delgado-Blas (2012) infomaron para Laeonereis culveri un valor de CL50 a 48 h de exposición para los detergentes Foca (fórmula: 59.56 mg·l-1; LAS: 12.88 mg·l-1) > Blanca Nieves® (fórmula: 70.79 mg·L-1; LAS: 13.03 mg·L-1) > Roma® (fórmula: 89.12 mg·l-1; LAS: 13.48 mg·l-1) > Puro-Sol® (fórmula: 91.83 mg·l-1; LAS: 14.12 mg·l-1). De la misma manera, Uc-Peraza y Delgado-Blas (2015) registraron valores de CL50 48 h para Capitella sp. con tres marcas de detergentes que son Roma (22.38 mg·l-1), Foca (15.48 mg·l-1) y Blanca nieves (19.05 mg.l-1). De esta manera que los valores de CL50 a 48 h de exposición para las especies registradas por los autores antes mencionados son más tóxicas en comparación a este estudio, por lo cual se infiere que N. oligohalina, L. culveri y Capitella sp., son sensibles a bajas concentraciones de los detergentes. P. gallapagensis mostró en general una menor sensibilidad en comparación a otras especies de poliquetos, siendo que en la presente investigación se usaron formas adultas, y lo más recomendado para los bioensayos son las formas larvales y más pequeñas (Reish, 1997).
La toxicidad de un surfactante en un detergente en estos dos organismos acuáticos marinos S. patagonicus y P. gallapagensis se ilustra mediante la interacción no específica entre el surfactante y la membrana celular. Esta interacción conduce a la alteración de la permeabilidad de la membrana celular de los dos invertebrados por lo que interrumpirá el funcionamiento de los órganos respiratorios. Además, el surfactante también causa daños graves en diversos órganos vitales, trastornos hematológicos, reproductivos, hormonales y enzimáticos (Kenconojati et al., 2020; Santos et al., 2019).
La prohibición total de los tensioactivos es imposible con el estilo de vida modernizado que necesita tensioactivos en nuestros alimentos, cosméticos, limpiadores, etc. Por ende, el problema de la toxicidad de los detergentes en los ambientes marinos debe abordarse con prudencia en cada país. El empleo inteligente y limitado de los tensioactivos en el nivel doméstico podría reducir el impacto de la contaminación por tensioactivos. El uso de diversas estrategias integradas como las físicas, químicas y de biorremediación podría ayudar a disminuir la toxicidad de los tensioactivos antes de su eliminación en el ambiente (Rebello et al., 2013). El uso de otras especies animales, vegetales o microbianas; así como ensayos de toxicidad crónica ayudarán a comprender el efecto de los detergentes en el ecosistema acuático (Charchar et al., 2017).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


