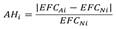Introducción
El régimen natural de flujo de agua y sedimentos es uno de los factores más importantes para la toma de decisiones en la gestión integrada de ecosistemas dulceacuícolas, ya que influye en la distribución y abundancia de especies y regula la integridad ecológica en los sistemas fluviales al condicionar características fisicoquímicas como la temperatura del agua y la geomorfología del cauce y las riberas, que en consecuencia modifica la diversidad de hábitats (Poff et al., 1997; Wohl et al., 2015). Por ello, es ampliamente aceptado que el régimen natural de caudales, considerando sus atributos de magnitud, frecuencia de ocurrencia, duración, estacionalidad y tasa de cambio, es el principal determinante en la estructura y funcionamiento del sistema fluvial (Merrit et al., 2010). Algunas de las principales alteraciones significativas del régimen natural de flujo de agua y sedimentos son: por un lado, la fragmentación de la red de drenaje por la construcción de presas, al introducir barreras artificiales que rompen la continuidad del flujo de agua, sedimentos y nutrientes (Fitzgerald et al., 2018; Ward et al., 2002); por otro, la regulación de dichos flujos por la generación de embalses y las reglas de operación asociados a su explotación (Costa et al., 2012). Lo anterior tiene, entre otras consecuencias negativas, la imposibilidad de cerrar el ciclo biológico en el caso de especies migratorias, cambios en las redes alimentarias, el flujo de nutrientes, calidad del agua, y los regímenes térmicos (O'Mara et al., 2021), así como el patrón de variabilidad interanual e intra-estacional de los caudales (Tranmer et al., 2018).
A nivel global la proporción de ríos libres está declinando rápidamente (Poff, 2019), siendo los ríos tropicales los principales afectados por su fragmentación y regulación (Aguirre et al., 2021; Anderson et al., 2018). Alrededor del 48 % de los grandes ríos del mundo están regulados (Schneider & Petrin, 2017), cifra que podría aumentar al 93 % en el 2030 (Buddendorf et al., 2017), situación que afectaría considerablemente el funcionamiento ecológico y la biodiversidad de ríos, humedales, llanuras de inundación y estuarios de todo el mundo (Poff, 2019; Schinegger et al., 2012; Tockner et al., 2010).
Actualmente, la conservación de los recursos en ríos regulados depende cada vez más de la manera como éstos son gestionados para restaurar y proteger el funcionamiento ecológico del ecosistema acuático (Angarita & Delgado, 2016; Angarita et al., 2018) e incluso los sistemas acuáticos en muchas ocasiones son protegidos indirectamente, ya que los planes de conservación generalmente son elaborados para organismos terrestres y los cuerpos de agua terminan siendo los límites políticos de estas áreas. Por otra parte, si bien desde el ámbito científico se ha avanzado en el conocimiento de los efectos de las represas sobre los ecosistemas acuáticos, hay lugares en el mundo donde el poco o deficiente conocimiento sobre la biodiversidad se convierte en un reto para una adecuada toma de decisiones (Harper et al., 2021), como es el caso del neotrópico, donde convergen dichos factores: los ríos son los principales focos de expansión de hidroeléctricas y albergan los más altos grados de biodiversidad, pero a su vez hay poca información sobre los efectos de este tipo de alteraciones en el régimen natural del caudal y los ecosistemas acuáticos.
En Colombia, existen algunos estudios que evidencian los efectos de la operación de los embalses en la macrocuenca Magdalena-Cauca. Por ejemplo, Carvajal-Quintero (2017) encontraron, entre otros aspectos, que las especies endémicas de peces dulceacuícolas están en mayor riesgo de extinción que las no-endémicas. Así mismo, Angarita et al. (2018) resaltan que las represas han producido alteraciones significativas de múltiples procesos vitales para la salud de las llanuras inundables de la parte baja de la macrocuenca del Magdalena-Cauca, en particular con la pérdida de conectividad se modifican y/o afectan los procesos de migración de especies potamodromas (56 %) y un decrecimiento en el transporte de sedimentos (39 %). Por otra parte, Martínez-Toro et al. (2021) realizaron un estudio de peces en áreas altoandinas modificadas cuyos resultados mostraron que la riqueza de especies fue mayor en los ríos, mientras que en el embalse dominaron las especies no nativas.
En relación con la región altoandina de Colombia, los embalses se han construido para múltiples propósitos (e.g. control de inundaciones, riego, suministro de agua, generación de energía hidroeléctrica), pero el conocimiento de la influencia de éstos sobre la alteración de caudales y su impacto en las comunidades hidrobiológicas es insuficiente (Martinez-Toro et al., 2021). Dicho desconocimiento es una limitación importante para la formulación de estrategias de conservación de las especies piscícolas endémicas, teniendo en cuenta que la mayoría de los ríos altoandinos presentan un avanzado proceso de deterioro ambiental a causa de la contaminación, pérdida de conectividad, degradación de hábitats e introducción de especies (Restrepo et al., 2015). Dado este escenario, se requieren investigaciones que provean información para apoyar la toma de decisiones dirigidas a la gestión sostenible de la biodiversidad acuática altoandina, particularmente de especies endémicas, por su importancia a nivel económico, histórico y cultural (Ministerio de Ambiente y Desarrollo Sostenible, 2017; Mojica et al., 2012).
Este estudio representa un avance en el conocimiento de la afectación de los embalses a los ecosistemas dulceacuícolas en la región altoandina, y en particular, aborda las afectaciones de la pérdida de conectividad sobre las especies de peces de estos ecosistemas, partiendo de un caso de estudio en Colombia. Por lo tanto, se tienen como objetivos: i) evaluar la alteración en el régimen natural de flujo del río Neusa (macrocuenca del Magdalena-Cauca) por efecto de la presa y su embalse; y ii) comparar la abundancia, longitud total y peso de la ictiofauna nativa e introducida en dos segmentos del río Neusa, uno en régimen natural y otro en régimen alterado. Los resultados de este estudio son novedosos considerando el tipo de hábitat (sistemas lóticos altoandinos) y las especies analizadas, respecto de las posibles alteraciones producidas por un embalse construido en los años 50 del siglo pasado.
Materiales y métodos
Área de estudio: El Neusa es un río altoandino y forma parte de la cabecera de la Subzona Hidrográfica (SZH) “Río Bogotá'', perteneciente a la Zona Hidrográfica (ZH) “Alto Magdalena'' y a su vez al Área Hidrográfica (AH) o macrocuenca del “Magdalena-Cauca'' (Instituto de Hidrología, Meteorología y Estudios Ambientales, 2013); su cuenca hidrográfica es alimentada por los ríos Cubillos (río Salitre y Guandoque) y el río Checua. La cuenca tiene un área de drenaje de 433.6 km2 y su cauce principal cuenta con una longitud aproximada de 40.38 km (Corporación Autónoma Regional de Cundinamarca, 2019). En la parte alta se encuentra el embalse del Neusa, construido a mediados del siglo XX y cuya funcionalidad es la de prevenir inundaciones en la “Sabana de Bogotá'', regulando los caudales para el abastecimiento de agua de los municipios de Cogua y Zipaquirá (Fig. 1), la distancia del nacimiento del río Neusa al embalse es de 13.32 km. En su zona noroccidental, la cuenca del río Neusa presenta valores medios anuales de precipitación que fluctúan de 1 200 a 1 300 mm y, en su parte baja tiene valores medios anuales entre 400 y 500 mm (Corporación Autónoma Regional de Cundinamarca, 2019). En la cuenca, la temperatura media es de aproximadamente 10 °C y la distribución temporal de los caudales es al igual que la de la precipitación, de tipo bimodal (Corporación Autónoma Regional de Cundinamarca, 2019).
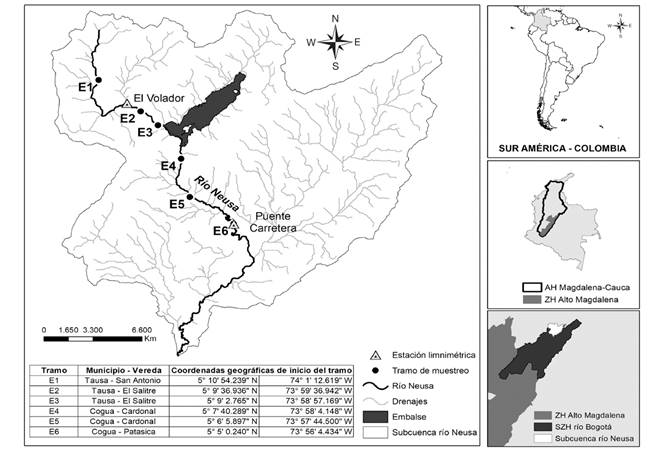
Fig. 1 Cuenca del río Neusa en Colombia, con detalle de los seis (6) tramos de muestreo. / Fig. 1. Neusa River basin in Colombia, with detail of the six (6) sampling stations.
Selección de segmentos: Para evaluar la alteración en el régimen natural de flujo por efecto de la represa y su embalse, se establecieron dos segmentos de estudio, uno por cada condición del régimen del río (Fig. 1). El segmento uno está ubicado aguas arriba del embalse a una distancia de 8.85 km a 3 263 m.s.n.m, y es el asumido como representativo del régimen natural del río Neusa; el segmento dos, localizado aguas abajo del embalse a una distancia de 10.64 km a 2 574 m.s.n.m., presenta un régimen de caudales alterado por efecto de la regulación del embalse (Fig. 1).
Análisis de la alteración en el régimen natural de flujo: En este estudio, se utilizó el método de Indicadores de Alteración Hidrológica (IHA, por sus siglas en inglés) de Richter et al. (1996) para evaluar el grado de cambios inducidos en el régimen natural de flujo. El IHA se ha utilizado ampliamente para definir cuantitativamente el comportamiento del régimen hidrológico de un río y para evaluar los efectos eco-hidrológicos de la alteración del régimen de caudales por actividades antrópicas, principalmente las asociadas a represas (e.g. Butchart-Kuhlmann et al., 2018).
El IHA incluye 34 parámetros para caracterizar los atributos estadísticos de los principales componentes del régimen de flujo que son relevantes desde el punto de vista del funcionamiento ecosistémico (e.g. magnitud, frecuencia de ocurrencia, duración, estacionalidad y tasa de cambio) (Mathews & Richter, 2007). El total de parámetros está agrupado en cinco componentes ambientales del flujo (EFC, por su sigla en inglés): caudales extremadamente bajos (caudales igual o menor al percentil 10 de los caudales bajos diarios); caudales bajos (caudales iguales o menores al percentil 50 de los caudales diarios);pulsos de caudal alto (caudales superiores al percentil 75 de los caudales diarios); pequeñas crecidas (caudal con período de retorno de 2 años; grandes crecidas (caudal con período de retorno de 10 años).
Las EFC deben mantenerse a lo largo del año para que se conserve la integridad ecológica del sistema fluvial (The Nature Conservancy, 2009). Dicho enfoque de EFC, permite identificar el grado de alteración hidrológica del régimen de flujo en un mismo segmento, tramo o sitio de observación en diferentes temporalidades, o establecer el grado de alteración entre segmentos y con ello avanzar hacia el establecimiento de unos requerimientos de caudal ambiental para conservar o restaurar especies de especial interés.
En este trabajo las EFC fueron empleadas para comparar un segmento del río Neusa en régimen natural de caudales y otro en régimen alterado, utilizando para ello una serie hidrológica de caudales diarios de 20 años (desde 1997 hasta el 2017) de la red de monitoreo hidrometeorológico de la Corporación Autónoma Regional de Cundinamarca - CAR. Los parámetros de las EFC se calcularon utilizando el programa Indicators of Hydrologic Alteration en su versión 7.1 (para conocer más información del método utilizado por el IHA, consultar The Nature Conservancy, 2009). El régimen hidrológico natural del segmento uno se determinó con base en la serie de caudales diarios registrados en la estación limnimétrica El Volador, la cual se encuentra aguas arriba del embalse El Neusa (Fig. 1). Por otro lado, el régimen alterado por efecto de la regulación impuesta por el embalse en el segmento dos, se determinó con la información hidrométrica diaria de la estación limnimétrica Puente Carretera (Fig. 1).
Las áreas drenantes de las estaciones El Volador y Puente Carretera difieren en 114. 26 km2, ya que la primera tiene 65.18 km2 y la segunda 179.44 km2, lo cual implica que el orden de magnitud de los caudales en el segmento alterado depende no solo del efecto regulador del embalse sino del área de cuenca aportante. Por lo cual, se hace necesario transformar los valores de caudal en ambos segmentos para eliminar su dependencia respecto a las unidades de medida y así ser comparables. De tal modo que, la transformación aplicada a cada parámetro de magnitud de caudal corresponde a la división entre el valor del parámetro y la mediana multianual del caudal diario en cada segmento. Finalmente, el grado de alteración hidrológica (AH) para cada uno de los 34 parámetros EFC se calculó a través de la siguiente expresión (Souter, 2017):
Donde, AH i es el grado de alteración hidrológica del parámetro EFC i del régimen alterado con relación al régimen natural, para i = 1,2,…34.
Monitoreo y caracterización de la ictiofauna: Se establecieron seis tramos de muestreo de monitoreo hidrobiológico, tres por cada condición hidrológica: natural y alterada (Fig. 1). Cada tramo correspondía a 100 m de extensión. Todos los tramos fueron muestreados cada dos meses entre el 2017 y 2019, abarcando tres periodos climáticos diferentes (lluvia, estiaje y transición). Cada tramo de estudio fue aislado usando redes de bloqueo con la finalidad de realizar una aproximación a una población cerrada (Alexiades & Encalada, 2017; Ortega et al., 2014). Una vez aislado, se utilizó un equipo de pesca eléctrica portátil con múltiples pasadas (Alexiades & Encalada, 2017). Se utilizó pesca eléctrica por ser un método poco selectivo y apropiado para el muestreo de la ictiofauna de sistemas lóticos altoandinos (Alexiades & Encalada, 2017).
A cada ejemplar capturado se le tomaron medidas de peso y longitud total; se registró la abundancia por especie y finalmente todos los individuos fueron liberados. Previo a la manipulación, todos los ejemplares fueron sedados con una solución de eugenol a una concentración entre el 5 y 10 %; se utilizaron claves especializadas para la identificación en campo hasta nivel de especie (Maldonado-Ocampo et al., 2005). No se depositaron ejemplares testigo por tratarse en su mayoría de especies amenazadas. La recolectas estuvieron amparadas por el permiso marco de recolección de especímenes de especies silvestres de la diversidad biológica con fines de investigación científica no comercial otorgado por la Corporación Autónoma Regional de Cundinamarca, Resolución 0919 del 2017.
Para determinar si había diferencia en la abundancia, longitud total y peso de la ictiofauna se realizaron una serie de pruebas t de Student con los datos previamente transformados con raíz cuadrada. Se utilizó raíz cuadrada para normalizar los datos, sumado a que de esta manera la abundancia reflejar mejor el papel de cada especie en el ecosistema que los datos sin transformar (Legendre & Legendre, 2012). Para explorar la variación de la abundancia por especie de acuerdo a la condición hidrológica (alterada, natural) y a los periodos climáticos (lluvia, estiaje, transición), se construyó una matriz donde cada celda representaba la sumatoria de la abundancia de cada especie por condición hidrológica (alterada, natural) y periodo climático (lluvia, estiaje, transición). Esta matriz se trató con la transformación de Hellinger (Legendre & Gallagher, 2001) y finalmente se realizó un análisis de componentes principales (PCA, por su sigla en inglés) utilizando el paquete vegan (Oksanen et al., 2007). Para identificar los componentes principales adecuados para la interpretación de la ordenación, se utilizó el modelo broken-stick (MacArthur, 1957). Todos los análisis se desarrollaron en el programa R (R Core Development Team, 2020).
Resultados
Caudales bajos mensuales: En los meses de enero, febrero, marzo, abril y junio la mediana mensual de los caudales diarios en régimen natural fue mayor que los caudales del segmento en régimen alterado (Tabla 1, Fig. 2). Las mayores diferencias se observaron en los meses de febrero y marzo.
Tabla 1 Componentes ambientales del flujo (EFC) para para los segmentos del río Neusa en régimen natural (NAT) y alterado (ALT). / Table 1. Environmental flow components (EFC) for the segments of the Neusa river in the natural (NAT) and altered (ALT) regime.
| EFC | Grupo de EFC / Parámetro hidrológico | Unidad | EFC NAT | EFC ALT | EFC-NAT transformado | EFC-ALT transformado | Grado de Alteración Hidrológica |
| Grupo 1. Caudales bajos mensuales | |||||||
| Octubre | m3s/d | 0.47 | 0.62 | 31.9 | 44.5 | 0.39 | |
| Noviembre | m3s/d | 0.61 | 0.79 | 12.3 | 29.3 | 1.38 | |
| Diciembre | m3s/d | 0.51 | 0.62 | 26.5 | 44.5 | 0.68 | |
| Enero | m3s/d | 0.37 | 0.64 | 46.1 | 43.3 | 0.06 | |
| Febrero | m3s/d | 0.32 | 1.03 | 53.6 | 8.0 | 0.85 | |
| Marzo | m3s/d | 0.36 | 1.10 | 48.2 | 1.9 | 0.96 | |
| Abril | m3s/d | 0.44 | 0.85 | 36.3 | 23.9 | 0.34 | |
| Mayo | m3s/d | 0.60 | 0.64 | 13.2 | 43.0 | 2.26 | |
| Junio | m3s/d | 0.46 | 0.82 | 33.9 | 27.4 | 0.19 | |
| Julio | m3s/d | 0.56 | 0.68 | 18.7 | 39.2 | 1.10 | |
| Agosto | m3s/d | 0.47 | 0.68 | 31.9 | 39.2 | 0.23 | |
| Septiembre | m3s/d | 0.55 | 0.81 | 21.5 | 27.8 | 0.29 | |
| Grupo 2. Caudales extremadamente bajos | |||||||
| Pico de caudal extremamente bajo | m3s/d | 0.11 | 0.14 | 83.8 | 87.1 | 0.04 | |
| Duración extremadamente baja | días | 4 | 7 | - | - | 0.75 | |
| Tiempo de ocurrencia del caudal bajo extremo | dato Juliano | 91 | 232 | - | - | 1.55 | |
| Frecuencia extremadamente baja | ocurrencia /año | 2.00 | 2.50 | - | - | 0.25 | |
| Grupo 3. Pulsos de caudal alto | - | ||||||
| Picos de caudal alto | m3s/d | 1.30 | 2.02 | 86.8 | 79.7 | 0.08 | |
| Duración de caudal alto | días | 3.00 | 3.00 | - | - | 0.00 | |
| Tiempo de ocurrencia del caudal alto | dato Juliano | 194 | 136 | - | - | 0.3 | |
| Frecuencia de caudales altos | ocurrencia/año | 12.00 | 5.00 | - | - | 0.58 | |
| Tasa alta de crecimiento de caudales | m3s/d | 0.58 | 0.43 | 16.2 | 62 | 2.83 | |
| Tasa alta decrecimiento de caudal | m3s/d | -0.32 | -0.25 | 145.4 | 122 | 0.16 | |
| Grupo 4. Crecidas pequeñas | - | ||||||
| Pico de pequeñas crecidas | m3s/d | 7.81 | 5.16 | 1024 | 359 | 0.65 | |
| Duración de pequeñas crecidas | días | 24.0 | 14 | - | - | 0.42 | |
| Tiempo de ocurrencia de pequeñas crecidas | dato Juliano | 320 | 151 | - | - | 0.53 | |
| Frecuencia de pequeñas crecidas | ocurrencia/año | 1 | 1 | - | - | 0.00 | |
| Tasas de crecimiento | m3s/d | 2.38 | 0.42 | 243 | 63 | 0.74 | |
| Tasas de decrecimiento | m3s/d | -0.60 | -0.70 | 187 | 162 | 0.13 | |
| Grupo 5. Grandes crecidas | - | ||||||
| Pico de caudal de grandes Crecidas | m3s/d | 14.17 | 7.84 | 1 940.8 | 598.1 | 0.69 | |
| Duración grandes Crecidas | días | 40.00 | 7 | - | - | 0.83 | |
| Tiempo de ocurrencia de grandes crecidas | dato Juliano | 85 | 229 | - | - | 1.69 | |
| Frecuencia de grandes crecidas | ocurrencia/año | 0.2 | 0.1 | - | - | 0.90 | |
| Tasas de crecimiento | m3s/d | 1.19 | 6.75 | 71.7 | 501.1 | 5.99 | |
| Tasas de decrecimiento | m3s/d | -0.72 | -3.59 | 203 | 419.4 | 1.07 | |
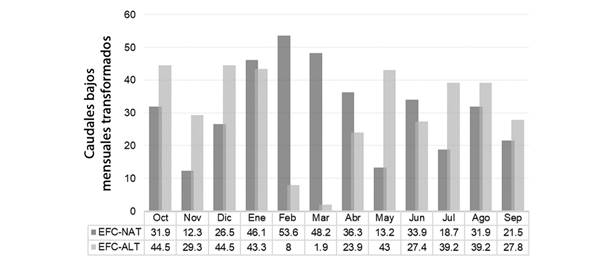
Fig. 2 Caudales bajos mensuales transformados en condiciones natural y alterada. / Fig. 2. Transformed monthly low flows in natural and altered conditions.
Caudales extremadamente bajos: La mediana del caudal pico extremamente bajos fue menor en el segmento en régimen natural en comparación de la condición alterada (Tabla 1), es decir, que, en la condición en régimen natural, hubo períodos más largos sin caudales extremadamente bajos que en el segmento con alteración hidrológica (Fig. 3A). En la condición alterada, la mediana del tiempo de ocurrencia del caudal bajo extremo se desplazó al segundo semestre del año, es decir al día juliano 232, mientras que, en el segmento en régimen natural, dicho indicador se ubicó en el primer semestre del año, es decir en el día juliano 91, lo cual evidencia la alteración del régimen natural. La frecuencia de caudales extremadamente bajos aumentó en un 25 % en el segmento en condición alterada con relación al segmento en régimen natural de caudales (Fig. 3A).
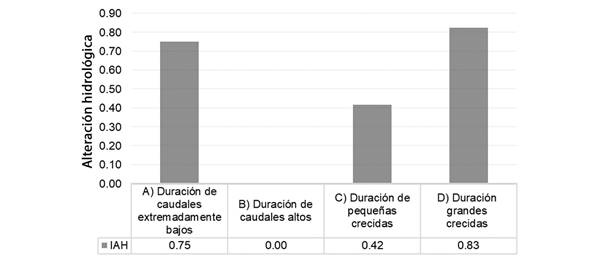
Fig. 3 Alteración hidrológica en relación con la duración de A. caudales extremadamente bajos, B. pulsos de flujo alto, C. pequeñas crecidas y D. grandes crecidas. / Fig. 3. Hydrological alteration regarding the duration of A. extremely low flows, B. high flow pulses, C. small floods, and D. large floods.
Pulsos de caudal alto: La magnitud de los picos de caudal alto en el segmento del río en condición natural y alterada fue similar en términos de magnitudes absolutas, sin embargo, los valores transformados y el grado de alteración hidrológica muestran una disminución en el segmento de régimen hidrológico alterado (Tabla 1); por su parte, la duración de caudal alto fue igual para las dos condiciones (Tabla 1). La mediana del tiempo de ocurrencia del pico de caudal alto se redujo en 58 días para la condición regulada, en contraste con dicha ocurrencia para la condición hidrológica del segmento en régimen natural, ya que pasó de una ocurrencia media en el día juliano 194 al día juliano 134. La frecuencia de caudales altos se redujo en un 58 % en la condición regulada con respecto a la natural, ya que pasó de 12 a 5 ocurrencias por año (Tabla 1, Fig. 4B). La diferencia de la tasa de cambio de pulsos de caudal alto es menor en condición alterada que en condición natural tanto para los cambios ascendentes como descendentes.
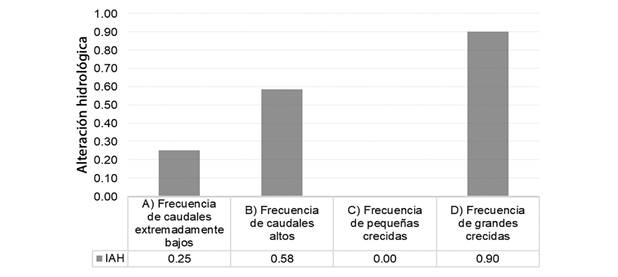
Fig. 4 Comparación del grado de alteración hidrológica del segmento en condición alterada con el segmento natural en términos de la frecuencia de A. flujos extremadamente bajos, B. pulsos de flujo alto, C. pequeñas crecidas y D. grandes crecidas. / Fig. 4. Comparison of hydrological alteration degree of the regulated condition segment with the natural segment in terms of the frequency of A. extremely low flows, B. high flow pulses, C. small floods and D. large floods.
Pequeñas y grandes crecidas: La mediana de los picos de pequeñas y grandes crecidas fue mayor para régimen natural que para régimen alterado. Para los picos de pequeñas crecidas, en el segmento con régimen natural fue de 7.81 m3s/d frente a 5.16 m3s/d en el segmento en régimen regulado (Tabla 1). Para los picos de grandes crecidas, tal diferencia fue más notable con valores de 14.17 y 7.84 m3s/d, respectivamente (Tabla 1). De igual forma, la duración de pequeñas y grandes crecidas fue menor en condiciones reguladas que la observada en el segmento en régimen natural de la siguiente manera: 24 días en régimen natural frente a 14 días en régimen alterado en pequeñas crecidas (Fig. 3C), 40 días en régimen natural frente a 7 días en régimen alterado, para el caso de grandes crecidas (Fig. 3D).
Hubo una gran diferencia en el tiempo de ocurrencia de pequeñas crecidas para los dos segmentos. En la condición alterada, las crecidas pequeñas iniciaron 169 días antes de que se dieran en el segmento en condición natural, mientras que las grandes crecidas comenzaron 144 días después de haberse presentado en la condición natural (Tabla 1). En las condición regulada y natural el promedio de recurrencia de una pequeña inundación es de una cada año (Tabla 1, Fig. 4C). Respecto a la frecuencia de grandes crecidas, el promedio de recurrencia de una gran inundación para el segmento en condición natural es de una cada 5 años, y para la condición alterada el promedio de recurrencia es de una gran inundación cada 10 años (Tabla 1, Fig. 4D). La tasa de crecimiento de pequeñas crecidas en las condiciones naturales fue considerablemente mayor (2.38 m3s/d) respecto a la condición del segmento alterado (0.42 m3s/d); en las grandes crecidas, la tasa de crecimiento fue mucho mayor en la condición natural que la alterada (Tabla 1).
La diferencia de la tasa de decrecimiento de pequeñas crecidas para las dos condiciones fue relativamente baja (-0.60 m3s/d en régimen natural frente a -0.70 m3s/d en régimen alterado), mientras que para grandes crecidas dicha tasa fue muy superior para la condición alterada (-3.59 m3s/d) en comparación con el segmento en régimen natural (-0.72 m3s/d).
Ictiofauna: Se registraron 729 individuos de cinco especies pertenecientes a cuatro órdenes y cuatro familias; tres especies fueron nativas, la guapucha (Grundulus bogotensis), el capitán de la sabana (Eremophilus mutisii), y el capitanejo o capitán enano (Trichomycterus bogotense), y dos introducidas, trucha arcoíris (Oncorhynchus mykiss) y la carpa común (Cyprinus carpio) (Tabla 2). Grundulus bogotensis fue la especie más abundante con 438 individuos (60.1 %), seguida por O. mykiss (165; 22.6 %), T. bogotense (94; 12.9 %), E. mutisii (31; 4.2 %) y C. carpio (1; < 1 %) (Tabla 2).
Tabla 2 Abundancia de cada especie por tramo de muestreo. Table 2. Abundance of each species by sampling station.
| Especie | Abundancia | TOTAL | |||||
| NAT (T1) | NAT (T2) | NAT (T3) | ALT (T4) | ALT (T5) | ALT (T6) | ||
| Grundulus bogotensis | 0 | 0 | 307 | 1 | 38 | 92 | 438 |
| Eremophilus mutisii | 1 | 1 | 0 | 0 | 1 | 28 | 31 |
| Trichomycterus bogotense | 4 | 25 | 8 | 0 | 55 | 2 | 94 |
| Oncorhynchus mykiss | 35 | 66 | 36 | 7 | 19 | 2 | 165 |
| Cyprinus carpio | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| TOTAL | 40 | 92 | 351 | 8 | 114 | 124 | 729 |
NAT: condición hidrológica natural; ALT: condición hidrológica alterada; T: tramo de muestreo. / NAT: natural hydrological condition; ALT: altered hydrological condition; T: sampling station.
Trichomycterus bogotense presentó una menor longitud y menor peso en la condición hidrológica alterada que en la natural (P < 0.05); sin embargo, no hubo diferencias estadísticamente significativas en términos de abundancia (Tabla 3, Fig. 5D, Fig. 5E, Fig. 5F). Por su lado, O. mykiss exhibió una menor abundancia, menor longitud y menor peso en la condición hidrológica alterada que en la natural (P < 0.05; Tabla 3 y Fig. 5J, Fig. 5K, Fig. 5L). Tanto G. bogotensis como E. mutisii no presentaron diferencias estadísticamente significativas en términos de abundancia, longitud y peso entre ambas condiciones (P > 0.05; Tabla 3, Fig. 5A, Fig. 5B, Fig. 5C, Fig. 5G, Fig. 5H, Fig. 5I, respectivamente). Sin embargo, al observar los tramos individualmente, la abundancia de G. bogotensis fue elevada en el tramo 3 (N = 307; i.e., la estación sin intervención más cercana al Embalse), para posteriormente disminuir en el tramo 4 y finalmente aumentar progresivamente en los tramos 5 y 6 (Tabla 2).
Tabla 3 Valores promedio de abundancia, longitud total y peso para las especies de peces del río Neusa. Table 3. Abundance, total length and weight mean values for the Neusa river fish species.
| Especie | Abundancia (individuos) | Longitud total (cm) | Peso (g) | ||||||||||||||
| NAT | ALT | P | NAT | ALT | P | NAT | ALT | P | |||||||||
| Promedio | Desviación estándar | Promedio | Desviación estándar | Promedio | Desviación estándar | Promedio | Desviación estándar | Promedio | Desviación estándar | Promedio | Desviación estándar | ||||||
| Grundulus bogotensis | 102.33 | 177.25 | 43.67 | 45.76 | 0.971 | 6.54 | 0.54 | 6.58 | 1.23 | 0.910 | 4.70 | 1.40 | 5.41 | 2.79 | 0.096 | ||
| Eremophilus mutisii | 0.67 | 11.15 | 9.67 | 31.19 | 0.473 | 13.70 | 1.84 | 13.18 | 5.54 | 0.530 | 25.00 | 11.31 | 28.69 | 28.10 | 0.802 | ||
| Trichomycterus bogotense | 12.33 | 0.58 | 19.00 | 15.89 | 0.902 | 8.72 | 4.51 | 6.09 | 1.61 | 0.012 | 10.39 | 10.16 | 2.67 | 1.84 | 0.000 | ||
| Oncorhynchus mykiss | 45.67 | 17.62 | 9.33 | 8.74 | 0.027 | 11.21 | 5.33 | 7.60 | 4.81 | 0.001 | 24.41 | 28.31 | 12.31 | 28.57 | 0.003 | ||
NAT: condición hidrológica natural; ALT: condición hidrológica alterada. En negrita los valores de P < 0.05 para las pruebas de t de Student. / NAT: natural hydrological condition; ALT: altered hydrological condition. In bold the values of P < 0.05 for the Student's t-tests.
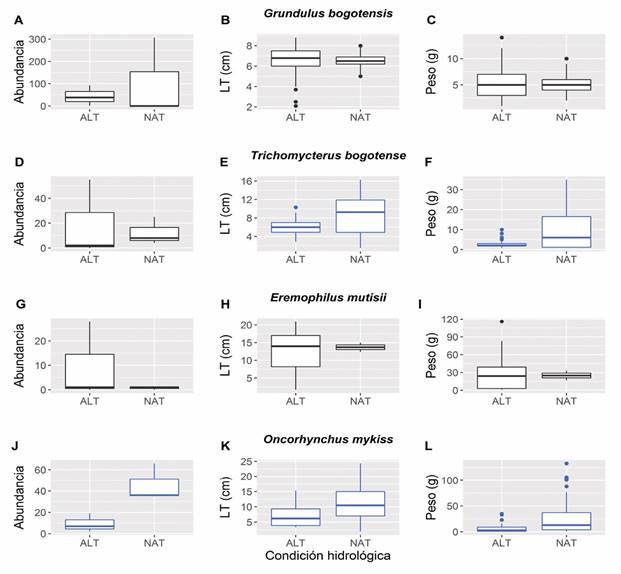
Fig. 5 Diagramas de cajas representando la abundancia, longitud total (LT) y peso de la guapucha, Grundulus bogotensis (A. B. y C.), el capitanejo o capitán enano, Trichomycterus bogotense (D. E. y F.), el capitán de la sabana, Eremophilus mutisii (G. H. e I.), y de la trucha arcoíris, Oncorhynchus mykiss (J. K. y L.) en las dos condiciones hidrológicas, alterada (ALT) y natural (NAT). En azul los diagramas que presentaron diferencias estadísticamente significativas (ver Tabla 3). / Fig. 5. Box plots representing abundance, total length (TL), and weight of Grundulus bogotensis (A. B. and C.), Trichomycterus bogotense (D. E. and F.), Eremophilus mutisii (G. H. and I.), and Oncorhynchus mykiss (J. K. and L.) in both hydrological conditions, altered (ALT) and natural (NAT). In blue the diagrams that presented statistically significant differences (see Table 3).
El análisis de componentes principales permitió explorar las relaciones existentes entre la condición hidrológica, los periódicos climáticos y la abundancia de especies, explicando en sus dos primeros componentes el 94 % de la variación (Fig. 6). En particular, el 84.3 % de la variación en la abundancia se relacionó fundamentalmente con la condición hidrológica, sugiriendo que, a pesar de existir cierta influencia de los periodos climáticos sobre las abundancias, en general esta relación sería débil en la escala temporal evaluada (Fig. 6). Así, independientemente del periodo climático, existe cierta afinidad de la trucha arcoíris (O. mykiss) y de la guapucha (G. bogotensis) por sistemas no alterados en su régimen hidrológico; mientras que, el capitán de la sabana (E. mutisii) y el capitanejo (T. bogotense) fueron más abundantes en condiciones alteradas (Fig. 6). No se interpretaron los componentes principales restantes (i.e., PC2, PC3 y PC4), ya que el modelo broken-stick seleccionó únicamente el PC1 para interpretación.
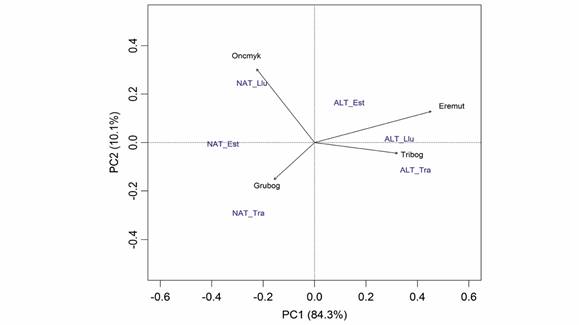
Fig. 6 Análisis de componentes principales a partir de los datos de abundancia de las especies de acuerdo con la condición hidrológica y los periodos climáticos. NAT: condición hidrológica natural; ALT: condición hidrológica alterada; Llu: temporada de lluvia; Est: temporada de estiaje; Tra: periodo de transición. Oncmyk = O. mykiss, Grubog = G. bogotensis, Eremut = E. mutisii, Tribog: T. bogotense. / Fig. 6. Principal components analysis from the abundance data of the species according to the hydrological condition and the climatic periods. NAT: natural hydrological condition; ALT: altered hydrological condition; Llu: rainy season; Est: dry season; Tra: transition period. Oncmyk = O. mykiss, Grubog = G. bogotensis, Eremut = E. mutisii, Tribog: T. bogotense.
Discusión
La magnitud de los cambios en los componentes ambientales del régimen hidrológico del río Neusa sugiere que el embalse produce un cambio ecológico profundo en el ambiente acuático. Por ejemplo, el impacto de la extracción del agua es evidente en el segmento alterado hidrológicamente, lo cual se observa en la disminución de la frecuencia, magnitud y duración de pequeñas y grandes crecidas, mientras que aumentan la frecuencia, magnitud y duración de los caudales extremadamente bajos, generando un régimen hidrológico que difiere significativamente de la condición natural (ver grupos 4 y 5 frente a grupo 2 en la Tabla 1). Así mismo, una porción de la ictiofauna del río Neusa presentó diferencias en términos de abundancia, tamaño y peso entre ambas condiciones hidrológicas. Por ejemplo, T. bogotense, una especie endémica de Colombia, exhibió menor longitud y peso en la condición de flujo alterado; asimismo, la trucha arcoíris (O. mykiss), una especie introducida, presentó menor abundancia, longitud y peso en dicha condición. Las especies nativas E. mutisii y G. bogotensis no presentaron diferencias estadísticamente significativas en los valores para estas variables. En general, no hubo variación temporal en la abundancia de la ictiofauna.
La regulación se refleja claramente en un aumento de la magnitud de los caudales mínimos mensuales en contraste con el régimen natural de caudales para el mes más seco y los subsiguientes meses de octubre, noviembre, diciembre, mayo, julio y agosto; justo antes del inicio de la temporada de lluvias mientras que en los meses de febrero y marzo se evidencia una reducción en la magnitud del caudal mínimo mensual para el régimen alterado en contraste con el régimen natural. Lo anterior genera una inversión del hidrograma para satisfacer la demanda hídrica agrícola en época de estiaje (Tabla 1, Fig. 2).
Como se esperaba, en la condición hidrológica alterada hubo períodos más largos de caudales extremadamente bajos en comparación con la condición natural; y lo mismo ocurrió con la frecuencia, que presentó un aumento del 25 % de caudales extremadamente bajos. Dichos caudales bajos mensuales pueden disminuir la disponibilidad de hábitats para la ictiofauna, debido a la reducción en la profundidad y ancho promedio del cauce del río Neusa, así como a la reducción de la superficie de lecho inundado (Chaparro et al., 2018). Al respecto, Rolls y Bond (2017) afirman que entornos con caudales extremadamente bajos afectan la producción de alimento y los eventos de desove de las especies de peces, lo que lleva a la disminución en la abundancia o inclusive a la extinción local de especies.
En la condición alterada la magnitud y la frecuencia de los caudales altos se redujo considerablemente con respecto a la condición natural, debido al control de crecidas que ejerce el embalse del Neusa durante la temporada de lluvias (Tabla 1, Fig. 4B). Igualmente, en la condición alterada disminuyó la magnitud, frecuencia y duración de las pequeñas y grandes crecidas, efectos característicos de la regulación de caudales por los embalses (Rolls & Bond, 2017). Al respecto, se ha demostrado que los pulsos de caudales altos son determinantes para el mantenimiento del hábitat físico de las comunidades acuáticas (Magilligan & Nislow, 2005), ya que crean y mantienen los hábitats del cauce y de la llanura de inundación (Bond et al., 2015), incluidos los remansos y rápidos necesarios para el ciclo de vida de los peces (Olaya-Marín et al., 2015).
Igualmente, se espera que la disminución significativa de la ocurrencia de pulsos altos en la condición alterada del río Neusa conduzca a un aumento de los flujos mínimos aguas abajo del embalse (Lu et al., 2018), afectando la composición biótica y el hábitat físico requerido por los peces (Hu et al., 2008). Por lo tanto, es posible que las diferencias en la abundancia de la trucha arcoíris (O. mykiss) estén dadas por la alteración de las variables hidrológicas aguas abajo de la represa, ya que modificaciones en la sincronización de las pequeñas y grandes crecidas provocan la pérdida de señales para el desove y la migración de los peces, así como la conectividad entre el cauce y su llanura de inundación, lo que impide el intercambio de materia, energía y organismos entre las planicies de inundación y los sistemas fluviales, reduciendo el área de desove y el reclutamiento de peces (Hu et al., 2008; Vazzoler, 1996).
Tanto el capitanejo (T. bogotense) como la trucha arcoíris (O. mykiss) presentaron menor longitud y peso en la condición hidrológica alterada, esto estaría relacionado con cambios en la disponibilidad y calidad del hábitat, aumento en el gasto energético y/o modificación de características fisicoquímicas del agua que regulan el tamaño y peso de los peces. Por ejemplo, si bien el capitanejo presenta un nicho trófico amplio que permitiría una adaptación a sistemas alterados, su menor tamaño y peso estaría relacionado con cambios en la calidad del recurso alimentar, e.g., a través de la pérdida de especies presa (macroinvertebrados acuáticos), un patrón en sistemas lóticos de mayor altitud impactados por represamientos (Wang et al., 2020), y/o por la reducción en el tamaño de las mismas (Lozada & Forero, 1999). Igualmente, considerando que T. bogotense tiene preferencia por lugares poco profundos, cubiertos por vegetación de ribera, con baja velocidad de la corriente (Lozada & Forero, 1999) y que probablemente el regulador físico de su reproducción sea el aumento del caudal durante los periodos de mayor precipitación (Maldonado-Ocampo et al., 2005), la modificación de estas características también estaría determinando su menor longitud y peso en la condición de flujo alterado (Tabla 2, Tabla 3, Fig. 5).
Respecto a la trucha arcoíris, se ha demostrado que individuos de mayor tamaño gastan más energía cuando nadan cerca de la superficie de un río, debido a la formación de ondas superficiales (Hertel, 1966; Webb et al., 1991). Por lo tanto, una reducción en la eficiencia del gasto de energía explicaría la presencia de truchas arcoíris de menor tamaño en el segmento alterado, cuya profundidad es menor. También es posible que la diferencia en tamaño y peso de los peces esté reflejando la alteración en las variables fisicoquímicas del agua. El embalse del Neusa se caracteriza por una liberación de agua del hipolímnio (Corporación Autónoma Regional de Cundinamarca, 2018), cuya principal característica es su baja temperatura, ya que proviene de la camada más profunda del sistema léntico (Clarkson et al., 2000). Se ha demostrado que la liberación de agua del hipolímnio de los embalses reduce las tasas de crecimiento, la longitud y el peso de la ictiofauna nativa e introducida, al afectar principalmente las fases iniciales de desarrollo (Clarkson et al., 2000).
Las especies endémicas, G. bogotensis y E. mutisii, no presentaron diferencias estadísticamente significativas en términos de abundancia, longitud y peso. Sin embargo, se considera de interés destacar algunos patrones observados. Por ejemplo, la abundancia de G. bogotensis fue baja en el tramo inmediatamente aguas abajo de la represa (T4), con una recuperación gradual a medida que aumentaba la distancia a esta (T5 y T6, Tabla 2); sugiriendo que el embalse potencialmente también afecta negativamente la abundancia de esta especie. Adicionalmente, G. bogotensis presentó la mayor abundancia en el tramo no alterado más cercano al embalse del Neusa (T3; Tabla 2). Por lo tanto, no se debe descartar que el embalse también pueda actuar como una fuente de recursos que son aprovechados por esta especie nativa. Al respecto, se sabe que esta especie se alimenta de microcrustáceos típicos de embalses altoandinos (Amphipoda, Cladocera y Copepoda), de modo que los individuos se podrían estar desplazando hacia el embalse para forrajeo y el ambiente acuático lótico actuaría como refugio o sitio de reproducción (Roa-Fuentes et al., 2013).
Este estudio proporciona evidencia de los impactos de la alteración en el régimen natural de flujo por efecto de una represa sobre la ictiofauna endémica e introducida en la región altoandina desde el caso de estudio del río Neusa en Colombia. Los resultados son consistentes con otros estudios que han documentado impactos significativos en la longitud total, peso y abundancia de poblaciones de peces nativos, donde la disminución de la intensidad de las inundaciones y la variación interanual del caudal generada por los embalses crean ríos con homogeneización en su dinámica fluvial, puesto que se modifica el régimen hidrológico natural, su limnología, los patrones de productividad biológica y la distribución de especies acuáticas tanto en el espacio como en el tiempo (e.g. Birnie-Gauvin et al., 2017; Nilsson et al., 2005; Sun et al., 2022).
También representa un aporte científico sólido, pero a la vez sencillo, para la gestión integral de ambientes acuáticos con especies endémicas amenazadas por la regulación del régimen natural de flujo de agua y sedimentos, como el caso del río Neusa. Destacamos la importancia de medidas de manejo eficientes para la prevención y mitigación de los impactos generados por las represas, como es el otorgamiento por parte de las Autoridades de cuencas hidrográficas de un caudal ambiental que permita mantener la estructura, composición y el correcto funcionamiento del sistema fluvial y la provisión de servicios ecosistémicos (Fornaroli et al., 2020). Desde el punto de vista de la planificación y la gestión, se deben analizar en profundidad los impactos acumulativos, sinérgicos y residuales de los diferentes proyectos existentes, planeados y/o futuros que sean reguladores de caudales líquidos y sólidos en la cuenca hidrográfica, manteniendo afluentes no regulados que permitan la conservación y uso sostenible de la biodiversidad de peces endémicos (Díaz et al., 2021).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio