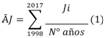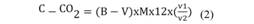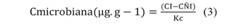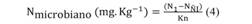Introducción
Aproximadamente el 30 % de dióxido de carbono (CO2) liberado a la atmósfera, proviene de la destrucción de los ecosistemas naturales contribuyendo con el calentamiento global (Houghton, 2003). Las altas tasas de deforestación se destacan como la principal causa que está provocando la pérdida de biomasa aérea y la liberación del CO2 a través de la respiración basal del suelo (RBS) como lo demuestran De Souza Costa, Bayer, Zanatta, y Mielniczuk (2008) y Troxler et al. (2015). Estudios de Stockmann et al. (2013) indican que la acumulación de carbono en el suelo es producto de la entrada de los compuestos orgánicos mediante el secuestro del CO2 atmosférico y las emisiones son causadas por la erosión, lixiviación y oxidación resultante de la actividad metabólica de los macro y micro organismos (Doran & Parkin, 1994).
Las emisiones de CO2 producto de los procesos naturales, ocurren por la respiración microbiana y radicular, la deposición y descomposición del material orgánico, favorecido por las propiedades físicas y químicas del suelo, factores ambientales y biológicos, sus tasas de descomposición y la vegetación (Reef, Feller, & Lovelock, 2010; Bond-Lamberty & Thomson, 2010; Kim, Vargas, Bond-Lamberty, & Turetsky, 2012; Fiedler, Buczko, Jurasinski, & Glatzel, 2015). Ecosistemas como los manglares que se caracterizan por un intenso reciclaje de materia orgánica en sus sedimentos, representan un impacto potencial para el equilibrio global del carbono tanto por la acción antrópica o natural, la pérdida anual se estima en 340 000 y 980 000 ha de mangle (Holguin, Vazquez, & Bashan, 2001; Sifleet, Pendleton, & Murray, 2011; Alongi, 2012).
Las emisiones globales por la degradación de los manglares representan hasta 0.12 pentagramas de carbono al año, el 10 % de las emisiones asociadas a los bosques tropicales, aunque solo ocupan el 1 % del área terrestre (Donato et al., 2011). En la literatura se reportan una gama de estudios de las emisiones de CO2, sin embargo, investigaciones por estratos de vegetación son limitadas a pesar de ser un ecosistema que es influenciado en su vegetación y sus características físico-químicas por la marea (Souza, Guedes, Oliveira, & Santos, 1996).
La hipótesis probada es que las emisiones de CO2 en los suelos de los manglares difieren entre los estratos de vegetación y son influenciadas por la estacionalidad, las características físico-químicas y los factores ambientales. Esta investigación tuvo como objetivo evaluar la estacionalidad y espacialidad de las emisiones de CO2 y su relación con las variables físico-químicas del suelo y ambientales en un manglar de la Amazonia Oriental brasileña.
Material y métodos
Área de estudio: El estudio se localizó en el Municipio de Salinópolis, en la comunidad de Cuiarana, en la región nordeste del estado de Pará, Brasil (47o28’47” E & 0o66’80” S), en la Microrregión Salgado según la clasificación fisiográfica de (Schaeffer-Novelli et al., 1990).
Análisis de variables ambientales: Los datos de precipitación fueron obtenidos de la técnica CMORPH del Centro de Previsión del Clima de la NOAA (https:// cpc.ncep.noaa.gov/products/.../cmorph) en la escala de media hora y resolución espacial de 8 km para enero de 1998 a diciembre de 2017 (Joyce, Janowiak, Arkin, & Xie, 2004). Se calcularon las medias totales mensuales y posteriormente los promedios climatológicos mensuales utilizados en las anomalías de la precipitación de enero a diciembre 2016 y 2017 y se calcularon sustrayendo del acumulado mensual de cada año la media climatológica mensual del período 1998/2017 a partir de la siguiente ecuación.
Donde: Āj= Anomalía de la precipitación en enero. El cálculo de la altura media mensual de la marea se efectuó a partir de la información del Fundeadouro de Salinópolis (Marina brasilera) para cuatro medidas diarias para el período 2016/2017, (https://surfguru.com.br/previsión/mare/20520). Se tomaron los valores correspondientes a la marea de sizigia (luna llena y nueva).
Diseño del muestreo y medición de las emisiones de CO2: a partir de tres parcelas 20x20 m demarcadas por estrato, mangle joven (1-3 m de altura), intermediario (3.1-6 m de altura) y adulto (≥ 6 m de altura), fueron recolectadas dos muestras de suelo de 400 g en cada parcela a una profundidad de 0-20 cm. Esto durante el período lluvioso de 2017 (mayo) y menos lluvioso de 2016/2017 (noviembre). En total se analizaron 36 muestras en el Laboratorio de Suelo de la Coordinación de Ciencias de la Tierra y Ecología del Museo Paraense Emilio Goeldi.
Las emisiones de CO2 se midieron a través de la metodología respiración basal del suelo (RBS), mediante la incubación en el laboratorio de 50 g de suelo y 30 ml de solución de NaOH 0.5 mol-1 en recipientes plásticos herméticos a 25 °C (Matos, 2005). El CO2 fue medido por un período de 88 días, con titulaciones los días 1,2,3,4 y posteriormente a intervalos de 3,3,5,6,7,10,14,16 y 22 días luego de la incubación, proceso replicado durante tres periodos estacionales. En la titulación se utilizaron 10 ml de NaOH y 10 ml de BaCl2 0.05 mol L-1 para la precipitación de los carbonatos y añadida la solución indicadora fenolftaleína al 1 %. Se tituló con ácido clorhídrico (HCL) de forma duplicada. El CO2 liberado fue expresado en mg/100cm3 y cuantificado según Anderson y Domsch (1993).
Donde; B = Volumen del HCl en blanco (mL); V = Volumen de HCl usado en la muestra (mL); M = Concentración real del HCl (mol L-1); 12 = Peso equivalente del carbono; v1 = Volumen total de NaOH utilizado en la captura de CO2 (mL); v2 = Volumen de NaOH utilizado en la titulación (mL). Los resultados se expresaron en toneladas de CO2 por hectárea por año (TCO2 ha/año). El cálculo comprende, conversiones de miligramos en cien centímetros cúbicos (mg/100 cm3) para miligramos por decímetro cúbico (mg/dm3) dividido entre el factor 500 para TCO2 ha/año.
Variables físico-químicas: Los valores de temperatura del suelo corresponden a los días de medición de las emisiones de CO2 y obtenidos con un termómetro portátil TASI 8601, a nivel superficial. La humedad gravimétrica en el suelo fue determinada en el laboratorio a través de la relación del peso húmedo y peso seco de la muestra. En campo, se midieron los valores del Eh (mV) y pH con un equipo Metrhom 744, en el Eh se utilizó un electrodo de platino con valor de lectura corregido con la adición del valor del electrodo de referencia de calomelano (+ 244 mV). Lecturas de pH se hicieron con un electrodo de vidrio calibrado con soluciones patrones de pH = 4.0 y 7.0, insertado directamente en el sedimento (Berrêdo, Costa, Vilhena, & Santos, 2018). La salinidad intersticial fue determinada con un refractómetro de campo, extrayendo bajo presión un pequeño volumen de agua. La granulometría se determinó por el método de la división de la masa de muestra seca (g)/volúmenes de muestra (m3). El carbono y el nitrógeno de la biomasa microbiana se analizaron mediante el método irradiado y no irradiado. El Carbono en la Biomasa Microbiana (CBM) se calculó de acuerdo a Matos (2005).
Donde; CI = muestra irradiada; CÑI = muestra no irradiada; Kc = 0.33 para el método de irradiación extracción de CBM.
El Nitrógeno de la Biomasa Microbiana (NBM) fue calculado por la siguiente ecuación:
NI = nitrógeno de la muestra irradiada; NÑI = nitrógeno de la muestra no irradiada; Kn = 0.54, para el método de irradiación-extracción del NBM.
Procesamiento de datos y análisis: Las relaciones entre las emisiones de CO2 y los estratos de vegetación se determinaron con un análisis Kruskal-Wallis y la prueba Tukey, (P < 0.05) y los intervalos de tiempo de incubación se analizaron a través de regresiones representadas en gráficos Kendel Density en el programa PAST3. La estacionalidad y espacialidad de las emisiones y otras variables se analizó a través de análisis de componentes principales (ACP) generando coeficientes de expansión temporal (autovalores) y espacial (autovectores) como patrones de correlación (Ter-Braak, 1986). Se seleccionaron los ACP con sumatoria de 80 % de la varianza total con un 95 % de significancia.
Resultados
Estacionalidad y espacialidad de las emisiones de CO2:En la Fig. 1 se muestra la estacionalidad de las emisiones de CO2 durante 2016/2017 en las 9 parcelas estudiadas. Se evidenció que tanto en el periodo lluvioso y menos lluvioso, el mangle adulto (7,8,9) liberó la mayor cantidad de CO2, situación contraria ocurrió en las parcelas del mangle joven (1,2,3) donde acontecieron las emisiones menores. Sin embargo, el periodo lluvioso 2017 presentó las mayores emisiones.
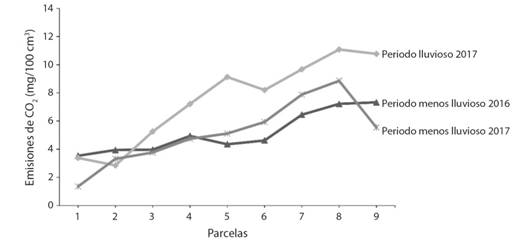
Fig. 1 Fig. 1 Emisiones de CO2 en 9 parcelas en los periodos menos lluviosos 2016/2017 (P.M. Lluvioso) y el periodo lluvioso 2017 (P. Lluvioso). CO2 emissions in 9 plots in the less rainy periods 2016/2017 (P.M. Rainy) and the rainy season 2017 (P. Rainy).
En la figura 2 se muestran las emisiones estacionarias del CO2 en los tres períodos estudiados. El período lluvioso 2017 (Fig. 2B) sobresale como la época con las mayores emisiones (0.6 - 16.1 mg/100 cm3). Las correlaciones revelan que las emisiones más importantes acontecieron durante los días 3,10,16 (mangle joven), 3,5,10,14,16 (mangle intermediario) y 3,5,7,10,14 (mangle adulto) respectivamente. En los períodos menos lluviosos (Fig. 2A, Fig. 2C) sobresale el 2017 con mayores emisiones que el 2016.
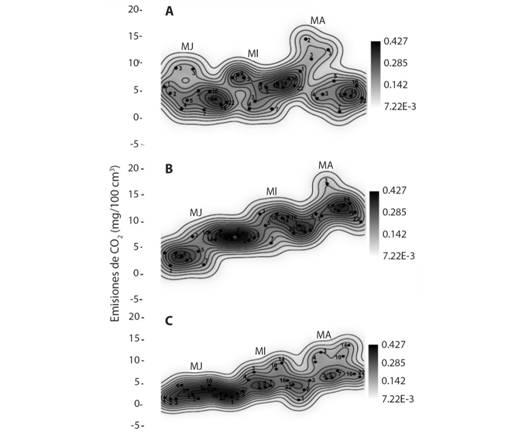
Fig. 2 Fig. 2 Correlaciones espaciales y temporales de las emisiones estacionales del CO2. (A) Periodo menos lluvioso 2016, (B) Periodo lluvioso 2017, (C) Periodo menos lluvioso 2017. Puntos negros representan intervalos de incubación, líneas negras son isolinas de correlación. Spatial and temporal correlations of seasonal CO2 emissions. (A) Less rainy period 2016, (B) rainy season 2017, (C) less rainy period 2017 (C). Black dots represent incubation intervals, black lines are correlation isolines.
Variables ambientales en el manglar: La precipitación presentó mayor acumulado en la estación lluviosa 2017 (Fig. 3A) lo que se corroboró con las mayores anomalías positivas de la precipitación de enero hasta abril (Fig. 3B), esta característica estuvo en concordancia con la mayor altura de la marea (Fig. 3C), favoreciendo el incremento de la actividad microbiana en el suelo particularmente en el estrato adulto localizado cerca del canal de la marea.
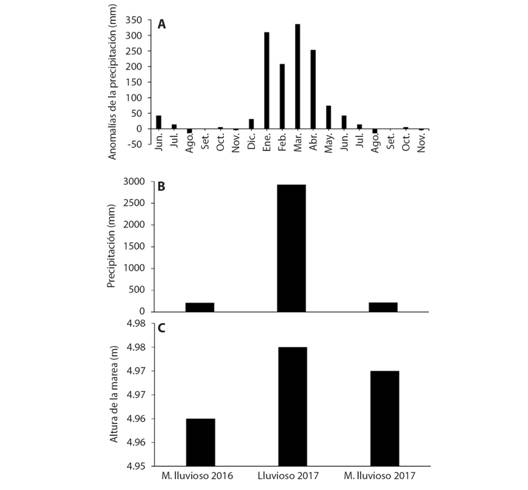
Fig. 3 Fig. 3 Variables ambientales. (A) Anomalías mensuales de la precipitación, (B) Acumulado de las precipitaciones, (C) Altura de la marea, período menos lluvioso y lluvioso 2016/2017. Environmental variables. (A) Monthly anomalies of precipitation, (B) Accumulated precipitation, (C) Height of the tide, less rainy period and rainy 2016/2017.
Emisiones de CO2 y los estratos de vegetación: La información presentada en la tabla 1 indica que las mayores emisiones de CO2 correspondieron al estrato adulto con 16.7 TCO2 ha/año, contrario al estrato joven que liberó 6.8 TCO2 ha/año. La prueba de Kruskal-Wallis indicó diferencia significativa entre las emisiones de CO2 y los estratos de vegetación (P = 0.0170), y el test de Tukey confirmó importancia estadística de las emisiones del mangle adulto en relación con los otros estratos (P = 0.0140) en el periodo lluvioso. En el período lluvioso se liberó la mayor cantidad de CO2 (21.0 ± 0.95 TCO2 ha/año) en comparación con los períodos menos lluviosos 2016/2017 donde la humedad del suelo se convirtió en la variable determinante (Fig. 4). Las menores emisiones se registraron en el estrato joven que se caracteriza por estar cerca de la tierra firme y poco cubierta por la marea.
TABLA 1 TABLE 1 Emisiones medias estacionales de dióxido de carbono en tres estratos de mangle con desviación estándar y N poblacional Seasonal average emissions of carbon dioxide in three mangrove strata with Standard deviation and population N
| N | Mangle Joven (TCO2ha/año) | Mangle Intermediario (TCO2ha/año) | Mangle Adulto (TCO2ha/año) | |
| Períodos | ||||
| Menos Lluvioso 2016 | 18 | 5.3 ± 2.5 | 9.8 ± 1.7 | 13.9 ± 3.4 |
| Lluvioso 2017 | 18 | 7.6 ± 0.5 | 15.0 ± 0.5 | 21.0 ± 0.9 |
| Menos Lluvioso 2017 | 18 | 7.6 ± 3.1 | 9.9 ± 2.9 | 15.0 ± 1.5 |
| Promedio | 6.8 | 11.6 | 16.7 | |
Promedio ± Desviación estándar.
Gradientes estacionales de las emisiones de CO2 y variables físico-químicas: Las correlaciones de emisiones de CO2 y las variables físico-químicas indican que el 56 % de la muestra total está representada en la CP1 y el 24 % en la CP2 (Fig. 4). En la CP1 (Fig. 4) se observa un gradiente diagonal de sudeste-noroeste, con altas correlaciones, representando las superficies del mangle adulto al sureste y mangle joven al noroeste. En el período lluvioso las parcelas 6,7 y 8 presentaron las mayores emisiones en el mangle adulto; situación inversa ocurre en el período menos lluvioso de 2016, con mayores emisiones de CO2 en el estrato que en el adulto. En el CP2 (Fig. 4C, Fig. 4D), se observa un patrón con altas correlaciones sur-noroeste. En el período lluvioso, las parcelas 4,5 y 9 presentaron las mayores emisiones en el mangle intermediario y adulto. Entre las variables más correlacionadas están: la humedad en el suelo (0.89), pH (P = 0.83), materia orgánica (P = 0.8), CBM (P = 0.87) y NBM (P = 0.89).
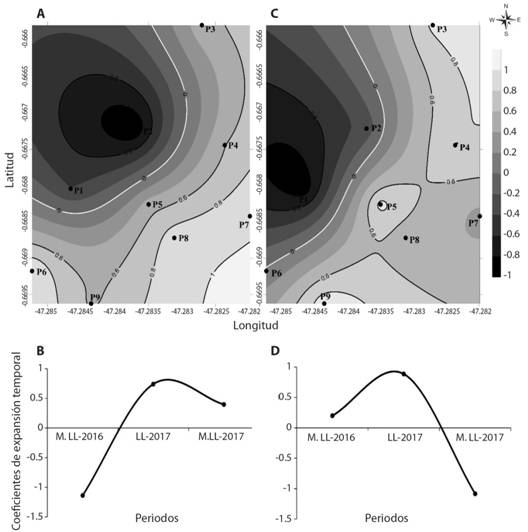
Fig. 4 Fig. 4 Representación espacial y temporal de las emisiones de CO2 y variables físico-químicas. (A) Componente principal 1 con 56 % de la varianza total, (B) Coeficiente de expansión temporal en el período menos lluviosos (M. LL), (C) Componente principal 2 con 24 % de la varianza total, (D) Coeficiente de expansión temporal en el período más lluviosos (LL). Spatial and temporal representation of CO2 emissions and physicochemical variables. (A) Principal component 1 with 56 % of the total variance, (B) Coefficient of temporal expansion in the less rainy period (M. LL), (C) Principal component 2 with 24 % of the total variance, (D) Coefficient of temporal expansion in the rainy period (LL).
Discusión
La precipitación acumulada en el 2017 (2 816 mm) sobresalió con relación al 2016 (1 670 mm). Al descartarse la estación lluviosa 2017 (2 597 mm) y anomalías positivas durante 4 meses favorecieron el incremento de la actividad microbiana en el suelo y por consiguiente las emisiones de CO2. Las mayores correlaciones estacionales de las emisiones relacionadas con los intervalos de incubación ocurrieron en el estrato adulto los días 3,5,7,10,14, favorecido por la mayor disponibilidad de humedad tanto por los acumulados de las precipitaciones y como por la altura de la marea (4.9 m).
Este resultado concuerda con un estudio similar de emisiones de CO2 en un bosque secundario de mangle, dominado por el género Avicennia,en el este de Tailandia donde encontraron mayores valores medios de emisiones en el período lluvioso (Poungparn et al., 2009). De igual manera en un estudio realizado por (Valentini, Abreu, & Faria, 2015), al medir las emisiones de CO2 en el Parque Estadual Massairo Okamura (Mato Grosso) corroboró la correlación de la respiración del suelo con la precipitación y la humedad en el suelo. Ya que la humedad favorece las reacciones bioquímicas de los microorganismos en la época lluviosa, acrecienta las emisiones de CO2. Sin embargo, Mukherjee y Ray (2012) estudiando variaciones mensuales de emisiones de CO2 en manglares de Sundarban, India encontraron que los suelos de manglar liberan más carbono en los meses del período de transición al período lluvioso.
Espacialmente se encontraron mayores emisiones medias en el estrato adulto con promedio de 16.7 TCO2 ha/año, contrario al estrato joven que liberó 6.8 TCO2 ha/año. En una investigación de manglares mexicanos encontraron valores medios de emisiones de CO2 hasta 6.7 TCO2 ha/año (Silveira et al., 2016). Resultados similares fueron reportados por Nóbrega et al. (2016) en el estudio de emisiones de CO2 en manglares en Ceará, Brasil donde registraron hasta 4 TCO2 ha/año. Sin embargo, en los manglares de Rhizophora y Avicennia en la costa venezolana, encontraron tasas de emisión de 11.2 TCO2 ha/año (Otero et al., 2017). Otros estudios de las emisiones de CO2 en manglares en la bahía de Gazi, Kenia por Lang’at et al. (2014), dominados por Rhizophora sp., encontraron emisiones de 25.4 TCO2 ha/año. Das, Ganguly, Ray, Jana, y Tarun Kumar (2017) por su parte reportaron bajas emisiones de CO2 en manglares tropicales de Sundarban, India, con valores medios de entre 0.23 a 1.94 TCO2 ha/año. Así mismo, Poungparn et al. (2009), en el este de Tailandia encontraron valores medios de 3.7 y 4.3 TCO2 ha/año respectivamente.
De las variables físico-químicas se destacan la humedad en el suelo, CBM, M.O, pH, salinidad y contenidos de limo y arcilla correlacionados con las emisiones principalmente en el estrato adulto próximo al canal de la marea. Argumentos de Reef et al. (2010) plantean que las propiedades físico-químicas de los suelos del manglar están asociadas a la frecuencia de inundación por la marea. Esta argumentación es concordante con Souza et al. (1996) que determinaron que los niveles de nutrientes en los bosques de manglares generalmente varían de acuerdo con las mareas y el grado de saturación del agua sedimentaria, lo que puede afectar la disponibilidad de los atributos del suelo. Martins y Matthes (1978) señalan que las características del suelo son claves en el comportamiento de los indicadores de calidad del suelo señalando que suelos arenosos, predominantes en mangle joven, son pobres en humedad y materia orgánica que puede significar menores emisiones de CO2.
Con el 56 % de la varianza total de los datos en la ACP1 se observa un gradiente diagonal de sudeste-noroeste que muestra las superficies del mangle adulto al sureste del área de estudio y mayores cantidades de carbono. Mientras que el mangle joven está ubicado al noroeste con bajos índices de humedad y materia orgánica. Las emisiones de dióxido de carbono de los manglares dependen del tamaño del depósito de carbono orgánico en el suelo y de las tasas de remineralización (Lovelock et al., 2017).
Los estudios de Lallier-Vergès, Marchand, Disnar, y Lottier (2008), sugieren que el factor marea puede influir en las emisiones de CO2 al alterar el estado de oxidación y los procesos de descomposición de la metería orgánica. De igual manera Keuskamp, Hefting, Dingemans, Verhoeven y Feller (2015) concluyeron que la descomposición microbiana depende de las condiciones ambientales del suelo. En el caso de los manglares se desempeña en gran parte por el régimen de mareas predominante. Los factores como la cantidad de materia orgánica, presencia de agua/humedad y la temperatura influyen en las emisiones de CO2, características que fueron propicias en el período lluvioso (Liblik, Moore, Bubier, & Robinson, 1997).
La distribución espacial y temporal de las emisiones de CO2 sugiere que la relación emisiones-estratos de vegetación está influenciada por características físicas, químicas y las condiciones ambientales en cada estrato de vegetación principalmente en el periodo lluvioso donde las emisiones de CO2 son en promedio de 14.5 TCO2 ha/año. El estrato adulto favoreció el incremento de las emisiones estacionales de CO2 por tener mayor contenido de humedad, tanto por las precipitaciones acumulados de 2 595 mm y altura de la marea de 4.9 m. Principalmente en el período lluvioso esto aumentó la actividad microbiana favoreciendo el incremento en los contenidos de las variables químicas en el suelo y por consiguiente generando mayores emisiones.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio