Introducción
Las semillas de numerosas especies de interés comercial son almacenadas a largo plazo para ponerlas a germinar posteriormente. La capacidad de las semillas para sobrevivir a la desecación es una característica importante en el desarrollo ecológico y la conservación de una especie (Wyse & Dickie, 2018). El comportamiento de almacenamiento varía con la tolerancia a la desecación, la temperatura y el tiempo de viabilidad; esto permite clasificar las semillas en ortodoxas, intermedias y recalcitrantes (Hong & Ellis, 1996; Magnitskiy & Plaza, 2007).
El inicio de la germinación está determinado por la disponibilidad de agua, que cuando se absorbe desencadena una secuencia de cambios metabólicos que incluyen respiración, síntesis proteica y movilización de reservas (Maldonado, Pujado, & Squeo, 2002; Doria, 2010). Además de agua, una semilla requiere de oxígeno y una temperatura apropiada para germinar (Graeber et al., 2010). No obstante, estos procesos fisiológicos dependen de diversos factores y son característicos de cada especie; por ejemplo, las variaciones en las condiciones de temperatura e intensidad de luz pueden generar estrés e inducir la expresión de genes que codifican proteínas para tales procesos fisiológicos (González, 1991; Rodríguez-Pérez, 2006; Funes, Díaz, & Venier, 2009).
Las especies del género Crescentia (Bignoniaceae) son de gran interés cultural y económico en Mesoamérica, especialmente en El Salvador y Nicaragua (Corrales et al., 2017), porque existe una variedad de usos registrados, algunos desde tiempos prehispánicos. Por ejemplo: elaboración de utensilios de cocina y artesanías, extracción de madera, carbón y tinte, preparación de bebidas (alcohólicas, horchata y “leche vegetal”), reposterías, caramelos y alimento para animales de engorde y de producción de leche (Standley, 1928; IICA, 1989; Nellis, 1997; Figueroa & Bressani, 2000; Salazar & Soihet, 2001; Zamora et al., 2001; Cordero & Boshier, 2003; Solares, 2004; Mundo Forestal, 2013). Pese a los diversos usos de estas especies, existe poca información biológica, por ejemplo sobre almacenamiento y germinación de semillas; esto limita la protección de las poblaciones silvestres y el establecimiento de plantaciones, que podrían permitir un aprovechamiento efectivo de los recursos sin tener un impacto negativo en la naturaleza.
Crescentia alata Kunth es un árbol caulifloro llamado jícaro, alcanza una altura de hasta 10 m, se distribuye desde México hasta Guanacaste en Costa Rica, principalmente en la vertiente pacífica, y habita en bosques secos, subperennifolios y caducifolios (Gentry, 1980; Solares, 2004; Quesada-Monge & Fernández-Vega, 2005). Los frutos son esféricos, con pericarpo duro y liso; poseen una pulpa dulce y abundante que rodea las semillas, que son pequeñas (entre 25 y 40 mg y de 6 a 8 mm de largo), delgadas (entre 1 y 2 mm de grosor), con testa color café, y se consideran oleaginosas por el alto contenido de lípidos y proteínas; cada fruto posee 300 a 900 semillas (Gentry, 1980; IICA, 1989; Cordero & Boshier, 2003; Corrales et al., 2017).
Los estudios sobre almacenamiento y germinación de semillas de C. alata son escasos (Solares, 2004). Por tanto, es importante conocer los factores que influyen sobre estos procesos en semillas de esta especie, que tiene un alto potencial para la producción comercial (Corrales et al., 2017), principalmente de frutos, cuyas dimensiones son relevantes en la fabricación de artesanías. El presente estudio pretende caracterizar el tamaño y la forma de frutos y semillas de C. alata, evaluar el proceso de germinación en diferentes condiciones de temperatura y luminosidad, y determinar las condiciones óptimas de temperatura, humedad y tiempo de almacenamiento para mantener las semillas viables, con el fin de generar información biológica de esta especie, principalmente sobre comportamiento de semillas almacenadas, que podrá aplicarse en proyectos futuros de conservación, propagación y reforestación.
Materiales y métodos
Se recolectaron frutos maduros de ca. 50 árboles de poblaciones silvestres en Guanacaste, Costa Rica (10°36’ N & 85°31’ W y 10°52’ N & 85°35’ W), donde predomina el bosque tropical seco con una marcada diferencia entre las épocas lluviosa y seca; el promedio anual de lluvia varía entre 1500 y 1950 mm y la temperatura promedio anual entre 24.0 y 27.8 °C (Leiva, Rocha, Mata, & Gutiérrez, 2009). En otros países se han observado diferencias morfológicas en los frutos de Crescentia cujete L., especie emparentada con C. alata (Aguirre-Dugua, Eguiarte, González-Rodríguez, & Casas, 2012). Por eso se realizaron visitas previas a cuatro sitios de Guanacaste, donde no se detectaron tales diferencias en forma, tamaño y color de frutos de C. alata. Para tener una muestra representativa de las características morfológicas, se recolectaron frutos en diferentes épocas secas durante tres años (2013-2015) en dos sitios diferentes: Liberia (febrero 2013) y Parque Nacional Santa Rosa (marzo 2015). Un espécimen de C. alata, testigo de esta investigación, se halla en el Herbario de la Universidad de Costa Rica (USJ-110912). Según datos de precipitación pluvial del Área de Conservación Guanacaste, en el Parque Nacional Santa Rosa se registraron 1 591.8 mm en 2013 y 627 mm en 2015.
Manualmente se despulparon 139 frutos y se mezclaron las semillas, que fueron lavadas y secadas a la sombra durante una semana. Posteriormente se descartaron las dañadas (con deformidades o agujeros) o de menor tamaño que la mayoría. Entre las semillas normales se hizo una selección al azar y se aplicó un remojo previo de 12 horas para homogenizar las condiciones; la salida de la radícula, de mínimo 2 mm, fue el indicativo de una semilla germinada. Además, con una prueba no paramétrica de Wilcoxon de dos muestras, con diez repeticiones de 50 semillas, se examinó si era necesario el remojo para mejorar la germinación.
Caracterización de frutos y semillas: Se midieron con cinta métrica dos circunferencias perpendiculares en cada fruto (n = 139) para calcular dos parámetros: la altura (h) entre el punto de inserción del pedicelo y el ápice, y el diámetro en el ecuador del fruto (D). Se utilizó el índice de redondez (IR) (Aguirre-Dugua et al., 2012) para determinar la forma dominante del fruto con la fórmula IR = (h/D)-1; si IR = 0 el fruto es esférico, IR positivo indica fruto alargado e IR negativo, achatado. Se midió ancho y largo de las semillas (n = 50), seleccionadas al azar, con un calibrador Vernier (± 0.05 mm). Se midió la masa de frutos frescos (n = 119) y de todas las semillas secas del fruto (n = 56). Asimismo, se contó el número de semillas por fruto (n = 76). Para relacionar la masa y el número de semillas por fruto, se aplicaron regresiones lineales: una para estimar la masa de las semillas (variable dependiente) con la masa del fruto (variable independiente), y otra regresión para determinar el número de semillas (variable dependiente) a partir de su masa (variable independiente). Las masas se determinaron con balanza marca Scout Pro SP601 (± 0.1 g). Se aplicó estadística descriptiva en las mediciones y regresión lineal.
La germinación de los siguientes experimentos se hizo en cámaras de germinación con control de luz y temperatura, en laboratorios de la Escuela de Biología y del Centro de Investigaciones en Granos y Semillas (CIGRAS) de la Universidad de Costa Rica en San José, Costa Rica.
Capacidad germinativa a distintas temperaturas: Las semillas se sometieron a cinco tratamientos: tres con temperatura constante de 15, 20 y 30 °C, y dos con alternancia de temperatura entre el día y la noche, de 20 a 30 °C y de 25 a 30 °C (en ambos casos la mayor temperatura corresponde al día). Cada tratamiento se hizo con 20 repeticiones de 20 semillas cada una. Para la germinación se usaron cajas de Petri con el fondo cubierto por papel filtro y se agregó agua destilada hasta la saturación. Estas cajas se colocaron en bandejas plásticas envueltas con bolsas plásticas transparentes para mantener la humedad, con fotoperíodo de luz blanca de 12 horas y humedad relativa de 98-100 %. El papel y las cajas se esterilizaron en una solución de hipoclorito de sodio al 1 %. Se usaron cámaras de germinación marca Hoffman Manufacturing LS-12, modelos SG2-22 y SG-30, y marca Precision Scientific, modelo RS-232. Se determinó el porcentaje de germinación acumulado y se hizo una prueba de ANDEVA para ver el efecto de la temperatura y el tiempo como mediciones repetidas.
Capacidad germinativa en luz y oscuridad: Se probó en dos ambientes permanentes: luz y oscuridad, con 20 repeticiones de 15 semillas cada una. Las cajas de Petri se colocaron en bandejas y éstas en una cámara de germinación con luz controlada (Environmental controlled Chamber marca Electro-Tech Systems modelo 518), con temperaturas fluctuantes del medio según las condiciones del día, y la humedad relativa de 98-100 %. La intensidad lumínica fue de ca. 275 µmol m-2 s-1. Para homogenizar la humedad, las bandejas se cubrieron con bolsas plásticas, transparentes para el ambiente de luz y negras para el de oscuridad. Se determinó el porcentaje de germinación acumulado y se hizo un ANDEVA para ver el efecto de luminosidad y el tiempo como mediciones repetidas.
Efecto del almacenamiento y la temperatura sobre la viabilidad de las semillas: Semillas secadas a la sombra durante una semana se colocaron en bolsas de papel cubiertas con bolsas plásticas y se almacenaron durante 36 meses a distintas temperaturas: 5 °C, 15 °C y ambiente (promedio entre 22 y 24 °C). Después se evaluaron los porcentajes de germinación en todos los tiempos de almacenamiento (0, 4, 8, 14, 20, 24 y 36 meses). Las semillas se colocaron en cajas plásticas de 21 cm de largo, 14 cm de ancho y 7 cm de alto; el fondo se cubrió con turba de germinación marca Fafard, con 10 repeticiones de 50 semillas cada una. Las pruebas se hicieron en una cámara de germinación Hoffman Manufacturing Inc., con fotoperíodo de 12 horas, 30 °C durante el día, 25 °C durante la noche y humedad relativa de 98-100 %. Se hizo un ANDEVA de dos vías con el porcentaje de germinación acumulado a las 5 semanas, como variable respuesta, y la temperatura y el tiempo de almacenamiento como factores. En el análisis anterior no se incluyó el porcentaje de germinación a 0 meses, porque no se generaron datos para 5 y 15 °C.
Además, en cada prueba de porcentaje de germinación anterior se midieron los contenidos de humedad (CH) de las semillas en todos los tiempos de almacenamiento (4, 8, 14, 20, 24 y 36 meses) y a 5 °C, 15 °C y temperatura ambiente; se utilizaron 20 repeticiones con 10 semillas cada una. Las masas fresca y seca se obtuvieron con una balanza analítica Sartorius AC 210S-MC1. Las semillas se dejaron en bolsas de papel en una secadora Sheldon Manufacturing Inc. modelo 14.5/89, a 80 °C por 15 días para alcanzar una masa seca constante y se mantuvieron en gel de sílice. El CH se calculó con la fórmula de la Asociación Internacional de Pruebas de semillas (ISTA, 2016), Contenido de humedad = [(Masa fresca - masa seca) / Masa fresca]*100. Se hizo ANDEVA de dos vías con el contenido de humedad como variable respuesta, y la temperatura y el tiempo de almacenamiento como factores. En el análisis no se incluyeron los datos a 0 meses, porque no se generaron datos para 5 °C ni 15 °C. Además, se determinó el coeficiente no paramétrico de correlación de Spearman entre el contenido de humedad y el porcentaje de germinación un mes después de poner las semillas en turba.
Capacidad germinativa de semillas almacenadas dentro y fuera del fruto: Se mantuvieron 25 frutos en sacos de malla plástica, que permiten la evaporación del agua, y aparte se almacenaron semillas secas (a la sombra durante una semana) y libres de pulpa en bolsas de papel. Los frutos y las semillas extraídas permanecieron a temperatura ambiente (promedio: 22-24 °C) y a la sombra en un invernadero. Después de 32 meses de almacenamiento, se extrajeron las semillas de los frutos, se seleccionaron al azar y se calculó el porcentaje de germinación de las semillas libres y de las conservadas dentro de frutos. Se hicieron diez réplicas con 50 semillas, en bandejas plásticas (21 cm de largo, 14 cm ancho y 7 cm de alto) con turba de germinación marca Fafard como sustrato, en una cámara de germinación a 30 °C en el día, 25 °C en la noche, con fotoperíodo de 12 horas y humedad relativa de 98-100 %. Se hizo una prueba no paramétrica de Wilcoxon de dos muestras.
Los análisis se realizaron con JMP® (SAS Institute Inc, 2012), Excel y Software R versión 3.1.1 (R Development Core Team, 2014). El nivel de significancia aplicado fue de P < 0.05.
Resultados
Se determinó que las semillas de C. alata no tienen latencia y germinaron sin tratamiento pregerminativo. Semillas que se humedecieron por 12 horas, a los 33 días de ser colocadas en turba tuvieron un porcentaje de germinación de 84.80 ± 7.61 % (promedio ± desviación estándar), que sin remojo fue de 79.4 ± 4.11 %; sin embargo, no hay diferencias de germinación con o sin remojo (Wilcoxon (W): x2 = 1.80, g.l. = 1, P < 0.18). La radícula brotó entre 4 y 6 días posteriores al inicio de la imbibición y en 21 días germinó ca. 90 % de las semillas.
Caracterización de frutos y semillas: Los promedios (± desviación estándar) de medidas del fruto fueron: altura: 7.90 ± 2.58 cm (n = 139), diámetro: 9.62 ± 1.21 cm (n = 139) y masa 414.57 ± 166.51 g (n = 119); el índice de redondez (IR) de -1.86 (ámbito: -3.55 a -0.16). En promedio (± desviación estándar), la semilla midió 0.75 ± 0.07 cm de longitud, 0.67 ± 0.05 cm de anchura (n = 50), y la masa de 50 semillas secas fue 1.96 ± 0.15 g. Además, la masa de las semillas en cada fruto fue de 28.66 ± 12.79 g (n = 56) y puede calcularse con la ecuación Masa de semillas (g) = 19.94 + 0.03 * masa del fruto (g) (R2 = 0.16, F1,38 = 7.51, P = 0.01). El fruto tuvo 691 ± 245.24 semillas (n = 76) y el total de semillas por fruto puede calcularse de la siguiente manera: Número de semillas = 409.17+11.90 * masa de semillas (g) (R2 = 0.45, F1,54 = 44.27, P < 0.001).
Capacidad germinativa a distintas temperaturas: Se encontraron diferencias en el porcentaje de germinación acumulado según la temperatura (F4,95 = 1971.86, P < 0.001, Fig. 1) y el tiempo (F8,88 = 1689.31, P < 0.001); además, las temperaturas en el tiempo tuvo diferencias (Hotelling-Lawley 32,346 = 106.00, P < 0.001). En la Fig. 1 se puede observar que las temperaturas se dividen en dos grupos: el primero fue de temperaturas más altas: 30 °C, 25-30 °C y 20-30 °C; el segundo de temperaturas más bajas: 20 °C y 15 °C.
La germinación de las semillas se inhibió a temperaturas de 15 °C y 20 °C, pero no perdieron la viabilidad al permanecer embebidas en cámaras de germinación por 21 días. Después de estar en esas condiciones se colocaron a temperatura ambiente en un invernadero (promedio: 25-30 °C); seis días después se obtuvo un porcentaje de germinación de 74 % a 15 °C y 70 % a 20 °C.
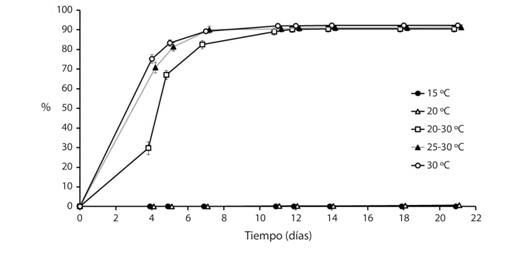
Fig. 1 Fig. 1 Porcentaje de germinación promedio (± error estándar) de Crescentia alata en distintas temperaturas en cámaras de ambiente controlado según el transcurso del tiempo Mean germination percentage (± standard error) of Crescentia alata seeds at different temperatures in germination chambers according to time.
Capacidad germinativa en ambientes de luz y oscuridad: Se encontraron diferencias en el porcentaje de germinación acumulado según la luminosidad (F1,38 = 26.73, P < 0.001, Fig. 2) y el tiempo (F3,36 = 553.78, P < 0.001); además, la luminosidad mostró diferencias con el tiempo (F3,36 = 8.65, P < 0.001). A los 22 días se alcanzó un porcentaje de germinación acumulado mayor en el ambiente de luz que en el de oscuridad.
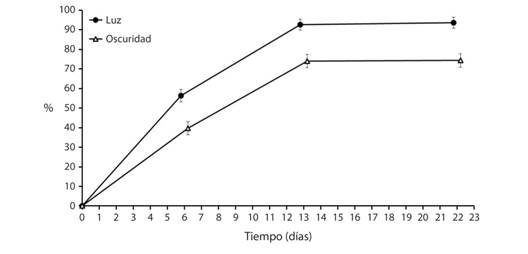
Fig. 2 Fig. 2 Porcentaje de germinación promedio (± error estándar) de Crescentia alata en cámara de germinación con temperaturas fluctuantes durante la noche y el día (25-40 °C) en condiciones de luz y oscuridad permanentes según el transcurso del tiempo Mean germination percentage (± standard error) of Crescentia alata seeds in a germination chamber with fluctuating temperatures during night and day (25-40 °C) in permanent light and dark conditions according to time.
Efecto del almacenamiento y de la temperatura sobre la viabilidad de las semillas: El porcentaje de germinación acumulado a las 5 semanas de semillas sin almacenamiento a temperatura ambiente fue de 84.80 ± 7.61 % (promedio ± desviación estándar). El porcentaje de germinación acumulado a las 5 semanas varió según el tiempo (F5, 162 = 71.11, P < 0.0001, Fig. 3) y la temperatura de almacenamiento (F2, 162 = 14.59, P < 0.0001) y su interacción (F10, 162 = 51.96, P < 0.0001). A temperatura ambiente disminuyó significativamente la germinación al aumentar el tiempo de almacenamiento, a 5 °C la germinación se mantuvo relativamente constante, aunque aumentara el almacenamiento, y a 15 °C tampoco cambió la germinación. Las temperaturas menores mantuvieron las semillas viables por al menos 36 meses; se alcanzó hasta 92 % de germinación a 15 °C y 89 % a 5 °C; en cambio, a temperatura ambiente germinó 32 % y la viabilidad disminuyó a partir de 20 meses.
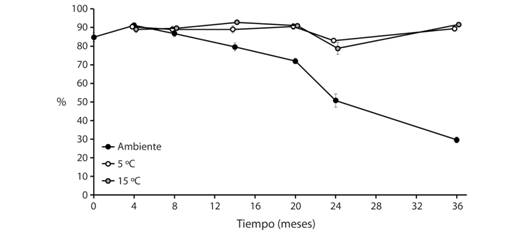
Fig. 3 Fig. 3 Porcentaje de germinación promedio (± error estándar) de Crescentia alata a cinco semanas, según el tiempo (0 a 36 meses) y las temperaturas (5 °C, 15 °C y ambiente) de almacenamiento de las semillas. Mean germination percentage (± standard error) of Crescentia alata seeds after five weeks according to time (0 to 36 months) and temperatures (5 °C, 15 °C, and ambient temperature) of seed storage.
El contenido de humedad de semillas sin almacenamiento a temperatura ambiente fue de 9.54 ± 0.38 % (promedio ± desviación estándar). El contenido de humedad (CH) de las semillas no varió según el tiempo (F5, 342 = 2.24, P = 0.05, Fig. 4), pero fue diferente según la temperatura de almacenamiento (F2, 342 = 19.41, P < 0.001) y su interacción (F10, 342 = 2.85, P = 0.002). Los CH a temperatura ambiente y a 5 °C fueron similares y no hay cambios con el tiempo de almacenamiento, mientras que a 15 °C la humedad de la semilla se redujo con el almacenamiento. Asimismo, no se encontró correlación entre el contenido de humedad y la germinación a las temperaturas analizadas: 1) ambiente (rs = 0.06, P = 0.95), 2) 5 °C (rs = -0.13, P = 0.21) y 3) 15 °C (rs = 0.21, P = 0.4304). Así, la germinación no depende de las variaciones observadas en el contenido de humedad de las semillas.
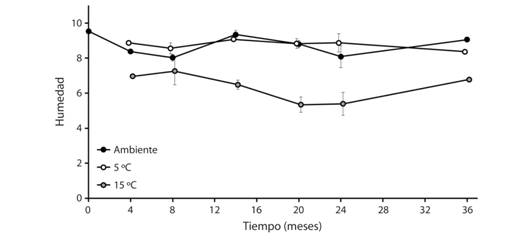
Fig. 4. Fig. 4 Contenido de humedad promedio (± error estándar) en semillas de Crescentia alata almacenadas por diferentes tiempos (0 a 36 meses) y temperaturas (5 °C, 15 °C y ambiente). Mean moisture content (± standard error) of Crescentia alata seeds stored at different time (0 to 36 months) and temperatures (5 °C, 15 °C, and ambient temperature).
Capacidad germinativa de semillas dentro y fuera del fruto: El porcentaje de germinación de las semillas conservadas dentro de los frutos fue menor que el de las semillas extraídas (W: x2 = 46.29, g.l. = 1, P < 0.001). La germinación de semillas mantenidas 33 días en turba, después de haber estado conservadas dentro de frutos, fue de 4.00 ± 2.49 % (promedio ± desviación estándar), mientras la de semillas previamente extraídas y limpias fue de 49.20 ± 11.08 %.
Discusión
En la caracterización de frutos y semillas de C. alata se midió un menor diámetro del fruto, mientras que la masa de la semilla y el número de semillas por fruto coinciden con los datos de la literatura (Gentry, 1980; Cordero & Boshier, 2003). El índice de redondez (IR), que indica que los frutos de C. alata son redondeado-achatados, se usó en otra especie, C. cujete, para analizar las variaciones en forma y tamaño inducidas por domesticación de esa especie en México (Aguirre-Dugua et al., 2012). Al contrario, la homogeneidad del IR en los frutos de C. alata, analizados en el presente estudio, sugiere que no ocurrió domesticación de esta especie en Guanacaste (Costa Rica), de modo que estas poblaciones podrían estar aportando semillas con características de un tipo silvestre de la especie.
En este estudio, la germinación de C. alata inició en 4 a 6 días y a los 21 días alcanzó valores de 90 % o más a 30 °C, sin necesidad de tratamiento pregerminativo, en contraste con Cordero y Boshier (2003), que registran el inicio a los 8 días, y de 75 % a 80 % en 30 días, pero no tenemos detalles de metodología de estos autores para una mejor comparación. Según Solares (2004) en sustrato de arena, después de dos años de almacenamiento la germinación fue de 52 %.
Los resultados indican que la germinación de C. alata varió con la temperatura; aumentó a 30 °C y fue nula a 15 °C y a 20 °C. La baja temperatura actúa como un factor limitante, probablemente porque la especie crece naturalmente en regiones donde predominan temperaturas más altas. El porcentaje de germinación depende de la temperatura adecuada para cada especie según su distribución geográfica; por ejemplo, en Puya berteroniana Mez (Bromeliaceae) la germinación óptima ocurre a 15 °C y disminuye a temperaturas mayores (Vadillo, Suni, & Cano, 2004); Solanum chilense Dunal (= Lycopersicon chilense Dunal, Solanaceae) no germina a temperaturas menores que 8 °C ni mayores que 35 °C (Maldonado et al., 2002); Prosopis cineraria (L.) Druce (Fabaceae) germina mejor a 30 °C y disminuye en ambientes más cálidos (Sacheti & Al-Areimi, 2000). En condiciones fluctuantes de 20 a 30 °C se observó un retraso en la germinación de C. alata; esto podría deberse a la activación de mecanismos para detectar las condiciones ambientales óptimas para iniciar el proceso de germinación y mejorar las probabilidades de sobrevivencia de las plántulas. Además, la luminosidad aumentó la germinación; por tanto, es un factor importante para C. alata, que habita en sitios con luz intensa. Algunas especies tienen germinación fotocontrolada, mientras que otras producen semillas insensibles a la luz (Figueroa & Vásquez-Yanes, 2002).
En bosques con estacionalidad térmica y pluvial, el proceso de germinación es influenciado principalmente por la temperatura (Funes et al., 2009), porque es un factor decisivo al tener influencia sobre las enzimas que regulan la velocidad de las reacciones bioquímicas relacionadas con la germinación, ya que cada enzima tiene un ámbito óptimo de actividad (Doria, 2010). De este modo, muchas semillas germinan solo en ciertas condiciones térmicas, aunque los demás factores, como humedad y luminosidad, sean favorables. En los cotiledones de las semillas de C. alata se detectaron enzimas que otorgan tolerancia a la desecación, como glucosa y ribitol deshidrogenasa homólogo-1 y aldosa reductasa, así como proteínas de choque térmico (Corrales et al., 2017). Para explicar la distribución geográfica restringida de C. alata probablemente actúan tres factores; el primero es alta intensidad lumínica, el segundo son temperaturas anuales relativamente altas, con promedio entre 24.0 y 27.8 °C (Leiva, Mata, Rocha, & Gutiérrez, 2009; Leiva, Rocha et al., 2009), pero valores máximos entre 35 y 37 °C, y el tercero es el suelo arcilloso predominante (vertisoles y sonsocuites) (Vargas, 2011).
Los factores que inhibieron la germinación de C. alata a temperaturas de 15 y 20 °C se desconocen; sin embargo, podrían relacionarse con la inactivación de las enzimas hidrolíticas, que impediría la activación metabólica de la semilla (Maldonado et al., 2002). Además, la latencia y la germinación son afectadas por la interacción antagonista entre el ácido abscísico (ABA) y las giberelinas (Graeber, Nakabayashi, Miatton, Leubner-Metzger, & Soppe, 2012). El ABA está implicado en la latencia de semillas y brotes; ante factores de estrés, como las bajas temperaturas para ciertas especies, esta hormona se acumula en los tejidos y puede inhibir la germinación de semillas sin latencia o las vías de transducción de señales que involucran elementos de ADN cis-actuantes llamados CRT, que determinan la expresión de genes que responden a bajas temperaturas (García et al., 2005; Graeber et al., 2010). Los genes de factores de transcripción del tipo ABI3/VP1 están asociados a la respuesta de ABA en brotes y semillas; estos son parte de una red de genes que controlan la disponibilidad de proteínas, la inducción y el mantenimiento de latencia en las semillas y la adquisición de tolerancia ante la desecación (Graeber et al., 2010).
Las semillas de C. alata permanecieron viables por más tiempo a las temperaturas más bajas del estudio (5 °C y 15 °C). En el café (Coffea arabica L., Rubiaceae) disminuye la germinación cuando las semillas son almacenadas a 20 °C (Barboza & Herrera, 1990), similar a lo observado en C. alata. Factores como tiempo y temperatura pueden influir en la germinación; por lo general, las condiciones óptimas son bajas temperaturas y bajo contenido de humedad, probablemente porque disminuye la probabilidad de aparición de hongos e insectos (FAO, 1991a, b; Sacheti & Al-Areimi, 2000; Buitrago-Rueda, Ramírez-Villalobos, Gómez-Degraves, Rivero-Maldonado & Perozo-Bravo, 2004), entre otros factores.
El retraso en el proceso de germinación y la disminución de viabilidad a temperatura ambiente, a partir de cuatro meses (Fig. 3), no pueden explicarse satisfactoriamente con el modelo experimental de este estudio; factores externos pudieron estar involucrados y haber interferido, en vista de que se observaron algunos daños en semillas provocados por insectos. Además, la disminución de la germinación en la prueba de 24 meses pudo deberse a contaminación fúngica de la turba utilizada, probablemente favorecida por la gran humedad y las altas temperaturas de las cámaras de germinación; así se dañaron algunas semillas, que no germinaron y por eso no se alcanzaron los niveles promedio de germinación. No obstante, si se evita la contaminación y se mantienen bajas las temperaturas, es posible conservar las semillas de C. alata viables por al menos tres años.
Según las evaluaciones del contenido de humedad, C. alata puede germinar con un bajo CH en la semilla. En la clasificación de las semillas según comportamiento de almacenamiento (Hong & Ellis, 1996), probablemente las de C. alata son ortodoxas, pues pueden tolerar hasta 5 % de contenido de humedad y mantener porcentajes de germinación de hasta 80 % a 24 meses de almacenamiento. Sin embargo, nuestro diseño experimental no arrojó resultados concluyentes sobre este asunto.
Asimismo, se comprobó que las semillas que permanecen dentro de los frutos pierden viabilidad. Se desconoce si la pulpa tiene un efecto sobre la viabilidad, pero al contener agua podría favorecer la pudrición de las semillas, que requieren de un medio aireado (Doria, 2010). Es probable que el proceso de fermentación de la pulpa influya en la disponibilidad de los gases oxígeno y dióxido de carbono, necesarios para las actividades metabólicas de las semillas. Asimismo, algunos animales pueden ser atraídos por el fuerte y dulce olor de la pulpa y algunos se alimentan de las semillas, cuyos cotiledones contienen ca. 44 % de proteínas y 38 % de lípidos (Cordero & Boshier, 2003; Corrales et al., 2017). También, el proceso de pudrición del fruto podría favorecer la aparición de agentes patógenos, como insectos u hongos. En el campo, al abrir algunos frutos del suelo se observaron larvas y adultos de Drosophila melanogaster (Diptera: Drosophilidae).
Los resultados de esta investigación indican que la germinación de C. alata se favorece en presencia de luz a temperaturas entre 20 °C y 30 °C. Para el almacenamiento a largo plazo, las mejores condiciones son temperaturas más bajas (5 °C y 15 °C), extraer las semillas del fruto, liberarlas de la pulpa y limpiarlas para evitar la contaminación y el deterioro. De esta forma, las semillas pueden mantenerse viables hasta por tres años. Estos resultados pueden favorecer las prácticas de conservación de semillas y la obtención de plántulas para propagación; así podría aumentar el tamaño de las poblaciones con fines económicos o de conservación, para garantizar la permanencia de C. alata en el bosque tropical seco y contribuir a reducir la explotación de este ecosistema. Se recomienda para futuros proyectos determinar la viabilidad de las semillas más allá de tres años de almacenamiento.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

