Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.56 n.2 San José Jun. 2008
Atributos vitales de especies leñosas en bordes de bosque altoandino de la Reserva Forestal de Cogua (Colombia)
Alba Lucía Montenegro1 & Orlando Vargas2
Departamento de Biología, Universidad Nacional de Colombia, A.A. 14490 Bogotá, Colombia. Fax. 316-53-10; montenegro.alba@gmail.com; jovargasr@gmail.com
Abstract: Vital traits of woody species in High Andean forest edges of the Cogua Forest Reserve (Colombia). The Cogua Forest Reserve was studied throughout eight months to detect the existence of functional species-groups associated with edge wood forest. A second goal was to determine which species were the most successful in edge areas and their particular vital traits. The regeneration and growth of the forest patches to the adjacent matrix depends on the establishment of these species and their tolerance to both habitats. Three types of High Andean edge forest were studied. Two forest patches were chosen for each of the three edge types: Chusquea scandens edge, "paramune" and old-edge; the name of the latter was given because of its advanced successional state. in each patch, the vegetation was evaluated in two 60 m transects perpendicular to the edge and along the matrix-edge-interior gradient of the forest. All woody species were identified and counted to determine their abundance. A total of nine species were chosen as representative of High Andean forest edges in the reserve, because of their high abundance in this environment, their presence in both patches of each edge type and their ability to colonize the adjacent matrix. Each species was evaluated using 20 vital attributes of individual, leaf, and reproductive traits. Six species groups were found through a Correspondence Analysis. However, all nine species have high variation and plasticity levels for the attributes, even inside the groups. This trend suggests that while they are not clearly differentiated functional groups, they probably are representing different strategies within a single functional group of great plasticity. Tibouchina grossa and Pentacalia Pulchella are found in all edge and matrix types; the other species are found in all edge types, except by Gaiadendron punctatum and Weinmannia tomentosa, absent in the Chusquea scandens edge. All nine species are important elements in the restoration of forest edges, mainly where they are more abundant, evidencing their success in the particular conditions of an edge type. Miconia ligustrina and M. squamulosa are the most relevant species in the Chusquea scandens edge and matrix; while G. punctatum, P. pulchella, W. tomentosa, W. balbisiana and especially Macleania rupestris, are more important in the paramune edge and matrix; Hedyosmum bonplandianum is more important in the edge than in the matrix regeneration, while T. grossa is the most successful edge and matrix regeneration species, because it is the most abundant and has high levels of tolerance, vegetative reproduction and litter production. These features are related with a high rate of tissue replacement, as well as a persistent seed bank with smaller and more numerous seeds, evidence of its high fecundity. Rev. Biol. Trop. 56 (2): 705-720. Epub 2008 June 30.
Key words: forest edge, vital traits, disturbance, plant functional groups, restoration ecology, Tibouchina grossa.
El presente trabajo es parte de un conjunto de investigaciones en diferentes aspectos, realizadas en la Reserva Forestal Municipal de Cogua (RFMC), cuya finalidad es reunir información ecológica básica para la realización de experimentos y la definición de estrategias dirigidas a la restauración del bosque altoandino. La Reserva está constituida por predios sometidos en el pasado a explotación agropecuaria, en ella se presentan fragmentos de bosque aislados, separados entre sí por más de 100 m, relativamente pequeños con áreas no mayores a 6 ha e inmersos en una matriz de pastizales abandonados o de zonas paramizadas, colonizadas principalmente por especies herbáceas del páramo. Estos parches presentan diferentes tipos de borde, siendo más comunes los bordes de chusque, los antiguos y los paramizados, cuya historia de disturbio, estructura de la vegetación y condiciones microambientales, entre otros aspectos es diferente; los dos primeros autorregulan su micro-ambiente, siendo el de chusque más cálido y húmedo, el paramizado más frío, seco, carente de autorregulación ambiental, mientras el antiguo exhibe condiciones intermedias entre los otros dos (Montenegro y Vargas, en prep.).
Actualmente, uno de los problemas para la restauración de los bosques fragmentados radica en las limitaciones que enfrentan las especies del bosque en las zonas de borde, deteniendo muchas veces la colonización de la matriz circundante, debido a los efectos de borde y entre ellos, a las condiciones ambientales drásticas que excluyen a muchas especies del bosque (Murcia 1995, Williams-Linera 1990, Williams-Linera et al. 1998, Davies-Colley et al. 2000) y favorecen en algunos casos a especies ajenas al mismo que poseen tolerancia a estos hábitats, como sucede en el borde de chusque y en el paramizado. Por esto, una de las metas principales en la Reserva es lograr la expansión de los parches de bosque hacia la matriz circundante, para aumentar gradualmente el tamaño de los mismos y recuperar su cobertura continua o al menos la conectividad; en los parches se encuentran algunas especies de bosque habitando en los bordes y en cierta medida también en la matriz; estas "especies de borde" podrían ser elementos importantes en la restauración de los fragmentos, dada su tolerancia a ambos ambientes como se reporta en otros ecosistemas, donde especies similares promueven la expansión del bosque y contribuyen a regular las condiciones ambientales para las sucesionales tardías, sensibles debido a sus requerimientos de un hábitat estable y protegido (Bannerman 1998). El presente estudio, además de detectar las especies más exitosas en cada tipo de borde potencialmente adecuadas para su restauración o para la creación de corredores entre parches, también pretende averiguar si estas especies son exitosas en los tres tipos de borde simultáneamente, o si existe un desempeño diferencial reflejado en su abundancia, dependiendo del tipo de borde donde se encuentran, el cual estaría determinado por atributos vitales específicos más favorables bajo las condiciones de un tipo de borde en particular.
Sin embargo, se parte de un vacío en el conocimiento de los atributos vitales de las especies del bosque altoandino, son pocos los estudios en este campo y se han centrado principalmente en comparar en forma puntual estrategias de regeneración de especies como W. tomentosa, Clusia multiflora y Drimys granadensis (Ramos 2002) o en determinar el tipo de dispersión y de banco de semillas de algunas especies (Montenegro y Vargas 2005) pero se desconocen atributos importantes que pueden estar determinando la capacidad para habitar uno u otro tipo de borde y la matriz adyacente. Por lo anterior, surgen varias interrogantes como: ¿Las especies de borde se encuentran en los tres tipos de borde simultáneamente o son más exitosas en un tipo de borde en particular?, ¿Qué atributos vitales poseen?, ¿Sus atributos vitales están relacionados con su habilidad para colonizar con mayor éxito un tipo de borde en particular? y ¿Pueden detectarse grupos funcionales asociados a los tipos de borde?
Materiales y métodos
Sitio de estudio: la RFMC está ubicada a los 5°435" N y 74°0000" W, presenta un ámbito altitudinal entre los 2 970 y 3 650 m, una temperatura media anual de 10.5 ºC, un régimen de lluvias bimodal y un promedio anual de precipitación de 1 046 mm. La Reserva se creó en 1992 mediante la compra de predios por la alcaldía, con el fin de proteger los remanentes de bosque y los nacimientos de las quebradas que abastecen al municipio, tiene una superficie de 500 ha (Zambrano 1995). En la Reserva pueden encontrarse parches de bosque en diferente estado de regeneración dependiendo del régimen de disturbio y del tiempo de abandono transcurrido desde su vinculación a la misma. Los parches con bordes antiguos llevan más tiempo de abandono (14 años) y la regeneración se encuentra en un estado más avanzado, mientras los parches con bordes paramizados o de chusque presentan tiempos de abandono entre seis y nueve años (Díaz 2004) y estados de regeneración menos avanzados. En los bordes de Chusquea scandens la dominancia de esta especie es muy marcada y se reduce gradualmente hacia el interior, abarcando entre 8 y 12 m; este borde como el antiguo posee una estructura donde los árboles alcanzan 10 m de altura en el borde y 15 m en el interior del bosque, su vegetación posee la capacidad de autorregular las condiciones microambientales, siendo el de chusque más cálido y húmedo que el antiguo (Montenegro y Vargas, en prep.). Por su parte, los bordes paramizados, que se ubican generalmente en la cima de las montañas están más expuestos a los factores ambientales, principalmente a la acción directa del viento, ese tipo tiende a ser el más frío y seco de los tres; el porte de los árboles es menor al de las otras clases de borde alcanzando 8 m de altura en el borde y 10 m en el interior del bosque; carece de los árboles más altos, presentes en los otros tipos de borde y debido a esto la vegetación es incapaz de amortiguar las condiciones ambientales drásticas de la matriz circundante (Montenegro y Vargas, en prep.).
Selección de parches y bordes: dada la amplia variedad de estados sucesionales de la vegetación y por consiguiente también de tipos de borde, se decidió considerar sólo aquellos parches de bosque que reunieran los siguientes criterios: a) tamaño superior a 5 000 m2 (0.5 ha), esta área mínima resultó ser suficiente para generar un microclima interior, b) estructura con más de dos estratos y con árboles de más de 7 m de altura cuyas copas conforman un dosel. Los parches con estas características son poco numerosos en la RFMC, se encuentran relativamente aislados al estar separados entre si por distancias superiores a 100 m y sólo presentan los tres tipos de borde investigados. Se evaluaron cinco parches de bosque con áreas entre 0.5 y 6 ha, a pesar de la variación en forma, tamaño de los parches y altitud de los bordes evaluados que varía entre 3 260 y 3 420 m, los fragmentos cumplieron con las especificaciones de área mínima y fisonomía de la vegetación mencionadas anteriormente y presentaron condiciones ambientales y topográficas equivalentes para cada tipo de borde, como reveló su caracterización detallada (Montenegro y Vargas, en prep.).
Vegetación de los tipos de borde: considerando la escasez de los fragmentos de bosque con las características descritas, sólo fue posible escoger dos parches de bosque para cada tipo de borde. En cada parche de bosque, una vez localizado el borde de interés se realizaron dos transectos de 60 m perpendiculares al mismo, abarcando 2 m a lado y lado del transecto, separados entre sí por 10 a 15 m; dejando 20 m en la matriz y los otros 40 m en el bosque. La longitud de los transectos fue determinada por las condiciones topográficas de los parches seleccionados, pues para la mayoría el relieve en su interior no es muy alto y alrededor de 60 ó 70 m (desde el borde) se presenta la cima expuesta a condiciones ambientales adversas y con una estructura de vegetación de menor porte, cobertura rala, semejante a la encontrada en zona de borde. Por este motivo no se tomó una longitud mayor para los transectos en el bosque; sin embargo dicha longitud fue suficiente para detectar el gradiente micro-ambiental, de estructura y composición de la vegetación entre borde e interior del bosque (Montenegro y Vargas, en prep.).
A lo largo de cada transecto interior-borde, se contabilizaron todos los individuos leñosos presentes en el área total de 60x4 m registrando su altura y DAP. Las especies presentes en la Reserva se identificaron en estudios previos realizados en la misma (Acosta 2004, Díaz 2004, Trujillo 2004), cotejadas con ejemplares botánicos del Herbario Nacional Colombiano (COL). La zona de borde se estableció con base en la composición de especies y las condiciones micro-ambientales (Montenegro y Vargas, en prep.).
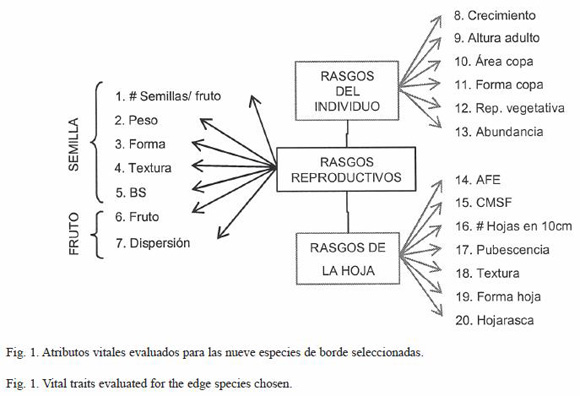
Atributos vitales de las especies de borde: con base en el comportamiento de la abundancia de las especies en los sectores matriz-borde-interior del bosque, se seleccionaron nueve especies de borde con los siguientes criterios: a) Presencia en la zona de borde, en algunos casos con tendencia a ser más abundantes en dicha zona, aunque la proporción entre interior-borde-matriz varía dependiendo de la especie y el tipo de borde; b) capacidad para colonizar la matriz adyacente a por lo menos un tipo de borde y c) presencia simultánea en los dos parches de bosque para cada tipo de borde donde estuvieron presentes. Cabe resaltar que Hedyosmum bonplandianum no coloniza la matriz y su abundancia es baja, pero estuvo presente en todos los parches y bordes analizados por lo que se incluyo como especie importante. Por otra parte, la abundancia puede considerarse un reflejo de la tolerancia de las especies a las condiciones de cada tipo de borde, más que una consecuencia de la disponibilidad de fuentes de semillas, considerando que aunque las semillas arriben a un sitio, el establecimiento y desarrollo del individuo está dado por el desempeño diferencial de las especies determinado por sus atributos vitales en relación con las condiciones particulares del hábitat y las interacciones bióticas (Ricklefs y Miller 1999). A las especies seleccionadas se les evaluaron 20 atributos vitales (Fig. 1) considerando su facilidad de medición y su repetibilidad en otras comunidades:
1. Rasgos del individuo: pueden estar asociados con la estrategia de la planta ante factores ambientales, indican la capacidad de un individuo para adquirir espacio. Estos atributos se evaluaron durante los levantamientos de vegetación para cada individuo registrado (Williams-Linera 1990, Williams-Linera et al. 1998, Cornelissen et al. 2003, Kolb y Diekmann 2005).
2. Rasgos de la hoja: son rasgos relevantes en la adquisición y uso de los recursos por la especie, representan la cantidad de área y masa que destina una hoja a la captura de luz y al almacenamiento de nutrientes. Usualmente se consideran dos índices: a) Área foliar específica (AFE) expresada como área foliar/peso seco (Garnier et al. 2001, Reich et al. 2003). b) Contenido de materia seca foliar (CMSF) expresado en términos de peso fresco x peso seco (Garnier et al. 2001, Li et al. 2005). Se escogieron cinco individuos por especie, en cada uno se recolectaron diez hojas desarrolladas para estimar los índices (Garnier et al. 2001) y se tomaron cinco ramas para contabilizar el número de hojas en 10 cm (Díaz et al. 1999b). Para la hojarasca se despejaron 16 parcelas de 1 m2 por especie, subdivididas en 25 cuadritos, al cabo de 20 días se estimó la cobertura de ésta en dicha área (Palacios-Bianchi 2002).
3. Rasgos reproductivos: permiten establecer la forma en que una especie puede llegar a nuevos ambientes y su capacidad para establecerse evadiendo condiciones desfavorables (Grime 1979). Se tomaron entre 25 y 30 frutos por especie, se contaron y pesaron las semillas contenidas en ellos, evaluando paralelamente sus atributos morfológicos. El tipo de dispersión y de banco de semillas se establecieron con base en trabajos previos realizados en el bosque altoandino (Jaimes y Rivera 1990, Acosta 2004, Montenegro y Vargas 2005), considerando: banco de semillas persistente (BSP) aquel con semillas que permanecen viables por más de un año, pseudopersistente (BSPP) cuyas semillas viven menos de un año, o transitorio (BST) con semillas de muy corta vida.
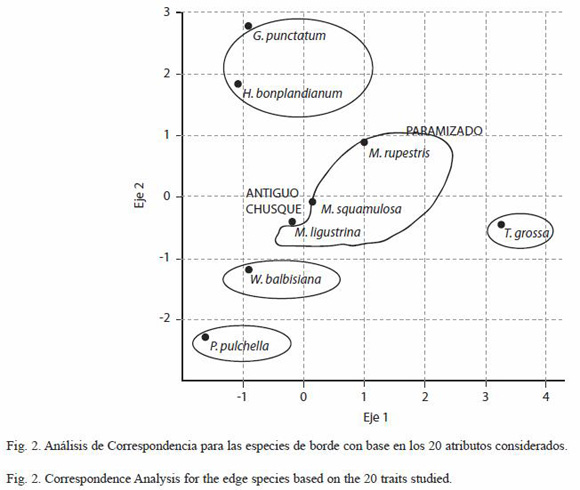
Análisis de datos: se realizó un Análisis de Correspondencia (AC) basado en los 20 atributos vitales estudiados para las nueve especies (Fig. 1) con el fin de establecer la existencia de grupos obtenidos a partir de los atributos compartidos por las mismas, que pueden estar relacionados con los tipos de borde; se usó el programa PAST versión 1.40 (Hammer et al. 2001) actualización enero de 2006.
Resultados
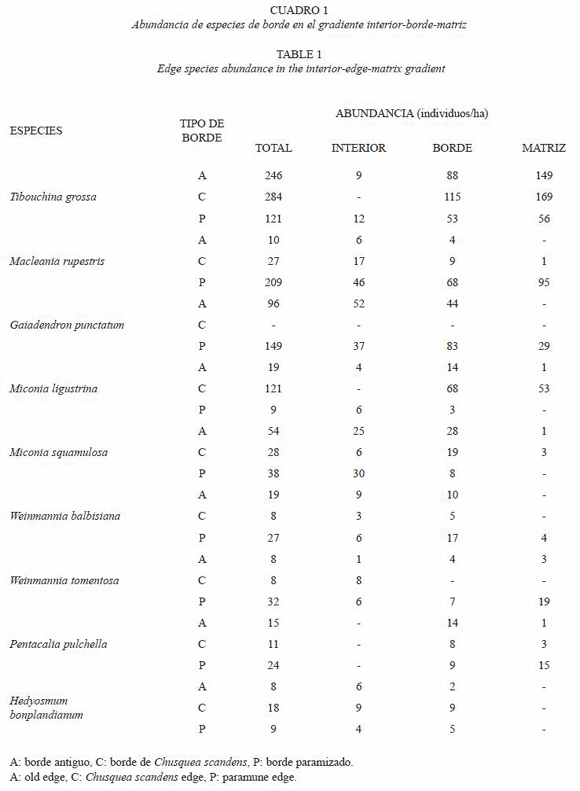
Especies de borde: se obtuvo un conjunto de nueve especies, el resumen de sus atributos se presenta en el Anexo 1. Entre ellas, dos especies P. pulchella y T. grossa son capaces de habitar en todos los tipos de borde y matriz investigados, siendo la segunda la especie más abundante en la Reserva (Cuadro 1); la mayoría de las especies (cinco) tiene la capacidad de habitar simultáneamente en todos los tres tipos de borde, variando su abundancia pero no colonizan todos los tipos de matriz: W. balbisiana, M. rupestris, M. ligustrina, M. squamulosa y H. bonplandianum; solamente dos especies G. punctatum y W. tomentosa no habitan el borde de chusque ni su matriz. Comparando la abundancia de las especies, aquellas que prefieren el borde paramizado (M. rupestris, G. punctatum, W. balbisiana y W. tomentosa) también son capaces de tolerar su matriz, pero en general no habitan la matriz adyacente a los bordes antiguo o de chusque, si lo hacen su abundancia es muy baja, no supera tres individuos/ha, al igual que su presencia en dichos bordes (máximo diez individuos/ha), excepto por G. punctatum en el antiguo. En contraste, excluyendo a T. grossa, dada su alta abundancia en todos los bordes, las otras especies que prefieren el borde de chusque (M. ligustrina, M. squamulosa) reducen su densidad en más de un 70 % en el borde paramizado y no colonizan su matriz. Por su parte, H. bonplandianum parece preferir el borde de chusque considerando que su densidad es baja y no supera los nueve individuos/ha. Adicionalmente, el borde antiguo cuyas condiciones microambientales son moderadas e intermedias entre las del borde de chusque y el paramizado, como es de esperar contiene a todas las especies a la vez, con una abundancia intermedia en relación con la exhibida en los otros bordes.
Grupos de especies de borde: el Análisis de Correspondencia (AC) explica el 96 % de la varianza con dos ejes (Fig. 2); se obtienen seis grupos de especies, de los cuales dos parecen estar más relacionados con el borde paramizado (G. punctatum -H.bonplandianum, M. rupestris) y uno con los bordes de chusque y antiguo (M. ligustrina – M. squamulosa); tres de los seis conjuntos comparten un alto número de atributos, entre 14 y 15, al interior de los mismos: 1) W. balbisiana – W. tomentosa, 2) G. punctatum – H. bonplandianum y 3) M. ligustrina – M. squamulosa. Por su parte, 4) M. rupestris comparte sólo cinco atributos con el segundo grupo tales como tolerancia al borde paramizado, rasgo exhibido principalmente por G. punctatum, semillas relativamente pesadas y BST; en contraste con el grupo de Miconia, con el que comparte 13 atributos entre una y otra de sus dos especies; sin embargo, las Miconia son más abundantes en los bordes de chusque y antiguo, mostrando baja tolerancia al borde paramizado, ninguna a su matriz y difieren también en el peso de la semilla y el tipo de banco; por esto, se consideró a M. rupestris en forma independiente. Los otros grupos los componen 5) T. grossa y 6) P. pulchella, respectivamente, dados sus atributos particulares y su capacidad para habitar en todos los tipos de borde y matriz, que las ubican lejos de las demás especies. Adicional a la obtención de grupos de especies de borde, debe considerarse que la mayoría de los rasgos analizados presenta una amplia variación generando en algunos casos solapamiento entre los grupos de especies; es necesario buscar la existencia de relaciones entre los atributos evaluados, con base en las asociaciones reportadas en la literatura como parte de las estrategias de historia de vida de las especies, para establecer si los conjuntos de especies obtenidos corresponden a grupos funcionales.
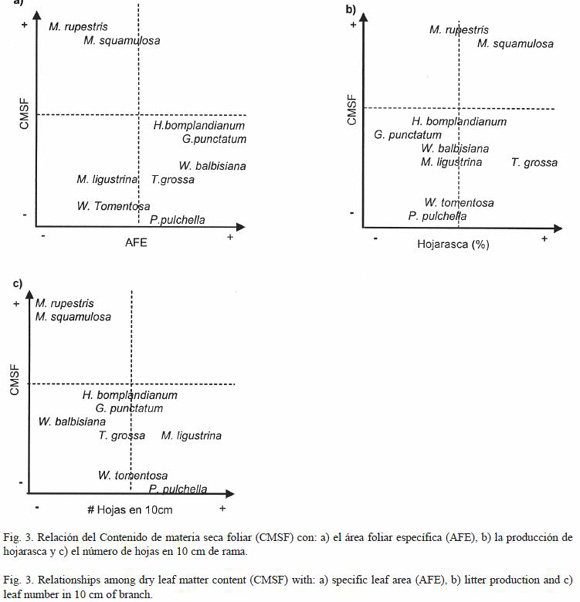
Rasgos de la hoja: en la RFMC se presentan especies con comparativamente bajo CMSF, menor a 0.1 y alta AFE, mayor a 100 (Anexo 1 y Fig. 3A) como G. punctatum -H. bonplandianum, W. balbisiana - W. tomentosa, T. grossa, P. pulchella y M. ligustrina que posee moderada AFE; todas tienen alta producción de hojarasca (Fig. 3B) exceptuando a G. punctatum. Por su parte, W. tomentosa, T. grossa, P. pulchella y M. ligustrina tienen además alta densidad de hojas, entre 27 y 49 (Fig. 3C), en contraste con W. balbisiana, G. punctatum -H. bonplandianum que tienen entre 12 y 24 (Fig. 3C). Por otro lado se encuentran las especies con alto CMSF (3.5 y 3.8) M. squamulosa con un valor intermedio en su AFE (90) y M. rupestris con una baja AFE (43) (Fig. 3A), ambas especies poseen una alta producción de hojarasca (Fig. 3B) y baja densidad de hojas, 12 en 10 cm de rama (Fig. 3C).
Rasgos reproductivos: en la RFMC se identifican tres tendencias relacionando la reproducción vegetativa y el número de semillas por fruto (NSPF); en la primera se tiene una alta expansión vegetativa unida a un alto NSPF (600 en promedio) como sucede con T. grossa (Fig. 4A). En la segunda, las especies exhibieron una moderada a alta propagación vegetativa y un moderado NSPF como M. rupestris (89), M. ligustrina (78) - M. squamulosa (142). La tercera corresponde a las especies que presentaron baja reproducción vegetativa y un bajo NSPF como G. punctatum (1) -H. bonplandianum (2), W. tomentosa -W. balbisiana (5) y P. pulchella (32). Por último, tradicionalmente se reconoce una relación entre el peso de las semillas, el tipo de dispersión, la persistencia de las mismas y sus requerimientos de germinación (Thompson 1993). Así, las semillas grandes y pesadas, usualmente son zoócoras, en las especies analizadas es el caso de G. punctatum (27 mg) - H. bonplandianum (7 mg) y M. rupestris (0.5 mg), que tienden a formar BST (Fig. 4B). A su vez, las semillas pequeñas y ligeras suelen asociarse con la formación de BSP, que suele estar asociado con una alto NSPF y dispersión anemócora (Montenegro y Vargas 2005) como sucede en T. grossa, o BSPP con moderado a bajo NSPF como en Miconia sp., P. pulchella y Weinmannia sp. (Fig. 4B). Si bien el peso de la semilla de P. pulchella parece alto (0.3 mg), buena parte del mismo corresponde a estructuras especializadas para la dispersión por el viento.
Discusión
El régimen de disturbio de la reserva, unido a características topográficas generó hábitats de borde particulares con condiciones microambientales específicas (Montenegro y Vargas, en prep.). La obtención de seis grupos de especies asociados en forma variable con los tipos de borde, de acuerdo con su tolerancia ambiental reflejada en su abundancia y su configuración de rasgos típicos, revela un desempeño diferencial de las especies en cada tipo de borde. Sin embargo, dichos grupos cambian de composición dependiendo tanto de los atributos analizados como de los ámbitos de éstos; la alta variación presente incluso entre elementos de un mismo grupo en algunos casos, conduce a pensar que dichos conjuntos no obedecen a grupos funcionales claramente diferenciados, aunque pueden estar reflejando estrategias diferentes para mantenerse en los diferentes tipos de borde; estas estrategias estarían determinadas por los atributos reproductivos, considerando que son los más importantes al establecer el ambiente donde puede habitar una especie y determinan su historia de vida (Coomes y Grubb 2003). Por otro lado, las nueve especies estudiadas podrían hacer parte de un solo grupo funcional de especies de borde de gran plasticidad, cualidad apreciable bajo las condiciones particulares de disturbio de la RFMC y también entre ambientes, pues en bosques poco disturbados algunas tienen un desempeño diferente y tradicionalmente se reportan como especies de interior (como Weinmannia sp., H. bonplandianum) mientras en las condiciones disturbadas de la RFMC, cambian su desempeño comportándose como especies de borde capaces de colonizar la matriz adyacente. Sin embargo, los atributos estudiados no brindan una total certeza de la existencia de este único grupo funcional; sería relevante profundizar en los atributos ecofisiológicos implicados en su tolerancia ambiental particular. Por otra parte, la asociación entre especies, atributos y tipos de borde no es contundente ni exclusiva; como las especies habitan más de un borde a la vez, la preferencia de una especie por un borde revela una mayor ventaja de algunos rasgos en ese hábitat pero sin excluirla de otros. Lo anterior revela que pueden existir varias estrategias adecuadas para habitar un borde en particular y a su vez, que una misma estrategia puede funcionar en más de un borde simultáneamente como se reporta bajo otras circunstancias (Westoby et al. 2002, Rusch et al. 2003).
En el borde antiguo el proceso de regeneración natural está sucediendo de manera autónoma, luego no requiere intervención para su restauración (Montenegro y Vargas en prep.), mientras en los bordes de chusque y paramizado se presenta la colonización por parte de especies ajenas al bosque, que junto con condiciones ambientales drásticas someten a las especies de borde a estrés por competencia y /o ambiental; es en estos bordes donde el desempeño diferencial de las especies puede determinar su grado de éxito en los mismos y por ende su potencial para la restauración. Por lo anterior, pueden detectarse diferentes estrategias en los grupos de especies exitosas en un borde determinado. Así en el borde de chusque los grupos más exitosos son el de las especies zoócoras M. ligustrina -M. squamulosa y el de la especie anemócora T. grossa; para estas especies la reproducción vegetativa moderada a alta es ventajosa en presencia del chusque, debido a que el principal inconveniente radica en la competencia por luz, espacio y nutrientes, además de la alta mortalidad de las plántulas del bosque que podrían establecerse, debido a la gran cantidad de hojarasca producida por C. scandens (Trujillo 2004); ambos grupos de melastomatáceas además cuentan con la formación de un BSPP o BSP, rasgo importante para lograr la masiva proliferación periódica de jóvenes cuando habita la muerte del chusque en su borde. Si se controla el chusque, las especies mencionadas podrían contribuir a la expansión del bosque, colonizando la matriz adyacente y generando condiciones ambientales más benignas tanto para otras especies de borde como W. balbisiana y H. bonplandianum que solas no toleran esta matriz, como para las especies sensibles del bosque maduro, como habita en el borde antiguo.
Por su parte, otro grupo de especies zoócoras prefiere los bordes paramizado y antiguo en el caso de G. punctatum y H. bonplandianum que además habita en el borde de chusque; ellas poseen una baja reproducción vegetativa en contraste con los grupos de especies más exitosas en el borde de chusque, pero en forma semejante al grupo formado por M. rupestris que prefiere el borde paramizado, poseen semillas pesadas y forman BST, aunque difieren en los atributos de sus hojas, cabe destacar que las únicas plántulas halladas en campo pertenecen a H. bonplandianum y M. rupestris, confirmando el valor de poseer una semilla relativamente grande o pesada para favorecer el establecimiento, incluso en situaciones de estrés ambiental (Ozinga et al. 2004) como habita en el borde paramizado.
El grupo formado por M. rupestris es particular, esta especie exitosa en el borde y la matriz paramizada, a diferencia de las otras que exhiben esta tendencia, también es capaz de colonizar el borde y la matriz de chusque, aunque en bajo número, evidenciando su alta plasticidad en los requerimientos lumínicos y en la tolerancia ambiental; estos aspectos contrastan principalmente con el grupo de Miconia, que requieren condiciones ambientales relativamente estables prefiriendo los bordes de chusque y antiguo. Sin embargo, un aspecto crucial en estas especies es su reproducción vegetativa media a alta, confiriéndoles una ventaja en la regeneración posterior a un disturbio y en la adquisición de espacio (Mcintyre et al. 1999) lo cual se observa en la tendencia de las Miconia a colonizar el borde de chusque cuando éste muere y de M. rupestris a colonizar los claros en el bosque. Por otra parte, las hojas de esta especie poseen un alto CMSF (3.8) comparable en este estudio solamente con el de M. squamulosa (3.5), este atributo se asocia con una alta inversión de recursos para su defensa o protección contra las heladas (Garnier et al. 2001, Reich et al. 2003, Li et al. 2005) aspecto clave para M. rupestris en el borde paramizado.
Por otro lado, en la RFMC los tres grupos de especies anemócoras investigados (T. grossa, P. pulchella, W. tomentosa -W. balbisiana) son exitosos en el borde paramizado, poseen semillas pequeñas, que en el grupo de Weinmannia tienen la testa cubierta de pelos para la dispersión; estas características resultan ventajosas en el borde paramizado pues facilitan la adhesión y el establecimiento en micro-sitios adecuados como las grietas y el musgo de los troncos caídos (Lusk y Kelly 2003), los cuales son más comunes en este tipo de borde. Además los tres grupos forman BSPP o BSP que pueden activarse fácilmente bajo los claros del dosel generados por la muerte y caída de los árboles más grandes, fenómeno característico en este borde. En cuanto a sus hojas tienen alta AFE y bajo CMSF, condiciones asociadas con una alta producción de biomasa, relativamente alta velocidad de crecimiento y de recambio de tejidos (Garnier et al. 2001, Reich et al. 2003, Li et al. 2005), dependiendo de su forma de crecimiento (arbusto o árbol). Adicionalmente, la forma de la hoja es un atributo primordial para estas especies en contraste con los demás grupos, pues su mayor presencia en la matriz, especialmente en la paramizada que exhibe el ambiente más drástico, puede relacionarse con el menor tamaño de sus hojas, la forma compuesta y/o la presencia de pelos, rasgos que confieren mayor protección contra los extremos de temperatura y las heladas (Gutschick 1999, Roy et al. 1999) al estar asociados con una mayor resistencia de las plantas a un ambiente adverso (Kappelle y Leal 1996). Estos grupos de especies anemócoras junto con M. rupestris y G. punctatum, aunque difieren en sus atributos y estrategias, son importantes en la restauración del borde y la matriz paramizada, los cuales requieren la mayor intervención debido a sus condiciones ambientales más adversas en contraste con los demás tipos investigados. Al parecer, la presencia de arbustos y árboles en la matriz paramizada contribuye a reducir el efecto de borde al interior del bosque amortiguando las condiciones microambientales de temperatura, humedad y viento, entre otras (Montenegro y Vargas, en prep.); luego la presencia de estas especies facilitaría el establecimiento de otras del borde con poca tolerancia a condiciones extremas como el grupo de M. ligustrina -M. squamulosa y también H. bonplandianum. Adicionalmente, dicha regulación ambiental reduciría la mortalidad y caída de los árboles más altos, ausentes en este tipo de borde y principales responsables de la mitigación microclimática en el sotobosque, como se reporta en otros bosques (Chen et al. 1999); esto permitiría a futuro el establecimiento de las especies sensibles de mayor porte típicas del bosque maduro, que se encuentran en otros sectores del mismo parche, como Oreopanax bogotensis y Schefflera sp.
En cuanto a los demás atributos investigados, los tres grupos de especies anemócoras difieren entre sí en su reproducción vegetativa, que es baja excepto para T. grossa cuyo alto valor de este atributo es clave en su éxito en el borde de chusque; también difieren en el NSPF y seguramente en sus niveles de tolerancia fisiológica. P. pulchella comparte con el grupo de las Weinmannia la baja reproducción vegetativa y el carácter pseudopersistente de sus semillas. Dada la capacidad de los grupos formados por P. pulchella y T. grossa para colonizar todos los tipos de matriz y borde, se pone en manifiesto su alta tolerancia fisiológica a las condiciones ambientales adversas, destacando que en la RFMC la última es la especie más exitosa y abundante en los tres tipos de borde, debido a su combinación de rasgos particular que incluye el NSPF más alto de las especies estudiadas, cuya forma compacta y tamaño pequeño contribuyen a la formación de un BSP, unidos a una alta reproducción vegetativa y rasgos de la hoja como la pubescencia y el tamaño pequeño que le confieren resistencia ante las condiciones extremas fluctuantes, especialmente en el caso de la temperatura, las sequías y la protección contra el ataque de herbívoros como reportan Gutshick (1999) y Roy et al. (1999) en otras especies; su alta plasticidad le permite ser la especie más abundante en todos los bordes y matrices investigados, lo que la convierte en el elemento más importante en la regeneración del bosque y en su expansión hacia la matriz.
Agradecimientos
Este trabajo fue realizado gracias a la financiación de COLCIENCIAS, el apoyo de la alcaldía y la UMATA del municipio de Cogua, así como del personal de guardabosques y la Escuela de Restauración Ecológica de la Universidad Nacional de Colombia.
Resumen
En la Reserva Forestal de Cogua (Colombia), estudiamos mediante transectos la vegetación leñosa en dos parches de bosque altoandino para tres tipos de borde: chusque, paramizado y antiguo (este último denominado así por presentar un estado sucesional más avanzado). Seleccionamos como especies típicas de borde las que tenían mayor abundancia en esta zona, presentes en ambos parches del borde y capaces de colonizar la matriz adyacente. Se obtuvo un conjunto de nueve especies a las cuales se les evaluaron 20 atributos vitales, generando seis grupos mediante un análisis de agrupamiento (cluster): 1) Weinmannia balbisiana-W. tomentosa, 2) Gaiadendron punctatum-Hedyosmum bonplandianum, 3) Miconia ligustrina-M. squamulosa, 4) Macleania rupestris, 5) Pentacalia pulchella y 6) Tibouchina grossa. La amplia variación y plasticidad de las especies estudiadas en cuanto a los atributos analizados, conduce a pensar que los conjuntos obtenidos no obedecen a grupos funcionales claramente diferenciados, sino más bien a estrategias diferentes y que estas especies podrían hacer parte de un solo grupo funcional de gran plasticidad. T. grossa es la especie de borde más exitosa en la reserva, dados sus altos valores de abundancia, tolerancia fisiológica, reproducción vegetativa, producción de hojarasca y producción de semillas pequeñas, numerosas, formadoras de un banco de semillas persistente que evidencian su alta fecundidad.
Palabras clave: atributos vitales, bordes de bosque, disturbio, grupos funcionales, restauración ecológica, Tibouchina grossa.
Referencias
Acosta, M.S. 2004. Efecto de borde sobre el banco de semillas germinable en un fragmento de bosque alto andino (Reserva forestal municipal de Cogua, Cundinamarca). Trabajo de grado, Departamento de Biología, Universidad Nacional, Bogotá, Colombia. [ Links ]
Bannerman, S. 1998. Biodiversity and interior habitats: The need to minimize edge effects. Extension note 21, p. 1-8. In Biodiversity management concepts in Landscape Ecology. Ministry of forest Research program, British Columbia, Canadá. [ Links ]
Chen, J.S.S., T. Crow, R. Naiman, K. Brosofske, G. Mroz, B.Y Brookshire & J. Franklin. 1999. Microclimate in forest ecosystem and landscape ecology. Variations in local climate can be used to monitor and compare the effects of different management regimes. BioScience 49: 288-297. [ Links ]
Coomes, D. & P.J. Grubb. 2003. Colonization, tolerance, competition and seed-size variation within functional groups. TREE 18: 283-291. [ Links ]
Cornelissen, J., S. Lavorel, E. Garnier, S. Diaz, N. Buchmann, D. Gurvich, P. Reich, H. ter Steege, H. Morgan, M. van der Heijden, J. Pausas & H. Poorter. 2003. A handbook of protocols forstandarised and easy measurement of plant functional traits worldwide. Aust. J. Bot. 51: 335-380. [ Links ]
Davies-Colley, D., G. Payne & M. Elswijk. 2000. Microclimate gradients across a forest edge. New Zealand. J. Ecol. 24: 111-121. [ Links ]
Díaz, M.C., M. Zunzunegui, R. Tirado, F. Ain-Lhout & F. García-Novo. 1999a. Plant functional types and ecosystem function in Mediterranean shrubland. J. Veg. Sci. 10: 709-716. [ Links ]
Díaz, R. 2004. Variación espacio-temporal de la lluvia de semillas en pastizales abandonados de alta montaña. Trabajo de grado, Departamento de Biología, Universidad Nacional, Bogotá, Colombia. [ Links ]
Díaz, S., M. Cabido, M. Zak, E. Martínez & J. Araníbar. 1999b. Plant functional traits, ecosystem structure and land-use history along a climatic gradient in central-western Argentina. J. Veg. Sci. 10: 651-660 [ Links ]
Díaz, S. & M. Cabido. 2001. Vive la difference: plant functional diversity matters to ecosystem processes. Tree 16: 646-655. [ Links ]
Garnier, E., G. Laurent, A. Bellmann, S. Debain, P. Berthelier, B. Ducout, C. Roumet & M. Navas. 2001. Consistency of species ranking based on functional leaf traits. New Phytol. 152: 69-83. [ Links ]
Grime, J.P. 1979. Plant strategies and vegetation processes. Wiley, Nueva York, EEUU. [ Links ]
Gutschick, V.P. 1999. Research reviews biotic and abiotic consequences of differences in leaf structure. New Phytol. 143: 3-18. [ Links ]
Hammer, Ø., D.A.T. Harper & P.D. Ryan. 2001. PAST: Palaeontological Statistics software package for education and data analysis. Paleontología electrónica 4: 9 p. PAST version 1.40 Øyvind Hammer y D.A.T. Harper (enero 2006). [ Links ]
Jaimes, V. & D. Rivera. 1990. Banco de semillas y tendencias en la regeneración natural de un bosque altoandino en la región de Monserrate, Colombia. Trabajo de grado, Departamento de Biología, Universidad Nacional, Bogotá, Colombia. [ Links ]
Kappelle, M. & M. Leal. 1996. Changes in leaf morphology and foliar nutrient status along a successional gradient in a Costa Rican upper montane Quercus forest. Biotropica 28: 331-344. [ Links ]
Kolb, A. & M. Diekmann. 2005. Effects of life-history traits on responses of plant species to forest fragmentation. Conserv. Biol. 19: 929-938. [ Links ]
Li, Y., D.A. Johnson, Y. Su, J. Cui & T. Zhang. 2005. Specific leaf area and leaf dry matter content of plants growing in sand dunes. Bot. Bull. Acad. Sin. 46: 127-134. [ Links ]
Lusk, C. & C. Kelly. 2003. Interspecific variationin seed size and safe sites in a temperate rain forest. New Phytol. 158: 535-541. [ Links ]
Mcintyre, S., S. Lavorel, J. Landsberg & T.D. Forbes. 1999. Disturbance response in vegetation-towards a global perspective on functional traits. J. Veg. Sci. 10: 621-630. [ Links ]
Montenegro, A.L. & O. Vargas. 2005. Estrategias de regeneración del banco de semillas en una comunidad de bosque alto andino secundario, p. 227-246. In M.A. Bonilla (ed.). Estrategias adaptativas de plantas del páramo y del bosque altoandino en la cordillera oriental de Colombia. Universidad Nacional, UNIBIBLOS, Bogotá, Colombia. [ Links ]
Murcia, C. 1995. Edge effects in fragmented forest: implications for conservation. Tree 10: 58-62. [ Links ]
Ozinga, W., R. Bekker, J. Schaminée & J. Van Groenandael. 2004. Dispersal potencial in plant communities depends on environmental conditions. J. Ecol. 92: 767-777. [ Links ]
Palacios-Bianchi, P. 2002. Producción y descomposición de hojarasca en un bosque Maulino fragmentado. Seminario de titulo, Biología ambiental, Universidad de Chile, Santiago, Chile. [ Links ]
Ramos, C. 2002. Estrategias regenerativas de Clusia multiflora, Drimys granadensis y Weinmannia tomentosa en el bosque alto andino. Trabajo de grado, Departamento de Biología, Universidad Nacional, Bogotá, Colombia. [ Links ]
Reich, P.B., . Wright, J. Cavender-Bares, J. Craine, J. Oleksyn, M. Westoby & M. Walters. 2003. The evolution of plant functional variation: traits, spectra and strategies. J. Plant Sci. 164: S143-S164.
Ricklefs, R. & G. Miller. 1999. Ecology. W.H. Freeman, Nueva York, EEUU. [ Links ]
Roy, B.A., M. Stanton & S. Eppley. 1999. Effects of environmental stress in leaf hair density and consequences for selection. J. Evol. Biol. 12: 1089-1113. [ Links ]
Rusch, G.M., J. Pausas & J. Leps. 2003. Plant functional types in relation to disturbance and land use: introduction. J. Veg. Sci. 14: 307-310. [ Links ]
Thompson, K. 1993. Seeds persistence in soil, p. 199-202. In G. Hendry & J.P. Grime (eds.). Methods in comparative plant ecology, a laboratory manual. Chapman & Hall, Nueva York, EEUU. [ Links ]
Trujillo, L. 2004. Caracterización de bordes con Chusquea scandens y evaluación de la regeneración luego de disturbios experimentales. Trabajo de grado, Departamento de Biología, Universidad Nacional, Bogotá, Colombia. [ Links ]
Westoby, M., D. Falster, A. Moles, P. Vesk & I. Wright. 2002. Plant ecological strategies: some leading dimensions of variation between species. Ann. Rev. Ecol. Syst. 33: 125-159. [ Links ]
Williams-Linera, G. 1990. Vegetation structure and environmental conditions of forest edges in Panama. J. Ecol. 78: 356-373. [ Links ]
Williams-Linera, G., V. Dominguez-Gastelú & M. García-Zurita. 1998. Micro environment and floristics of different edges in a fragmented tropical rainforest. Conserv. Biol. 12: 1091-1102. [ Links ]
Zambrano, M.A. 1995. Plan de manejo del área de Reserva Forestal Protectora de los nacimientos de quebradas Honda y Calderitas en el municipio de Cogua. Corporación Autónoma Regional de Cundinamarca (CAR). Subdirección de operaciones de áreas protegidas. Bogotá, Colombia. [ Links ]