Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.54 n.3 San José Sep. 2006
Reproducción y alimentación del tiburón enano Mustelus dorsalis (Pisces: Triakidae) en el Golfo de Nicoya, Costa Rica: Elementos para un manejo sostenible
José Rodrigo Rojas M.
Apdo. 20-4200, Naranjo, Alajuela, Costa Rica; rrojasm@ice.go.cr; yoyi66@yahoo.com
Recibido 20-X-2005. Corregido 14-II-2006. Aceptado 23-V-2006.
Abstract: Reproduction and feeding habits of Mustelus dorsalis (Pisces: Triakidae) in the Gulf of Nicoya, Costa Rica: Elements for a sustainable management. A total of 311 sharptooth smooth-hound Mustelus dorsalis were collected in the Gulf of Nicoya, Costa Rica from March 1999 to May 2000 to determine reproduction and feeding habits. The fishes were collected using hook and line. 250 females and 61 males were identified. The females are bigger (550-660 mm) and heavier (400-1 000 g) than males (500-585 mm and 200-300 g, respectively). All samples collected were mature and the minimum length to first maturity observed is 500 and 541 mm for females and males, respectively. From September to March individuals were mature, while samples caught during April and August were immature. A total of 1 259 embryos were analyzed. Number of embryos per liter ranged from two to six, the total length is from 130 to 205 mm and the weight from 6 to 35 g. This shark is a polyphagous opportunistic carnivore that preys on crustaceans (Squilla hancocki, S. parva, Litopenaeus sp.), fishes (Anchoa sp., Caranx sp., Lutjanus sp., Engraulis sp.) and mollusks (Loligo sp. and Octopus sp.). Main prey item was S. hancocki. The presence of mature sharks of both sexes along the year and the consumption of food items associated to shallow coastal rocky waters suggest that this sector of Nicoya Gulf is a nursery ground and an essential habitat. Based on these results the establishment of an integral management plan is proposed. Rev. Biol. Trop. 54 (3): 861-871. Epub 2006 Sept. 29.
Key words: Mustelus dorsalis, reproduction, stomach content analysis, Gulf of Nicoya, Costa Rica.
El género Mustelus (Triakidae) está compuesto por 20 especies, dos de ellas, M. dorsalis y M. lunulatus, han sido reportadas para las aguas del Pacífico Oriental costarricense (Bussing y López 1996). M. dorsalis (Gill, 1864) se distribuye desde el Golfo de México hasta el Golfo de Guayaquil (Compagno 1984). Comercialmente es conocido como toyo, cazón, bolillo, bolillón o mamón. Junto con 13 especies de camarones (Penaeidae), cinco especies de corvinas (Sciaenidae) y tres especies de pargo (Lutjanidae), conforma el suministro más importante de proteína y recursos económicos para miles de personas que viven en el Golfo de Nicoya (J.R. Rojas obs. pers. 2005). A pesar de su manifiesta importancia y como la mayoría de las especies de tiburones de este sector del Pacífico, M. dorsalis es desde el punto de vista ecológico, una especie prácticamente desconocida. Ignoramos aspectos básicos de su estrategia de vida, entre ellos las épocas y lugares de reproducción, fecundidad y requerimientos alimentarios. Ante esta situación se ha desarrollado una investigación que tiene como objetivo describir las características básicas de la reproducción y alimentación de M. dorsalis, reconociendo que estos elementos deben constituirse en insumos básicos para el establecimiento de un programa de educación marina, conservación, manejo y uso sostenible de los recursos marino costeros en Costa Rica, con extensión a otros sectores del Pacífico Tropical Oriental.
Materiales y métodos
Entre marzo de 1999 y mayo del 2000 se obtuvieron ejemplares de M. dorsalis a partir de desembarques de pescadores artesanales en Tárcoles, Golfo de Nicoya, Costa Rica. Las zonas de pesca se encuentran en la franja marina entre Playa Jacó e Isla Tortuga, incluyendo los bajos de Herradura y Tárcoles (10º N, 84º50W). Todas las jornadas de pesca fueron nocturnas. Los tiburones se capturaron utilizando línea con anzuelos número siete y trozos de lisa (Opisthonema sp.) como carnada, la profundidad de captura fue entre los 25 y 100 metros. A cada ejemplar se le determinó la longitud total y estándar (±0.5 cm) y el peso total (±0.5 g). La determinación de la madurez sexual se llevó a cabo visualmente, tal como lo sugieren Yudin y Cailliet (1990), Castro (1996) y Márquez-Farias et al. (1998). Los machos se diferenciaron por la presencia de mixopterigios y su estado de madurez se hizo visualmente reconociendo el grado de calcificación, presencia o ausencia de semen, grado de rotación, turgencia y el desarrollo de vascularización de los órganos copuladotes. La identificación y estado de madurez de las hembras se llevó a cabo mediante el reconocimiento del oviducto, presencia de literas con embriones o huevos y características externas del himen, así como cicatrices por cópula (Yudin y Cailliet 1990). Las épocas de reproducción fueron determinadas considerando la distribución de frecuencias de hembras con embriones, el tamaño de los embriones y la presencia de huevos en estados avanzados de desarrollo. Los embriones fueron medidos (±01. cm) y pesados (±0.1 g) y preservados en formaldehído al 10 %. El contenido estomacal fue lavado y vertido en una caja Petri. La identificación de los ítems alimentarios se hizo hasta el taxón más bajo posible. La ictiofauna se identificó mediante características osteológicas y anatómicas externas (Allen y Robertson 1994). Los crustáceos fueron identificados mediante la clave de Pérez-Farfante (1971). El análisis del contenido estomacal se hizo de acuerdo con lo que propone Hyslop (1980) y Rojas (1996, 1997).
Resultados
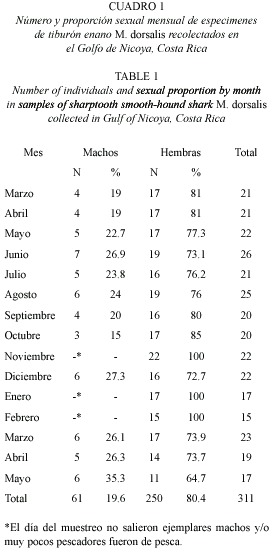
Quince meses de muestreo permitieron el análisis de 311 ejemplares, 250 son hembras (80.4 %) y 61 machos (19.6), para una proporción sexual de 0.25:1 (macho:hembra) (Cuadro 1). No se capturaron juveniles, únicamente machos y hembras maduras. En términos generales las hembras son más grandes (550 a 660 mm) vs. (500-585 mm) y más pesadas (400) (1000 g) vs. (200-300 g) que los machos. En el Cuadro 1 y 2 se presenta información sobre la distribución de pesos, tallas, número de ejemplares por sexo, así como el número de ejemplares en los diferentes intervalos de tallas de machos y hembras.
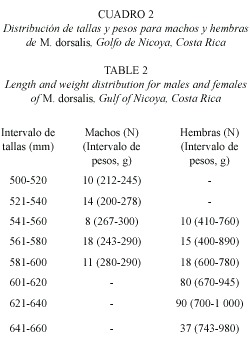
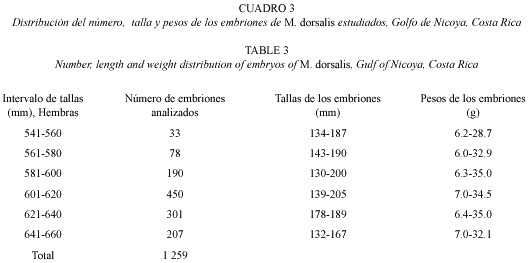
No se logró determinar la talla de la primera madurez, ya que no se encontraron ejemplares vírgenes. La talla mínima de especimenes maduros varió entre 500 y 541 mm para hembras y machos respectivamente. No se evidenció una marcada época de reproducción, ya que todos los ejemplares analizados estaban maduros o acababan de reproducirse, sin embargo entre septiembre y marzo las hembras analizadas portaban los embriones de mayor tamaño, probablemente listos para ser expulsados. Se estudiaron 1 259 embriones. Por hembra hay entre 4 y 10 y por litera hay un mínimo de dos hasta un máximo de seis. La longitud total de los embriones es entre 130 y 205 mm y el peso fluctúa entre 6 y 35 g. El análisis de varianza (ANDEVA) señala que no existen diferencias estadísticamente significativas (p = α 0.05) entre la talla, ni peso de la hembra y el número, talla, tamaño y peso de los embriones de embriones. En el Cuadro 3 se presenta la distribución de las tallas y pesos de embriones de acuerdo con el intervalo de tallas de las hembras.
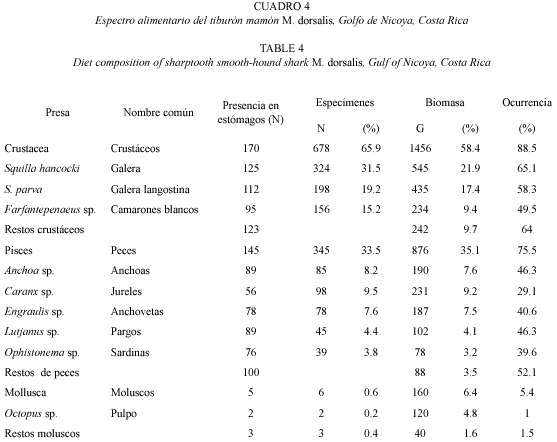
M. dorsalis es carnívoro polífago, al igual que muchos tiburones presenta un carácter oportunista y en este caso con una clara tendencia carcinófaga (Cuadro 4). Del total de estómagos analizados, 119 (38.2 %) estaban vacíos. La biomasa total analizada fue de 2 492 g. El espectro alimentario incluye peces (Anchoa sp. Caranx, sp, Lujanus sp., Engraulis y Ophistonema sp.), crustáceos (Squilla hancocki, S. parva, Farfantepenaeus sp.) y moluscos (Octopus sp.). Squilla hancocki es el ítem alimentario mas importante, estuvo presente en 125 estómagos (N=31.5 %) para un total de 324 ejemplares y una biomasa de 545 g y una ocurrencia de 65.1 %. En orden descendente según su presencia en los estómagos y biomasa tenemos a S. parva (N=112), además los camarones blancos del género Farfantepenaeus (N=95). Dentro de los peces, M. dorsalis demuestra una preferencia por anchoas (Engraulidae) y pargos (Lutjanidae) (N=89). Consume muy pocos moluscos, de hecho solo se identificaron dos ejemplares (Loligo sp.) en dos estómagos, la biomasa total fue de 120 g. El avanzado estado de descomposición no posibilitó la identificación de algunos contenidos, por ello fueron clasificados como restos de crustáceos, peces y moluscos y su masa corresponde a 370 g. De acuerdo con la hora de captura, la proporción de estómagos con alimento, puede suponerse que los adultos de M. dorsalis son depredadores nocturnos.
Discusión
Por su tamaño y dientes en forma de placa, M. dorsalis es un tiburón inofensivo, de hábitos costeros y frecuentes, durante todo el año, en la pesca artesanal. Generalmente es capturados cerca de la costa donde la profundidad varía entre 50 y 100 metros. La ausencia de ejemplares provenientes de embarcaciones que pescan más allá de las 10 millas marítimas, combinado con el análisis del comportamiento alimentario (presencia de presas bentónicas que viven cerca de la costa), apoya la hipótesis de que en la zona de estudio existe una población costera residente de ejemplares adultos. Los juveniles salen del alcance de esta conclusión ya que no se capturaron. La ausencia de ejemplares inmaduros podría señalarnos una separación espacial entre los diferentes estados ontogénicos, donde los embriones y juveniles no ocurren en los mismos sitios de captura de adultos, sino quizás en zonas más cerca de la costa. Esta condición ya ha sido observada en juveniles de M. schmitti (Cousseau 1986, Chiaramonte y Pettovello 2000) y otras especies de tiburones, donde los estados tempranos tienden a concentrarse en sectores poco profundos de gran productividad y abundante alimento, como por ejemplo aguas someras, planicies submareales costeras y estuarios (Bass 1978 y Castro 1987). El área de estudio, tal como lo define (Rojas 2001), podría estar funcionando como hábitat marino esencial, es decir una delimitada área geográfica en la cuál M. dorsalis desarrolla su ciclo de vida y de la cuál depende para su alimentación, protección, crecimiento, apareamiento y reproducción.
Una de las limitaciones de este estudio es que en el Pacífico Centroamericano no existen antecedentes publicados que permitan comparar nuestros hallazgos, confrontar nuestras hipótesis o simplemente mejorar la discusión. A pesar de que existen reportes desde el Golfo de California hasta Perú (Compagno 1995, Bearez 1996 y Balart et al. 1997), ninguna de ellos hace referencia a elementos de ecología trófica o reproductiva. Esta condición nos lleva a plantear una discusión de mayor nivel jerárquico, es decir a nivel del género Mustelus, donde si es posible encontrar información comparativa. La ausencia de antecedentes, per se, es un hallazgo de gran valor para la planificación de la conservación marina, ya alerta sobre los vacíos de información vital y señala un redoble de esfuerzos por mejorar el conocimiento de un grupo, cuya estrategia de vida podría ser desfavorable ante la pesca dirigida o incidental, sobre todo por tratarse de especies dioicas, vivíparos con placenta y saco vitelino y probablemente, como lo señala Pratt y Casey (1990), con baja tasa reproductiva, baja fecundidad, lenta tasa de crecimiento, madurez tardía y bajo número de embriones.
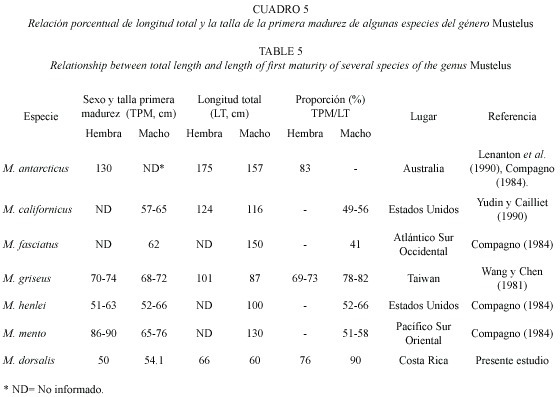
Ecología reproductiva: Si bien es cierto la talla de primera madurez no fue exactamente establecida, la información sobre las hembras maduras más pequeñas nos permite hacer algunas inferencias. M. dorsalis, al igual que la mayoría de las especies de Mustelus, es vivípara (Compagno 1984, Stevens 1990, Moulton et al. 1992) y considerada como una especie pequeña, que alcanza su madurez a tallas bajas. Posiblemente existan solo dos especies en el mundo que maduren antes, M. higmani que mide hasta 43 cm LT (macho) y 48 cm LT (hembra) (Compagno 1984) y M. minicanis que alcanza 47.8 cm LT (machos) y 57.4 cm LT (hembras) (Heemstra 1997). M. dorsalis repite el patrón de que las hembras son más grandes que los machos, este carácter es un elemento de manejo importante de considerar, ya que probablemente los ejemplares de mayor tamaño y los preferidos por los pescadores sean hembras.
Cuando se compara la relación de la longitud de la primera madurez sexual versus la longitud total encontramos que M. dorsalis necesita alcanzar entre el 76 y el 90 % del tamaño total para madurar, mientras que otras especies de diferentes partes del mundo tienen una proporcionalidad menor (Cuadro 5). Lo anterior es otra condición negativa para M. dorsalis, ya que para alcanzar la madurez necesitan mucho mas tiempo, variable que implica la posibilidad de ser capturada antes de haberse reproducido al menos una vez. Si la madurez se logra a menores tallas, también existe la probabilidad de haber dejado descendencia. Este hallazgo es una alerta roja para los administradores del recurso marino costero, ya que estamos en presencia de una especie que necesita períodos más largos para reclutarse. Para efectos de medidas de ordenamiento pesquero, ejemplares de 50 cm probablemente sean tiburones maduros, pero a tallas más bajas es incierto. Bajo estos supuestos, las medidas de control pesquero y de educación marina deberían promover la liberación de tiburones de tallas menores de 50 cm, para asegurar el reclutamiento de las siguientes generaciones. En tal sugerencia se incluye, en alguna medida, el llamado criterio precautorio.
La presencia, durante el estudio, de ejemplares maduros y hembras con embriones listos para nacer, pequeños oocitos y huevos intrauterinos, apoya la hipótesis de que esta especie se reproduce durante todo el año, pero entre septiembre y marzo las hembras analizadas portaban los embriones de mayor tamaño listos para ser expulsados. Similar condición ha sido observada en otras especies de tiburón, entre ellas Carcharhinus leucas (Compagno 1984, van der Elst y Adkin 1991) y Galeocerdo cuvier (Randall 1992).
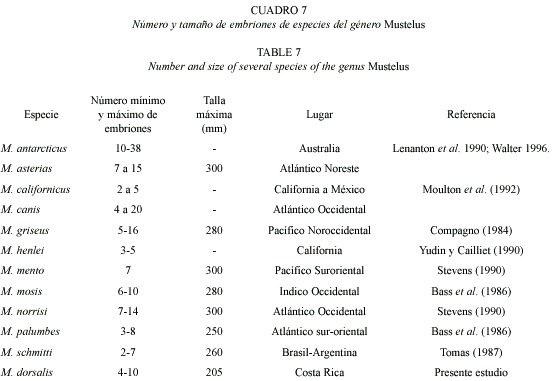
En el Cuadro 6 se presenta una comparación de las épocas de reproducción de diferentes especies del género Mustelus. El patrón que se sugiere es que el género no parece tener ninguna preferencia por ninguna estación climática, sino que se reproducen tanto en verano e invierno (en el caso de los trópicos), como en invierno y otoño para el caso de las regiones templadas. Con respecto a la fecundidad, medida como número de embriones por litera M. dorsalis presenta una condición intermedia (Cuadro 7). Algunas especies tienen menos embriones (M. henlei, M. palumbes, M. californicus y M. schmitti) y otros mayores números (M. antarcticus, M. norrisi y M. asterias). Lo que si queda evidente con esta comparación, es que con respecto a la talla máxima de embriones, M. dorsalis es la que produce los más pequeños, condición que implica mayor vulnerabilidad a la pesca, si consideramos que esta especie en algunas épocas del año, especialmente cuando hay veda en la parte interna del Golfo de Nicoya, se convierte en uno de los recursos de mayor importancia económica. No parece existir una armonía entre la estrategia reproductiva y la extracción del recurso, delicada situación que hay que considerar en los próximos planes de manejo del recurso pesca. Además Branstetter (1990) sugiere que a menor tamaño de embriones mayor la posibilidad de depredación por ejemplares mas grandes de la misma o de diferentes especies de tiburones y que la mortalidad natural se acrecienta cuando combinamos bajas en la frecuencia reproductiva, tamaño de litera, tamaño al nacer y tasa de crecimiento temprano.
Ecología alimentaria: Aunque es ampliamente reconocido que los tiburones y otras especies de elasmobranquios juegan un papel importante en la transferencia de energía entre los niveles tróficos superiores en los ecosistemas marinos, la comprensión sobre la dinámica del consumo de presas y procesamiento de alimento en tiburones es aún desconocido. Tal como lo señalan Wetherbee y Cortés (2004), comprender el flujo de energía de los tiburones en las comunidades es vital, no solo para saber que, cuando y donde comen, sino para determinar la oferta alimentaria del entorno en que viven los tiburones. Sin embargo, a diferencia de los numerosos estudios de ecología alimentaria que se han desarrollado para vertebrados y otros grupos de peces, el conocimiento sobre tiburones es muy escaso. De ahí la importancia de este reporte, en donde se describe por primera vez la alimentación de un miembro de la Familia Triakidae del Pacífico Oriental.
M. dorsalis, como la mayoría de los tiburones es un depredador polífago oportunista, probablemente de hábitos bentónicos, que consume principalmente crustáceos, en segundo orden peces y ocasionalmente moluscos. Este comportamiento alimentario ya ha sido reportado en varias especies del género, entre ellas M. californicus (Talent 1982), M. schmitti (Capitoli et al. 1995), M. asterias (Ellis et al. 1995), M. henlei (Cortés 1999) y M. manazo (Yamaguchi y Taniuchi 2000). Su preferencia por los crustáceos, y en concordancia con lo que reporta, Heemstra (1973), Compagno (1984) y Chiaramonte y Pettovello (2000), le ha hecho merecedor del término carcinófago. Según lo reportado por Smale y Compagno (1997), Mustelus tiende a consumir presas cuyo exoesqueleto sea fuerte y posibilite cierto grado de presión sobre ellas al momento de la captura.
Estadísticamente no se encontraron diferencias significativas (p=α 0.05) en los contenidos estomacales entre tallas ni entre sexos, condiciones que coinciden con lo reportado para otros elasmobranquios (Cortιs et al. 1996, Segura-Zarzosa et al. 1997, Avsar 2001, Simpfendorfer et al. 2001a, b). Esta aparente homogeneidad alimentaria quizás pueda explicarse por la ausencia de grupos de edad o de tallas y señale la posibilidad de que M. dorsalis forme agregaciones ontogénicas en donde las hembras y machos de tallas semejantes coincidan, espacial y temporalmente, en cotos de alimentación muy cerca del fondo y próximos a la costa. A pesar de lo evidencia presentada se recomienda profundizar en este tema.
La elevada proporción (38.2 %) de estómagos vacíos quizás pueda atribuirse a la expulsión violenta, regurgitación (por contracción del músculo esofágico) o por la eversión del estómago causada por cambios en la presión durante el enganche y ascenso a la superficie. El porcentaje de estómagos sin alimento es superior a la reportada para M. schmitti (15.1 %) por Chiaramonte y Pettovello (2000) en aguas argentinas. No obstante en concordancia con Wetherbee et al. (1990), la ocurrencia de altas proporciones de estómagos vacíos es común y es un patrón normal que se observa cuando se usan artes de pesca activos, como son la línea y anzuelos. Probablemente M. dorsalis, como ha sido observado para otras especies (Randall 1977, Branstetter 1990, Castro 1983), es depredado por otros grandes tiburones y quizás por algunas especies de peces óseos (Epinephelus sp. y Lutjanus sp.), sin embargo en recientes investigaciones sobre ecología alimentaria en el Golfo de Nicoya, no se han reportado restos de M. dorsalis en los contenidos estomacales analizados (Rojas 1996, 1997).
La ausencia de juveniles en los sitios de captura de adultos, confirma la separación espacial ontogénica. Los embriones, neonatos y juveniles posiblemente ocurren en diferentes zonas de crecimiento, condición que desde el punto de vista evolutivo puede ser ventajoso, así lo sugiere Branstetter (1990), quien agrega que esta separación reduce el riesgo de depredación.
Hacia el manejo del recurso: M. dorsalis, es un recurso que paulatinamente cobra mayor importancia comercial en el sector central de la costa del Pacífico costarricense, no solo por su creciente demanda (debido a la alta calidad de su carne), sino por la disminución de la oferta de categorías comerciales consideradas tradicionales (Lutjanus, Epinephelus, Cynoscion y Centropomus). Sin embargo este auge socioeconómico no necesariamente es una situación ventajosa, sobre todo cuando se consideran los siguientes elementos: (a) No existen medidas de manejo específicas para tiburones costeros y posiblemente se esté extrayendo el recurso indiscriminadamente, con total desconocimiento de aspectos de historia de vida; (b) La estrecha dependencia evolutiva por hábitats costeros compromete su supervivencia. Como muchas especies de importancia comercial, probablemente su desarrollo ontogénico ocurra en diferentes ambientes (manglares, estuarios y la franja marina del borde costero), todos ellos antrópicamente alterados por la desordenada explosión demográfica costera, el acelerado y poco planificado crecimiento de la frontera industrial, turística y de servicios en zonas costeras, la contaminación y la sobrepesca entre otros; (c) La flota camaronera que arrastra el fondo impacta directa y negativamente las poblaciones de crustáceos (camarones, esquilas y jaibas) bentónicos del Golfo de Nicoya, lo que se traduce en una alteración de la disponibilidad de la oferta alimentaria y de la abundancia de alimento de M. dorsalis. Esta sistemática reducción de fuentes de proteína podría causar migraciones espacio-temporales, lo que a posteriori conllevaría a la extinción de poblaciones, situación que a todas luces afectaría la trofia del ecosistema. El principio de realidad señala un redoble de esfuerzos ya que la sinergia y encadenamiento de este conjunto de impactos podría alterar localmente el ciclo natural de M. dorsalis, sobre todo en lo que se refiere a sobrevivencia, migración de juveniles y tasas de reclutamiento desde zonas poco profundas hacia sectores más alejados del borde costero.
La estrategia de sobrevivencia e historia de vida de M. dorsalis incluye pocos embriones, pequeños, madurez sexual a tallas altas y aunque se encontraron hembras con embriones durante todo el año, al parecer tienen ciclos bianuales. Estos rasgos evolutivos no son muy alentadores, si consideramos que en la zona de estudio hay un creciente aumento en el esfuerzo pesquero y amenazas ecológicas, tales como la contaminación del golfo por influencia del Río Grande de Tárcoles. La condición es crítica y la brecha entre el conocimiento aplicado y la conservación y el manejo de poblaciones de condrictios costeros es cada vez mayor. Para un futuro plan de manejo deben considerarse épocas de veda y talla mínima de captura. Se sugiere un plan de educación ambiental marina que divulgue estos resultados y que incluya a pescadores, estudiantes y administradores pesqueros, entre otros. Es necesario visibilizar los condrictios como grupo, siendo urgente que sean incluidos en las propuestas de áreas marinas protegidas, ya que además del riesgo ecológico, hay implicaciones socio-económicas por su importancia comercial, fuente de proteína y generación de empleo de cientos de pescadores artesanales costarricenses. De seguir con el actual ritmo de explotación esta especie de tiburón, de acuerdo con (Thorson 1982), puede tener la misma suerte que han corrido en Centroamérica el tiburón toro (Carcharhinus leucas) y el pez sierra (Pristis pristis).
Agradecimientos
Esta investigación se hizo gracias al apoyo de los compañeros de la pesca y Junta Directiva de Coopetárcoles, quienes dieron facilidades para el estudio de los ejemplares.
Resumen
Se determinaron aspectos reproductivos y alimentarios del tiburón enano Mustelus dorsalis, a partir de 311 ejemplares capturados con línea y anzuelo en el Golfo de Nicoya, Costa Rica, durante marzo de 1999 y mayo de 2000. Se reconocieron 250 hembras y 61 machos. Las hembras son más grandes (550 a 660 mm) vs. (500-585 mm) y más pesadas (400-1 000 g) vs. (200-300 g) que los machos. Todos los ejemplares estaban maduros, la talla mínima de especimenes maduros fue de 500 y 541 mm para hembras y machos respectivamente. Entre septiembre y marzo todas las hembras y machos estaban maduras, e inmaduras entre abril y agosto. Se estudiaron 1 259 embriones, con una variación entre dos y seis embriones por litera. La longitud total de los embriones es entre 130 y 205 mm y el peso entre 6 y 35 g. Este tiburón es carnívoro polífago oportunista que consume crustáceos (Squilla hancocki, S. parva, Farfantepenaeus sp.), peces (Anchoa sp. Caranx, sp, Lujanus sp., Engraulis y Ophistonema sp.), y moluscos (Loligo sp. y Octopus sp.). Squilla hancocki es el ítem alimentario mas importante. La presencia de tiburones maduros de ambos sexos a lo largo del año en aguas poco profundas, y el consumo de presas bentónicas que viven en fondos rocosos costeros, sugiere la posibilidad de que este sector del Golfo de Nicoya esté funcionando como una zona de crianza y hábitat esencial. Con base en estos resultados se propone el establecimiento de un plan de manejo integral.
Palabras clave: Mustelus dorsalis, reproducción, análisis de contenido estomacal, Golfo de Nicoya, Costa Rica.
Referencias
Allen, G. & R. Robertson. 1994. Fishes of the Tropical Eastern Pacific. Univ. of Hawaii. Honolulu, Hawaii, EEUU. 332 p. [ Links ]
Avsar, D. 2001. Age, growth, reproduction and feeding of the spurdog (Squalus acanthias Linnaeus, 1758) in the South-eastern Black Sea. Est. Coast. Shelf Sci. 52: 269-278. [ Links ]
Balart, E., J. Castro-Aguirre & F. De Lachica-Bonilla. 1997. Análisis comparativo de las comunidades ícticas de fondos blandos & someros de la Bahía de La Paz, B.C.S., p. 20-35 In J. Urbán Ramírez & M. Ramírez Rodríguez (eds.). La Bahía de La Paz Investigación Conservación. México. [ Links ]
Bass, A. 1978. Problems in studies of sharks in the southwest Indian Ocean, p. 545-594. In E.S. Hodgson & R.F Mathewson (eds.). Sensory Biology of Sharks, Skates & Rays, Office of Naval Research, Department of the Navy. Arlington, Virginia, EEUU. [ Links ]
Bass, A., P. Heemstra & L. Compagno. 1986. Carcharhinidae, p. 67-87. In M.M. Smith & P. Heemstra (eds.). Smith´s Sea Fishes. Springer-Verlag. Berlin, Alemania. [ Links ]
Bearez, P. 1996. Lista de los peces marinos del Ecuador continental., Rev. Biol. Trop. 44: 731-741. [ Links ]
Branstetter, S. 1990. Early life-history implications on selected Carcharhinoid & Lamnoid sharks of the Northwest Atlantic, p. 17-28. In H.L. Pratt Jr., S.G. Gruber, & T. Taniuchi (eds.). Elasmobranchs as living resources: advances in the biology, ecology, systematic and the status of the fisheries NOAA, Tech. Reps. 90 (1990). EEUU. [ Links ]
Bussing, W. & M. López. 1996. Fishes collected during the RV Victor Hensen Costa Rica Expedition, (1993/1994). Rev. Biol. Trop. 44: 183-187. [ Links ]
Capitoli, R., R. Rufino & M. Vooren. 1995. Alimentacão do Tubarão Mustelus schmitti Springer na plataforma costeira do estado do Rio Grande do Sul, Atlântica. Rio Grande 17: 109-122. [ Links ]
Castro, J. 1983. The sharks of North America waters. Texas A & M Univ. Press, College Station, Texas, EEUU. 180 p. [ Links ]
Castro, J. 1987. The position of sharks in marine biological communities, p. 11-17. In S. Cook (ed.). Sharks, an inquiry into biology, behavior, fisheries and use. Corvallis, Oregon State University Extension Service. USA. [ Links ]
Castro, J. 1996. Biology of the blacktip shark Carcharhinus limbatus, off the Southeastern United States. Bull. Mar. Sci. 59: 508-522. [ Links ]
Chiaramonte, G. & P. Pettovello. 2000. The biology of Mustelus schmitti in southern Patagonia, Argentina. J. Fish Biol. 57: 930-942. [ Links ]
Compagno, L. 1984. Sharks of the world. An annotated and illustrated catalogue of sharks species known to date. Part 1. Hexanchiformes to Lamniformes. FAO species Catalogue. FAO Fish Synop. No. 125: 1-249. [ Links ]
Compagno, L. 1995. FAO species catalogue. Vol. 4. Sharks of the world. An annotated and illustrated catalogue of shark species known to date. Part 2. Carcharhiniformes., FAO Fish. Synop. 125. 655 p. [ Links ]
Cortés, E. 1999. Standarized diet composition & trophic levels of sharks. ICES J. Mar. Sci. 56: 707-717. [ Links ]
Cortés, E., C. Manire & R. Hueter. 1996. Diet, feeding habits, & diel feeding chronology of the bonnethead shark, Sphyrna tiburo, in southwest Florida. Bull. Mar. Sci. 58: 353–367. [ Links ]
Cousseau, M. 1986. Estudios biológicos sobre peces costeros con datos de dos campañas de investigación realizadas en 1981. V. El gatuzo (Mustelus schmitti). Publ.Com. Téc. Mixta del Frente Mar. 1: 60-66. [ Links ]
Ellis, J., M. Pawson & S. Shackley. 1995. The comparative feeding ecology of six species of shark and four species of ray (Elamosbranchii) in the north-east Atlantic. J. Mar. Biol. 76: 89-106. [ Links ]
Heemstra, P. 1973. A revision of the shark genus Mustelus (Squaliformes: Carcharhinidae). Ph.D. Thesis, University of Miami. Miami, Florida, EEUU. [ Links ]
Heemstra, P. 1997. A review of the smooth-hound sharks (Genus Mustelus, Family Triakidae) of the Western Atlantic Ocean, with descriptions of two new species and a new sub-species. Bull. Mar. Sci. 60: 894-928. [ Links ]
Hyslop, E. 1980. Stomachs contents analysis: a review of methods and their application. J. Fish. Biol. 17: 411-429. [ Links ]
Lenanton, R., D. Helad, M. Platell, M. Cliff & J. Shaw. 1990. Aspects of the reproductive biology of the gummy shark, Mustelus antarcticus Günther, from waters off the south coast of Western Australia. Aust. J. Mar. Fresh. Res. 41: 807-822. [ Links ]
Márquez-Farias, F., L. Castillo-Géniz & M. Rodríguez de la Cruz. 1998. Demografía del cazón pech Sphyrna tiburo (Linnaeus, 1758) en el sureste del Golfo de México. Cien. Mar. 24: 13-34. [ Links ]
Moulton, P., T. Walker & S. Saddlier. 1992. Age and growth of gummy shark, Mustelus antarcticus and school sharks Galeorhinus galeus from southern Australian waters. Austr. J. Mar. Freshwat. Res. 43:1241-1267. [ Links ]
Pérez-Farfante, I. 1971. A key to the American Pacific shrimps of the genus Trachypenaeus (Decapoda: Penaeidae), with description of a new species. Fish. Bull. 69: 635-646. [ Links ]
Pratt, H. & J. Casey. 1990. Shark reproductive strategies as a limiting factor in directed fisheries, with a review of Holden´s method of estimating growth parameters. NOAA. Tech. Rep. NMFS 90: 97-109. [ Links ]
Randall, J. 1977. Contribution to the biology of the whitetip reef shark (Triaenodon obesus). Pac. Sci. 31: 143-164. [ Links ]
Randall, J. 1992. Review of the biology of the tiger shark (Galeocerdo cuvier). Aust. J. Mar. Freshwat. Res. 43: 21-31. [ Links ]
Rojas, J. 2001. Corredores biológicos y hábitats marinos esenciales. Ambientico 95: 15-18. [ Links ]
Rojas, J. 1996. Hábitos alimentarios del pargo mancha Lutjanus guttatus (Pisces: Lutjanidae) en el Golfo de Nicoya. Rev. Biol. Trop. 44 /45: 471-476. [ Links ]
Rojas, J. 1997. Hábitos alimentarios del pargo colorado Lutjanus colorado (Pisces: Lutjanidae) en el Golfo de Nicoya. Rev. Biol. Trop. 45: 1173-1183. [ Links ]
Segura-Zarzosa, J., L. Abitia-Cárdenas & F. Galván-Magaña. 1997. Observations on the feeding habits of the shark Heterodontus francisci Girard 1854 (Chondrichthyes: Heterodontidae), in San Ignacio Lagoon, Baja California Sur, México. Cien. Mar. 23: 111-128. [ Links ]
Simpfendorfer, C., A. Goodreid & R. McAuley. 2001a. Size, sex & geographic variation in the diet of the tiger shark, Galeocerdo cuvier, from Western Australian waters. Environ. Biol. Fish. 61: 37-46. [ Links ]
Simpfendorfer, C., A. Goodreid & R. McAuley. 2001b. Diet of three commercially important shark species from Western Australian waters. Mar. Freshwater Res. 52: 975–985. [ Links ]
Smale, M. & L. Compagno. 1997. Life history and diet of two southern African smoothhound sharks, Mustelus mustelus (Linnaeus, 1758) and Mustelus palumbes Smith, 1957 (Pisces: Triakidae). S. Afr. J. Mar. Sci. 18: 229-248. [ Links ]
Stevens, J. 1990. The status of Australian shark fisheries. Chondros 2: 1-4. [ Links ]
Talent, L. 1982. Food habits of the gray smoothhound, Mustelus californicus, the brown-smoothhound, Mustelus henlei, the shovelnose guitarfish, Rhinobatos productus, and the bat ray, Myliobatus californica, in Elkhorn Slough, California. Cal. Fish Game 68: 224-234. [ Links ]
Thorson, T. 1982. The impact of commercial exploitation on sawfish and shark populations in Lake Nicaragua. Fisheries 7: 2-10. [ Links ]
Tomas, A. 1987. Chave taxonomica para cacoes evicerados do sudeste do Brasil. III Reuniao do Grupo de Trabalho Sobre pesca e pesquisa de Tubaroes e Raias no Brasil, Fortaleza, Brasil. (28-31 Julio). [ Links ]
Van der Elst & F. Adkin. 1991. Marine linefish: priority species & research objectives in southern Africa. Oceanog.. Res. Inst. Spec. Publ. 1: 1-132. [ Links ]
Walter, T. 1996. Stock assessment report. Gummy shark 1995. (Compiled for the Southern Shark Fishery Assessment Group). Australian Government, Camberra, Australia. 33 p. [ Links ]
Wang, T. & C. Chen. 1981. Reproduction of smooth dogfish Mustelus griseus in northwestern Taiwan waters. J. Fish. Soc. Taiwan. 8: 23-26. [ Links ]
Wetherbee, B.M. & S.H. Gruber. 1990. The effect of ration level on food retention time in juvenile lemon sharks, Negaprion brevirostris. Environ. Biol. Fish. 29: 59-65. [ Links ]
Yamaguchi, A., T. Taniuchi & M. Shimizu. 1997. Reproductive biology of the starspotted dogfish Mustelus manazo from Tokyo Bay, Japan. Fisc. Sci. 63: 918-922. [ Links ]
Yamaguchi, A. & T. Taniuchi. 2000. Food variations and ontogenetic dietary shift of the starspotted-dogfish Mustelus manazo at five locations in Japan and Taiwan. Fish. Sci. 66: 1039-1048. [ Links ]
Yudin, K.G. & G.M. Cailliet. 1990. Age and growth of the gray smoothhound, Mustelus californicus, and the brown smoothhound, M. henlei, from central California. Copeia 1990: 191-204. [ Links ]