Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.4 San José Dec. 1999
Alberto de Jesús Navarrete1 y Jaqueline Herrera Gómez
Abstract
Sediments were collected at fifteen stations in five transects at Chetumal Bay (June and December 1995). Sediments were medium and fine sands with 15.62% organic matter. In June, 2 239 individuals represented 20 families and 37 genera; in December, 1 426 individuals represented 21 families and 35 genera. Neotonchoides, Desmodora, Bathylaimus, Pseudochromadora, Desmolaimus, Chromadorina and Steineria were the most abundant. In both months the same transect had the highest abundance and richness (957 and 744 individuals, 28 and 25 genera, respectively). The lowest abundance in a transect was 48 individuals and six genera. Diversity fluctuated among 0.53 and 2.53 beles/ind. In general, the genus composition in Chetumal bay is homogeneous. The noteworthy occurrence of marine genera in this brackish environment shows their adaptability.
Key words
Caribbean, Chetumal, free-living nematodes, Meiobenthos, Mexico.
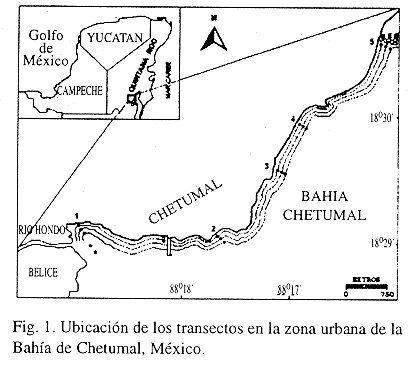
Los nematodos de vida libre habitan los intersticios de los sedimentos acuáticos y el suelo. Es el grupo más numeroso de la meiofauna y el número de especies presentes en un hábitat, generalmente es superior por un orden de magnitud al de cualquier otro táxon (Heip et al. 1982). Su conocimiento es importante para entender la biodiversidad regional (Boucher y Lambshead 1995). Las investigaciones taxonómicas sobre nematodos marinos en América del Norte, se han realizado principalmente en el golfo de México y el mar Caribe (Hopper y Cefalu 1973, Gourbault y Decramer 1986). En México, se estudió la ecología de los nematodos de la Sonda de Campeche (Castillo y Lambshead 1990, de Jesús-Navarrete 1993a) y en la laguna de Buenavista (de Jesús-Navarrete 1993b). La bahía de Chetumal ha sido motivo de múltiples investigaciones, entre ellas resaltan las de calidad del agua, la contaminación, el plancton y el macrobentos (Gasca y Castellanos 1993, Ortíz y Sáenz 1995), pero no existen antecedentes sobre el meiobentos ni sobre los nematodos de vida libre. El objetivo de este trabajo fue determinar la distribución y abundancia de los nematodos en la zona urbana de la bahía de Chetumal. Las muestras se recolectaron en junio y diciembre de 1995, en cinco transectos a lo largo de la zona urbana de la ciudad de Chetumal, Q. Roo México. Los transectos T1-T5 se ubicaron de la siguiente manera: T1 (18°2942.2 N, 88°1852.9 W), T2, (18°2932.5 N, 88°1731.0 W), T3 (18°2959.0N, 88°1702.0W), T4, (18°3043.3N, 88°1637.5 W) y T5, (18°3125 N, 88°1600.5 W). Cada transecto incluyó estaciones separadas 5, 50 y 100 m de la costa (Fig.1).
El sedimento se recolectó con un tubo de PVC de 5 cm de diámetro para el análisis de sedimentos y materia orgánica. Para el estudio de la nematofauna, se recolectó una muestra de sedimento con un nucleador transparente de PVC de 3.2 cm de diámetro, con un émbolo graduado. El sedimento se fijó inmediatamente después de la recolecta con formalina caliente (60°C) al 5%. El contenido de materia orgánica se determinó por pérdida por calcinación (Dean 1974) y el análisis granulométrico se realizó según lo señalado por Giere, (1993).
La meiofauna se extrajo por elutriación, recogiendo los organismos en un tamiz de 42 µm. Los nematodos se separaron manualmente del resto de los meiobiontes y se montaron para su identificación, con las claves de Tarjan (1980) y de Platt y Warwick (1983).
Con el fin de comparar la estructura de la comunidad entre los sitios, se calcularon los siguientes índices: Shannon-Weaner (H), utilizando Ln, y equidad (J). Para el análisis de conglomerados se usó el índice de Bray-Curtis y el método de agrupación flexible (Ludwig y Reynolds, 1988).
La temperatura y oxígeno disuelto de la columna de agua se midieron con un oxímetro YSI modelo 58.
Resultados
La temperatura máxima en junio fue de 30.6° C en T5 y la mínima de 29° C en T2. En diciembre la máxima fue de 33.8° C en T4 y la mínima de 29° C en T2. El oxígeno disuelto no se midió en junio; en diciembre presentó un máximo de 7.4 mg/l en T4 y un mínimo de 6.6 mg/l en T1 (Cuadro 1).
Temperatura y oxígeno en la columna de agua en los sitios de recolecta de la nematofauna
de la Bahía de Chetumal.
Temperature and dissolved oxygen in nematofauna sample sites at Chetumal Bay.
| Transectos | | | | | |
| Junio | |||||
| Temperatura °C | | | | | |
| Dicembre | |||||
| Temperatura °C | | | | | |
| Oxígeno (mg/l) | | | | | |
El porcentaje de materia orgánica y tipo de sedimentos en cada estación se muestran en el cuadro 2. Los valores más altos de materia orgánica se presentaron en junio. En ese mes, en la mayoría de las estaciones los sedimentos fueron arena fina y mediana. Los gránulos y matatenas se encontraron en los T3 y T5. Los sedimentos de acuerdo con el valor de la desviación estándar de los sedimentos, estuvieron moderadamente y mal clasificados en ambos muestreos (Cuadro 2).
Diciembre tuvo sedimentos de arena fina en los T1 y T2; arena muy fina en el T4; arenas medianas sólo en el T5 100 m y matatenas en el T3 a 5 m y 50 m.
2 239 organismos se recolectaron en junio, mismos que quedaron, clasificados en 4 órdenes, 20 familias y 37 géneros. En diciembre se obtuvieron 1 426 individuos pertenecientes a 5 órdenes, 21 familias y 35 géneros (Cuadros 3 y 4).
Las familas se distribuyeron de la siguiente manera dentro de los ordenes: Enoplida 6, Chromadorida 9, Monhysterida 4 y Araeolaimida 1 en junio, mientras que en diciembre; Enoplida 7, Dorylaimida 1, Chromadorida 8, Monhysterida 4 y Araeolaimida 1.
Porcentaje de materia orgánica y tipo de sedimentos en los sitios de recolecta de la nematofauna
de la Bahía de Chetumal.
Organic matter percentage, and sediment type in nematofauna sample sites at Chetumal Bay.
| Transectos | | | | | |
| Junio | | | | | |
| 5 m | | | | | |
| 50 m | | | | | |
| 100 m | | | | | |
| Tipo de sedimento | | | | | |
| 5 m | Mod. Clas. | Mod. Clas. | | Mal Clas. | Muy mal Clas. |
| 50 m. | Mal. Clas. | Mal Clas. | Muy mal Clas. | Mod. Clas. | Mal Clas. |
| 100 m | Mal Clas. | | Mod. Clas. | Mod. B. Clas. | |
| Diciembre | | | | | |
| 5 m | | | | | |
| 50 m | | | | | |
| 100 m | | | | | |
| Tipo de sedimento | | | | | |
| 5 m | Mod. Clas. | Mod. Clas. | Muy mal Clas. | Mal Clas. | Mod. B. Clas. |
| 50 m | Mal Clas. | Mod. Clas. | Muy mal Clas. | Mod. B. Clas. | Mod. Clas. |
| 100 m | Mal Clas. | Mod. Clas. | Mod. Clas. | Mod. B. Clas. | Mal Clas. |
Distribución y abundancia de los nematodos de la zona urbana de la bahía de Chetumal. Junio.
Distribution and abundance of nematodes from the urban zone at Chemutal Bay. June.
| Transectos | | | | | | ||||||||||
| Entidades taxonómicas | | | | | | | | | | | | | | | |
| Anonchus | | | | | | | | | | | | | | | |
| Anoplostoma | | | | | | | | | | | | | | | |
| Anticoma | | | | | | | | | | | | | | | |
| Aphanolaimus | | | | | | | | | | | | | | | |
| Bathylaimus | | | | | | | | | | | | | | | |
| Calyptronema | | | | | | | | | | | | | | | |
| Chromadora | | | | | | | | | | | | | | | |
| Chromadorina | | | | | | | | | | | | | | | |
| Daptonema I | | | | | | | | | | | | | | | |
| Daptonema II | | | | | | | | | | | | | | | |
| Pseudochromadora I | | | | | | | | | | | | | | | |
| Pseudochromadora II | | | | | | | | | | | | | | | |
| Desmodora III | | | | | | | | | | | | | | | |
| Desmolaimus | | | | | | | | | | | | | | | |
| Desmoscolex I | | | | | | | | | | | | | | | |
| Desmoscolex II | | | | | | | | | | | | | | | |
| Halalaimus | | | | | | | | | | | | | | | |
| Halichoanolaimus | | | | | | | | | | | | | | | |
| Hypodontolaimus | | | | | | | | | | | | | | | |
| Leptolaimus | | | | | | | | | | | | | | | |
| Marylynnia | | | | | | | | | | | | | | | |
| Metalinhomoeus | | | | | | | | | | | | | | | |
| Microlaimus | | | | | | | | | | | | | | | |
| Monhystera | | | | | | | | | | | | | | | |
| Monhysterida | | | | | | | | | | | | | | | |
| Neotonchoides | | | | | | | | | | | | | | | |
| Oncholaimidae A | | | | | | | | | | | | | | | |
| Oncholaimus | | | | | | | | | | | | | | | |
| Oxystomina | | | | | | | | | | | | | | | |
| Paramonohystera | | | | | | | | | | | | | | | |
| Parodontophora | | | | | | | | | | | | | | | |
| Polygastrophora | | | | | | | | | | | | | | | |
| Prochromadorella | | | | | | | | | | | | | | | |
| Sabatieria | | | | | | | | | | | | | | | |
| Steineria | | | | | | | | | | | | | | | |
| Terschellingia | | | | | | | | | | | | | | | |
| Viscosia | | | | | | | | | | | | | | | |
| Juveniles | | | | | | | | | | | | | | | |
| Abundancia por estación | | | | | | | | | | | | | | | |
| Abundancia por transecto | | | | | | | | | | | | | | | |
| Géneros | | | | | | | | | | | | | | | |
Distribución y abundancia de los nematodos de la zona urbana de la bahía de Chetumal. Diciembre.
Distribution and abundance of nematodes from the urban zone at Chetumal Bay. December.
| Transectos | | | | | | | ||||||||||
| Entidades taxonómicas | | | | | | | | | | | | | | | | |
| Anonchus | | | | | | | | | | | | | | | | |
| Anoplostoma | | | | | | | | | | | | | | | | |
| Anticoma | | | | | | | | | | | | | | | | |
| Aphanolaimus | | | | | | | | | | | | | | | | |
| Bathylaimus | | | | | | | | | | | | | | | | |
| Chromadora | | | | | | | | | | | | | | | | |
| Chromadorina | | | | | | | | | | | | | | | | |
| Daptonema II | | | | | | | | | | | | | | | | |
| DaptonemaI | | | | | | | | | | | | | | | | |
| Pseudochromadora I | | | | | | | | | | | | | | | | |
| Pseudochromadora II | | | | | | | | | | | | | | | | |
| Desmodoridae III | | | | | | | | | | | | | | | | |
| Desmolaimus | | | | | | | | | | | | | | | | |
| Desmoscolex I | | | | | | | | | | | | | | | | |
| Desmoscolex II | | | | | | | | | | | | | | | | |
| Dorylaimidae | | | | | | | | | | | | | | | | |
| Dorylaimus A | | | | | | | | | | | | | | | | |
| Dorylaimus B | | | | | | | | | | | | | | | | |
| Entidades taxonómicas | | | | | | | | | | | | | | | | |
| Halalaimus | | | | | | | | | | | | | | | | |
| Halichoanolaimus | | | | | | | | | | | | | | | | |
| Leptolaimus | | | | | | | | | | | | | | | | |
| Marylynnia | | | | | | | | | | | | | | | | |
| Monhystera | | | | | | | | | | | | | | | | |
| Neotonchoides | | | | | | | | | | | | | | | | |
| Oncholaimus | | | | | | | | | | | | | | | | |
| Oxystomina | | | | | | | | | | | | | | | | |
| Paramonohystera | | | | | | | | | | | | | | | | |
| Parodontophora | | | | | | | | | | | | | | | | |
| Polygastrophora | | | | | | | | | | | | | | | | |
| Sabatieria | | | | | | | | | | | | | | | | |
| Steineria | | | | | | | | | | | | | | | | |
| Terschellingia | | | | | | | | | | | | | | | | |
| Tobrilus | | | | | | | | | | | | | | | | |
| Tripyloides | | | | | | | | | | | | | | | | |
| Viscosia | | | | | | | | | | | | | | | | |
| Juveniles | | | | | | | | | | | | | | | | |
| Abundancia por estación | | | | | | | | | | | | | | | | |
| Abundancia por transecto | | | | | | | | | | | | | | | | |
| Géneros | | | | | | | | | | | | | | | | |
Los géneros más abundantes, en número de individuos (ind), en junio fueron: Neotonchoides (312 ind), Desmodora (269 ind), Bathylaimus (252 ind), Pseudochromadora (179 ind), Desmolaimus (160 ind), Chromadorina (117 ind) y Steineria (107 ind).
Los géneros que se presentaron en más del 10% de los transectos y estaciones fueron: Desmodora, Daptonema, Marylynnia, Microlaimus, Neotonchoides, Sabatieria, Steineria, Theristus, Pseudochromadora, Anoplostoma y Oxystomina.
El T3 presentó la mayor abundancia de nematodos (937 ind) y la mayor riqueza de géneros representados (28). Desmolaimus (144 ind), Pseudochromadora (140 ind), Desmodora (92 ind) y Chromadorina (85 ind) fueron los más abundantes.
El T1 presentó la menor abundancia (218) y el menor número de géneros (12); Neotonchoides fue el más abundante (123). En diciembre, Neotonchoides (254), Oncholaimus (195), Desmodora (176), Desmolaimus (156) y Parodontophora (131) fueron los más abundantes. Los géneros más frecuentes fueron: Daptonema, Parodontophora, Netonchoides, Pseudochromadora,Sabatieria,Desmodora, Steineria, Polygastrophora, Tripyloides, Monhystera, Terschellingia.
Diciembre mostró un comportamiento similar a junio, el T3 presentó la mayor abundancia de nematodos (744) y la mayor riqueza de géneros (25). Oncholaimus (194 ind), Desmolaimus (154 ind), Parodontophora (115 ind), Viscosia (92 ind) y Desmodora (90 ind) fueron los más abundantes. El T5 tuvo el segundo valor más alto de géneros representados (24 ind). El T1 presentó la menor abundancia (48 ind) y el menor número de géneros (6), donde Tobrilus fue el más abundante (36 ind).
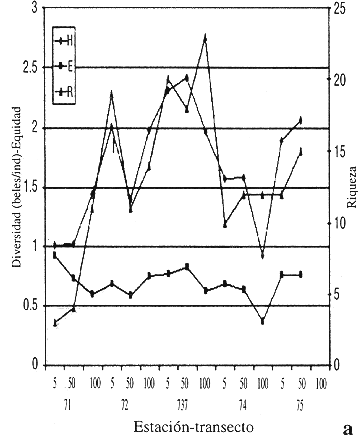
La diversidad en junio osciló entre 0.9222 y 2.4091 (beles/ind); el mínimo valor se registró en T4 100 m y el máximo en T3 50 m (Fig. 2a). La equidad varió de 0.3711 a 0.9206; estos valores correspondieron al T4 100 m y T1 5 m, respectivamente; la riqueza de géneros fluctuó de 3 a 23.
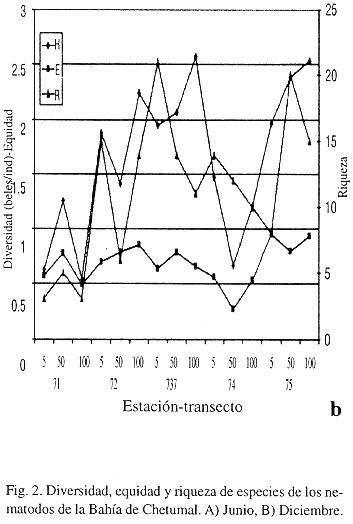
En Diciembre la diversidad varió entre 0.5366 y 2.5338 beles/ind; el menor valor fue en T1 100 m y el máximo en T5 100 m (Fig. 2b). La equidad varió de 0.2692 a 0.9474, en T4 50 m y T5 5 m, respectivamente; la riqueza de géneros fluctuó de 3 a 20.
La mayor equidad (0.9) se registró en junio (T1 5 m), en éste sitio se encontró el valor más bajo de la riqueza de géneros. En diciembre la abundancia del género Tobrilus determinó los valores de equidad y diversidad debido a su baja riqueza, principalmente en T1.
En el T2 se observó una disminución notable de la diversidad a 50 m, en diciembre, la abundancia de este género disminuyó; sin embargo, la riqueza disminuyó al igual que la diversidad.
El T3 presentó valores de diversidad y equidad altos principalmente a 5 m y 50 m en junio; la riqueza alcanzó el valor máximo a 100 m. En diciembre los valores de diversidad disminuyeron ligeramente debido a las variaciones de la riqueza y baja equidad, ocasionado por los géneros Parodontophora, Desmodora, Desmolaimus,Oncholaimus y Viscosia.
El T4 registró valores bajos de diversidad y equidad, en la estación de 100 m en junio. Lo mismo ocurrió en diciembre a a 50 m.
En el T5 se registraron altos valores de diversidad y equidad tanto en junio como en diciembre, debido a una mayor riqueza de géneros.
Tobrilus y Dorylaimus son nematodos comunes en agua dulce, Anderson (1992) encontró a Tobrilus como dominante en el Mississippi (19-46 %). En la Bahía de Chetumal, constituyó el 75 % de la abundancia, en el T1.
La alta diversidad registrada en el T5 100 m en diciembre, se debió principalmente a la equidad. Al igual que en T3, existió mayor complejidad en los sedimentos, con una mayor variedad de tamaños de partículas sedimentarias, lo que favorece una mayor disponibilidad de espacios. En general, los valores de diversidad pueden ser altos en sedimentos finos o gruesos, mal clasificados (Tietjen 1991).
En Chetumal la diversidad tuvo valor promedio de 3.92 bits/ind, pero podría ser más alto, al nivel de especie. Este valor es comparable a lo informado por Tietjen (1991) que determinó una diversidad de 3.35-4.08 bits/ind, en sedimentos gruesos de arenas carbonatadas. Nuestros valores son más altos a los encontrados por Alongi (1986) en arena fina (1.65 bits/ind) y arena gruesa (1.62 bits/ind), Gourbault et al. (1995) registraron 3.06 bits/ind. y 3.7 bits/ind en sedimentos gruesos del Indopacífico.
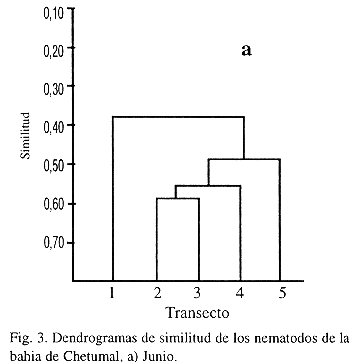
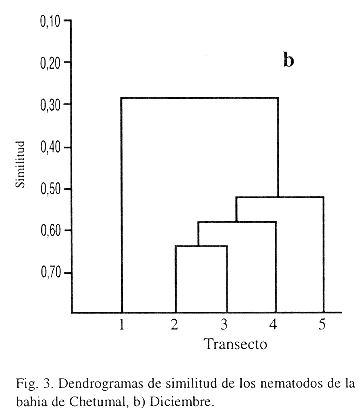
La similitud mostrada en los grupos, tanto en junio como en diciembre se establece en función del tipo de sedimentos encontrados en cada transecto, lo que coincide con las preferencias de las asociaciones faunísticas. La variación en los valores de abundancia relativa en ambos muestreos, reflejó un mayor valor de similitud (0.6364) en diciembre que en junio (0.5898). El T3 y T5 constituyeron grupos separados, pero siempre asociados con el grupo T2 y T4. En general, el T3 y T5 guardan una relación entre sí al compartir abundancia y composición de géneros semejantes, a diferencia del T1 el cual tiene muy poca similitud con los demás transectos debido a la abundancia de unos cuantos géneros, relacionados con la baja salinidad del río Hondo y el desagüe pluvial.
Agradecimientos
Resumen
En junio y diciembre de 1995 se recolectaron sedimentos en 15 estaciones distribuidas en cinco transectos en la bahía de Chetumal. Los sedimentos fueron, en su mayoría arena fina y mediana, con un máximo de 15.62% de materia orgánica. En junio se recolectaron 2 239 organismos pertenecientes a 20 familias y 37 géneros, en diciembre se obtuvieron 1 426 nematodos que se ubicaron en 21 familias y 35 géneros. Neotonchoides, Desmodora, Bathylaimus, Pseudochromadora, Desmolaimus, Chromadorina y Steineria fueron los generos más abundantes. El transecto 3 en ambas temporadas fue el de mayor abundancia y riqueza, con 957 y 744 individuos y 28 y 25 géneros respectivamente. La menor abundancia ocurrió en el transecto 1 con 48 individuos y 6 géneros. La diversidad osciló entre 0.53 y 2.53 beles/ind. En general existe una homogeneidad en la composición de géneros en la bahía, aunque es notorio que muchos géneros considerados estrictamente marinos estén representados en aguas salobres, lo que muestra su capacidad de adaptación.
Referencias
Alongi, D. M. 1986. Population structure and trophic composition of the free-living nematodes inhabiting carbonate sands of Davies Reef, Great Barrier Reef, Australia. Aust. J. Mar. Freshw. Res. 37: 609-619. [ Links ]
Anderson, R. V. 1992. Free-living nematodes associations in pool 19, Mississippi River. J. Freshw. Ecol. 7: 243-249. [ Links ]
Boucher, G. & N. Gourbault. 1990. Sublittoral meiofauna and diversity of nematode assemblage off Guadeloupe Islands. Bull. Mar. Sci. 47: 448-463. [ Links ]
Boucher, G. & P.J. Lambshead 1995. Ecological Biodiversity of Marine Nematodes in samples from Temperate, Tropical and Deep-Sea Regions. Conserv. Biol. 9: 1594-1604. [ Links ]
Castillo, D. & P. J. Lambshead. 1990. Revision of the genus Elzalia Gerlach, 1957 (Nematoda: Xyalidae) including three new species from oil producing zones in the Gulf of Mexico, with a discussion of sibling species problem. Bull. Brit. Mus. Nat. Hist. (Zool.) 56: 63-71. [ Links ]
Dean, W. E. Jr. 1974. Determination of carbonate and organic matter in calcareous sediments and sedimentary rocks by loss on ignition: comparison with other methods. J. Sedim. Petrol. 14: 242-248. [ Links ]
de Jesús-Navarrete, A. 1993a. Distribución, abundancia y diversidad de los nematodos (Phylum Nematoda) bénticos de la Sonda de Campeche, México. Enero 1987. Rev. Biol. Trop. 41: 57-63. [ Links ]
de Jesús-Navarrete, A. 1993b. Nematodos (Nematoda) de la laguna de Buena Vista, Quintana Roo, México. Rev. Biol. Trop. 41: 649-652. [ Links ]
Gasca, R & I. Castellanos. 1993. Zooplancton de la Bahía de Chetumal, Mar Caribe, Mexico. Rev. Biol. Trop. 41: 619-625. [ Links ]
Giere, O. 1993. Meiobenthology: The Microscopic Fauna in Aquatic Sediments. Springer-Verlag, Hamburg, 328 p. [ Links ]
Gourbault, N. & W. Decramer. 1986. Marine nematodes from Guadeloupe and other Caribbean Islands. II. Draconematidae.-Zool. Scr. 15: 107-118. [ Links ]
Gourbault, N. E., R. M. Warwick & M. N. Helléouet. 1995. A survey of intertidal meiobenthos (especially Nematoda otros autores. in Coral sandy beaches of Moorea (French Polynesia). Bull. Mar. Sci. 57: 476-488. [ Links ]
Heip, C., M. Vincx, N. Smol & G. Vranken. 1982. The systematics an ecology of free-living marine nematodes. Helminthol. Abstr. ser. B, Plant Nematol. 51: 1-24. [ Links ]
Hopper, B. E. & Cefalu R. C. 1973. Free-Living Marine Nematodes from Biscayne Bay, Florida. V11. Enoplidae: Enoplus species in Biscayne Bay with Observations on the culture and Bionomics of E.paralittoralis Wieser,1953. Proc. of the Hermint. Soc. Wash. 40: 275-280. [ Links ]
Ludwig, J. A. & J. F. Reynolds. 1988. Statistical ecology: A primer on methods and computing. Wiley-Interscience, New York. 339 p. [ Links ]
Ortíz, M. C. & J. R. Sáenz. 1995. Monitoreo de la contaminación de la Bahía de Chetumal, Quintana Roo. Informe anual, Consejo Nacional de Ciencia y Tecnología; Centro de Investigaciones de Quintana Roo, México. 50 p. [ Links ]
Platt, H. M. 1982. Revision of the Ethmolaimidae (Nematoda: Chromadoridae). Bull. Brit. Mus. Nat. Hist., Zool. Ser. 43: 185-252. [ Links ]
Platt, H. M. & R. M. Warwick. 1983. A synopsis of free-living marine nematodes, Part I. British Enoplids. Cambridge University, London. 307 p. [ Links ]
Riemann, F. 1966. Die interstitielle Fauna im Elbe-Aestuar Verbreitung und Systematik. Arc. Hydrobiol (Supple) 31: 1-279. [ Links ]
Tarjan, A. C. 1980. Marine nematodes. Institute of Food and Agricultural Sciences University of Florida, Gainesville. 135 p. [ Links ]
Tietjen, J. H. 1991. Ecology of free-living nematodes from the Continental Shelf of the Central Great Barrier Reef Province. Est. Coast. Shelf Sci. 32: 421-438. [ Links ]
Vincx, M., P. Meire & C. Heip. 1990. The distribution of nematodes communities in the Southern Bight of the North Sea. Cah. Biol. Mar. 31: 107-129. [ Links ]
1 El Colegio de la Frontera Sur- Unidad Chetumal. A.P. 424 Chetumal Q. Roo México. Fax 98320447; alberto@nicteha.ecosur-qroo.mx