La familia Enterobacteriaceae es un amplio y heterogéneo grupo de bacilos Gram negativos que se aíslan de manera rutinaria en el laboratorio clínico y está constituida por muchos géneros, como Escherichia, Shigella, Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, entre otros. Su hábitat natural es el intestino de animales y seres humanos. Son agentes causales de muchas enfermedades como infecciones de tracto urinario, neumonía, infecciones de piel y tejidos blandos, meningitis y sepsis. De manera adicional, Shigella, Salmonella y las E. coli diarreogénicas se asocian a cuadros de gastroenteritis bacteriana.1,2
El incremento de la resistencia a los antibióticos es considerado una emergencia mundial. Las enterobacterias no escapan de este escenario. En particular, la resistencia a los carbapenémicos (CRE) ha sido catalogada por la Organización Mundial de la Salud (OMS) como un problema prioritario debido al potencial de esos patógenos y la necesidad de desarrollar nuevas terapias antimicrobianas (World Health Organization. Prioritization of pathogens to guide discovery, research, and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. Geneva: WHO; 2017. (accesado 07-08-2022). Disponible en: https:// www.who.int/publications/i/item/WHO-EMP- IAU-2017.12). En los últimos años, la incidencia de CRE ha aumentado de un 1% a un 30% en salones de medicina y hasta un 60% en unidades de cuidados intensivos (UCI).3,4 Como principales factores de riesgo, se ha citado el uso previo de antibióticos, la admisión a la UCI o el empleo de procedimientos invasivos (catéteres, endoscopias, entre otros).5 Costa Rica no está exenta de esta situación. El Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA) ha publicado alertas sobre brotes por Enterobacterales productores de metalobetalactamasas de tipo NDM en hospitales nacionales, como el Hospital San Juan de Dios (Jiménez A, Duarte F, Baltodano P, Cordero E, Godínez A, Calderón M. “Caracterización de aislamientos de Enterobacterales MBL-NDM positivos asociados a un brote en pacientes del Hospital San Juan de Dios, mayo 2021” (Internet). Tres Ríos, Costa Rica: INCIENSA; 2021. (accesado 1 de abril de 2023) Disponible en: www.inciensa.sa.cr). Así mismo, como parte de la estrategia de vigilancia de laboratorio de la resistencia a los antimicrobianos, se ha registrado aislamiento de E. coli, K. pneumoniae y P. aeruginosa productoras de carbapenemasas de tipo NDM, IMP y VIM (Jiménez A, Chaverri J, Pérez C, Ramírez M, Bolaños H, Grupo de trabajo de la Estrategia para la Vigilancia de Laboratorio de la resistencia a los antimicrobianos en microorganismos de importancia en salud pública. “Informe técnico: Estrategia Vigilancia de laboratorio de la resistencia a los antimicrobianos de microorganismos de importancia en salud pública, 2018” (Internet). Tres Ríos, Costa Rica: INCIENSA; 2020. (accesado 1 de abril de 2023) Disponible en: www.inciensa.sa.cr).
El tratamiento de las infecciones por CRE representa un reto a nivel hospitalario. Una de las opciones que se ha explorado es el uso de antibióticos de uso histórico como la colistina, la nitrofurantoína y la fosfomicina en monoterapia o terapia combinada.3,5 En particular, la fosfomicina y la nitrofurantoína surgen como una opción para el manejo de las ITU no complicadas, ya que existe un alto porcentaje de resistencia a otras opciones de antimicrobianos orales no b-lactámicos.6,7
Ante el interés en el uso de estos fármacos, el objetivo de esta revisión es explorar los principales mecanismos de resistencia a la colistina, la nitrofurantoína y la fosfomicina presentes en las enterobacterias. Esto es de particular importancia ya que los plásmidos que acarrean determinantes de resistencia a los carbapenémicos también pueden albergar genes de resistencia a estos antimicrobianos.8
Métodos
Se realizó una búsqueda de literatura científica relevante sobre los mecanismos de resistencia a la colistina, la nitrofurantoína y la fosfomicina en enterobacterias usando bases de datos como PubMed (NCBI), PLOS, Redalyc, Google Scholar y Science Direct. Para ello, se utilizaron palabras clave y términos DeCS como “Carbapenem-Resistant Enterobacteriaceae”, “colistin”, “nitrofurantoin”, “fosfomycin”, “resistance” y “plasmids”. Los artículos encontrados se clasificaron de acuerdo con el año de publicación y sólo se incluyeron aquellos de investigación y revisión. Para el trabajo se tomaron en cuenta únicamente los artículos publicados entre los años 1999 y 2022 de forma que se analizan trabajos clásicos y los avances más recientes en el tema.
Mecanismos de resistencia a la colistina
La colistina es un polipéptido catiónico que pertenece al grupo de las polimixinas. Dentro de este grupo, se tienen cinco compuestos químicos diferentes, pero sólo la poliximina B y la colistina (polimixina E) se utilizan de forma clínica. En la naturaleza, es producida por la especie Paenibacillus polymyxa.9,10 Por su mecanismo de acción, se considera un antibiótico bactericida. Este consiste en la unión al lipopolisacárido (LPS) de la membrana externa de bacterias Gram negativas. En primera instancia, provoca un desplazamiento del Ca2+ y Mg2+ que estabiliza esta estructura al interactuar con los grupos fosfatos del lípido A. Esto permite que la colistina se inserte en la membrana. Como consecuencia, ocurre una permeabilización de la estructura, la incapacidad de retener el contenido intracelular y una lisis de la célula. Al unirse al lípido A, ejerce también un efecto antitoxina, lo que evita un choque endotóxico.11,12
En cuanto al espectro de acción, la colistina es activa frente a la mayoría de las enterobacterias como E. coli, Klebsiella sp., Enterobacter sp., Citrobacter sp., Salmonella sp. y Shigella sp. Sin embargo, algunas especies presentan una resistencia intrínseca a la colistina como Proteus sp., Providencia sp., M. morganii y S. marcescens.9,13
La resistencia intrínseca, particularmente en P. mirabilis y S. marcescens, recae sobre el operón arnBCADTEF y el gen eptB. Cuando ocurre la expresión de estos elementos genéticos, la 4-amino-4-desoxi-L-arabinosa (L-Ara4N) y la fosfoetanolamina (pEtN) son incorporadas al LPS por el operón y el gen, de forma respectiva. Esta modificación provoca que la carga positiva del LPS aumente y que, como resultado, se reduzca la unión de la colistina a la membrana externa bacteriana. En P. mirabilis también se ha descrito el gen eptC que, de forma similar a eptB, participa en la modificación del LPS con pEtN.13,14
En relación con la resistencia adquirida a la colistina, no se conoce la prevalencia exacta. Sin embargo, el género Enterobacter muestra una tasa más alta (4-20%) que otros géneros como Escherichia y Klebsiella (aproximadamente <2% para cada uno).15 La mayoría de los mecanismos se basan en la modificación del LPS. Para entender dichos mecanismos, se tienen que estudiar dos sistemas de componentes que regulan los procesos de modificación del LPS: PmrAB y PhoPQ (Figura 1). El primero consta del operón pmrABC que codifica por 3 proteínas: PmrA (proteína reguladora), PmrB (sensor citoplasmático unido a la membrana con actividad quinasa) y PmrC (proteína de membrana putatitva). PmrB se activa por estímulos ambientales como una alta concentración de hierro (Fe3+), exposición a aluminio (Al3+) y pH ácido.11,13 Cuando esto ocurre, PmrB fosforila y activa a PmrA que, a su vez, activa la regulación de los operones pmrABC, pmrHFIJKLM y el gen pmrE. La activación de estos últimos tres elementos genéticos lleva a la adición de L-Ara4N y pEtN al lípido A y, como consecuencia, a la modificación del LPS. Aquí se tiene el primer mecanismo de resistencia, ya que mutaciones en los genes pmrA y pmrB llevan a una mayor expresión de pmrABC, pmrHFIJLM y pmrE.10,14 Por lo tanto, el LPS se carga positivamente y se reduce la unión de la colistina.

Figura 1 Sistemas de dos componentes implicados en la modificación del lipopolisacárido: PmrAB y PhoPQ. Diferentes estímulos ambientales activan las proteínas sensoras PhoQ y PmrB que culminan con la modificación del lípido A por adición de 4-amino-4-desoxi- L-arabinosa (L-Ara4N) y la fosfoetanolamina (pEtN). El proceso de fosforilación se denota por un círculo conteniendo la letra “P”. Figura adaptada de referencias 13, 14 y 18. Creada con BioRender.com
Por otra parte, el sistema de dos componentes PhoPQ está formado por dos proteínas: PhoP (reguladora) y PhoQ (sensor con actividad quinasa). El sistema se ve activado por bajas concentraciones de Ca2+ y Mg2+, pH ácido o presencia de péptidos catiónicos antimicrobianos. Cuando esto ocurre, PhoQ fosforila y activa PhoP lo que activa el operón pmrHFIJLM. Asimismo, PhoP puede activar de forma directa o indirecta (por medio de la proteína conectora PmrD) a PmrA lo que también estimula transcripción de pmrHFIJLM. En razón de ello, se tiene una modificación del LPS por adición de L-Ara4N. Si existen mutaciones en los genes phoP/Q, se estimula todo este sistema, lo que lleva a resistencia a la acción de la colistina.13 Mutaciones en ambos de los sistemas de dos componentes mencionados antes se han reportado en cepas de E. coli, K. pneumoniae y Salmonella sp. resistentes a la colistina.14
Aunado a lo anterior, se tiene el gen mgrB, que codifica por una proteína que regula de forma negativa el sistema PhoPQ al inhibir la actividad quinasa de PhoQ. Si se tiene una inactivación de mgrB por inserciones, deleciones, mutaciones sin sentido o con cambio de sentido, se da una regulación al alta del sistema PhoPQ.11 Como resultado, la bacteria adquiere resistencia a la colistina. Se ha observado que el cambio genético en mgrB es el mecanismo de resistencia más prevalente en cepas de K. pneumoniae y K. oxytoca. No obstante, también se ha identificado este mecanismo en aislamientos de E. coli.14
Mutaciones en los genes involucrados en la biosíntesis de LPS se han relacionado con resistencia a la colistina. Uno de ellos es el locus ramA, que consta de tres genes: ramA, romA y ramR. Las modificaciones genéticas en ramA, que llevan a un incremento en sus niveles, provocan una activación de genes involucrados en la biogénesis del lípido A, en especial lpxC, lpxO y lpxL2. Esto, a su vez, lleva a alteraciones en el lípido A que confieren resistencia a este antibiótico.11,16 De igual manera, la resistencia a la colistina puede estar dada por bombas de eflujo, particularmente las proteínas Sap, KpnEF y AcrAB.13 En el caso de KpnEF, además de la colistina, también disminuye la susceptibilidad a otros antimicrobianos como cefepime, ceftriaxona, eritromicina, rifampicina, tetraciclina y estreptomicina.17
Así mismo, la cápsula bacteriana limita la interacción de la colistina con la membrana externa de los Gram negativos. Se ha visto que modificaciones que regulen de forma positiva los genes que estimulan la producción de polisacárido capsular favorecen la resistencia al antimicrobiano.18 Existen además dos reguladores de la formación de polisacárido capsular que están localizados en la membrana externa: Cpx (expresión del pili conjugativo) y Rcs (regulador de la síntesis de cápsula). Ambos se relacionan con resistencia a la colistina ya que activan la bomba de eflujo KpnEF y el sistema PhoPQ, respectivamente.13 A nivel de membrana externa, un aumento en los niveles de la proteína H1 contribuye con la resistencia a la colistina ya que se reemplaza el Mg2+ y Ca2+ en los sitios de unión del antibiótico. Sin embargo, este mecanismo se ha descrito más en otras bacterias, como P. aeruginosa.18
Los mecanismos de resistencia mencionados anteriormente corresponden a alteraciones genéticas. Hasta el momento, se ha descubierto sólo un mecanismo de resistencia mediado por plásmidos: el gen mcr-1. Este gen codifica por una enzima que modifica el lípido A mediante la adición de pEtN.14 Además del mcr-1, se han descrito otros 8 homólogos (mcr-2 a mcr-9). La sola presencia del gen mcr-1, sin presencia de otros mecanismos de resistencia, es suficiente para que la bacteria adquiera un fenotipo de resistencia a la colistina. Además de la transferencia horizontal que ocurre entre enterobacterias, los plásmidos acarreadores del gen mcr-1 cobran una alta importancia clínica ya que por lo general contienen genes de resistencia a una variedad de agentes antimicrobianos como b-lactámicos, fosfomicina, aminoglucósidos y quinolonas.11,14
Con la colistina ocurre un fenómeno conocido como heterorresistencia, en el que se tiene una subpoblación resistente al antibiótico contenida dentro de una población catalogada como susceptible. En el caso de este antimicrobiano, se tienen subpoblaciones que logran soportar una concentración de ≥4 ug/mL dentro de una población cuya concentración mínima inhibitoria (CMI) obtenida es ≤2 ug/mL. Uno de los principales problemas de la heterorresistencia es que no es detectada por los métodos tradicionales de laboratorio utilizados para realizar la prueba de sensibilidad a la colistina. En países como EE. UU., se han realizado estudios que han demostrado que los aislamientos con heterorresistencia alcanzan un porcentaje mayor que los aislamientos resistentes y que muchos de ellos han sido mal clasificados como susceptibles por las metodologías tradicionales.13,19
Los mecanismos detrás de la heterorresistencia no están totalmente dilucidados, pero se ha observado que esta puede generarse por alteraciones en el sistema de dos componentes PhoPQ.20 Las implicaciones clínicas de este fenómeno deben estudiarse más. Sin embargo, en experimentos con modelos murinos de infección utilizando aislamientos de Klebsiella y Enterobacter, se ha demostrado que la heterorresistencia a la colistina puede llevar a fracaso terapéutico.21,22
Mecanismos de resistencia a la nitrofurantoína
La nitrofurantoína es un antimicrobiano sintetizado a partir del nitrofurano. En el año 1953, fue aprobado su uso por la FDA para el tratamiento de la ITU no complicada ya que posee un amplio espectro contra bacterias Gram negativas y Gram positivas, se administra por vía oral, se absorbe rápidamente en el intestino delgado y es excretado por orina, donde alcanza una alta concentración (100 - 250 μg/mL).23,24
El mecanismo de acción de la nitrofurantoína no se conoce con claridad. No obstante, se sabe que a nivel intracelular debe ser modificado por nitrorreductasas para producir metabolitos reactivos que se unen a los ribosomas e inhiben enzimas involucradas en la síntesis de ADN, ARN y enzimas metabólicas. Sobre el cromosoma bacteriano, en particular, actúa formando aductos sobre el nitrógeno de la posición 2 de la desoxiguanosina. Esto provoca una inhibición de la ADN polimerasa y, como consecuencia, la muerte bacteriana.23 En E. coli se describen dos tipos de nitrorreductasas: I (no sensibles al oxígeno) y II (sensibles al oxígeno). Las de tipo I están codificadas por los genes nfsA y nfsB.25 La mayoría de los estudios de resistencia a la nitrofurantoína se han basado en esta bacteria, al ser el principal patógeno asociado con ITU. Los principales mecanismos de resistencia a este antibiótico están listados en el Cuadro 1.
Cuadro 1 Principales mecanismos de resistencia a la nitrofurantoína registrados para los Enterobacterales
| Alteración genética | Mecanismo de resistencia | Observaciones |
|---|---|---|
| Deleciones, inserciones o sustituciones en los genes nfsA y nfsB. | Disminución en la formación de metabolitos tóxicos. | La inactivación de cualquiera de los dos genes es suficiente para generar altos niveles de resistencia. |
| Deleciones en el gen ribE que codifica por la enzima lumazina sintasa. | Disminución en la síntesis de flavín mononucléotido (FMN), cofactor importante de las nitrorreductasas de tipo I. | Encontrada en pocos aislamientos clínicos. La deleción posee un alto costo para el fitness bacteriano ya que afecta su tasa de crecimiento. |
| Presencia de la bomba de eflujo OqxAB. | Expulsión de diversos sustratos: nitrofurantoína, olaquindox, cloranfenicol, ciprofloxacina, ácido nalidíxico, trimetoprim y amonios cuaternarios. | Únicamente en compañía de modificaciones de los genes nfsA y nfsB posee la capacidad de potenciar la resistencia y aumentar los valores de la CMI. Diseminación por medio de transposones (Tn6010). |
La resistencia a la nitrofurantoína es un fenómeno que se debe comenzar a vigilar con mayor atención, sobre todo por el aumento en su uso dada la alta resistencia a otras opciones orales para el tratamiento de la ITU no complicada, como la ciprofloxacina, el trimetoprim/sulfametoxazol y los antibióticos b-lactámicos.23 Adicional a lo anterior, se han obtenido aislamientos de enterobacterias resistentes a la nitrofurantoína a los que no se les ha encontrado ninguno de los determinantes genéticos anteriores, por lo que se requiere mayor investigación.27 Cabe recordar que Serratia spp., Proteus spp., Providencia spp. y Morganella morganii son resistentes intrínsecamente a este antimicrobiano.24
Mecanismos de resistencia a la fosfomicina
La fosfomicina es un antibiótico derivado del ácido fosfónico y es producido por diversas especies de Streptomyces sp. y Pseudomonas sp. En su estructura química, posee un grupo epóxido y un grupo propílico. Se considera un antibiótico de amplio espectro que tiene buena actividad contra los patógenos urinarios más comunes, tanto Gram negativos como Gram positivos.10,31 Su mecanismo de acción consiste en interferir con los pasos iniciales de la síntesis de peptidoglicán. Funciona como un análogo del fosfoenolpiruvato que se une a la enzima MurA. En el sitio activo de la enzima, forma un enlace covalente con un residuo de cisteína. Al inactivar la enzima, impide la formación del ácido-N-acetilmurámico y provoca una lisis de la bacteria.32,33
La fosfomicina se puede encontrar en varias presentaciones: intravenosa (en forma de sal disódica) y oral (combinada con una sal de calcio o formulada con trometamol). La presentación oral se encuentra aprobada por la FDA para el tratamiento de la ITU no complicada ya que se excreta casi totalmente por vía renal y alcanza una alta concentración en orina por más de 24 horas. En algunos países, la presentación intravenosa es usada en combinación con otros antibióticos para el tratamiento de infecciones por microorganismos multidrogorresistentes.32,34 En la actualidad, una formulación intravenosa para el tratamiento de la ITU complicada está siendo revisada por la FDA.35,36
Para entender los mecanismos de resistencia a la fosfomicina (Figura 2) es necesario primero estudiar los sistemas que permiten su ingreso hasta el citoplasma bacteriano, donde ejerce su acción bactericida. La entrada del antibiótico se da por el transportador del glicerol-3-fosfato (GlpT) y por el transportador de la glucosa-6-fosfato (UhpT), ya que la fosfomicina imita la estructura química de ambas moléculas. La expresión de ambos sistemas es inducida por sus substratos y requiere de la presencia de AMPC.33,34
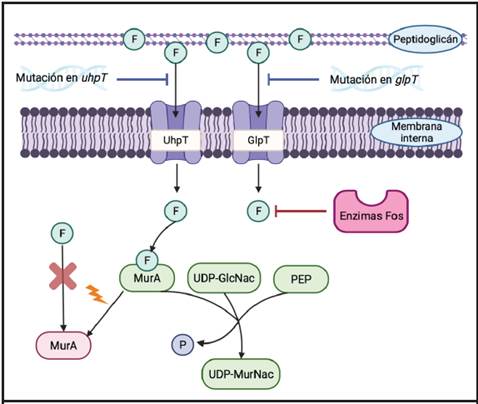
Figura 2 Mecanismos de resistencia a la fosfomicina presentes en Enterobacteriaceae: impermeabilidad, alteración del sitio blanco y modificación enzimática por enzimas Fos. La fosfomicina (denotada por un círculo conteniendo la letra “F”) entra al citoplasma bacteriano por los transportadores UhpT y GlpT. Una vez dentro de la célula, mimetiza la estructura del fosfoenolpiruvato (PEP) e inhibe la enzima MurA. Esta enzima es la encargada de sintetizar el ácido UDPN- acetilmurámico (UDP-MurNac; precursor del peptidoglicano) a partir de UDP-N-acetilglucosamina. Las mutaciones en MurA se denotan con un cambio de color en la enzima. Adaptado de referencias 34 y 36. Creado con BioRender.com
El primer mecanismo de resistencia a la fosfomicina consiste en deleciones, inserciones o mutaciones puntuales en los genes estructurales que codifican por los sistemas transportadores GlpT y UhpT. Esto provoca un bloqueo o una disminución de la entrada del antibiótico a la célula. Además, las variaciones se pueden dar en los genes reguladores de UhpT: uhpA, uhpB o uhpC.32 Las alteraciones en glpt, uhpt o uhpA se observan con frecuencia en aislamientos clínicos, no así aquellas en los genes uhpC o uhpB. Experimentos de mutagénesis in vitro han demostrado que una alta proporción de las mutaciones en los genes uhpC y uhpB retienen la expresión del sistema UhpT, lo que podría explicar este fenómeno.34
AlteracionesenlosgenesptsI(fosfotransferasa) y cyaA (adenilato ciclasa) llevan a una disminución en los niveles intracelulares de AMPC, por lo que se podrían relacionar con resistencia a la fosfomicina ya que reducen la expresión de los sistemas GlpT y UhpT.33 Sinembargo,anivelclínico,estasmutaciones no se observan. Se ha visto que estas alteraciones genéticas pueden conducir a una perturbación en el metabolismo de los carbohidratos, por lo que tendrían un alto costo biológico. A parte de eso, también pueden disminuir la biosíntesis del pili y afectar la unión de las bacterias al epitelio urinario y, como consecuencia, mermar la virulencia.33,34
Modificaciones en el sitio blanco también han sido relacionadas con el desarrollo de resistencia a la fosfomicina. Una de estas mutaciones se da en la posición 115 de la enzima MurA en E. coli que provoca un cambio de cisteína por aspartato en el sitio activo. Con esta alteración, la enzima mantiene su actividad, pero pierde la afinidad por la droga. Adicionalmente, otras sustituciones de aminoácidos también se han asociado a resistencia a la fosfomicina (Asp369Asn y Leu370Ile).33 Este tipo de mecanismo de resistencia es muy raro de encontrar en aislamientos clínicos, lo que hace suponer que variaciones en la secuencia de MurA que alteran su afinidad por la fosfomicina también pueden llegar a afectar la biosíntesis de peptidoglicán en la bacteria.34
La fosfomicina provoca una modificación covalente de la enzima MurA, por lo que un aumento en la expresión de esta puede conllevar a un fenotipo resistente. Al contrario de las mutaciones en la enzima, se ha visto que el costo biológico de este mecanismo no es alto.34,37 Incrementos en la expresión de MurA ya han sido registrados en ciertos aislamientos clínicos de E. coli.38 El último mecanismo descrito es la inactivación de la fosfomicina por enzimas (ver Cuadro 2).
Cuadro 2 Tipos de enzimas involucradas en la inactivación de la fosfomicina.
| Metaloenzimas | ||||
| Enzima | Mecanismo de acción | Cofactores | Microorganismos | |
| FosA | Glutatión-S-transferasa que abre el grupo epóxido de la fosfomicina por la adición de un grupo sulfihidrilo. | Mn2+ y K+ | Enterobacterales, Pseudomonas y Acinetobacter. El gen fosA3 es el de mayor diseminación en Enterobacterales. | |
| FosB | Bacilitiol-S-transferasas que utiliza la L-cisteína o el bacilitiol como donador del grupo tiol para inactivar el antibiótico. | Mg2+ | Bacterias Gram positivas, de forma cromosomal (Bacillus subtilis) o plasmídica (Staphylococcus sp. y Enterococcus sp.). | |
| FosX | Hidrolasas que rompen el grupo epóxido de la fosfomicina por medio de la adición de H2O. | Mn2+ | Listeria monocytogenes, Brucella melitensis y Clostridium botulinum | |
| Quinasas | ||||
| Enzima | Mecanismo de acción | Cofactores | Microorganismos | |
| FomA y FomB | Inactivación del antibiótico por conversión a fosfomicina monofosfato y fosfomicina difosfato. | Mg2+ | S. wedmorensis y S. fradiae | |
| FosC | Inactivación del antibiótico por conversión a fosfomicina monofosfato. | P. syringae | ||
Fuente: Elaboración propia a partir de referencias 31-34
En enterobacterias, los genes que codifican por enzimas modificadoras de fosfomicina se encuentran frecuentemente en plásmidos, transposones o contenidos en integrones. Se ha visto que las secuencias de inserción (IS) son importantes en su diseminación. En el caso de fosA3, la IS26 es un elemento clave. El principal reto es que los plásmidos que contienen los genes fos usualmente acarrean genes que confieren resistencia a otros antibióticos como aminoglucósidos, b-lactámicos, fluoroquinolonas, entre otros. Esto provoca que la resistencia a la fosfomicina se pueda coseleccionar por la presión selectiva de otros antibióticos.8,39 Por ejemplo, se han descrito aislamientos de E. cloacae con plásmidos que acarrean simultáneamente genes de resistencia a carbapenémicos (blaNDM-1), aminoglicósidos (armA) y fosfomicina (fosA3).40 Sumado a eso, se han encontrado aislamientos de K. pneumoniae resistentes a los carbapenémicos portando genes blaKPC, blaNDM, blaIMP en conjunto con fosA3.41
Las infecciones por CRE representan un desafío para el personal de salud ya que las opciones terapéuticas son escasas. Ante la dificultad que implica el desarrollo de nuevos antimicrobianos o de adquirir los de última línea para ciertos sistemas de salud, se ha puesto la mirada otra vez en fármacos de uso histórico como la colistina, la nitrofurantoína y la fosfomicina.
Un incremento en el uso de estos antimicrobianos representa un aumento en la selección de cepas que posean mecanismos de resistencia. Para los tres antibióticos, se ha observado que los mecanismos son variados y abarcanmodificaciones delsitioblanco,inactivación enzimática de la droga, impermeabilidad y eflujo. Adicionalmente, los determinantes genéticos de resistencia se pueden encontrar a nivel cromosomal o en plásmidos.
La vigilancia basada en el laboratorio es fundamental para combatir el problema de la resistencia a los antibióticos. Conocer los determinantes genéticos, los mecanismos y la frecuencia de las resistencias, así como la posibilidad de transferencia horizontal entre microorganismos, permite mejorar este proceso de forma considerable. Por ejemplo, se pueden dar alertas oportunas que instauren modificaciones terapéuticas o medidas de aislamiento requeridas. De esta forma, se puede optimizar el uso de antimicrobianos como la colistina, la nitrofurantoína y la fosfomicina que forman parte del escaso repertorio para algunas infecciones causadas por microorganismos multidrogorresisentes, como las CRE.















