Las esponjas marinas representan la mayor fuente de moléculas con potencial bioactivo de los últimos 50 años (Blunt, Copp, Keyzers, Munro, & Prinsep, 2015). De los miles de compuestos reportados en organismos marinos, solo 121 compuestos están disponibles comercialmente por sus propiedades farmacológicas útiles en la investigación biomédica, de los cuales 43 compuestos son procedentes de esponjas marinas, representado el mayor número de compuestos con respecto a otros phylums (Gerwick & Moore, 2012).
En la Bahía de Mochima habitan esponjas del género Aplysina,Cliona, Aaptos,Cinachyrella, Amphimedon, entre otras (Amaro & Liñero-Arana, 2002). En otras partes del mundo a partir de las esponjas de estos géneros se han reportado compuestos con diversas actividades biológicas.
Las esponjas del género Aplysina son ricas en metabolitos bromados (Silva, Carneiro, Fechine, Sobral, da Cunha, Filgueiras, Cezar, da Silva & Barbosa, 2011). De la esponja Aplysina lacunosa, se ha aislado un alcaloide tipo bromotirosina, 11-oxoaerotionina, el cual exhibe citotoxicidad in vitro contra líneas celulares de cáncer de colon humano (HCT 116) (Acosta & Rodríguez, 1992). Por otro lado, las lectinas CLv purificadas de Cliona varians han presentado una considerable actividad proinflamatoria, usando el modelo in vivo de migración de leucocitos para el estudio inflamatorio de peritonitis en ratones (Moura, 2006). Una gran variedad de aaptaminas se han reportado en las esponjas del género Aaptos (Larghi, Bohn, & Kaufman, 2009), estos alcaloides presentan actividad anticancerígena contra las líneas celulares de cáncer humano THP-1, HeLa, SNU-C4, SK-MEL-28, and MDA-MB-231(Dyshlovoy, Fedorov, Shubina, Kuzmich, Bokemeyer, Keller-von Amsberg, & Honecker, 2014).
El alcaloide cinachyramino aislado de la esponja Cinachyrella sp., presenta actividad citotóxica contra células de HeLa S3 con un CL50 de 6,8µg/mL (Shimogawa & Kuribayashi, 2006), sin embargo, de otra esponja del mismo género, Cinachyrella kuekenthali se ha reportado el aislamiento de un aminoácido derivado de treonina, 2-N-acetilglucosamina-α-O-treonina [2-N-AcNGlc-αO-Thr, el cual es inactivo contra las líneas celulares de cáncer humano Sk Br-3, HT-29 y la línea celular de riñón de mono MA-104. (Henríquez, Sevcik, D'Suze, Visbal, & Christophersen, 2013) De la esponja Amphimedon viridis, se ha logrado aislar halitoxinas y amphitoxinas con propiedades neurotóxicas y antimicrobianas (Henríquez, Crescente & López, 1997; Kelman, Kashman, Rosenberg, Ilan, Ifrach, & Loya, 2001).
En este trabajo, se realizaron pruebas químicas y de bioactividad a las fracciones solubles en acetato de etilo de las esponjas marinas Aplysina lacunosa, Aplysina fulva, Cliona varians, Cinachyrella kuekenthali, Amphimedon viridis y Aaptos pernucleata recolectadas en las costas venezolanas, con el propósito de evaluar la capacidad de estos invertebrados de biosintetizar metabolitos secundarios con posible actividad letal y antimicrobial.
Métodos
Área de muestreo y características: Se recolectaron ejemplares de las esponjas marinas A. lacunosa, A. fulva, C. varians, C. kuekenthali, A. viridis y A. pernucleata, en octubre del 2009, a profundidades entre los 0.1 y 10 metros aproximadamente, en diferentes substratos (coralino, rocoso, raíces de mangle, arenoso, pedregoso y praderas de Thalassia). La recolección se realizó por medio de equipos de buceo libre y autónomo, en dos localidades de la Bahía de Mochima, Isla Larga (10º21'05"-10º21'38'' N y 64º21'05' - 64º21'25" O)y Mangle Quemao (10º22'28'' - 10º22'40'' N y 64º20'53'' - 64º20'70'' O) ubicadas en la costa norte de Venezuela, a unos 30km de la ciudad de Cumaná, estado Sucre.
Obtención de los extractos: Las esponjas frescas se cortaron en trozos pequeños para eliminar la fauna endobiótica visible que podía habitar en estos organismos, se dejaron suspendidas en agua de mar bifiltrada cambiando el agua en intervalos de una hora en dos ocasiones. Se colocaron en un envase con metanol (99,9%) durante 48h, se filtraron y el residuo se reextrajo sucesivamente. Los filtrados combinados fueron evaporados y concentrados a presión reducida (aprox. 11mbar) en un rotoevaporador marca Hildolph, para la obtención del extracto metanol/agua. Posteriormente, este extracto se particionó con agua y se extrajo con acetato de etilo; la fase orgánica se separó y fue secada con sulfato de sodio anhidro y concentrada a presión reducida, obteniéndose la fracción soluble en acetato de etilo (FAE).
Pruebas químicas: Se realizó una evaluación química de la FAE, para detectar la presencia de metabolitos secundarios. Se procedieron según las metodologías descritas por Domínguez (1983) y Marcano & Hasegawa (2002), empleándose los siguientes reactivos de clasificación: Dragendorff (una mezcla: 20mL nitrato de bismuto al 40% en ácido nítrico al 30% y 50mL yoduro de potasio al 54,4%, aforado a 100mL) para alcaloides, LiebermannBurchard (una mezcla 5:1 cloroformo-anhídrido acético, y una gota de ácido sulfúrico concentrado) para esteroles y triterpenos, Baljet (una mezcla 1:1 ácido pícrico al 10% en etanol e hidróxido de sodio acuoso al 5%) para lactonas sesquiterpenicas, cloruro de hierro al 10% en agua para polifenoles, ensayo de gelatina-sal para taninos (gelatina al 1% en NaCl al 1% acuoso), para glicósidos cardiotónicos ácido 3,5-dinitrobenzoico (2%) e KOH (0,5mol/L),) y el ensayo de la espuma para saponinas.
Pruebas de actividad biológica
Actividad antibacteriana y antifúngica: Para determinar la actividad antibacteriana se utilizó la técnica de difusión en placas, según la metodología descritas por Bauer et al., (1966), empleándose diversas cepas de bacterias Gram positivas (Listeria monocytogenes y Staphylococcus aureus) y Gram negativas (Escherichia coli y Salmonella sp.) pertenecientes a la Colección Americana de Cultivos Tipo (ATCC). Para evaluar la actividad antimicótica se siguió la técnica descrita por Madubunyi (1995), utilizando cepas de un hongo patógeno (Candida albicans) y hongos fitopatógenos (Aspergillus niger, Curvularia sp. y Penicillium crustosum) de origen clínico.
Se evaluaron los diámetros de los halos de inhibición tomando como referencia los criterios expuestos por Monks et al., (2002) para extractos crudos de organismos marinos.
Actividad letal en Artemia salina : La actividad letal se evaluó mediante el bioensayo descrito por Meyer et al., (1982), donde se midió la toxicidad de las distintas fracciones, contra nauplios del crustáceo comercial Artemia salina. La cuantificación de la mortalidad de los nauplios se llevó a cabo 24 y 48h de exposición a las diferentes fracciones, por medio del software LC50 program V2.5, considerando los análisis estadísticos computarizados (Probit, Binomial, Logit y Moving Average) indicados por Stephan (1977), para determinar la concentración letal media (CL50).
Resultados
Obtención de las fracciones solubles en acetato de etilo (FAE): Las especies del género Aplysina, presentaron los rendimientos de extracción más altos y la esponja C. Varians mostró el rendimiento más bajo con respecto a las demás esponjas (Cuadro 1).
Cuadro 1: Porcentajes secos de las fracciones solubles en acetato de etilo
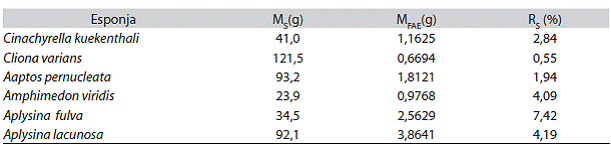
MS: masa de la esponjas seca; MFAE: masa de la fracción en acetato de etilo; RS: rendimiento con respecto a la masa seca.
Metabolitos secundarios: Las pruebas químicas realizadas a las FAE de los invertebrados marinos, evidenciaron la presencia de alcaloides en todos los organismos (Cuadro 2), y en su mayoría resultaron positivas en esteroles insaturados y triterpenos pentacíclicos. Lasesponjas de género Aplysina fueron las que presentaron mayor cantidad de metabolitos, por otro lado la esponja C. kuekenthali mostró la menor cantidad de los metabolitos detectados. Los ensayos para la detección de antraquinonas, polifenoles, saponinas, glicósidos cianogénicos y glicósidos cardiotónicos resultaron negativos en todas las esponjas.
Cuadro 2: Metabolitos secundarios de las fracciones solubles en acetato de etilo

+: Detectado, - : No detectado.
Actividad antimicrobiana: La capacidad antimicrobiana de las FAE ante diferentes bacterias y hongos, mostraron un comportamiento homogéneo de la bioactividad de dichas fracciones (Cuadro 3). La fracción obtenida de la esponja A. lacunosa mostró mayor espectro de inhibición contra microorganismos empleados, los cuales fueron en su totalidad bacterias, siendo esta actividad entre fuerte y moderada contra L. monocytogenes, S. aureus y E. coli, igualmente la FAE de la esponja A. fulva presentó una actividad moderada y leve contra S. aureus y E. coli, repectivamente. Las FAE de C. varians, C. kuenkenthaliy A. viridisno presentaron actividad antibacteriana ni antimicótica. Todas las FAE de las especies resultaron inocuos frente a los hongos estudiados, a excepción de A. pernucleata que presentó actividad leve contra C. albicans.
Cuadro 3: Actividad antimicrobiana de las fracciones solubles en acetato de etilo
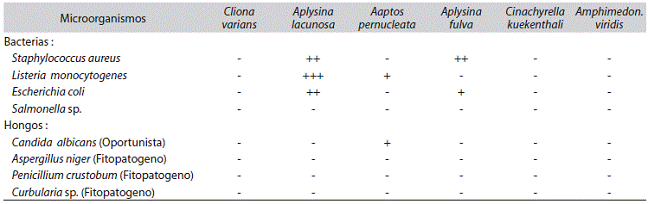
+++: Actividad fuerte (diámetro superior a 18mm), ++: Actividad moderada (diámetro entre 15-18mm), +: Actividad leve (diámetro entre 11-14mm), -: no hay actividad.
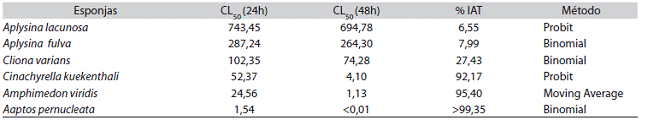
Letalidad: Las FAE de las esponjas estudiadas resultaron letales a los nauplios A. salina. Los valores de concentración letal media (CL50) de las FAE fueron inferiores a 1 000μg/mL (Cuadro 4) transcurridas 24h de exposición de los nauplios. Las FAE de las esponja del género Aplysina fueron las menos activas presentando los mayores valores de CL50, por otro lado las fracciones de las esponjas A. pernucleata, C. kuekenthali y A. viridis resultaron ser las más activas, con valores de CL50 por debajo de 55μg/mL, y observándose un incremento de la letalidad superior al 90% a las 48h de exposición, para estas tres especies.
Discusión
En este trabajo se reporta por primera vez la presencia de alcaloides en esponjas del género Cliona (Cuadro 2). Adicionalmente, se observó la presencia de alcaloides en todas las esponjas analizadas. Este resultado es consistente con los estudios previamente reportados, en los cuales se ha aislado una variedad de alcaloides tipo bromotirosina en esponjas del género Aplysina, tipo aaptaminas en el género Aaptos, cinachyramino en el género Cinachyrella, y tipo halitoxina en A. viridis (Tsuda & Hirano, 1999; Kelman et al., 2001; Shimogawa & Kuribayashi, 2006; Nuñez & De Almeida 2008; Khozirah et al., 2009; Larghi et al., 2009; Silva et al., 2011).
Los esteroles y triterpenos también mostraron una abundancia importante en las esponjas estudiadas (Cuadro 2), debido a que estos compuestos están vinculados con la formación de la membrana plasmática de las células de las esponjas, la cual está constituida por lípidos, donde los compuestos de origen esteroidal tienen una significativa participación (Sarma et al., 2009; Mun et al., 2015).
Muchos estudios han observado un orden creciente de abundancia entre los tres tipos de núcleos esteroidales encontrados, dirigido en la forma: Δ7-Δ5-Δ0 (Valle & Santafé 2009). Estas habilidad que tienen las esponjas para transformar los esteroles, reduciendo (en ese mismo orden) los dobles enlaces de los núcleos, obedece a la necesidad de satisfacer los requerimientos de sus membranas celulares logrando así la adaptación requerida en cualquier ambiente marino (Castellanos & Duque, 2008). Por lo cual las esponjas son consideradas como la mayor fuente de esteroles con estructuras poco comunes en el ambiente marino, lo que puede comprobarse con los 250 esteroles polares descubiertos hasta el año 2002; adicionalmente, se identificaron 80 esteroles provenientes de esponjas marinas, entre los años 2003 y 2008 (Valle & Santafé, 2009).
Las esponjas del género Aplysina presentaron taninos y metilencetonas, siendo este el primer reporte en el cual se detectaron estos tipos de metabolitos en este género. Considerando que estas familias de metabolitos se han caracterizado por poseer actividades biológicas significativas, tales como actividad antitumoral, antimicrobiana, fototóxica, entre otras, es posible que estos metabolitos estén asociados a algún mecanismo de defensa (Marcano & Hasegawa, 2002).
Reportes previos demostraron la presencia de saponinas y polifenoles en el extracto acuoso de la esponja A. lacunosa (Kazanjian & Fariñas, 2006). Sin embargo las pruebas para polifenoles, saponinas, glicósidos cianogénicos y glicósidos cardiotónicos resultaron negativas en la FAE A. lacunosa de este estudio. La ausencia de estos metabolitos en la FAE A. lacunosa puede atribuirse a la alta polaridad que presentan estos compuestos, por lo cual permanecen en la fase acuosa originada durante la partición con el acetato de etilo del extracto hidroalcohólico.
La FAE de la esponja A. lacunosa presentó actividad antibacteriana fuerte, contra L. monocytogenes, y moderada contra S. aureus y E. coli, mostrando actividad frente bacterias Gram (+) como Gram (-) (Cuadro 3). Esta fuerte actividad antibacteriana podría ser atribuida a la presencia de más de un constituyente activo en esta esponja, entre los cuales se encontrarían, los bromometabolitos con actividad antibacteriana significativa que han sido reportados en esponjas de este género (Silva et al., 2011). Además, se puede inferir que la presencia de taninos y metilencetonas, detectados solamente en estas esponjas, pudiesen estar asociados a la actividad antibacteriana observada.
El extracto acuoso de la esponja A. lacunosa, recolectada en el Morro de Tigüitigüe, Santa Fe, estado Sucre, mostró actividad contra E. coli, pero no inhibió el crecimiento de las cepas S. aureus y L. monocytogenes (Kazanjian & Fariñas, 2006). Sin embargo, la FAE de la esponja A. lacunosa (Cuadro 3) ensayada en esta investigación, fue capaz de inhibir el crecimiento de estas tres bacterias, indicando que los extractos orgánicos de este organismo poseen un rango mayor de actividad antibacteriana. La efectividad de los extractos orgánicos sobre el extracto acuoso de A. lacunosa para inhibir el crecimiento de una mayor cantidad de bacterias, coincide con lo reportado en la literatura para el extracto clorofórmico de A. lacunosa, colectada en la bahía de Santa Marta (Colombia), el cual presentó actividad bactericida contra las cepas S. aureus, E. coli y Salmonella sp (Silvestri et al., 1994). Por otra parte, La FAE de A. lacunosa en este estudio no mostró actividad contra Salmonella sp., pudiendo deberse a un efecto antagónico producido por metabolitos más polares extraídos con AcOEt, los cuales suprimen el efecto del (los) compuesto(s) que produce(n) la inhibición de esta bacteria.
Las FAE de las esponjas A. viridis y C. kuekentali, no presentaron actividad contra ninguna de las bacterias ensayadas (Cuadro 3), pero existen reportes de actividad antibacteriana de A. viridis recolectada en la bahía de Cispatá (Colombia) y C. kuekentali recolectada en la Isla de Coche (Venezuela), las cuales presentaron actividad bactericida contra S. aureus y E. coli (Hernández, 2004; Galeno et al. 2007). Muchos antibióticos son más efectivos contra las bacterias Gram (+), que las Gram (-). Sin embargo, los resultados de esta investigación mostraron que ambos grupos de bacterias resultaron ser inhibidas por la fracción soluble en acetato de etilo de A. lacunosa y A. fulva, lo cual es consecuente con los resultados reportados sobre el extracto acuoso de A. aerophoba, el cualfue capaz de inhibir tanto bacterias Gram (+) como Gram (-) (Stainer et al., 1984 y Sepcic et al., 1997).
La capacidad de inhibición de la esponjas A. pernucleta frente a la cepa de C. albicans, posiblemente se deba a la presencia de triterpenos y alcaloides, debido a que éstos son capaces de actuar sobre colonias de bacterias y hongos hasta producir el fallecimiento de los mismos (Ebada et al., 2010; Stout et al., 2012). La sensibilidad de C. albicans frente a la FAE de A. pernucleata, repercute en un avance para el tratamiento de enfermedades infecciosas causadas por este hongo, donde los principales inconvenientes se la escasez de antimicóticos. Esto obedece a la tendencia tóxica de los antimicóticos comerciales para los humanos, debido a la similitud que conservan los hongos con las células eucariotas superiores (Mora et al., 2008).
La FAE de la esponja C. kuekentali, no mostró actividad antifúngica en contra de ninguna de las cepas de hongos ensayadas, estando en concordancia con los resultados expuestos en un estudio de los extractos orgánicos de C. kuekentali recolectada en Santa Marta, Colombia (Mora et al., 2008). Sin embargo, el extracto acuoso de C. kuekentali colectada en la Isla de Coche, mostró actividad contra C. albicans y P. crustosum (Hernández, 2004), por lo cual se puede decir que, posiblemente los extractos acuosos de las esponjas analizadas sean más prometedores para el aislamiento de antimicóticos.
Se ha propuesto que la actividad antimicótica de algunas esponjas marinas, puede ser parte de un mecanismo químico de defensa para evitar el asentamiento de larvas y de otros organismos, con el fin de prevenir la epibiosis. Estos organismos epibióticos podrían interferir y disminuir la eficiencia en el proceso de filtración de la esponja, evitando el desarrollo desde los primeros estadios celulares (Becerro et al., 1997; Engel et al., 2002). Las letalidades de las FAE de las esponjas C. kuekentali, A. viridis y A. pernucleata en A. salina, evidencia la presencia de compuestos con actividad citolítica en estas esponjas (Cuadro 4). Posiblemente, este efecto letal se deba a los alcaloides reportados en C. kuekentali, A. viridis y en el género Aaptos, con actividad citotóxica (Tsuda & Hirano, 1999; Kelman et al., 2001; Shimogawa & Kuribayashi, 2006; Nuñez & De Almeida, 2008; Khozirah et al., 2009; Larghi et al., 2009; Dyshlovoy et al., 2014), pero también estas esponjas presentaron esteroles y triterpenos, los cuales, pueden ser responsables en parte del efecto observado; evidenciando la posible habilidad de estas especies para producir la muerte de células cancerígenas en cultivos de tejidos y otros usos farmacológicos (Marcano & Hasegawa, 2002; Pérez & Lazo, 2010).
La mortalidad de A. salina, con una concentración menor 30μg/mL tiene una correlación positiva con los ensayos sobre células 9KB, (Marcano & Hasegawa, 2002; Nunes et al., 2006). Los valores de CL50, observados para estas esponjas, indican la presencia de compuestos activos en las fracciones, con posibles propiedades antitumorales y/o pesticidas, que le confieren un carácter letal o citotóxico sobre este crustáceo.
La letalidad en A. salina de la FAE de C. kuekenthali es apreciable y coinciden con el estudio de la letalidad del extracto acuoso de C. kuekenthali colectada en la Isla de Coche, el cual mostró un CL50 de 31,74μg/mL, evidenciándose que esta esponja es capaz de producir metabolitos con potencial antitumoral (Hernández, 2004).
La presencia mayoritaria de alcaloides, esteroles insaturados y triterpenos pentacíclicos, la actividad antimicrobiana contra S. aureus L. monocytogenes E. coli y C. albicans y alta toxicidad contra A. salina que presentan las esponjas estudiadas, pueden obedecer a mecanismos de defensa que utilizan estos organismos en contra de depredadores, asegurando así la preservación de su especie. Además estos resultados permiten perfilar a las esponjas A. lacunosa A. pernucleata y A. fulva como fuentes prometedoras para obtener compuestos antimicrobianos y a las esponjas C. kuekenthali, A. viridis y A. pernucleata como fuentes de compuestos antitumorales.












 uBio
uBio