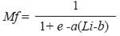Los calamares de la familia Loliginidae están represen tados por 47 especies (Jereb, Vecchione & Roper, 2010). Lolliguncula (Steenstrup, 1881) es uno de los 10 géne ros incluidos en esta familia, comprende las formas más abundantes de calamares en áreas costeras y la plata forma continental en todo el mundo. Los loliginidos son organismos sujetos a explotación pesquera de manera directa o incidental, sus capturas han alcanzado el 9% de la captura mundial de cefalópodos (FAO, 2003).
La distribución geográfica del género Lolliguncula se centra en la región de Panamá, con límites tropicales y subtropicales al norte y sur de las costas de América. El género comprende dos subgéneros y cuatro especies, todas ellas calamares de tamaño pequeño que habi tan en aguas costeras cálidas (Vecchione, Brakoniecki, Natsukari & Hanlon, 1998). Lolliguncula (Loliolopsis) dio-medeae (Hoyle, 1904), Lolliguncula (Lolliguncula) panamensis (Berry, 1911) and Lolliguncula (Lolliguncula) argus (Brakoniecki & Roper, 1985) se localizan en el océano Pacífico Oriental, mientras que Lolliguncula (Lolliguncula) brevis (Blainville, 1823) es la única especie del gé nero que se encuentra en el Océano Atlántico Oeste (Jereb et al., 2010).
El estatus taxonómico de las especies del género Lolliguncula reportado para el Océano Pacífico Oriental ha sido en gran parte resuelto. Sin embargo se conoce poco de su biología y ecología (Vecchione et al., 2005), con excepción de L. panamensis que ha sido estudiada en el Pacífico colombiano (Barragán, 1977a; 1977b; Squires & Barragán, 1979), y el Golfo de California (Arizmendi-Rodríguez, Cruz-Escalona, Quiñones-Velázquez, Salinas-Zavala, 2011; Arizmendi-Rodríguez, Rodríguez-Jaramillo, Quiñones-Velázquez, Salinas-Zavala, 2012; Arizmendi-Rodríguez, Salinas-Zavala, Quiñones-Velázquez, Mejia-Rebollo, 2012).
Los loligínidos forman parte de la captura incidental en la pesquería de arrastre del camarón que opera en aguas costeras tropicales de México (Hernández-Vázquez, 1987; Alejo-Plata, Cerdenares, Herrera, 2001). En la pesca del camarón en el Golfo de Tehuantepec se captura de manera incidental varias especies de crustáceos, peces y moluscos, dentro de estas el calamar dardo es recurrente y abundante, con un porcentaje en peso de 2 a 4%(Alejo-Plata et al., 2001).
Lolliguncula diomedeae ha sido capturada entre los 12 y 135m de profundidad, se distribuye desde Baja California y Golfo de California, México al sur de Perú, es una especie endémica del Pacífico Tropical Oriental (Jereb et al., 2010; Cardoso & Hochberg, 2013). La infor mación biológica y ecológica para este calamar es prác ticamente inexistente y no se conoce el impacto de la presión selectiva por la pesquería del camarón; además, es necesario establecer líneas de investigación que abor den de manera detallada los aspectos biológicos básicos de las especies consideradas recursos potenciales. Así, el objetivo de este estudio fue examinar la estructura de ta llas, proporción de sexos y madurez de L. diomedeae du rante las temporadas de pesca del camarón 1999-2001, 2004 y 2006 en el Golfo de Tehuantepec, México.
Material y métodos
Área de estudio: El Golfo de Tehuantepec (14° 30'-16°10'N y 92°25'-98°08'W) es un área tropical del sureste de México con un alto potencial de recursos pesqueros. Transita a lo largo del año por dos temporadas climáti cas, una la temporada de lluvias y tormentas tropicales, que comprende de mayo a octubre, que coincide con los meses "cálidos" y la época de estiaje, que abarca de octubre a mayo y coincide con los meses "frescos'; y se ubica la temporada de "nortes", los cuales a medida que estos descienden y se intensifican producen eventos de viento muy intensos y de baja altitud sobre el Istmo de Tehuantepec, que se dirigen en pulsos intermitentes de gran intensidad hacia el océano Pacífico, provocando lo que localmente se conoce como Tehuanos, que in ducen surgencias costeras en el Golfo de Tehuantepec (González-Silveira, Santamaría del Ángel, Millán-Núñez & Manzo-Monroy, 2004).
Trabajo e información de campo: La captura de ca marón en altamar se realiza en la zona 90 de pesca, se si túa entre Punta Chipehua (16°10' N y 98°08'W) en Salina Cruz, Oaxaca y Puerto Chiapas (14° 30'N y 92°25'W) en Chiapas (Reyna-Cabrera & Ramos-Cruz, 1998). Se rea lizaron cinco viajes de pesca abordo del B/M UMAR (octubre-noviembre 1999; febrero-marzo 2000; octubre-noviembre 2000; enero-febrero 2001; noviembre 2006). El B/M UMAR fue equipado con red de arrastre cama ronera (27.4m en relinga superior con luz de maya de 57,1mm en el cuerpo y 33,9mm en el copo; tablas de madera de 25,4 X 152,4cm). Se efectuaron 350 lances a profundidades entre 16 y 56m, los arrastres tuvieron una duración de 1hr a una velocidad aproximada de 2 nudos.
La captura de cada arrastre se colocó sobre la cubierta del barco y se recolectó al azar una muestra de 40-50kg. Los organismos de la muestra se separaron en grupos taxonómicos (peces, crustáceos, equinodermos, molus cos), mismos que se colocaron por separado en bol sas de plástico y se mantuvieron en congelación hasta su procesamiento.
En el laboratorio los ejemplares de L. diomedeae fueron identificados hasta el nivel de especie emple ando los caracteres diagnósticos de Roper, Sweeney y Hochberg (1995).
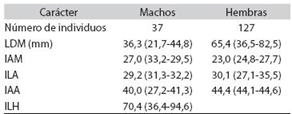
Las mediciones (en mm) e índices usadas en este trabajo fueron definidas por Roper y Voss (1983): lon gitud dorsal del manto (LDM); índice ancho del manto (IAM); índice de la longitud de la aleta (ILA); índice ancho de la aleta (IAA) y el índices de la longitud del brazo hectocotilizado (ILH).
A cada organismo se registró el peso total (PT, ±0,1g). En hembras la madurez fue determinada por la presen cia de ovocitos maduros en el ovario y a lo largo de la glándula nidamental; en machos por la presencia de espermatóforos. Los cambios ontogénicos en la morfo logía del cuerpo y el desarrollo del hectocotilo fueron documentados. Para clasificar los estadios de madurez se utilizó un sistema simplificado de la escala de madu rez para calamares: inmaduros, madurando, maduros y desovados (Lipinski & Underhill, 1995).
Estructura de tallas y relación LDM-Peso: La estruc tura por tallas y pesos se analizó por sexo, agrupando la LDM en intervalos de 5mm y el PT en intervalos de 1g. Se evaluó la normalidad de las distribuciones de ambas variables con una prueba Shapiro-Wilk, y las diferencias en talla y peso se evaluaron con la prueba Kolmogorov-Smirnov (Zar, 1999).
El modelo PT=aLDMb fue usado para analizar datos de longitud y peso (a = pendiente, b = intercepto), se consi deró a hembras y machos por separado. La prueba T de Student fue usada para aceptar (o rechazar) la hipótesis de crecimiento isométrico (Pauly, 1984)
Proporción de sexos y madurez La proporción de sexos estuvo basada en la razón hembras/machos (H:M) de la muestra analizada. Se utilizó el análisis de Chi cuadrada (x2 0051=3,841) para determinar si la proporción de sexos por intervalo de longitud y por mes se desviaba de la relación 1:1 (Zar, 1999).
El índice gonadosomático (IGS) se estimó de acuerdo a Sauer, Melo y de Wet (1999):
IGS = 100 x P G /PT
IGS, índice gonadosomático; PG, peso de la gónada (hembras, peso ovario; machos, peso complejo espermatofórico).
Con los organismos en estado de madurez III, IV y V se estimó la talla promedio de primera madurez. La lon gitud a la cual el 50% de todos los especímenes fueron sexualmente maduros (L50) fue estimada para machos y hembras por separado usando la función logística (Haddon, 2001):
Donde Mf es la fracción de calamares maduros; L es LDM; a es la pendiente de la curva que describe la tasa de cambio en Mf y b=L50.
Se han depositado especímenes de referencia en la colección de cefalópodos de la Universidad del Mar (CEPHA 0112).
Resultados
Estructura de tallas y relación LDM-Peso: Se obtuvi eron 28 lances positivos de calamar dardo (8% del total de lances). Se registraron 1 065 hembras (89%) en un in tervalo de tallas de 35 a 97mm LDM (Media=74,66mm, DE=6,99mm), pesos de 2 a 30,9g (Media=16,53g, DE=3,55g); 135 machos (11%) en el intervalo de 20,7 a 65mm LDM (Media=38,99mm, DE=8,54mm), pesos de 0,4 a 12g (Media=4,45g, DE=2,71g).
En hembras se observó una moda en 80mm y en ma chos en 35-40mm LDM. Las hembras fueron más abun dantes a tallas >60mm y los machos a tallas menores a 60mm (Figura 1). En lo que corresponde al peso, las hem bras presentaron una distribución normal en su estruc tura, a diferencia de los machos cuyos valores tendieron a agruparse en los pesos <15g (Figura 1). Las diferencias en la LDM y el PT entre machos y hembras fueron sig nificativas (K-S, p<0,05). Las tallas observadas, indican que L. diomedeae es capturado por las redes de arrastre de camarón en longitudes a partir 20,7mm en machos y 35mm LDM en hembras.
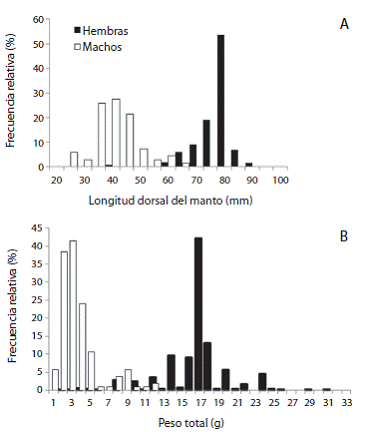
Figura 1: Distribución de frecuncias de (A) la longitud dorsal del manto y (B) el peso total de L. diomedeae en el Golfo de Tehuantepec.
La relación LDM-Peso es de tipo potencial para hembras y machos y en ambos casos se determinó un crecimien to alométrico negativo: machos, PT=0.0014LDM2,0268, r2=0,8121; hembras, PT=0,001LDM2,2595, r2=0,81.
Proporción de sexos y madurez: Durante las tem poradas de pesca evaluadas se observó predominancia de las hembras, la proporción de sexos fue de 8:1 H:M (p<0,05). Con respecto a la talla se observó diferencias en la proporción de sexos, a LDM<60mm la proporción de sexos fue 3:1 M:H (x2=47,15; p<0,05) y a tallas mayores a los 60 mm las hembras fueron significativamente más numerosas (x2=1018,02; p<0,05).
Del total de hembras capturadas 83% se encontraron maduras y <5% inmaduras; respecto a los machos <20% se encontraron maduros y 60% en desarrollo (Figura 2). El IGS se estimó de 8,5 a 82,3 en hembras (Figura 3) y de 0,01 a 0,1 en machos. Estás diferencias en los valores se deben al sistema reproductor más grande y pesado en las hembras.
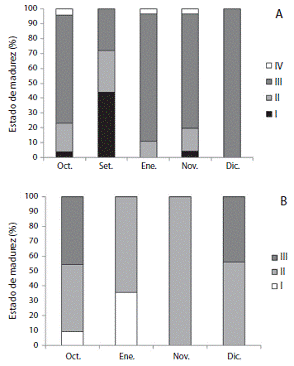
Figura 2: Variación del desarrollo gonadal en hembras (A) y ma chos (B) de L. diomedeae en el Golfo de Tehuantepec.
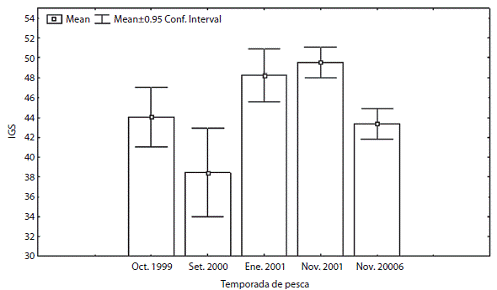
Figura 3: Índice gonadosomático (IGS) para hembras de L. diomedeae por temporada de pesca de camarón en el Golfo de Tehuantepec.0.5
La talla estimada a la madurez sexual (L) en hembras fue de 74,5mm, y 42,7mm LDM en machos (Figura 4).
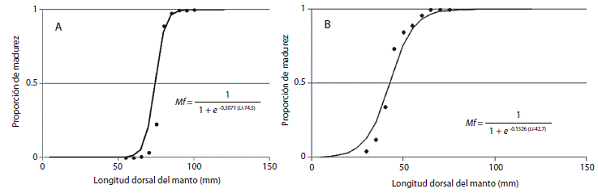
Figura 4: Talla a la primera madurez (L50) en hembras (A) y machos (B) de L. diomedeae en el Golfo de Tehuantepec durante 1999 a 2006.
Lolliguncula diomedeae presentó un marcado dimor fismo sexual en todas las tallas observadas, las hembras tienen el cuerpo más grande, los brazos relativamente más cortos y aletas 30% más grandes que los machos (Cuadro 1).
Patrón de crecimiento en machos. En organismos jóvenes el manto es más delgado y menos robusto que en adultos; el tentáculo y maza tentacular bien desarrol lados; las aletas son débiles. En organismos mayores a 50mm de LDM las aletas se tornan más fuertes y robus tas (Figura 5). A partir de 25mm de LDM ambos brazos del par IV inician la hectocotilización, el brazo izquierdo se va alargando conforme el organismo se va desarrollando; el número de ventosas en la parte basal se incrementa y los pedúnculos de las ventosas se transforman en papilas, al final de la hectoctilización el brazo asemeja una fusta (Figura 6). Los organismos jóvenes siguen los mismos pa trones de pigmentación que los adultos.
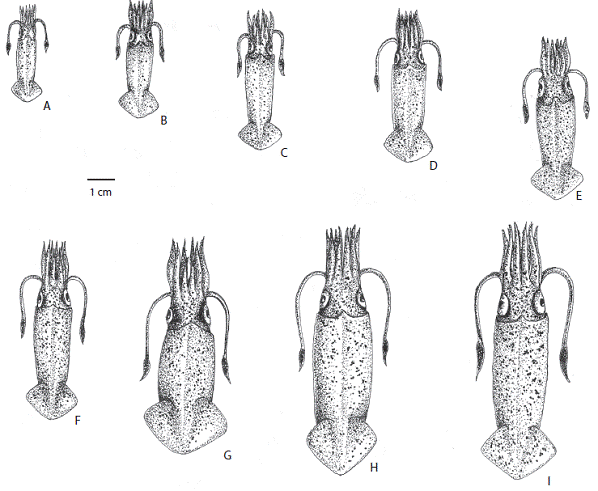
Figura 5: Fases de desarrollo de machos de L. diomedeae, los organismos se encuentran representados en su tamaño original.
Discusión
Lolliguncula diomedeae presentó un crecimiento mayor en longitud que en peso para ambos sexos. La es tructura por tallas y pesos mostró que las hembras son más pesadas a tallas grandes, estas diferencias en el cre cimiento se pueden explicar por el rápido desarrollo del ovario durante la madurez sexual, como ha sido obser vado en otras especies de calamares (Boyle & Rodhouse, 2005). Las tallas registradas en este estudio (20,7 a 65mm, machos; 35 a 97mm LDM, hembras) son similares a los datos reportados por Sánchez (2003) para la costa del Pacífico mexicano, pero son menores a las tallas ob servadas por Cardoso & Hochberg (2013) en organismos recolectados en la captura incidental de la pesquería de langostino en aguas de Perú (51,1-75,6mm, machos; 57,0-114,2mm LDM, hembras). Al respecto Farías et al. (2009) mencionan que las especies de cefalópodos en aguas frías son metabólicamente más eficientes que las especies tropicales. Esto posiblemente pueda explicar las tallas más grandes en Perú donde las aguas son frías con temperatura superficial del mar (TSM) de 16°C, y sólo en la porción norte en la frontera con Ecuador se alcanzan temperaturas de 23 a 28°C. En contraparte con el Golfo de Tehuantepec una zona tropical, donde la TSM men sual promedio se encuentra por arriba de los 26°C todo el año (Magaña, Pérez, Vázquez, Carrisoza & Pérez, 1999).
La proporción de sexos 3:1 H:M es una particularidad de la familia Loliginidae (Vecchioneet al., 1998). Para L. diomedeae en aguas de Perú Cardoso, Rivadeneira & Esquerre (1989) reportan una mayor proporción de hem bras grandes respecto a machos pequeños. Este esquema se observó en los ejemplares del Golfo de Tehuantepec, las diferencias en la proporción de sexos por talla puede ser consecuencia del dimorfismo sexual, los machos al canzan tallas menores que las hembras; esto también se ha observado en L. plei (Pérez, de Aguiar & Oliveira, 2002).
La condición reproductiva mostró que más del 80% de las hembras se encontraron maduras, en este sentido varios autores han reportado que las hembras de loligínidos presentan agregaciones durante el desove (para L. forbesi Collins et al., 1999; para Alloteuthissubulata Hastie et al., 2009); o bien que la mayor abundancia de hembras a tallas mayores podría ser consecuencia de una distri bución diferencial por sexos después de la copula y de un desgaste fisiológico que les ocasionaría directamente la muerte (para L. panamensis, Arizmendi-Rodríguez et al., 2012).
Se observó un desfasamiento en la madurez sexual de hembras y machos, algunos autores sugieren que el desarrollo gonadal en los calamares de ambos sexos no tiene que estar sincronizado para la cópula o desove, los machos pueden depositar paquetes de espermatóforos en las hembras inmaduras (Hanlon & Messenger, 1996). Los machos pueden alcanzar la madurez sexual a tallas menores que las hembras (Mangold, 1987; González, Raserro & Guerra, 1994; Guerra & Rocha, 1994) y permane cen durante más tiempo en estado maduro copulando con más de una hembra (Boyle & Rodhouse, 2005). Esta particularidad también se ha observado en los loligínidos (Barragán, 1977b; Pineda, Brunetti, Scarlato, 1998; Perez et al., 2002; Jackson, 2004; Arizmendi-Rodríguez et al., 2012). La diferencia a la talla de madurez entre sexos ha sido atribuida al dimorfismo sexual (Pérez et al., 2002), así la mayor talla a la madurez en hembras se puede in terpretar como una táctica de la especie para maximizar su potencial reproductivo, debido a que en calamares las hembras definen el éxito reproductivo al almacenar los espermatóforos desde el estadio inmaduro (Hanlon & Messenger, 1996; Pineda et al., 1998; Rocha, Guerra & González, 2001; Boyle & Rodhouse, 2005).
El IGS es considerado un indicador de la actividad reproductiva (Sauer et al., 1999), los valores del IGS su gieren que L. diomedeae se reproduce en el Golfo de Tehuantepec de noviembre a enero, cuando ocurren los "Tehuanos", este pulso de reproducción coincide con la temporada de pesca del camarón. No obstante las tallas pequeñas y grandes registradas pueden indicar que es posible que se reproduzca a través del año con dos pi cos de desove bien definidos, uno en la temporada de surgencias, evidenciado en este trabajo, y un segundo pulso en la temporada de lluvias. En otras regiones se han observado dos picos en la actividad reproductiva de los loligínidos, por ejemplo Sauer, Smale y Lipinski (1992) mencionan un pulso en primavera y otro en verano para L. vulgaris; Cota y Fernándes (1993) encontraron que en L. sanpaulensis la reproducción se presenta en invierno-primavera y verano-otoño.
Los patrones de maduración gonadal en calamares tropicales llegan a ser más complejos que los patrones de maduración estacional (Arizmendi-Rodríguez et al., 2012); así, la distribución diferencial de la abundancia por sexos, que las hembras presentaron mayor peso por talla que los machos y la talla de primera madurez, po drían considerarse como parte de la estrategia reproduc tiva de L. diomedeae en el Golfo de Tehuantepec.
La presencia del calamar dardo en los meses de surgencia posiblemente esté asociada a la disponibilidad de alimento, y muestra que esta especie forma agrega ciones. La tendencia a formar agregaciones ha sido ob servada para otros loligínidos en diferentes latitudes (L. gahi, Archipkim, Grzebielec, Sirota, Remeslo, Polishchuk & Middleton, 2004; Agnew, Baranowski, Beddington, Desclers & Nolan, 1998; L.plei, Rodríguez & Gasalla, 2008; L. panamensis, Arizmendi-Rodríguez, Salinas-Zavala et al., 2012). De acuerdo a los resultados del IGS y de las características oceanográficas del Golfo de Tehuantepec, se puede inferir que en ésta región ocurre el desove de L. diomedeae y muy probablemente de otros loligínidos como L. panamensis que comparte la misma área de dis tribución (Alejo-Plata et al., 2001).
Debido al carácter oportunista de este estudio, los datos fueron obtenidos únicamente en la temporada de pesca del camarón, por lo que sólo se está estudiando la fracción de la población en esos meses y que es seleccio nada por las redes de arrastre, por lo que se hace nece sario realizar observaciones en la temporada de veda del camarón. L. diomedeae es un recurso con potencial pes quero que puede ser complementario a la pesca del ca marón y escama en la región del Istmo de Tehuantepec. Este trabajo constituye el primer reporte sobre la distri bución de la abundancia del calamar dardo en el Golfo de Tehuantepec.












 uBio
uBio