Introducción
La biodiversidad del orden Thysanoptera (trips) en Costa Rica se ha estudiado ininterrumpidamente desde finales del siglo pasado (Retana Salazar, 1992; Retana-Salazar et al., 2017; Soto-Rodríguez & Retana-Salazar, 2013). Si se compara con los primeros datos publicados por Mound y Marullo (1996) y el escaso esfuerzo de muestreo debido a la baja cantidad de investigadores del tema en Latinoamérica, el resultado más promisorio ha sido una alta biodiversidad reconocida de este grupo de insectos en Costa Rica.
En los primeros diez años del presente siglo, Costa Rica contaba con aproximadamente trecientas especies de trips (Soto-Rodríguez, 2011). Para el año 2017 el género más abundante del orden en el país fue Frankliniella (Thripidae), con más de doscientas especies conocidas (Retana-Salazar et al., 2017), aunque autores han señalado con cautela el número exacto de especies, debido a que la mayoría fueron descritas con poco material recolectado o sin tomar en cuenta su variabilidad morfológica (Mound, 2015).
Una discrepancia que se ha presentado entre especialistas fue que la alta biodiversidad se debió a la colonización de especies desde el sur y norte del continente hacia el istmo centroamericano. Si bien, ambas secciones continentales comparten especies con Centroamérica, con el avance de las técnicas de caracterización morfológica y molecular, se presentaron aún más propuestas sobre el endemismo de estos insectos en dicha región (Brunner et al., 2002; Fedor et al., 2008), mientras que en las zonas de cultivos y sus plantas asociadas se ha reportado una inusual riqueza de especies del género Frankliniella (Berzosa, 2006; Soto & Retana, 2003).
A nivel mundial, es conocida una amplia biodiversidad de especies de trips como plagas de cultivos (Cluever & Smith, 2017). En árboles de Persea americana Mill. (aguacate) de Costa Rica solo se presentaron reportes de especies directamente asociadas a estos, sin el registro de daños debido a fitofagia (González-Herrera, 2003). En total, fueron veintinueve especies de trips oficialmente reportadas como asociadas con el cultivo, sin determinar cuáles se trataban exactamente de visitadores esporádicos en el árbol. De ellas, trece especies pertenecían al género Frankliniella, pero con una distribución y frecuencia variable, así como fueron reportadas en otros países (Ascención-Betanzos et al., 1999; Urías et al., 2007).
Las especies que pertenecen al género Frankliniella, han sido asociadas a flores de diversas plantas, con más de 120 hospederos conocidos para Costa Rica (Mound & Marullo, 1996). En el pasado, recolecciones exhaustivas en este país ayudaron a comparar un gran número de ejemplares con el fin de observar con mayor detalle el ámbito de variación dentro del género. Sin embargo, la falta de estudios de colonización del entorno generó poco conocimiento sobre los factores que pudieron incidir en la preferencia al hospedero de aguacate, o bien, si la presencia del género en las flores del árbol está relacionado como consecuencia del control fitosanitaro sobre el follaje y el fruto (Hoddle et al., 2003; Stevens et al., 1999).
El objetivo del presente trabajo fue registrar las especies de Frankliniella asociadas a los árboles de aguacate y sus arvenses, en la región de Costa Rica y presentar una clave para la identificación de dichos trips.
Materiales y métodos
Localización de zonas de estudio
El material biológico se recolectó en forma sistemática cada dos meses desde el mes de febrero de 2019 y hasta diciembre de 2021. Se visitaron zonas de producción de aguacate (Persea americana) variedad Hass en Birrí de Santa Bárbara de Heredia (N10º03.514, W084º09.364, altitud 1337 m s. n. m.), Carrizal de Alajuela (N10º06.049, W084º09.77, altitud 1641 m s. n. m.) y la región central de San José denominada como Zona de los Santos (San Marcos y Santa María de Dota, N9˚42'44'', W84˚03'24'', altitud 1800 m s. n. m.).
Muestreo
En cada sitio fueron seleccionados veinte árboles y en cada árbol se seleccionaron cinco ramas, en ambos casos de forma aleatoria. Las ramas se encontraron a una altura máxima de 2 m del suelo con el fin de que fueran accesibles para el muestreo directo. Las plantas arvenses muestreadas fueron aquellas que se encontraron a 1 m de distancia desde los cuatro puntos cardinales del árbol de P. americana. Para recolectar los trips de estas plantas se procedió a sacudir las ramas con flores contra una bandeja plástica de color blanco; los insectos recolectados con un pincel fueron almacenados en alcohol etílico al 70 % en viales plásticos y trasladados al laboratorio para su procesamiento en el laboratorio del Centro de Investigación en Estructuras Microscópicas (CIEMic) de la Universidad de Costa Rica (UCR).
Identificación de trips
Las muestras fueron clasificadas en morfo-especies con un microscopio estereoscópico. Los especímenes de trips fueron procesados para montaje permanente en bálsamo de Canadá (Mound & Marullo, 1996). Las identificaciones de trips se efectuaron empleando un microscopio con magnificaciones de 5X a 63X, con regla ocular micrométrica incorporada. Los especímenes montados en laminillas de vidrio fueron donados a la Colección de Thysanoptera del CIEMic-UCR. Para la identificación se utilizaron las claves respectivas para América y Centroamérica (Mound & Marullo, 1996; Retana-Salazar & Mound, 1994; Soto & Retana, 2003). Para la creación de la clave se establecieron las siguientes abreviaturas: sedas interocelares III= io III; sedas posoculares= po; sedas anteroangulares= aa; sedas anteromarginales= am; sedas posteroangulares= pa; sedas posteromarginales= pm (Retana-Salazar, Ruiz de la Cruz et al., 2014).
Resultados
El registro referencial mostró que hasta el año 2018 hubo un total de veintinueve especies de trips asociadas al cultivo de aguacate en Costa Rica (Cuadros 1 y 2). En este trabaajo, se identificaron en total 795 especímenes de trips y el listado general de especies mostró la presencia total de veintidós especies de Frankliniella (Cuadro 3). Ninguna de estas ha sido reportada en la Lista de Plagas Reglamentadas del Servicio Fitosanitario del Estado del Ministerio de Agricultura y Ganadería del Gobierno de Costa Rica.
Cuadro 1 Reportes oficiales de las especies de tisanópteros causando daños en aguacate desde 1996 al 2010 en Costa Rica. CIEMic-Universidad de Costa Rica, San José, Costa Rica, 2022.
| Año | Especie reportada | Referencia |
| 1996 | Pseudophilothrips avocadis (=Liothrips avocadis) | Mound & Marullo (1996) |
| 1999 | Pseudophilothrips avocadis (=Liothrips avocadis) | Gómez (1999) |
| 2003 | Pseudophilothrips avocadis (=Liothrips avocadis) Heliothrips haemorrhoidalis a Selenothrips rubrocinctus a | González-Herrera (2003) |
| 2005 | Selenothrips rubrocinctus a | Soto-Rodríguez & Retana-Salazar (2005) |
| 2010 | Pseudophilothrips avocadis (=Liothrips avocadis) Pseudophilothrips perseae (=Liothrips perseae) | Garbanzo-Solís (2011) |
a Reportado causando daños en otros cultivos en Costa Rica. / a Recorded causing damages in other plant cultivars in Costa Rica.
Cuadro 2 Reportes oficiales de las especies de tisanópteros asociados directamente al árbol de aguacate desde 2011 al 2018 en Costa Rica. CIEMic-Universidad de Costa Rica, San José, Costa Rica, 2022.
| Año | Especie reportada | Referencia |
| 2011 | Franklinothrips vespiformis b | Retana-Salazar & González-Herrera (2011) |
| Franklinothrips caballeroi b | ||
| Pseudophilothrips perseae a | ||
| (=Liothrips perseae) | ||
| Heliothrips haemorrhoidalis a | ||
| Hoodothrips constrictus | ||
| Frankliniella insularis a | ||
| Frankliniella occidentalis a | ||
| Frankliniella cubensis | ||
| Frankliniella bagnalliana | ||
| Frankliniella alonso sp.nov. | ||
| Frankliniella doris sp.nov. | ||
| Frankliniella nita sp.nov. | ||
| 2011 | Frankliniella spp. | Vargas Martínez et al. (2011) |
| Scirtothrips spp. | ||
| Neohydatothrips spp. | ||
| Leptothrips sp. | ||
| 2016 | Scirtothrips hansoni sp.nov.a | Mound & Hoddle (2016) |
| 2018 | Frankliniella annulipes | Solís Calderón (2016)c |
| Frankliniella occidentalis a | ||
| Frankliniella insularis a | ||
| Frankliniella bagnalliana | ||
| Frankliniella nigricauda | ||
| Frankliniella insularis | ||
| Frankliniella minuta | ||
| Frankliniella microchaeta | ||
| Frankliniella montanosa | ||
| Haplothrips gowdeyi | ||
| Franklinothrips vespiformis b | ||
| Heterothrips sp. | ||
| Bravothrips mexicanus | ||
| Elaphrothrips sp. | ||
| Aeolothrips sp.b | ||
| Leptothrips sp.b | ||
| Aurantothrips sp.a | ||
| Psectrothrips longiceps |
a Reportado causando daños en aguacate u otros cultivos en Costa Rica. / a Recorded causing damages in avocado crops and other plant cultivars in Costa Rica.
b Reportado como depredador y potencial agente de biocontrol. / bRecorded as predator and possibly biocontrol agent.
c La autora reporta Frankliniella fortissima y Frankliniella inutilis, sin embargo en este trabajo se mantuvo las propuestas de sinonimia de Jacot-Guillarmod (1974): Frankliniella insularis (=Frankliniella fortissima Priesner 1925) y de Mound & Marullo (1996) como Frankliniella bagnalliana (=Frankliniella inutilis Priesner 1932). / c Author recorded Frankliniella fortissima and Frankliniella inutilis, however in this work is used the synonym proposed by Jacot-Guillarmod (1974): Frankliniella insularis (=Frankliniella fortissima Priesner 1925) and Mound & Marullo (1996) as Frankliniella bagnalliana (=Frankliniella inutilis Priesner 1932).
Cuadro 3 Especies de Frankliniella recolectadas de flores y hojas el cultivo de aguacate (Persea americana Mill.) y en plantas arvenses en la región central de Costa Rica, entre 2019 y 2021. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2021.
| Especie | Hospedero |
| Frankliniella albacuriosa (Johansen, 1998) | Arvenses en el cultivo |
| Frankliniella alonso (Retana-Salazar & González-Herrera, 2011) | Aguacate, en la flor |
| Frankliniella annulipes (Hood, 1915) | Arvenses en el cultivo |
| Frankliniella bagnalliana (Hood, 1925) | Arvenses en el cultivo |
| Frankliniella borinquen (Hood, 1942) | Arvenses en el cultivo |
| Frankliniella bruneri (Watson, 1926) | Arvenses en el cultivo |
| Frankliniella cephalica (Crawford, 1910) | Aguacate en la flor, en arvenses en el cultivo |
| Frankliniella difficilis (Hood, 1925) | Arvenses en el cultivo |
| Frankliniella doris (Retana-Salazar & González-Herrera, 2011) | Aguacate, en la flor |
| Frankliniella fallaciosa (Priesner, 1933) | Arvenses en el cultivo |
| Frankliniella gardeniae (Moulton, 1948) | Arvenses en el cultivo |
| Frankliniella grandecuriosa (Johansen, 1998) | Arvenses en el cultivo |
| Frankliniella insularis (Franklin, 1908) | Arvenses en el cultivo |
| Frankliniella invasor (Sakimura, 1972) | Arvenses en el cultivo |
| Frankliniella microchaeta (Retana-Salazar et al., 2010) | Arvenses en el cultivo |
| Frankliniella nigricauda (Hood, 1925) | Arvenses en el cultivo |
| Frankliniella nita (Retana-Salazar & González-Herrera, 2011) | Aguacate, en la flor |
| Frankliniella occidentalis (Pergande, 1895) | Arvenses en el cultivo |
| Frankliniella panamensis (Hood, 1925) | Arvenses en el cultivo |
| Frankliniella parvula (Hood, 1925) | Arvenses en el cultivo |
| Frankliniella rostrata (Priesner, 1932) | Arvenses en el cultivo |
| Frankliniella sandovalensis (Retana, 1998) | Aguacate, en el follaje |
Ninguna de las especies recolectadas en el presente estudio reportó datos técnicos que demuestre una incidencia como plagas del aguacate dentro o fuera de Costa Rica. Sin embargo, F. occidentalis y F. insularis, han sido conocidas a nivel mundial por su fitofagia en múltiples cultivos. De las veintidós especies de Frankliniella que estuvieron asociadas al cultivo del aguacate en Costa Rica, solo cinco fueron encontradas usando el árbol como hospedero. Cuatro especies estuvieron asociadas a la flor y solamente F. sandovalensis se registró en el follaje. La mayor parte de las especies (dieciocho en total) fueron recolectadas en las plantas arvenses asociadas al cultivo. La especie F. cephalica se registró simultáneamente en las flores del árbol de aguacate y en la floración de arvenses cercanas al cultivo.
Las especies F. alonso, F. doris y F. nita recolectadas en árboles de aguacate en floración en Costa Rica están estrechamente asociadas a P. americana, ya que no se les ha observado en ningún otro hospedero. En Costa Rica y en las hojas jóvenes de dicho hospedero se ha observado a los adultos de F. sandovalensis ocasionar daños superficiales que podría a la vez, deformar los brotes nuevos en el árbol. La presencia de esta especie, tanto en Costa Rica como en México, indicó que probablemente se encontraba distribuida en el resto de Centroamérica.
De todas las especies registradas, la diferenciación de F. cephalica y F. sandovalensis fue compleja, sobre todo si los especímenes son tratados con hidróxido de sodio. Este compuesto provocó que el exoesqueleto de F. sandovalensis fuera traslúcido, el cual fue uno de los principales caracteres que se empleó para la determinación, lo que provocó que se confundiera con F. cephalica. El tratamiento de maceración de las muestras, según sugerencia de algunos autores, pudo provocar que F. sandovalensis fuera subestimada en estudios pasados.
Otra de las especies que se reportó en el árbol de P. americana y que requiere futura atención en su correcta clasificación es F. insularis, especie polífaga y de distribución mundial. Esta especie ha causado problemas en plantas de importancia comercial en América Central y América del Sur, sin embargo, no ha sido conocida como especie cuarentenaria en los sistemas fitosanitarios de los diferentes países latinoamericanos. Las especies restantes de trips no han constituido problemas fitosanitarios en Costa Rica y su aparición en el árbol de aguacate era poco común, con bajos conteos, pero de manera constante a lo largo del estudio.
Clave de las especies de Frankliniella asociadas al cultivo del aguacate Persea americana var. Hass en Costa Rica sobre los 1000 m s. n. m.
1a) Segmento antenal III modificado en el borde externo expandido como un pequeño cono y dirigido hacia atrás cubriendo el pedicelo (Figura 1A); especies de color claro ……………………………………………………2
1b) Segmento antenal III con el borde externo sin proyección posterior, color y tamaño variables ……………3
2a) Sedas ocelares I más largas que el diámetro anteroposterior del ocelo I; con hilera de sedas (5-7) en la parte media del pronoto (Figura 2A) ....................................................................................................grandecuriosa.
2b) Sedas ocelares I nunca más largas que el diámetro anteroposterior del ocelo I; pronoto sin hilera de sedas en la parte media (Figura 2B) ...................................................................................................................albacuriosa.
3a) Sedas interocelares reducidas, longitud menos de dos veces el diámetro posteroanterior de los ocelos posteriores (Figura 3A), en algunas especies tan reducida que no sobrepasan los 5 µm …………………………….……………4
3b) Sedas interocelares desarrolladas, longitud dos o más veces el diámetro posteroanterior de los ocelos posteriores ...................................................................................................................................................................5
4a) Sedas interocelares muy reducidas a tan solo 5 µm de longitud; sensilias placoideas del metanoto ausentes; sedas anteroangulares reducidas, color café oscuro .................................................................................microchaeta.
4b) Sedas interocelares ubicados en el margen anterior interno de los ocelos posteriores, estas son mayores a 5 µm de longitud; sensilias del metanoto presentes (Figura 3B); sedas anteroangulares relativamente desarrolladas; tibias I de color amarillo claro y fémur I sombreado con café; cuerpo de macho de color amarillo ……..bagnalliana.
5a) Pedicelo del segmento antenal III alongado, longitud dos veces el ancho del disco sub basal (Figura 1B), de color café claro a oscuro ............................................................................................................................parvula.
5b) Pedicelo del segmento antenal III nunca sobrepasa más allá de 1,5 veces al ancho del disco sub basal, si este existe; pedicelo puede ser simple ........................................................................................................................6
6a) Collar del segmento antenal III modificado en forma de campana invertida (Figura 1C) o el segmento antenal II fuertemente asimétrico con proyecciones ventrales en el borde posterior con un par sedas fuertes bien desarrolladas (Figura 1D); en algunas especies pueden hallarse ambas condiciones; el pedicelo puede ser simple o con disco sub basal en diferentes estados de desarrollo ……………………..………………………………….…....…7
6b) Collar del segmento antenal III simple, ausente o tan solo como una banda estrecha en la base del segmento antenal; sin disco sub basal .......................................................................................................................................16
7a) Sin sensilias placoideas en el metanoto; especies pequeñas .........................................................................8
7b) Con sensilias placoideas en el metanoto; especies de tamaño variable ......................................................11
8a) Exoesqueleto sin macerar totalmente traslúcido, los miotomos musculares de las patas y tórax de color amarillo o naranja; peine en el margen posterior del tergo VIII del abdomen representado solo por pocos dientes en los extremos laterales ............................................................................................................................sandovalensis.
8b) Exoesqueleto con alguna coloración, generalmente amarillo o café claro ..................................................9
9a) Pedicelo del segmento antenal III en forma de trofeo, con un anillo sub basal evidente en la parte media del pedicelo del segmento antenal III (Figura 4A) ..............................................................................................doris.
9b) Pedicelo del segmento antenal III ensanchado, pero no en forma de un trofeo .........................................10
10a) Pedicelo del segmento antenal III corto con anillo sub basal evidente y muy agudo (Figura 4B); collar de lados paralelos; segmento antenal II con dos sedas ventroapicales de color oscuro ……………………...…nita.
10b) Pedicelo del segmento antenal III corto y en forma de hongo, no hay un anillo sub basal evidente; collar ensanchado en la parte distal (Figura 4C) ........................................................................................................alonso.
11a) Segmento antenal II alargado entre 2,0-2,5 veces que su ancho (Figura 5A), de color amarillo o con sombras de color gris o café claro, con anillo sub basal evidente ...........................................................................12
11b) Segmento antenal II nunca alargado .........................................................................................................13
12a) Cuerpo de color amarillo sin marcas oscuras en los segmentos abdominales; segmento antenales I y II subiguales en color, V café claro en la mitad distal (Figura 6B). Macho amarillo claro con sedas B1 y B2 del tergo IX subiguales en tamaño (Figura 9A) ……………………………………………………………………...gardeniae.
12b) Cuerpo de color amarillo con marcas de color café-grisáceo, segmento antenales II de color amarillo con gris en la mitad distal, segmento antenal V de color amarillo claro (Figura 6A). Cuerpo del macho de color amarillo claro con sedas B1 del tergo IX reducidas y sedas B2 muy desarrolladas ........................................................invasor.
13a) Segmento antenal II asimétrico, más largo en la sección ventral que en la dorsal, collar muy dilatado y en forma de campana invertida; con el pedicelo con disco sub basal evidente (Figura 5B) …………………cephalica.
13b) Segmento antenal II no presenta asimetría ...............................................................................................14
14a) Pedicelo simple o ligeramente ensanchado hacia la sección distal; con o sin anillo sub basal evidente... 15
14b) Pedicelo con anillo sub basal evidente, sección convexa bien definida sobre el pedicelo; collar poco evidente o ausente; peine posteromarginal del tergo abdominal VIII completo y de dientes largos ………borinquen.
15a) Márgenes del pedicelo paralelos, con un contorno ensanchado antes del collar y con anillo sub basal ligeramente evidente (Figura 5C); sedas io III están alineadas entre ocelos posteriores y anterior pero dentro del triángulo ocelar (Figura 8A) ...........................................................................................................................difficilis.
15b) Pedicelo simple y sin anillo sub basal, sin ensanchamiento antes del collar; cuerpo de color amarillo….bruneri.
16a) Cuerpo de color amarillo claro o café claro, habitualmente con patrones de color café oscuro en los tergos abdominales ..............................................................................................................................................................17
16b) Cuerpo de color café claro o café oscuro, habitualmente sin patrones de coloración en los tergos abdominales ..............................................................................................................................................................18
17a) Segmento antenal VI con dos tercios distales color café claro y base amarillo claro (Figura 6C); pronoto con dos pares de sedas am menores; cono bucal largo proyectándose entre las coxas I y más allá del prosterno (Figura 7A); con peine largo y regular en el margen posterior del tergo VIII del abdomen (Figura 7C) ……rostrata.
17b) Cono bucal corto (Figura 7B), no sobrepasa las coxas I; peine del margen posterior del tergo VIII del abdomen irregular en los dientes mediales (Figura 7D); generalmente segmentos antenales IV-V amarillos en la sección basal; seda po I presente; cabeza y pterotórax de color café claro, abdomen generalmente con patrón de coloración característico en los tergos abdominales (Figura 8B) …………………………................... occidentalis.
18a) Alas sombreadas con café claro en toda la extensión, cuerpo de color café oscuro, sin ser negro; seda po I presente (Figura 8D); con peine regular en el margen posterior del tergo VIII del abdomen (Figura 9D) .............................................................................................................................................. panamensis.
18b) Alas de color café oscuro con la base más clara; cuerpo color café oscuro, casi negro; sin patrones de coloración en el cuerpo; peine en el margen posterior del tergo VIII completo, irregular o con ausencia de dientes mediales.....................................................................................................................................................................19
19a) Pedicelo del segmento antenal III simple; peine en el margen posterior del tergo VIII presente en forma regular o irregular; sedas aa y pa muy desarrolladas ...............................................................................................20
19b) Cuerpo color café claro; peine en el margen posterior del tergo VIII interrumpido medialmente; sedas aa y pa bien desarrolladas. Sedas io III fuera del triángulo de los ocelos (Figura 8C); sedas po I presente; machos con glándulas en posición centro anterior en los esternos III-VII (Figura 9B) …………………………….insularis.
20a) Cuerpo bicolor con los segmentos caudales del abdomen (V-X), de color café oscuro profundo (Figura 9C); el resto del cuerpo de color claro; sedas corporales muy desarrolladas …………………..…………… nigricauda.
20b) Cuerpo de un solo color; sedas io III dentro del triángulo de los ocelos, sedas corporales de desarrollo variable ......................................................................................................................................................................21
21a) Tibias II-III café oscuro, casi negro; sedas po I presentes; con dos pares de sedas am menores (Figura 8E) y peine en el margen posterior del tergo VIII del abdomen, irregular pero completo (Figura 9E) …………fallaciosa.
21b) Tibias II-III bicolor; la tibia III con el tercio basal amarillo; color del cuerpo café oscuro casi negro; tibia I amarilla ………………………………………………...…………..............................................................annulipes.

Figura 1 Segmentos antenales III. A, Frankliniella grandecuriosa, modificado en el borde anteroventral, con proyección hacia la cabeza. B, Frankliniella parvula. C, collar modificado en forma de campana invertida. D, sedas bien desarrolladas en segmento antenal II. Misma escala en toda la imagen. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
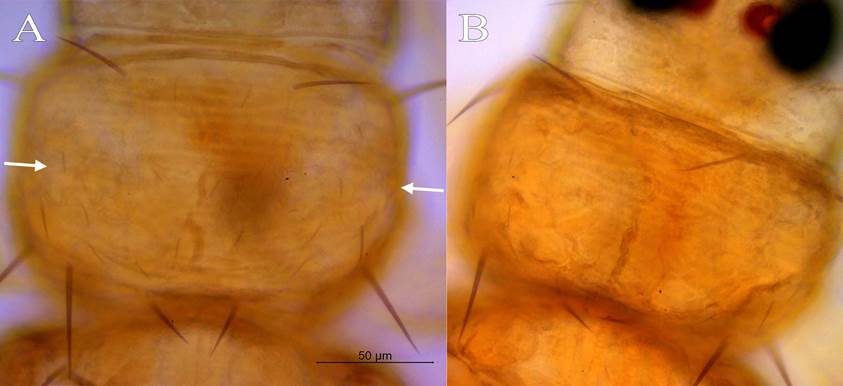
Figura 2 Pronoto. A, Frankliniella grandecuriosa con hilera de sedas mediales. B, Frankliniella albacuriosa. A y B con misma escala. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
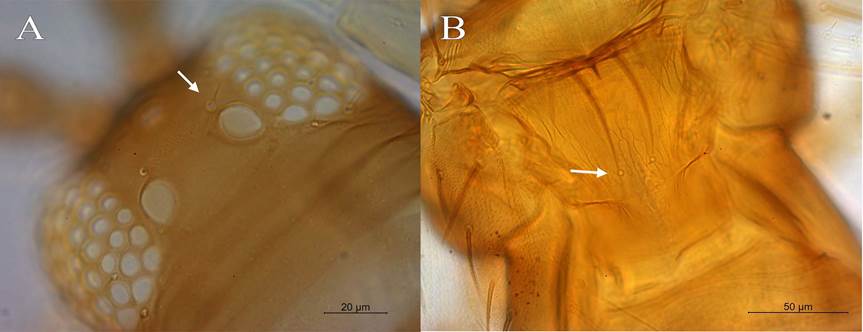
Figura 3 A, sedas interocelares III reducidas. B, Frankliniella bagnalliana con sensilias en el metanoto. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
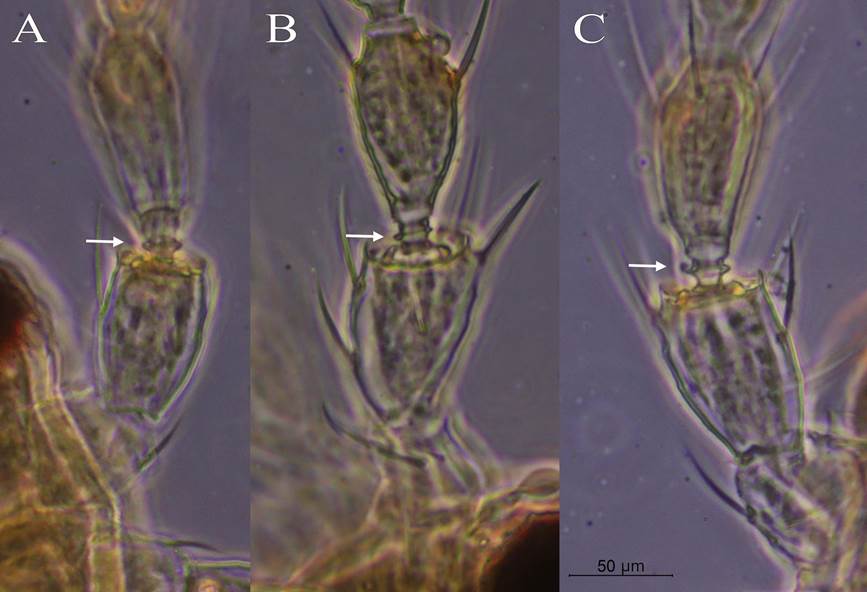
Figura 4 A, Frankliniella doris, con presencia de anillo subbasal evidente. B, Frankliniella nita. C, Frankliniella alonso. Misma escala en toda la imagen. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
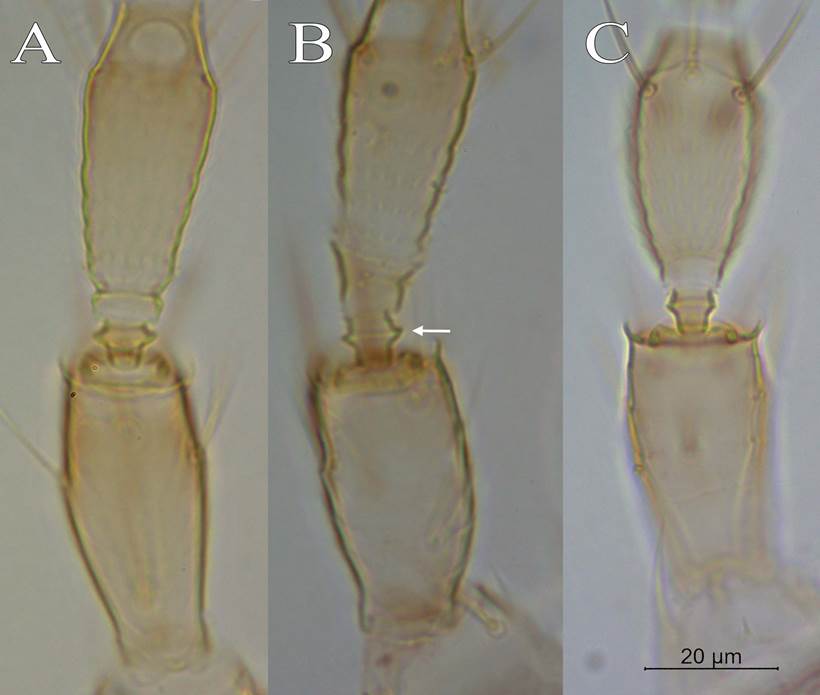
Figura 5 A, segmento antenal II alargado. B, Frankliniella cephalica, presencia de anillo sub basal evidente en pedicelo del segmento antenal III. C, pedicelo del segmento antenal III en Frankliniella difficilis. Misma escala en toda la imagen. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
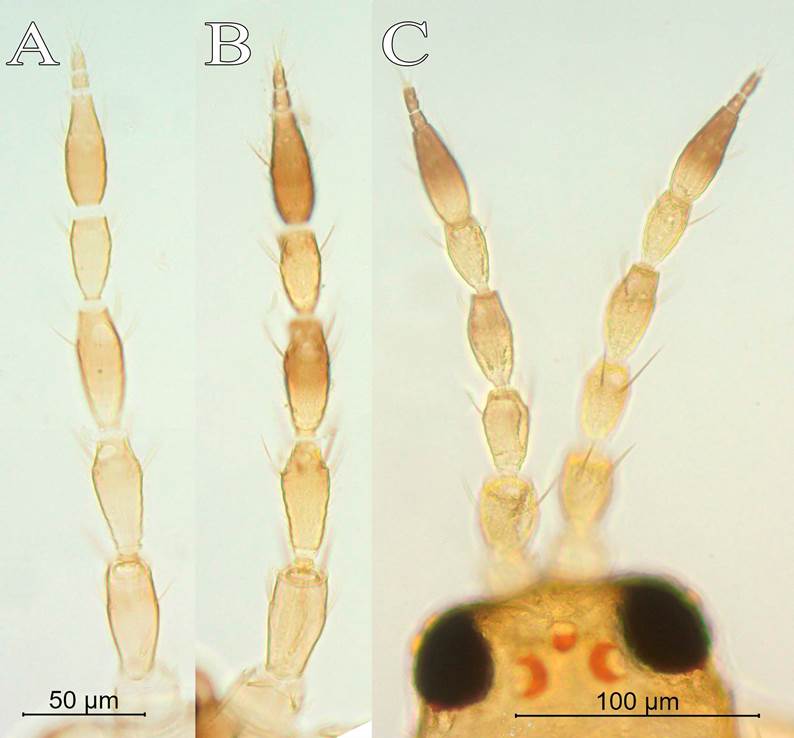
Figura 6 Coloración segmentos antenales. A, Frankliniella invasor. B, Frankliniella gardeniae. C, Frankliniella rostrata. A y B con misma escala. CIEMic-Universidad de Costa Rica, San José, Costa Rica, 2020.
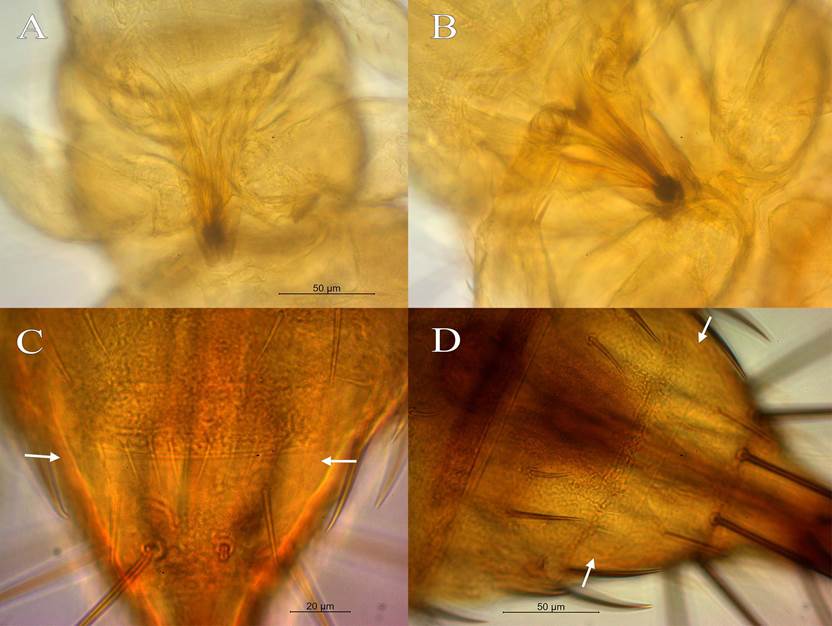
Figura 7 A, cono bucal en Frankliniella rostrata. B, cono bucal en Frankliniella occidentalis. C, peine del margen posterior del tergito VIII de la hembra de Frankliniella rostrata completo. D, peine irregular en el margen porterior del tergito VIII de la hembra de Frankliniella occidentalis. A y B con misma escala. CIEMic-Universidad de Costa Rica, San José, Costa Rica, 2020.

Figura 8 A, sedas ocelares III dentro de triángulo ocelar en Frankliniella difficilis. B, Frankliniella occidentalis -variante más común- con patrón de coloración en abdomen. C, sedas fuera del triángulo ocelar en Frankliniella insularis. D, sedas posoculares I presentes en Frankliniella panamensis. E, sedas anteromarginales reducidas en Frankliniella fallaciosa. C y E con misma escala. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.

Figura 9 A, sedas B1 y B2 del tergito IX en machos de Frankliniella gardeniae. B, placas esternales -glándulas esternales- en machos de Frankliniella insularis. C, abdomen bicolor en Frankliniella nigricauda: de café claro en primeros tergitos a café oscuro en últimos tergitos. D y E, peine en margen posterior del tergito VIII del abdomen en Frankliniella panamensis (D) y Frankliniella fallaciosa (E). D y E con misma escala. Centro de Investigación en Estructuras Microscópicas, Universidad de Costa Rica, San José, Costa Rica, 2020.
Discusión
De las veintidós especies del género Frankliniella registradas en el presente estudio, tres fueron reportadas como endémicas en la floración del árbol: F. doris, F. nita y F. alonso. A la fecha, estas han sido recolectadas únicamente en Costa Rica, mientras que las restantes diecinueve compartieron su presencia con México y en menor medida con las Islas del Caribe, Colombia y Brasil (Cavalleri & Mound, 2012; Johansen-Naime, 1982; Mound & Marullo, 1996; Retana-Salazar & González-Herrera, 2011). Entre las especies de mayor presencia durante la época de floración se encuentra F. cephalica, registrada comúnmente en las flores de plantas ornamentales en el centro del país (Retana-Salazar, 2014) y F. gardeniae, localizada comúnmente en el cultivo de mango en México y América Central (Retana-Salazar & Rodríguez-Arrieta, 2015b).
Las especies F. parvula y F. bruneri fueron registradas en flores de algunas plantas del género Musa, donde eventualmente podrían causar algún tipo de daño. Sin embargo, aún no se han desarrollado estudios formales de su posible impacto en cultivos productivos (Retana-Salazar & Rodríguez-Arrieta, 2015a). La primera, es una especie variable en su morfología, que se ha localizado en múltiples hospederos en Costa Rica y sus variaciones podrían responder a factores ambientales (Mound & Marullo, 1996), la segunda es poco común en Costa Rica.
Dos aspectos particulares, con especies que fueron identificadas en el presente estudio, fueron la existencia de F. grandecuriosa por primera ocasión fuera de México, y la especie F. sandovalensis fue la única del género que se reportó para el follaje de aguacate Hass, aunque en Centroamérica y parte de México también se ha reportado en otros géneros y asociados directamente al follaje, tal es el caso de Scirtothrips (Dickey et al., 2015; Hoddle et al., 2003). Del total de las especies de Frankliniella en follaje y floración del árbol, solamente dos han sido asociadas a daños en cultivos de interés productivo: F. occidentalis y F. insularis (Berzosa, 2006; de Borbón, 2013; Monteiro et al., 2001; Pérez-López, 2006; Soto & Retana, 2003).
Las especies F. occidentalis y F. panamensis, mantienen una cercanía morfológica, lo que dejó al descubierto que pudieran existir linajes de especies (Rugman-Jones et al., 2010). En el caso de F. occidentalis, se requirió de la determinación molecular con el fin de discernir sobre un posible complejo de especies recientemente (Rugman-Jones et al., 2010). Esta misma idea ya había sido propuesta por Bryan y Smith (1956) y de previo desestimada por autores que dan un peso a la clasificación por medio de caracteres taxonómicos altamente variables. Para F. panamensis, su ecología no ha sido estudiada en profundidad, pero se le ha localizado esporádicamente en invernaderos de plantas ornamentales a los 1000 m s. n. m. (Retana-Salazar, Rodríguez-Arrieta et al., 2014).
En el género Frankliniella los machos presentan caracteres dimórficos con respecto a las hembras (Mound, 2002; 2005), haciéndolos de valor para la determinación de especies (Garita-Cambronero & Lizano-Fallas, 2006). Estas variaciones pueden incluir el tamaño, que es la diferencia más común, también pueden existir variaciones como la ausencia de peine marginal en el tergo VIII del abdomen o diferencias en presencia de sensilias. En consecuencia, las variaciones en proporciones, quetotaxia y color pueden ser de utilidad para la determinación de las especies. El mayor problema está en que se deben presentar factores intrínsecos poblacionales para que aumente la aparición de machos, sumado a factores ambientales, que ya limitan la obtención de machos en campo.
Un resultado del presente estudio fue el requisito de evaluar la biodiversidad de trips asociados a los sistemas agroecológicos donde sea incluida la distribución espacial de las especies. Esta propuesta se debe a que si se continúa estableciendo relaciones taxonómicas jerárquicas, sin determinar las relaciones biogeográficas, se podría estar generando nomenclatura taxonómica inexacta, tal es el caso de los conjuntos de especies nuevas del género Scirtothrips (Johansen-Naime & Mojica-Guzmán, 1998; Hoddle, Heraty et al., 2008; Hoddle, Mound et al., 2008) en aguacate y mango mexicano. En numerosos sistemas ecológicos agrícolas se ha demostrado que hay una fuerte tendencia a la aparición de especies simpátricas (Berlocher & Feder, 2002).
Las especies de tisanópteros asociadas a cultivos frutales pueden presentar varios niveles de importancia, ya que una misma especie puede tener más de una función a lo largo del ciclo fenológico completo. Uno de los aspectos a tomar en cuenta es que las especies depredadoras podrían tener valor como controladores biológicos (Cambero-Campos, et al., 2011), el caso más conocido que se ha estudiado sobre aguacate es el posible uso de especies como Franklinothrips orizabensis (Hoddle, 2003). En otros casos hay especies que pueden ser potenciales polinizadores, como se ha propuesto recientemente para el cultivo de mango en Costa Rica (Retana-Salazar & Rodríguez-Arrieta, 2015b). De ahí la necesidad de estudios biológicos y ecológicos bien estructurados con sólidas bases en la clasificación de las especies, para revelar el papel de las especies involucradas en el agroecosistema.
Conclusiones
A nivel agrícola, el control de las especies de trips con pesticidas químicos ha sido muy común. Este estudio evidenció que la presencia de las especies del género Frankliniella en las zonas de cultivo de aguacate variedad Hass en la región central de Costa Rica está constituido por veintidós especies, con las arvenses como el mayor reservorio de las especies de Frankliniella capturadas y no el árbol de aguacate.
Durante la floración de este cultivo hay tres especies endémicas: F. doris, F. nita y F. alonso que aún no han sido registradas en flores de otros hospederos. Los únicos reportes fitosanitarios regionales conocidos pertenecieron a F. occidentalis y F. insularis, no obstante, dichos reportes se originaron para diferentes cultivos de aguacate. La única especie del género que fue detectada en follaje fue F. sandovalensis, misma que no ha presentado ningún reporte fitosanitario formal. Por último, la especie F. cephalica fue localizada tanto durante la floración como visitando las arvenses cercanas a las zonas productoras.















