Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.5 n.3 San José Dec. 2003
Introducción
En 1981, de Bold y sus colegas observaron que la infusión de extractos de tejido atrial en ratas provocaba una natriuresis abundante; esto llevó al aislamiento y clonación del péptido natriurético atrial (PNA), primer miembro de la familia de los péptidos, los cuales se caracterizan por tener potentes efectos natriuréticos, diuréticos y actividad vasorelajante. (1)
Múltiples investigaciones, tanto en animales como en humanos, han establecido que los péptidos natriuréticos tienen un papel importante en la defensa del cuerpo contra la hipertensión y la expansión de volumen plasmático. (1) Esto se hace más evidente, en pacientes con disfunción del ventrículo izquierdo (VI), donde los niveles circulantes elevados de los péptidos tienen implicaciones importantes en el pronóstico y en la terapia. (2)
Se ha observado que en la disfunción temprana del ventrículo izquierdo, la activación del sistema de renina-angiotensina-aldosterona y el sistema nervioso simpático renal son inhibidos por la acción de los péptidos natriuréticos. Sin embargo, la respuesta renal a los péptidos disminuye a medida que la insuficiencia cardíaca se empeora, incluso si las concentraciones plasmáticas de los péptidos se ven aumentadas. (3)
Esto probablemente refleja cambios en la hemodinamia renal, regulación a la baja de los receptores, un aumento en la degradación de los péptidos o una disminución de sodio en los conductos colectores, como resultado de una tasa de filtración glomerular disminuida o un incremento en la reabsorción de sodio en el túbulo proximal y un aumento de la actividad de la fosfodiesterasa GMPc. (3)
Esta respuesta cada vez menor hacia los péptidos, lleva a una potenciación de las acciones locales vasoconstrictoras de la angiotensina II y del sistema nervioso simpático a nivel renal, lo que resulta en retención de sal y el posterior deterioro de la función cardíaca. De forma semejante, la relativa falta de respuesta a los péptidos natriuréticos endógenos puede contribuir a la sobrecarga de volumen asociada con la falla renal aguda. (1)
Los péptidos natriuréticos claramente defienden contra el exceso de sal y la retención de agua. Ratas inmunizadas contra su propio péptido natriurético atrial no pueden excretar el exceso de agua normalmente. El rol de estos péptidos posiblemente puede ser mejor explicado en los pacientes con insuficiencia cardíaca congestiva. La hipertrofia cardíaca que acompaña el fallo cardíaco, lleva a un aumento en la producción ventricular del péptido natriurético atrial y del péptido natriurético cerebral. Su liberación en el plasma es incluso estimulada por la tensión sobre el atrio y el ventrículo agotados y por la elevación de las concentraciones plasmáticas de angiotensina II y la endotelina 1. (1)
Como se ha mostrado in vitro, el péptido natriurético atrial inhibe el crecimiento de los fibroblastos cardíacos, potencialmente limita la proliferación del remodelado del corazón, retardando el depósito de colágeno. Por lo tanto, ya sea a través de acciones directas e indirectas (por ejemplo, reducción de la postcarga), los péptidos natriuréticos potencialmente limitan la proliferación miocárdica o la respuesta hipertrófica ante la lesión o la isquemia. (2)
Bioquímica y biología molecular
La familia de los péptidos natriuréticos consiste en tres péptidos: péptido natriurético atrial (PNA), péptido natriurético cerebral (PNC) y péptido natriurético tipo C. La prehormona precursora para cada uno de ellos es codificada por un gen separado. La distribución específica en los tejidos y la regulación de cada péptido es única. (4) (Tabla 1)
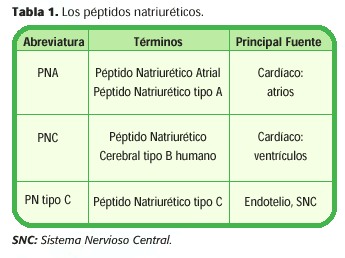
Péptido Natriurético Atrial (PNA)
El péptido natriurético atrial (PNA) es un péptido de 28 aminoácidos que se sintetiza y secreta en los atrios. Varias hormonas y neurotransmisores como la endotelina, vasopresina-arginina y las catecolaminas, estimulan directamente la secreción del PNA. Sin embargo, el principal estímulo para su secreción es el aumento de la tensión en las paredes atriales, lo que refleja un aumento en el volumen intravascular. (1, 5)
En un estudio con pacientes con enfermedad cardíaca y sujetos sanos, se observó que ante una presión basal atrial derecha de 4 mmHg, la elevación de 1 mmHg, provocaba un aumento en la concentración del péptido natriurético atrial en el atrio derecho de un 36%. El ejercicio en sujetos con presiones atriales normales provocó un aumento rápido y marcado en las concentraciones del PNA, lo cual se correlacionó con el aumento de la presión del atrio. (5)
El PNA se almacena en el miocito como una prohormona de 126 aminoácidos; cuando es secretada se divide en una parte N-terminal de 98 aminoácidos (PNA-N) y el PNA biológicamente activo con 28 aminoácidos. El PNA-N es más fácilmente cuantificable en laboratorio y tienen una vida media plasmática más larga comparada con el PNA, el cual tiene una vida media de 2.5 minutos y por lo tanto, en un momento dado, PNA-N presenta hasta 50 veces las concentraciones plasmáticas de PNA. (4)
Una pequeña cantidad del PNA es producido por el tejido ventricular en adultos normales, sin embargo está bien documentada su presencia en el tejido ventricular de los fetos, neonatos y ventrículos hipertrofiados. (1)
El gen del PNA también está expresado a nivel renal, a partir de cuyo precursor se genera un péptido de 32 aminoácidos denominado urodilatin. El urodilatin se considera una hormona paracrina y puede ser un importante regulador local del sodio y del agua. (1, 4)
Péptido Natriurético Cerebral (PNC)
El péptido natriurético cerebral (PNC) es un péptido de 32 aminoácidos que es estructuralmente similar al PNA. La hormona precursora humana contiene 108 aminoácidos, cuya activación produce el PNC activo y un fragmento amino terminal. (1)
Matsuo y su colaboradores lo aislan en 1988, en un principio se identificó en el cerebro porcino, de ahí su denominación; posteriormente, se aisló del tejido cardíaco de muchas especies, incluyendo los humanos. (4)
El PNC se secreta principalmente desde el ventrículo como respuesta a la dilatación ventricular, sin embargo, también es secretado, pero en menores cantidades, desde los miocitos atriales. Como se observó en estudios que involucraban tanto a pacientes con patología de predominio ventricular (cardiomiopatía dilatada) y aquellas con predominio atrial (estenosis mitral).(6, 7)
En las distintas especies, las secuencias de aminoácidos para el PNA y el péptido natriurético tipo C se conservan, sin embargo el PNC varía de forma significativa de una especie a otra. A pesar de que tienen efectos hemodinámicos similares, el PNC presenta un mayor tiempo de acción y causa una intensificación de la respuesta natriurética. (4)
Péptido natriurético tipo C
Es el tercer miembro de la familia, se aisló por primera vez por Matsuo y sus colaboradores en 1990. (4)
Se han logrado identificar in vivo, dos tipos de péptido natriurético tipo C, uno con 22 y otro de 53 aminoácidos. El péptido tipo C de 22 aminoácidos está presente principalmente en el sistema nervioso central, la hipófisis anterior, riñón, células endoteliales vasculares y el plasma y es más potente que la forma de 53 aminoácidos. (1)
Las concentraciones sistémicas del péptido natriurético tipo C son muy bajas, ya que el péptido natriurético tipo C parece localizarse exclusivamente en el sistema nervioso central y sus niveles en estas áreas son de 30-70 veces más altos que las de los PNA y PNC. Se cree que actúa como un neurotransmisor que coordina los aspectos relacionados con el equilibrio de la sal, el agua y la presión sanguínea. (4)
Receptores de los péptidos natriuréticos
Los péptidos natriuréticos ejercen sus efectos a través de la interacción con una gran cantidad de receptores en la superficie de las células diana. Se han identificado tres tipos de receptores para los péptidos natriuréticos (A, B y C) en los tejidos de los mamíferos. (1, 2, 4)
Los receptores A y B están unidos a una vía de señalización dependiente del GMPc, la unión de los péptidos natriuréticos a su receptor activa la guanilato ciclasa, lo que lleva a un aumento del GMPc intracelular, el cual interviene en muchos de los efectos cardiovasculares y renales de los péptidos. (1, 4)
Los receptores A y B son estructuralmente semejantes. El receptor A se une tanto al péptido natriurético atrial como al cerebral, con preferencia 10 veces mayor por el PNA. El péptido natriurético tipo C es el ligando natural para el receptor B. El receptor A es el tipo más abundante en los grandes vasos, pero también se pueden observar algunos receptores B. (4)
Los receptores tipo C se relacionan con la degradación de los péptidos natriuréticos. Los péptidos natriuréticos se unen a ellos con igual afinidad, lo que ocasiona la internalización del péptido dentro de la célula y su degradación enzimática; tras lo cual los receptores tipo C regresan a la superficie de la célula. Estos receptores son abundantes en el tejido vascular, donde absorben el exceso del PNA y protegen contra el inicio súbito de hipotensión. Los péptidos natriuréticos circulantes también se inactivan por la acción de las endopeptidasas neutrales presentes en las células tubulares renales y en las células vasculares. (4)
El péptido natriurético atrial (ANP) se une a su receptor A (NPR-A) y, en una vía dependiente de ATP, estimula la actividad intrínseca del receptor dependiente guanilato ciclasa. El monofosfato de guanosina cíclico (cGMP) ejerce sus efectos biológicos indirectamente a través de una proteína cinasa dependiente del cGMP o a través de una o varias fosfodiesterasas (PDE), o por acción directa sobre efectores tales como los canales de sodio sensibles a la amilorida en el riñón. El péptido natriurético atrial también se une a los receptores C (NPR-C), los cuales lo internalizan y degradan. El receptor C podría tener, también, otras funciones de señalización independientes. Finalmente, el péptido natriurético atrial puede ser degradado por endopeptidasas neutrales extracelulares (NEP) que se encuentran en el riñón y tejido vascular. GTP se refiere al trifosfato de guanosina. (N Engl J Med 1998; 339: 321-3281)
Efectos cardiovasculares
En animales las dosis bajas y sostenidas del péptido natriurético atrial y cerebral disminuyen la resistencia vascular periférica y bajan la presión sanguínea; sin embargo, a altas dosis aumentan las resistencias vasculares periféricas a pesar de disminuir la presión sanguínea, lo que sugiere una activación contraregulatoria de los baroreceptores. (2)
La disminución de la presión sanguínea dependiente de los péptidos natriuréticos se da en parte como resultado de la reducción de la precarga cardíaca causada por el cambio del líquido intravascular hacia el compartimento extravascular, lo que refleja un aumento en la permeabilidad vascular del endotelio y tal vez un aumento en la presión hidrostática del lecho capilar. Sin embargo, la extravasación de líquidos al compartimento extravascular no es el único mecanismo para la reducción de la precarga. Los péptidos natriuréticos aumentan la capacidad venosa y promueven la natriuresis, lo que a su vez también reduce el volumen extravascular. Esto último como resultado directo del efecto de los péptidos sobre el riñón y la supresión del eje renina-angiotensina-aldosterona. (2, 8, 9)
Ya que la concentración de ambos péptidos (PNA y PNC) es mucho más baja en el sistema nervioso central que en el corazón o en la circulación, se postula que las acciones biológicas del PNA y el PNC son principalmente periféricas.(4)
Efectos renales
Los efectos diuréticos y natriuréticos de los péptidos natriuréticos se deben a acciones sobre la hemodinamia renal y efecto directo sobre los túbulos. (8)
El aumento en el flujo renal sanguíneo se debe a dos mecanismos, primero estimula la dilatación de las arteriolas renales aferentes y la constricción de las arteriolas eferentes; lo cual lleva a un aumento de la presión dentro de los capilares glomerulares, este aumento en la presión va a provocar un aumento en la filtración glomerular. El segundo mecanismo de acción es debido a que los péptidos aumentan la concentración de GMPc en las células mesengiales, lo cual relaja las células y por lo tanto aumenta el área de superficie efectiva para la filtración. (8)
La natriuresis provocada por lo péptidos, no se ve asociada al aumento de la filtración glomerular, lo que sugiere que los péptidos tienen efecto también, sobre el túbulo renal. Este último mecanismo, podría involucrar la producción local de péptidos natriuréticos (por ejemplo, urodilantin) el cual actúa a través de un mecanismo paracrino o a través de la acción de las concentraciones sistémicas de los péptidos. Los péptidos natriuréticos pueden inhibir la angiotensina II, la cual estimula el transporte de agua y sodio en los túbulos contorneados proximales. A nivel de los conductos colectores, los péptidos inhiben el transporte de agua, antagonizando la acción de la vasopresina. En el túbulo colector medular interno, estimulan la producción de GMPc y bloquean la absorción de sodio. (3)
Estudios con HS-142-1, el cual es un antagonista competitivo de los péptidos natriuréticos para la unión a los receptores A o B; entrega información adicional sobre la importancia de los péptidos en la función renal. En animales normales o en animales a los cuales experimentalmente se les indujo a una insuficiencia cardíaca; éste fármaco bloqueó la natriuresis y diuresis inducida por los péptidos, aumentó la resistencia vascular renal y aumentó la concentraciones de catecolaminas. Este fármaco también redujo el flujo plasmático renal y la filtración glomerular. Estos resultados implican que los péptidos natriuréticos tienen alguna implicancia en la patogénesis de la disfunción renal de estos trastornos. (9)
Efectos sobre el sistema nervioso central
A pesar de que el péptido natriurético atrial y el péptido natriurético cerebral no cruzan la barrera hematoencefálica, sí alcanzan ciertos lugares del sistema nervioso central que se encuentran por fuera de esta barrera. Los tres péptidos y en especial el péptido tipo C son producidos en el cerebro. (4)
Hormonas presoras o aminas como la endotelina, la vasopresina y la norepinefrina (no lo hace la angiotensina II), estimulan la liberación del péptido natriurético atrial en neuronas hipotalámicas cultivadas. (1)
Las acciones de los péptidos natriuréticos a nivel cerebral refuerzan los efectos periféricos. Por ejemplo, el efecto natriurético periférico se ve amplificado por la inhibición central de la ingesta de sal o de la sed, lo cual complementa los efectos diuréticos renales del péptido. (1, 4)
Los péptidos natriuréticos actúan a nivel del tallo cerebral disminuyendo el tono simpático. En ratas con formas genéticas de hipertensión, la inhibición de la acción del péptido natriurético atrial endógeno en el nucleus tractus solitari provocó la elevación de la presión sanguínea, lo que sugiere que el péptido tiene un papel en la regulación del tono de la señal baroreceptora cardiovascular en esta región del cerebro. (1)
El mecanismo de acción de los péptidos natriuréticos atrial y tipo C en cerebro se explica mejor por la distribución de los subtipos de receptores. Los receptores del péptido natriurético tipo C se encuentran en todo el sistema nervioso central, lo que tal vez podría reflejar su efecto anticrecimiento de la glia. Los receptores A predominan en las áreas adyacentes al tercer ventrículo que no están separadas de la sangre por la barrera hematoencefálica, una posición que les permite unirse al péptido natriurético atrial circulante como también al péptido producido a nivel central. Estos receptores parecen mediar los efectos del péptido sobre la ingesta de sal y la sed. (1)
Implicaciones clínicas del Péptido Natriurético Atrial
Implicaciones pronósticas en la disfunción del ventrículo izquierdo
Las implicaciones pronósticas del PNA han sido bien establecidas en los pacientes con insuficiencia cardíaca (IC) y en los pacientes asintomáticos con disfunción del ventrículo izquierdo tras un infarto de miocardio.
En varios estudios (10, 11) que involucran a más de 300 pacientes, se ha observado que los niveles del PNA están aumentados en la insuficiencia cardíaca en relación directa con el grado de severidad de la enfermedad y de forma paralela con la activación de los sistemas neurohormonales; a pesar de que la asociación de los péptidos natriuréticos con el pronóstico de los pacientes con insuficiencia cardíaca es importante, no se considera un hallazgo totalmente inesperado. (10)
De más interés son las observaciones de que el PNA sérico y el PNA-N están significativamente elevados en los pacientes asintomáticos con disfunción del ventrículo izquierdo, a pesar de ser en cantidades menores que en aquellos pacientes con síntomas floridos de insuficiencia cardíaca. Una elevación de las concentraciones plasmáticas del PNA-N > 54 pmol/L de los valores basales tiene una sensibilidad del 90% y una especificidad del 92% para detectar a los pacientes asintomáticos con disfunción del ventrículo izquierdo. (10) Por lo tanto, las mediciones plasmáticas del PNA y PNA-N circulantes podrían ser útiles como marcadores para identificar a estos pacientes asintomáticos.
Más aún, en el estudio Survival and Ventricular Enlargement (SAVE) que incluyó a 2.460 pacientes con disfunción del ventrículo izquierdo tras un infarto, los niveles plasmáticos del PNA, igual que los niveles de otras neurohormonas, lograron predecir la mortalidad cardíaca y/o el desarrollo de insuficiencia cardíaca en pacientes asintomáticos con disfunción del ventrículo izquierdo. (12) En un metanálisis de la información del estudio SAVE, la actividad de la renina plasmática y el PNA fueron las únicas dos hormonas que, independientemente, lograron predecir la mortalidad. (12)
De forma similar, en el CONSENSUS (11), un estudio escandinavo que incluyó a 2.560 pacientes con insuficiencia cardíaca clase NYHA IV, el PNA plasmático fue fuertemente relacionado con la mortalidad cardiovascular. Sin embargo, en ambos estudios (SAVE y CONSENSUS) los niveles del PNA plasmático fueron también fuertemente asociados con la severidad de la disfunción del ventrículo izquierdo, pero el valor predictivo independiente de los niveles plasmáticos de PNA fue reducido o eliminado en los análisis que incluían la fracción de eyección del ventrículo izquierdo, la cual está establecida como un determinante poderoso de pronóstico. (11)
Por lo tanto, una vez que se conoce la fracción de eyección del ventrículo izquierdo, la medición del PNA plasmático y otras neurohormonas parece agregar muy poca información a la valoración del riesgo en los pacientes cardiópatas. Sin embargo, parece ser útil conocer los niveles de PNA en situaciones en donde no se dispone de otras medidas para valorar la función del ventrículo izquierdo. (10, 11, 12)
Información posterior del SAVE, reportada por Hall et al. (12), demostró que el PNA-N, tal vez debido a que se encontraba en mayor cantidad en el plasma o que su forma de medición es mas fácil, se definió como un factor de predicción más fuerte de muerte y otros puntos cardíacos que el PNA por sí solo en pacientes que habían sufrido un infarto del miocardio previo. El PNA-N también fue un factor de predicción independiente de la evolución cuando se consideró en un modelo que incluía fracción de eyección y otras variables clínicas y fue de hecho, un factor de predicción más fuerte de muerte cardiovascular e insuficiencia cardíaca que la edad, infarto previo o fracción de eyección. Esta información sugiere que el PNA-N entrega información pronóstica que es independiente y adicional a la fracción de eyección del ventrículo izquierdo en pacientes con infarto agudo de miocardio previo y fortalece el concepto de que la única razón de que la activación neurohormonal es una variable importante de pronóstico es debido a que refleja la severidad de la disfunción del ventrículo izquierdo. Hall et al. llegan a concluir que para un paciente masculino de 60 años sin diabetes, ni hipertensión, que sufrió infarto previo de miocardio, terapia trombolítica, arritmias atriales o con insuficiencia cardíaca transitoria, un Killip Kimbal clase 1, una fracción de eyección del 30% y un elevación del 12% de la creatinina kinasa sobre lo normal; un aumento de las concentraciones plasmáticas del PNA-N de 452.5 pmol/L sobre la media de 1.331.5 pmol/L implica un aumento en un 27% en el riesgo de muerte cardiovascular y un aumento del 51% en el riesgo de desarrollar insuficiencia cardíaca severa. (10,12)
Ante el potencial que tienen los niveles del PNA-N como marcador de disfunción del ventrículo izquierdo se han realizado estudios para valorar las diferencias de estas concentraciones con respecto al sexo y a la edad, Wang et al. demostraron en su estudio de más de 3.532 sujetos, que las mujeres presentan niveles significativamente más altos de los péptidos cardíacos que los hombres, por lo que debe tomarse en cuenta en el momento de proponer un valor referencial con fines prácticos. (13)
En función a la edad, se observa un aumento de las concentraciones asociado a la edad, lo cual puede reflejar una mayor prevalencia de enfermedad cardíaca subclínica en sujetos mayores sin enfermedad manifiesta. (13)
Implicaciones terapéuticas del PNA
En un estudio en humanos, se administró el péptido natriurético atrial sintético en seis pacientes con insuficiencia cardíaca (NYHA III o IV) y en seis sujetos sin IC. La infusión en pacientes sanos a concentraciones plasmáticas ligeramente por arriba de las normales, provoca la diuresis y natriuresis sin cambios en la presión sanguínea. Estas infusiones reducen las concentraciones plasmáticas de renina y aldosterona e inhibe la secreción de la angiotensina II, estimulada por la secreción de la aldosterona; sin cambios significativos en el volumen efectivo. (14)
Al aplicarse en cantidades mayores en pacientes con insuficiencia cardíaca (ya que el PNA tiene una vida media tan corta se recomiendan infusiones a una velocidad de 0.1 ug/kg/min) se provocó una reducción en las presiones del atrio derecho y en la presión de la arteria pulmonar enclavada, una reducción de las resistencias vasculares sistémicas, aumento del volumen disponible, estimuló la natriuresis y la diuresis pero en menor grado que en los pacientes sin insuficiencia cardíaca, e inhibió tanto el sistema de renina-angiotensina como el sistema nervioso simpático, al demostrarse una disminución en las concentraciones de norepinefrina a medida que se administraba la infusión del PNA. (14)
Los resultados hemodinámicos observados en este estudio son compatibles con el concepto establecido de que los vasodilatadores convencionales producen un mayor beneficio en la función del ventrículo izquierdo en un corazón deteriorado que en el corazón normal. (14)
Este estudio indica que la administración adicional del PNA es efectiva en los pacientes con insuficiencia cardíaca, lo cual sugiere que los receptores del PNA no están saturados, incluso si están regulados a la baja. (14)
Por lo tanto la vasodilatación y la natriuresis se logran sin la activación posterior de las neurohormonas vasoconstrictoras. Lo que proporciona intrigantes posibilidades para el tratamiento de la insuficiencia cardíaca, como un agente vasodilatador sin el reflejo de la estimulación simpática y un agente natriurético sin la activación del sistema renina-angiotensina. (14)
Implicaciones Clínicas del Péptido Natriurético Cerebral
Implicaciones diagnósticas en la Insuficiencia Cardíaca
La insuficiencia cardíaca suele ser, por lo general, un diagnóstico difícil en el departamento de Emergencias; ya que los síntomas son inespecíficos y los hallazgos físicos, no son lo suficientemente sensibles para utilizarlos como base del diagnóstico. La ecocardiografía que es considerado el método estándar para la detección de la disfunción del ventrículo izquierdo; consume recursos importantes para su realización, no siempre es accesible para todos y no suele reflejar con exactitud una condición aguda. (15)
El fallo en el diagnóstico de la insuficiencia cardíaca congestiva puede llegar a amenazar la vida del paciente, ya que el tratamiento estándar para la ICC puede ser dañino para otras condiciones que tienen los mismos síntomas de presentación; como por ejemplo, la enfermedad pulmonar obstructiva crónica. (15)
En un estudio con 1.586 pacientes tanto en Norteamérica como en Europa, que llegaron al Servicio de Emergencias con dificultad para respirar, la medición del PNC mostró ser útil para distinguir entre las causas agudas cardíacas y no cardíacas de disnea con una muestra de sangre y un exámen de laboratorio que no tomó más de 15 minutos. Se demostró que los niveles del péptido natriurético cerebral por sí mismos son más confiables que otro tipo de hallazgo clínico o físico o de laboratorio; para evaluar la posible causa de disnea. (15)
Harrison et al. siguieron por 6 meses a 325 de los pacientes del estudio aneterior y evaluaron su evolución con respecto a las concentraciones del PNC que presentaron al inicio y llegaron a determinar que el 54% de los pacientes que tenían niveles del PNC mayores a los 480 pg/mL tuvieron una descompensación de su insuficiencia cardíaca en los siguientes seis meses tras su egreso. (16)
Implicaciones pron sticas del PNC
En la disfunción del ventrículo izquierdo
El PNC ha demostrado ser un marcador más sensible que el PNA para el daño ventricular o de su disfunción; se sugiere que esto se debe a que el PNC es originado a partir del mismo ventrículo. (17)
Los niveles normales del PNC están generalmente por debajo de los 30 pg/mL. En los pacientes con ICC descompensada estos suelen elevarse por arriba de los 100 pg/mL y también tienden a aumentar progresivamente a medida que aumenta la clasificación funcional de la NYHA. (17)
En un estudio con 86 pacientes con insuficiencia cardíaca crónica (con fracción de eyección por debajo de 0.45), a los cuales se les hizo un seguimiento por 2 años, se observó que los niveles plasmáticos de PNC estaban elevados proporcionalmente al grado de disfunción del VI. Además, se demostró que las concentraciones del PNC estaban relacionadas en menor grado con la magnitud de la depresión de la fracción de eyección en comparación con el PNA, lo que sugiere que el PNC podría entregar información pronóstica para valorar mortalidad, independiente a la fracción de eyección y la presión pulmonar enclavada en pacientes con ICC crónica.(17,18)
Estos hallazgos sugieren que el PNC potencia la acción del PNA en los pacientes con insuficiencia cardíaca y que la síntesis ysecreción del PNC son estimuladas por el grado de isquemia miocárdica, necrosis, daño y tensión mecánica local en los miocitos ventriculares, incluso cuando los parámetros hemodinámicos globales estén normales. (17, 18)
Más del 50% de las muertes en los pacientes con insuficiencia cardíaca se deben a arritmias más que al deterioro de la función de bomba; los niveles aumentados del PNC han demostrado predecir la muerte súbita en estos pacientes, por lo que sus concentraciones elevadas se relacionan no solo a la disfunción mecánica sino también a la inestabilidad arrítmica en los paciente con insuficiencia cardíaca. Lo que sugiere que el PNC es más un indicador de la elevación de la presión intracardíaca más que de una patología en específico. En un estudio con 241 pacientes con insuficiencia cardíaca NYHA III-IV con concentraciones aumentadas del PNC (> 400 pg/ml) se analizó la prolongación del intervalo QTc y se determinó que aquellos pacientes con concentraciones elevadas e intervalo QTc prolongado tenían un peor pronóstico de muerte súbita y fallo de bomba, siendo esta información independiente de otros predictores de mal pronóstico en los pacientes con insuficiencia cardíaca. (19)
En los Síndromes Coronarios Agudos (SCA)
En un análisis con 2.525 pacientes del estudio Orbofiban se observó cómo aumentaban proporcionalmente a la gravedad del evento, las concentraciones del PNC en pacientes con infarto de miocardio con elevación del segmento ST (n=825), infarto de miocardio sin elevación del segmento ST (n=565) y tras un episodio de angina inestable (n=1.133). Los tres grupos presentaron una mayor incidencia de muerte, insuficiencia cardíaca e infarto del miocardio, si sus niveles basales del PNC estaban por arriba de 80 pg/mL al momento del evento. (20)
Estos hallazgos sugieren que la isquemia miocárdica aumenta la síntesis y la liberación del PNC, incluso en la ausencia de necrosis miocárdica o de disfunción ventricular izquierda preexistente. La isquemia reversible puede transitoriamente elevar la tensión en las paredes ventriculares izquierdas, lo cual puede ser suficiente para provocar una elevación del PNC. (20)
El PNC se libera en cantidades crecientes por el miocardio ventricular pero principalmente desde la zona del infarto, presumiblemente como respuesta a un aumento regional del estrés de la pared. Por lo tanto, la magnitud de la elevación de los niveles séricos de PNC está relacionada con el tamaño del infarto, la severidad de la disfunción global del ventrículo izquierdo, o ambos; lo cual puede relacionarse con el pronóstico. (20)
Los niveles del PNC son considerablemente más altos que los niveles del PNA durante las primeras horas tras el infarto, elevándose hasta veinte veces más que las concentraciones del PNA y 60 veces más que los niveles normales. Durante las primeras 24 horas tras el infarto las concentraciones del PNC se elevan rápidamente y tienden a estabilizarse, lo que permite su medición. (20)
Una única medida del PNC obtenida en las primeras 40 horas posteriores al inicio de los síntomas isquémicos, entrega información importante para la estratificación de los riesgos en todo el espectro de los SCA. Sin embargo, la evolución de las concentraciones plasmáticas del PNC en los pacientes con infarto de miocardio puede dividirse en dos patrones, según el estudio de Morita et al en 50 pacientes. El patrón monofásico alcanza un único pico a las 16 horas en la fase temprana del infarto de miocardio, mientras que un segundo grupo presentó un patrón bifásico, con un segundo pico al quinto y séptimo día de haberse iniciado los síntomas. (21)
Este patrón bifásico predominó en los pacientes con infarto de cara anterior, síntomas de IC, liberación aumentada de creatinina-kinasa-MB y fracciones de eyección bajas. El pico tardío de PNC se presume está relacionado con un mayor estrés de la pared ventricular en tales pacientes, lo que sugiere que el PNC podría ser un marcador temprano del remodelado posterior del ventrículo izquierdo y del crecimiento progresivo de las cámaras. Por lo tanto, la evaluación seriada del PNC entrega más información pronóstica que una única medición al inicio. (21)
En su estudio, Omland et al (22), reportaron por primera vez que los niveles plasmáticos del PNC entregan información pronóstica significativa en pacientes con infarto agudo de miocardio y que esta información es de hecho independiente a la fracción de eyección del ventrículo izquierdo. A pesar de que el PNA y el PNA-N también fueron factores invariables de predicción para la muerte cardiovascular, estos péptidos estaban muy cercanamente relacionados con la fracción de eyección y solo el PNC entregó información pronóstica adicional más allá de la obtenida por la de fracción de eyección. (22)
Los pacientes con niveles elevados del PNC después de un síndrome coronario agudo tienen un riesgo alto de muerte, un nuevo evento isquémico e insuficiencia cardíaca y se benefician con una terapia antitrombótica y antiplaquetaria intensa, antagonismo neurohormonal con agentes como los beta-bloqueadores y los inhibidores de la enzima convertidora de angiotensina y la revascularización temprana. Igual de importante, los pacientes que presentan niveles normales de PNC tras un evento coronario agudo, parecen presentar un menor riesgo a largo plazo de muerte e insuficiencia cardíaca. En este grupo de pacientes, se considera apropiado un manejo menos intenso con el propósito de evitar el costo y riesgo asociado a terapias potencialmente innecesarias. (22, 23)
La asociación entre el PNC y el riesgo a largo plazo de muerte, demostró en una investigación con 666 pacientes, ser independiente (todos p<0.001) a la edad del paciente, género, infarto de miocardio previo, antecedentes de hipertensión o diabetes, evidencias clínicas de insuficiencia cardíaca, la función renal, los niveles de la troponina I, las concentraciones plasmáticas de norepinefrina, creatinina, colesterol, los cambios electrocardiográficos, la terapia farmacológica y procedimientos coronarios de revascularización; si se complementaba su información con la entregada por la fracción de eyección, como predictores de muerte conocidos para los SCA.(24)
En el Embolismo Pulmonar Agudo
Los pacientes con embolismo pulmonar son parte de un grupo clínicamente heterogéneo, que varía desde pacientes con un mínimo dolor pleurítico hasta aquellos con compromiso hemodinámico. Los pacientes, hemodinámicamente estables son tratados en un inicio con heparina y posteriormente con antagonistas de la vitamina K. A pesar de ser una terapia muy efectiva, durante los siguientes tres meses, 2-7% de los pacientes morirá como resultado de su embolismo pulmonar. (25)
La mortalidad se ha visto asociada principalmente en aquellos pacientes que al momento de la presentación del cuadro cursan también con disfunción del ventrículo izquierdo. Han sido varios los intentos por estratificar a los pacientes con mayor riesgo de embolismo pulmonar fatal, lo cual permitiría una terapia mucho más agresiva. Estudios previos han demostrado que la ecocardiografía tiene un valor predictivo positivo tan solo del 5% para valorar la disfunción del ventrículo izquierdo en pacientes con embolismo pulmonar, más recientemente las troponinas T e I se postularon como posibles candidatas para la estratificación de riesgo, sin embargo, las troponinas son liberadas como consecuencia de la lesión miocárdica, mientras que el estímulo liberador del PNC es el aumento de la tensión o de la presión en los ventrículos, lo cual precede al fallo ventricular derecho. (25)
Siendo el PNC un importante marcador de disfunción ventricular, se han realizado diversos estudios con más de 200 pacientes donde se ha demostrado que la medición al ingreso de las concentraciones del péptido cerebral en los pacientes con embolismo pulmonar, hemodinámicamente estable, puede estratificar a los pacientes que se encuentran en mayor riesgo de mal pronóstico a los tres meses de su egreso, pudiéndose beneficiar a estos pacientes con una terapeútica más agresiva (por ejemplo, trombolisis). (26, 27)
Implicaciones terapéuticas del PNC
Estudios sobre tratamiento en la insuficiencia cardíaca descompensada
De forma similar a las acciones del PNA, la infusión del PNC en pacientes con IC provoca una relajación del músculo liso, reducción de la precarga y poscarga, un aumento del volumen disponible, estimula la natriuresis y la diuresis, y provoca una reducción de la aldosterona, efectos antimutagénicos y lusitropismo positivo. No presenta propiedades inotrópicas intrínsecas, a pesar de que sí causa un aumento reflejo del índice cardíaco debido a la vasodilatación. (28)
Al contrario del PNA, el PNC no reduce los niveles de norepinefrina circulantes; más bien parece ser que los aumenta a través de los baroceptores mediadores de la descarga simpática. Ya que el PNA y el PNC tienen en común los receptores guanilato ciclasa, grandes cantidades intravenosas de PNC compiten con el PNA por estos receptores y pueden aumentar los niveles circulantes de PNA a pesar de la reducción de las presiones atriales derecha e izquierda. (18)
El Nesiritide es el nombre genérico para el péptido sintético producido por biotecnología recombinante, el cual es idéntico al péptido natriurético cerebral. Fue aprobado por la Food and Drug Administration (FDA) como el nuevo agente parenteral para la terapia de IC, es un péptido idéntico al PNC y generalmente se produce a partir del ADN de la Escherichia coli. (29)
El Nesiritide puede administrarse en bolos intravenosos, infusión intravenosa o por inyección subcutánea. El inicio de acción después de una inyección de bolos intravenosos ocurre en los siguientes 15 minutos, cuyo pico máximo de acción aparece a la hora y el efecto persiste por lo menos por 3 horas más. Después de una administración inicial en bolos y un seguimiento con infusión continua, 60% de la respuesta hemodinámica se observa en los siguientes 15 minutos y un 95% en una hora. La vida media promedio de eliminación es de 18 minutos. (29)
El Nesiritide se une a los receptores del músculo liso vascular y provoca una relajación de las venas, principalmente a través de la estimulación del monofosfato de la guanosina cíclica. Tiene influencia mínima sobre las arterias. El Nesiritide no depende de los receptores beta-adrenérgicos para producir sus efectos biológicos, no provoca cambios en la frecuencia cardíaca o en la presión sanguínea. (30)
Se administró en 10 pacientes directamente en la circulación coronaria y concluyó que el Nesiritide ejerce efectos vasodilatadores coronarios; aunque llega a disminuir la presión de perfusión coronaria, el flujo coronario sanguíneo está aumentado, las resistencias vasculares disminuidas y el consumo de oxígeno también está disminuido. (31)
En pacientes sanos, dosis bajas de Nesiritide aumentan el flujo renal efectivo, la tasa de filtración glomerular, la excreción de sodio urinario y la tasa de flujo urinario. En IC crítica, la respuesta renal a los péptidos natriuréticos está atenuada debido a varios factores, pero principalmente por la acción del angiotensinógeno II. (29)
El Nesiritide ha sido estudiado en más de 700 pacientes hospitalizados con una IC agudamente descompensada utilizando tanto bolos como infusiones intravenosas. Un bolo de 2 mg/Kg. ofrece grandes ventajas por sus rápidos efectos hemodinámicos, los cuales persisten hasta por 4 horas. Una infusión de 0.01 mg/Kg/min tiene la ventaja de poder manejar la dosis. La vía de administración por infusión presenta los beneficios hemodinámicos sin provocar hipotensión excesiva. (32) (Tabla 2)
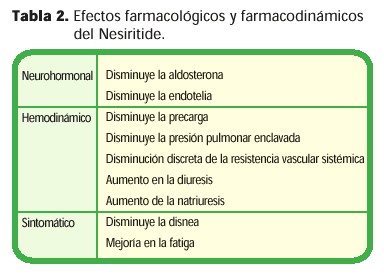
El Nesiritide no es arritmogénico. En contraste con la dobutamina, su uso no se ha visto asociado con un aumento significativo de la frecuencia cardíaca o con ectopia ventricular. Este fármaco no tiene metabolitos tóxicos. Su efecto adverso más importante es la hipotensión dosis-dependiente, la cual ocurre en un 4-5% de los pacientes. Cuando se da la hipotensión, el cese o la reducción de la infusión, generalmente restaura la presión sanguínea a niveles aceptables en cuestión de minutos. (37)
La terapia usual con Nesiritide ha sido por 2-3 días. Durante la infusión del fármaco, la hemodinamia anormal, mejora. Los diuréticos generalmente se utilizan para movilizar el exceso de líquidos, y la terapia vasodilatadora subyacente se intensifica si la presión sanguínea lo permite. Los pacientes mostraron una mejoría de sus síntomas en las siguientes horas tras la infusión. La terapia con Nesitiride se ha dado por 1 semana sin perder sus beneficios hemodinámicos. La tolerancia a este fármaco no se ha observado. Una vez el paciente muestra mejorías clínicas, debe abandonarse el Nesitiride y volver a la terapia de IC previamente establecida. (29)
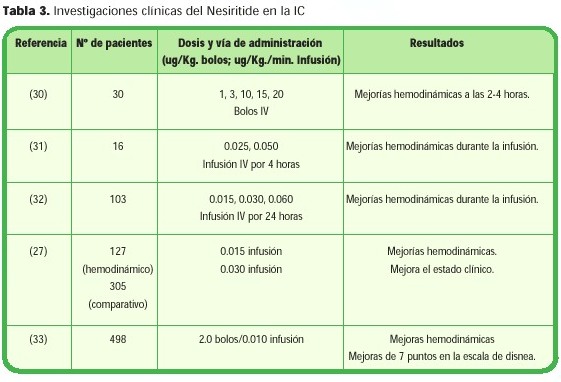
El estudio recientemente finalizado Vasodilation in the Managment of Acute Congestive Heart Failure (VMAC) utilizó 498 pacientes con una NYHA clase IV (disnea en reposo) que requerían de hospitalización para terapias parenterales. El objetivo principal fue medir los cambios en la presión enclavada pulmonar a las 3 horas; el grupo con Nesiritide mostró una reducción significativa de aproximadamente 8 mmHg, otro objetivo fue analizar la escala de siete puntos de la disnea a las tres horas, el grupo con Nesiritide mostró estar mucho mejor comparado con el grupo placebo. Los efectos adversos durante estas tres horas fueron más notorios en los pacientes que recibieron nitroglicerina - más dolor de cabeza, hipotensión y dolor abdominal - que en el grupo con nesiritide (27% vs. 18%). (36) (Tabla 3)
La infusión de Nesiritide ofrece varias ventajas sobre el tratamiento de "primera línea" para la insuficiencia cardíaca descompensada en el escenario hospitalario. Es más fácil de administrar que el nitroprusiato, y produce efectos hemodinámicos más rápidos y significativos que la nitroglicerina. Es mejor tolerado, con la presencia mínima de efectos adversos. Es particularmente útil para los pacientes con sobrecarga de líquidos evidente y una presión sanguínea razonable. Posiblemente sea efectivo en el tratamiento del edema agudo pulmonar, a pesar de que todavía los estudios no han incluido a este grupo de pacientes, ni tampoco existe información con respecto a los síndromes agudos coronarios. (34, 35)
Este fármaco debe administrarse con precaución en los pacientes que se presentan euvolémicos o "secos" y no debe utilizarse en el shock cardiogénico. Los pacientes con hipotensión, estados de bajo gasto cardíaco y presiones intracardíacas cercanas a lo normal; no son candidatos para recibir la terapia con Nesiritide; ya que responderán mejor a los inotrópicos intravenosos. Los pacientes que se presentan con trastornos del ritmo subyacentes pueden utilizar éste fármaco, ya que las arritmias no se ven exacerbadas con su uso, al contrario de la dobutamina. La terapia de fondo con inhibidores de la enzima convertidora de angiotensina y beta bloqueadores debe continuarse sin interrupción. (36, 37, 38)
Estudios de tratamiento en la insuficiencia cardíaca diastólica
Varios estudios (39, 40, 41) evalúan los efectos del PNC sobre la hemodinamia y la tolerancia al ejercicio en pacientes con IC y con función sistólica normal del VI. Este es un grupo de pacientes, que pueden representar desde un 30 a un 40% de los pacientes con síntomas de IC. A pesar de que se han llegado a encontrar grandes avances en la comprensión de las anormalidades de la relajación del VI y su compliance, lo que contribuye a la insuficiencia cardíaca diastólica; los avances terapéuticos hasta la fecha generalmente han sido desilusionantes y el estudio del PNC podría representar una nueva puerta de investigación en ese sentido.
Existen numerosos factores que predisponen a las anormalidades del comportamiento diastólico del ventrículo y que llevan a una incapacidad de expulsión y a la elevación de las presiones de llenado; a pesar de contarse con una función sistólica normal. Dentro de estos factores se encuentra el envejecimiento, la hipertensión, la hipertrofia, isquemia y fibrosis; y la mayoría de los pacientes con este desorden fisiológico son ancianos con hipertensión e hipertrofia del VI. En teoría, los fármacos que bajen la presión sanguínea efectivamente sin activar las neurohormonas que estimulan la posterior hipertrofia, podrían ser beneficiosos; y los beta-bloqueantes, los antagonistas de los canales del calcio y los inhibidores de la enzima convertidora de angiotensina son efectivos en muchos pacientes. Sin embargo, existen otros, en los cuales estos fármacos estándares no son efectivos o solo parcialmente ayudan a aliviar los síntomas. (40)
Es conocido que muchos de los pacientes con función sistólica normal y disfunción de la relajación diastólica y del llenado tienen una utilización inadecuada de los mecanismos de Frank-Starling durante el ejercicio lo que lleva a una intolerancia al esfuerzo. Un ventrículo izquierdo normal aumenta el gasto cardíaco durante la fase temprana del ejercicio a expensas del reclutamiento de la reserva de la precarga y la dilatación de las cámaras cardíacas. Esto se acompaña de un aumento en el retorno venoso desde los lechos musculares en ejercicio, en combinación con los efectos lusitrópicos para estimular la contracción (lo que resulta en un mayor fuerza elástica o de las "fuerzas restauradoras") y estimulación nerviosa simpática, lo que a su vez, aumenta la relajación ventricular y permite que el ventrículo se llene a volúmenes diastólicos más altos sin la contraparte de presiones diastólicas finales más altas. Este mecanismo es particularmente importante con el envejecimiento, ya que la reducción en la respuesta cronotrópica al ejercicio requiere de una mayor dependencia sobre la reserva contráctil y la reserva de precarga para aumentar el gasto cardíaco a demandas cada vez mayores. (40)
En pacientes con IC y función sistólica normal, particularmente aquellos con hipertensión e hipertrofia, esta respuesta normal al ejercicio es inadecuada; ya sea porque el volumen diastólico final no puede aumentarse adecuadamente para alcanzar el volumen necesario o porque el aumento del volumen diastólico final se asocia con un aumento exagerado de la presión diastólica final, lo que lleva a síntomas de fatiga o disnea. (40)
El estudio de Clarkson et al., investiga los efectos fisiológicos y posiblemente terapéuticos de la administración del PNC en seis pacientes con IC diastólica aislada con síntomas al esfuerzo de moderados a severos, cinco de los cuales tenían hipertensión y cuatro hipertrofia del VI. Durante el ejercicio y previo a la administración del péptido, tanto la presión arterial pulmonar como la presión enclavada pulmonar aumentaron significativamente. Los niveles plasmáticos del PNA y del PNC se elevaron más allá del rango normal en estos pacientes bajo condiciones basales; mientras que las presiones del VI estaban normales en reposo y no existió ninguna evidencia definitiva de que la hipertensión por si sola se asocie con elevaciones de los péptidos cardíacos circulantes. (41)
Esto sugiere que la elevación repetitiva de las presiones de llenado cardíaco durante el ejercicio pueden ser el estímulo para la liberación de los PNC y PNA. La administración del PNC resultó en una reducción significativa del aumento de las presiones enclavada pulmonar y de la arterial pulmonar, inducidas por el ejercicio sin ningún cambio en el volumen de carga. Como en estudios previos en pacientes con disfunción sistólica del VI, la administración del PNC resulta en una disminución de los niveles plasmáticos de aldosterona. La mejoría en la hemodinamia con la infusión del PNC durante el ejercicio es una observación única que tiene el potencial de representar un paso enorme en el entendimiento de la disfunción diastólica y el rol de los péptidos natriuréticos cardíacos en la regulación de la función tanto diastólica como sistólica. (41)
Conclusiones
La secreción y liberación del péptido natriurético atrial y el péptido natriurético cerebral es una respuesta fisiológica ante el aumento de la presión en el atrio y ventrículo izquierdo, respectivamente. Tienen un papel importante en la homeostasis del sodio y del agua, al defender contra el exceso y la retención de ambas sustancias.
La concentración plasmática del péptido natriurético atrial y el péptido natriurético cerebral son marcadores biofisiológicos importantes y de gran sensibilidad para el daño ventricular izquierdo, tanto en pacientes con insuficiencia cardíaca sintomática como asintomáticos. El péptido natriurético cerebral ha demostrado mayor sensibilidad que el atrial y un valor pronóstico de disfunción ventricular independiente a la fracción de eyección.
A través de un sencillo y práctico exámen de sangre los péptidos han demostrado valorar, a corto y largo plazo, la evolución de los pacientes que han sufrido infarto agudo de miocardio y embolismo pulmonar, lo cual podría guiar la agresividad de la terapéutica a implementar.
La infusión de dosis superiores a las normales de ambos péptidos han demostrado una mayor diuresis, natriuresis y cambios hemodinámicos importantes, cuyos potenciales terapéuticos están en investigación.
El péptido natriurético cerebral se logró sintetizar con tecnología recombinante: Nesiritide, y es un fármaco aprobado por la FDA para el tratamiento de la insuficiencia cardíaca descompensada con importantes ventajas sobre el tratamiento convencional y cuyos beneficios están todavía en investigación.
Referencias
1. Levin Ellis R, Gardner David G., Samson Willis K. Natriuretic Peptides, N Engl J Med 1998, 339: 321-328. [ Links ]
2. Bonow Robert O, New Insights Into the Cardiac Natriuretic Peptides Circulation. 1996;93:1946-1950. [ Links ]
3. Schrier RW, Abraham WT. Hormones and Hemodynamics in Heart Failure. N Engl J Med 1999; 341 (8): 577: 585.
4. Koller KJ, Goeddel DV. Molecular biology of the natriuretic peptides and their receptors. Circulation. 1992; 86: 1081-1088. [ Links ]
5. Raine AEG, Phil D, Erne P, Burgisser E, Muller FB, Bolli P, Burkart F. et al. Atrial natriuretic peptide and atrial pressure in patients with congestive heart failure. N Engl J Med. 1986; 315: 533-537 [ Links ]
6. Yoshimura M, Yahue H, Okumura K, Ogawa H, Jougasaki M, Mukoyama M, et al. Different secretion patterns of atrial natriuretic peptide and brain natriuretic peptide in patients with congestive heart failure. Circulation. 1993; 87: 464-469. [ Links ]
7. Yasue H, Yoshimura M, Sumida H, Kikuta K, Kugiyama K, Jougasaki M, et al. Localization and mechanism of secretion of B-type natriuretic peptide in comparison with those of A-type peptide in normal subjetcts and patients with heart failure. Circulation. 1994; 90: 195-203. [ Links ]
8. Yoshimura M, Yasue H, Morita E, Sakaino N, Jougasaki M. Kurose M, et al. Hemodynamic, renal, and hormonal responses to brain natriuretic peptide infusion in patients with congestive heart failure. Circulation. 1991; 84: 1581-1588. [ Links ]
9. Wada A., Tsutamoto T, Matsuda Y, Kinoshita M. Cardiorenal and neurohormonal effects of endogenous atrial natriuretic peptide in dogs with severe congestive heart failure using a specific antagonist for guanylate cyclase-coupled receptors. Circulation. 1994; 89:2232-2240. [ Links ]
10. Lerman A, Gibbons RJ, Rodeheffer RJ, Bailey KB, McKinley LJ, Heublein DM, et al. Circulating N-terminal atrial natriuretic peptide as a marker for symptomless left-ventricular dysfunction. Lancet. 1993; 341: 1105-1109. [ Links ]
11. Swedberg K, Eneroth P, Kjekshus J, Wilhelmsen L, for the CONSENSUS Trial Study Group. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. Circulation. 1990; 82: 1730-1736. [ Links ]
12. Hall C, Rouleau JL, Moye L, de Champlain J, Bichet D, Klein M, et al. N-terminal proatrial natriuretic factor: an independent predictor of long-term prognosis after myocardial infarction. Circulation, 1994; 89: 1934-1942. [ Links ]
13. Wang TJ, Larson MG, Levy D, Leip EP, Benjamin EJ, Wilson PWF et al. Impact of Age and Sex on Plasma Natriuretic Peptide Levels in Healthy Adults. Am J Cardiol 2002; 90: 254-258. [ Links ]
14. Saito Y, Nakao K, Nishimura K, Sugawara A, Okumura K, Obata K, et al. Clinical application of atrial natriuretic polypeptide in patients with congestive heart failure: beneficial effects on left ventricular function. Circulation. 1987: 76: 115-124 [ Links ]
15. Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, Omland T, et al. Rapid Measurement of B-type Natriuretic Peptide in the Emergency Diagnosis of Heart Failure. N Engl J Med; 2002; 347 (3): 161-167. [ Links ]
16. Harrison A, Morrison lLk, Krishnaswamy P et al. B-type natriuretic peptide predicts future cardiac events in patients presenting to the emergency department with dysnea. Ann Emerg Med 2002; 39: 131-8. [ Links ]
17. Tsutamoto T, Wada A, Maeda K, Hisanaga T, Maeda Y, Fukai D et al., Attenuation of Compensation of Endogenous Cardiac Natriuretic Peptide System in Chronic Heart Failure. Prognostic Role of Plasma Brain Natriuretic Peptide Concentration in Patients With Chronic Symptomatic Left Ventricular Dysfunction. Circulation 1997; 96:509-516. [ Links ]
18. Yamamoto K, Burnett JC, Jougasaki M. Superiority of brain natriuretic peptide as a hormonal marker of ventricular systolic and diastolic dysfunction and ventricular hypertrophy. Hypertension. 1996; 28: 988-994 [ Links ]
19. Vrtovec B, Delgado R, Zewail A, Thomas C, Richartz B, Radovanevic B. Prolonged QTc Interval and High B-Type Natriuretic Peptide Levels Together Predict Mortality in Patients UIT Advanced Herat Failure. Circulation. 2003; 107: 1764-1769. [ Links ]
20. De Lemos JA, Morrow DA, Bentley JH, Omland T, Sabatine M, McCabe C et al. The Prognostic Value of B-Type Natriuretic Peptide in Patients with Acute Coronary Syndromes. N Engl J Med; 2001; 345: 1014-1021 [ Links ]
21. Morita E, Yasue H, Yoshimura M, Ogawa H, Jougasaki M, Matsumura T, et al. Increased plasma levels of brain natriuretic peptide in patients with acute myocardial infarction. Circulation. 1993; 88: 82-91. [ Links ]
22. Omland T, Aakvaag A, Bonarjee VVS, Caidahl K, Lie RT, Nielsen DWT, et al. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction: comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide. Circulation. 1996; 93: 1963-1969. [ Links ]
23. Motwani JG, McAlpine H, Kennedy N. Struthers AD. Plasma brain natriuretic peptide as an indicator for angiotensin-converting-enzyme inhibition after myocardial infarction. Lancet. 1993; 341: 1109-1113. [ Links ]
24. Richards M, Nicholls G, Espiner E, Lainchbury J, Troughton R, Elliot J et al. B-Type Natriuretc Peptides and Ejection Fraction for Prognosis After Myocardial Infaction. Circulation. 2003; 107: 2786-2792. [ Links ]
25. Wolde T, Tulevski I, Mulder J, Söhne M, Boomsma F, Mulder B, Büller H. Brain Natriuretic Peptide as a Predictor of Adverse Outcome in Patients With Pulmonary Embolism. Circulation 2003; 107: 2082-2084. [ Links ]
26. Kucher N, Printzen G, Doernhoefer T, Windecker S, Meier B, Martin O. Low Pro-Brain Natriuretic Peptide Levels Predict Benign Clinical Outcome in Acute Pulmonary Embolism. Circulation 2003; 107: 1576-1578. [ Links ]
27. Kucher N, Printzen G, Goldhaber S. Prognostic Role of Brain Natriuretic Peptide in Acute Pulmonary Embolism. Circulation 2003; 107:2545- 2547. [ Links ]
28. Marcus LS, Hart D, Packer M, Yushak M, Medina N, Danziger R et al. Hemodynamic and Renal Excretory Effects of Human Brain Natriuretic Peptide Infusion in Patients With Congestive Heart Failure. Circulation. 1996; 94: 3148-3189. [ Links ]
29. Mills RM, Hobbs RE, Young JB. "BNP" for Heart Failure: Role of Nesiritide in Cardiovascular Therapeutics. CHF 2002, 8 (5): 270-273. [ Links ]
30. Colucci WS, Elkayam U, Horton DP. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated heart failure. N Engl J Med. 2000; 343: 246-253. [ Links ]
31. Michaels AD, Klein A, Madden J, Chatterjee K. Effects of Intravenous Nesiritide on Human Coronary Vasomotor Regulation and Myocardial Oxygen Uptake. Circulation. 2003; 107: 2697-2701. [ Links ]
32. Mills RM, Le Jemtel TH, Horton DP.Sustained Hemodynamic effects of an infusion of nesiritide (human B-type natriuretic peptide) in heart failure: a randomized, double blind; placebo-controlled clinical trial. Natrecor Study Group. Am Coll Cardiol. 1999; 34 (1): 155-162. [ Links ]
33. Hobbs Re, Miller LW, Bott-Silverman C et al. Hemodynamic effects of a single intravenous injection of synthetic human brain natriuretic peptide in patients with heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 1996; 78: 896-901. [ Links ]
34. Abraham WT, Lowes BD, Ferguson Da et al. Systemic hemodynamic, neurohormonal, and renal effects of a steady-state infusion of human brain natriuretic peptide in patients with hemodinamically decompensated heart failure. J Card Fail. 1998; 4: 37-44. [ Links ]
35. Mills RM, Le Jemtel TH, Horton DP et al. Sustained hemodynamic effects of an infusion of nesiritide (human B-Type natriuretc peptide) in heart failure. J Am Coll Cardiol. 1999; 34: 155- 162. [ Links ]
36. Publication committee for the VMAC Investigators (Vasodilatation in the Management of Acute Congestive Heart Failure). Intravenous nesiritide versus nitroglycerin for the treatment of decompensated congestive heart failure. A randomized controlled trial. JAMA 2002; 287:1531-1540. [ Links ]
37. Burger AJ, Elkayam U, Neibaur MT. Comparison of the occurrence of ventricular arrhythmias in patients with acutely decompensated congestive heart failure receiving dobutamine versus nesiritide therapy. Am J Cardiol. 2002; 88: 35-39. [ Links ]
38. Kayser Steven R. The Use of Nesiritide in the Managment of Acute Decompensated Heart Failure. Considerations in Drug Therapy. Prog Cardiovasc Nurs 2002. 17 (2): 89-95. [ Links ]
39. Kitzman DW, Higginbotham MB, Cobb FR, Sheikh KH, Sullivan MJ. Exercise intolerance in patients with heart failure and preserved left vetnricular systolic function: failure of the Frank-Starling mechanism. J Am Col Cardiol. 1991; 17: 1065-1072. [ Links ]
40. Cuocolo A, Sax FL, Brush JE, Maron BJ, Bacharach SL, Bonow RO. Left ventricular hypertrophy and impaired diastolic filling in essential hypertension: diastolic mechanisms for systolic dysfunction during exercise. Circulation. 1990; 81: 978-986 [ Links ]
41. Clarkson PBM, Wheeldon NM, MacFadyen RJ, Pringle SD, MacDonald TM. Effects of brain natriuretic peptide on exercise hemodynamics and neurohormnes in isolated diastolic heart failure. Circulation. 1996; 93:2037-2042. [ Links ]
* Universidad Interamericana (UNIBE),
** Asistentes del Servicio de Cardiología del Hospital Max Peralta, C.C.S.S., Cartago, Costa Rica.














