Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.3 n.3 San José Dec. 2001
Generalidades
La homocisteína es reconocida actualmente como un nuevo factor de riesgo independiente de aterotrombosis. (1)
Es una sustancia derivada del metabolismo intermedio de la metionina, aminoácido esencial de la dieta el cual se encuentra en mayores concentraciones en banano, cereales como arroz, maíz, guisantes y pescado.
La dosis recomendada para ingerir en la dieta es de 0.9g/día y el consumo promedio en USA es de 2 g/día. (2)
La elevación de la homocisteína en sangre es multifactorial, se puede deber a diferentes causas como una elevada ingesta de metionina, una reducción en el metabolismo, una alteración genética o debida a medicamentos. (2)
Dentro de las causas de alteraciones genéticas asociadas a la Hiperhomocisteinemia están alrededor de 60 mutaciones en los genes que participan en su vía metabólica dentro de las principales están:
1-) Cistationin-a B-sintetasa ( 17 mutaciones identificadas) ( 3)
2-) 5, 10 metilenotetrahidrofolato reductasa con dos variantes principales:a- enzima termoestable (9 mutaciones indetificadas) ( 3)
b- enzima termolábil (1 mutación identificada)3-) Methiltetrahidrofolato - homocisteína methiltransferasa (sintetasa de metionina) ( 3)
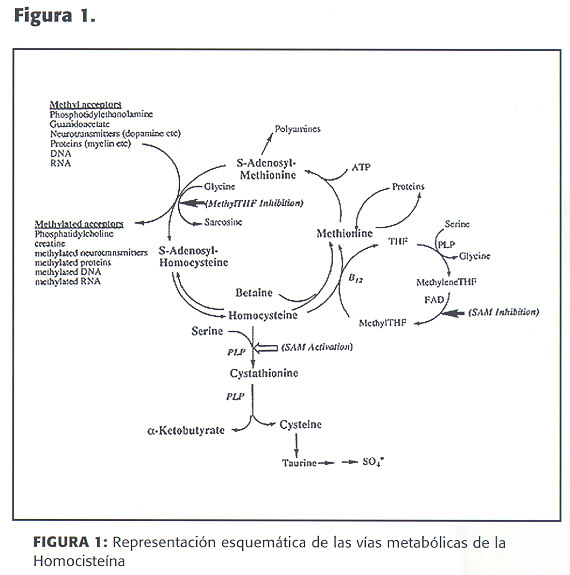
La deficiencia de la primera se asocia a luxación de cristalino, la cual puede cursar con glaucoma agudo con disminución de la agudeza visual, retardo mental y la aparición de eventos trombóticos o arteriosclerosis temprana(32).
Esta mutación esta localizada en el cromosoma 21 y se hereda en forma autosómica recesiva, la prevalencia es de 1/200.000- 300.000, en su forma homocigota produce valores marcadamente elevados de hasta 400 umol/L, produciéndose la excresión en la orina, denominada homocistinuria(11,12).
La relación entre la xistencia de hiperhomocisteinemia y el desarrollo de trombosis fue propuesta hace más de 25 años por Mc Cully, el cual demostró una relación consistente entre la hiperhomocisteinemia y la enfermedad vascular arteriosclerótica(9,10)
La deficiencia de la 5-10 metilenotetrahidrofolato reductasa, donde se han descrito hasta 14 mutaciones poco comunes, todas ellas causantes de alteraciones en la actividad enzimática. Lo que produce una reducción marcada de 5-metitetrahidrofolato necesaria para la conversión de homocisteína a metionina, dando lugar a la hiperhomocisteinemia. Las mutaciones de esta enzima descritas hasta el momento, tienen diferentes alteraciones, sean termoestables y termolábiles y presentan diferentes cambios en la secuencia de aminoácidos.
Una de estas variantes es la descrita por Kang (1988), la cual se considera una mutación común para el gen de esta enzima, que tiene la particularidad de ser una variante con menos del 50% de actividad a 37° C y termoestabilidad disminuída a 46° C en relación a la enzima normal (34). Es una mutación puntual (C677T), que provoca la sustitución de una valina por una alanina. Esta variante se hereda de forma autosómica recesiva, su frecuencia de homocigosis entre grupos caucásicos es de 5 al 15%, del 1,4% en americanos de origen africano, y en nuestro país se describe una prevalencia del 23% en la población general y de hasta un 44,7% en grupos indígenas autóctonos (33).
Un hecho importante es el aporte de Frosst et al. (1995) señala en homocigotos de esta variante niveles de homocisteína dos veces mayores en relación con individuos no portadores(28). Estudios recientes demuestran que las concentraciones de homocisteína plasmática en homocigotas están relacionados con niveles de folato y vitamina B12, otras investigaciones internacionales han discutido su posible asociación con incremento del riesgo de enfermedad coronaria prematura(26,27,28,29,30,31).
Con relación a la alta frecuencia de homocigosidad para esta variante en la población general y en los pacientes con enfermedad arteriocoronaria, su detección podría ser de importancia para la medicina preventiva, aunque algunos autores no consideran esta variante los suficientemente significativa como factor de riesgo independiente (33).
Los mecanismos por los cuales la homocisteína produce arteriosclerosis y eventos trombóticos están bien estudiados aunque todavía no están todos los responsables elucidados:
Mecanismos posibles de daño endotelial
5-A causa de la unión de trombina a trombomodulina cambia la formación del anticoagulante Proteína C e inhibe la activación de trombina con fibrinógeno (23,24,25).
6-El déficit de trombomodulina cambia la formación de fibrina (29,30). Todos estos eventos efectivamente cambian el balance de sustancias coagulantes y anticoagulantes y se produce un aumento en el consumo de Antitrombina III razón por la cual estas sustancias pueden encontrarse disminuídas en la sangre de los pacientes(29,30).
7-A nivel de endotelio, la hiperhomocisteinemia produce una disminución en la producción de óxido nítrico lo que puede inducir espasmo coronario en estos pacientes y se alteran también los otros papeles del óxido nítrico a nivel cerebral y gástrico (29,30).
8-Además la homocisteína produce engrosamiento de las células del músculo liso vascular.(4).
9-Disminuye la producción de la proteína S anticoagulante natural la cual al darse tratamiento con suplementos vitamínicos pueden retornar a sus niveles normales(29,30).
Un hallazgo importante de anotar en las investigaciones que se están llevando a cabo en nuestros enfermos coronarios es que los valores de vitamina B12 se encuentran marcadamente bajos, aún con dietas normales.
Lo cual nos indicaría que el paciente puede tener una deficiencia de factor intrínseco asociado.
Es importante al hablar de homocisteína y sus co-factores el ácido fólico y la Vitamina B 12 y del papel que juegan estas sustancias en el organismo.
Recordemos que la deficiencia de alguna de éstas vitaminas puede llegar a desarrollar anemia de tipo megaloblástica entre un 20 y 40 % de todos los enfermos con deficiencia y se dice en algunos artículos que la anemia es un estadio muy avanzado de la enfermedad.
Hoy en día se sabe que parte de las deficiencias de B12 no se van a manifestar como anemia megaloblástica, sino que se presentarán como trastornos inespecíficos de cansancio, dolores musculares, parestesias, mareos o de fenómenos trombo embólicos y enfermedad coronaria, etc.
La dieta que recomienda la Asociación Americana del Corazón para el tratamiento de la Hiperhomocisteinemia es a base de cítricos, tomates, vegetales y los productos integrales basándose en granos y fibra. (16)
Cabe señalar que dentro de los alimentos que más concentración de ácido fólico tienen están el jugo de naranja, los cereales cada uno con 100 ug, la lechuga (1 taza) 98 ug, espinaca 82 mcg y la vitamina B6 se encuentra en mayores concentraciones en los cereales con 50 ug. (15)
La dosis recomendada de consumo diario de ácido fólico son 180 ug, pero la capacidad máxima de absorción del ácido fólico por la mucosa gástrica es de 400ug. Para los pacientes que tienen deficiencias enzimáticas las recomendaciones de ingesta varían de un estudio a otro y todavía no se tiene estandarizada la dosis correcta.
Se debe recordar que dentro de las características propias de estas vitaminas es que son termo-sensibles lo que hace que al recalentarse los alimentos demasiado, se desnaturalizan, la otra es que su estructura molecular también se ve afectada por el uso del microondas.
Por esto la FDA ( Food Drugs Administration, USA ) implementó la fortificación de ésta vitamina en los alimentos desde 1998 como política de prevención para reducir los ataques cardíacos (31).
El ácido fólico se encuentra en el mercado farmacéutico en dos presentaciones de 1 mg y de 5 mg y también se encuentran la presentación de ácido folínico en 1000ug.
Los pacientes que definitivamente necesitan suplementos de ácido fólico son aquellos que estén bajo tratamiento con los siguientes fármacos: Fenitoína (interactua con el metabolismo del ácido fólico y puede causar moderada hiperhomocisteinemia), (16,17), ácido valproico, ciclosporina, primidona, barbitúricos y methotrexate que depletan el folato y el co-sustrato para la metionina sintetasa causando elevaciones transitorias de la Homocisteína (16,17).
El Hospital San Juan de Dios, C.C.S.S., San José, Costa Rica, tiene el siguiente protocolo de manejo de estos enfermos:
A su ingreso en la Unidad Coronaria se miden los factores de riesgo clásico y los niveles de homocisteína, de ácido fólico, la vitamina B12 y sobre la base de los resultados se restituyen.
Siempre restituir vitamina B12 primero, usando el siguiente esquema:
Dosis de impregnación abarca el uso de 2.000 ug día por medio 5 dosis vía Intramuscular, luego 2.000 ug por semana 5 dosis IM y luego 2.000 ug por mes si el nivel de B12 fue menor de 200 mg. Al completar el primer mes se administra el ácido fólico a una dosis de 1mg por día como tratamiento continuo.
Para el ácido fólico usamos la presentación en tabletas de 1 mg con un control al mes de tratamiento, si el nivel no se ha normalizado cambiamos a la administración de ácido polínico.
Las precauciones que se deben tener al administrar la vitamina B 12 en estos enfermos es la suspensión de los diuréticos y asegurarse una adecuada administración de alimentos con potasio pues se pueden dar arritmias por hipopotasemia.
En el seguimiento de los pacientes con deficiencia de B 12 se les realiza un control de niveles cada 6 meses, si comprobamos que después de hacer la impregnación se mantiene normal pasamos a suplementos vitamínicos orales.
Se considera que en las mutaciones genéticas el tratamiento de suplementos vitamínicos debe ser constante.
Conclusión
Este nuevo factor de riesgo parece ser importante dentro de las enfermedades cardiovasculares sobre todo que puede resultar tan dañino como otros factores de riesgo, lo importante de recordar es que se puede prevenir con una dieta balanceada, y el cuidado de no prescribir medicamentos que puedan aumentar los niveles de homositeína en los pacientes coronarios.
Referencias
1.Franklin H. Epstein, et al. Homocysteine and aterothrombosis N Engl J Med.41-14: 9 1998. [ Links ]
2A.EllenL.Mayer et al. Homocysteine and Coronary Atherosclerosis. JACC Vol 27. No 3 March, 1996:517-27. [ Links ]
2B.Ueland PM, Refsum H, Brattstrom L Plasma homocysteine and cardiovascular disease. In: Francis R B Jr. editor. Atheroscletotic Cardiovascular Disease, Hemostasis, and Endothelial Function. New York: Marcel Delker, 1992:183-236. [ Links ]
3.Susan C. Guba, et al Hyperhomocysteinemia Am J Clin Pathol 1996;105:709-722. [ Links ]
4.Fonseca V. Guba SC, Fink LM: Hyperhomocysteinemia and the endocrine system: Implicationes for atherosclerosis and trhobosis. Endocrine Rev 1999,20:738-756. [ Links ]
Selhub J, Jacques P F, Bostom AG, et al. Association between plasma homocysteine concentrations and extracranial carotid-artery stenosis. N Engl J Med 1995; 332:286-91.
5.Mudd S H,Skovby F,Levy Hl,et al. The natural History of homocystinuria due to cystathionine B- synthase deficiency. IS J Hum Genet 1985, 37:1-31? [ Links ]
6.Ueland PM,Refsum H,Stabler S P, Malinow MR,Andersson A, Allen RH. Total homocysteine in plasma or serum: methods and clinical applications, Clin Chem 1993;39:1764-79. [ Links ]
7.Finkelstein JD,Martin JJ, Harris BJ.Methionine metabolism in mammals: the methionine-sparing effect of cysteine. J Biol Chem 1998; 263:11750-43 [ Links ]
8.Brattstrom LE, Israelsson B; Jeppsson Jo, Hultberg BL. Folic acid an innocuous means to reduce plasma homocysteine. Scand J Clin Lab Invest 1988; 48:215-21. [ Links ]
9.McCully KS. Vascular pathology of Homocysteine: implications for the pathogenesis of arteriosclerosis. Am.J.Pathol 1969; 56:111-128. [ Links ]
10- McCully KS. Homocysteine and vascular disease Nature Med 1996; 2,386-389. [ Links ]
11.Malinow MR,Bostom AG, Krauss RM. Homocysteine,Diet and Cardiovascular Disease. Circulation 1999;99: 178-182. [ Links ]
12.Hankey GJ, Eikelboom J. Homocysteine and vascular disease Lancet 1999; 354:407-413. [ Links ]
13.Saltzman E, Mason JB, Jacques Pf, et al. B vitamin supplementation lowers homocysteine levels in heart disease. Scand J Clin Lab Invest 1988;48:215-21 [ Links ]
14.Wenstrom KD, Johaninng GL, Johston KE, Du Bard M. Association of the C/T methylenetetrahydrofolate reductase mutation and elevatedhomocysteine levels with congenital cardiac malformations. Am J Obstet Gynecol 2001 Apri; 184 (5): 806-12.121- [ Links ]
15.Van der Put NM, van Straaten HW, Trijbels FJ, Blom HJ. Folate, homocysteine and neural tube defects: an overview. Exp Biol Med (Maywood) 2001 Aphri; 226(4): 243-70. [ Links ]
16.Raijmakers Mt, Zusterzeel PL, Steegers EA, Peters WH. Hyperhomocysteinemia: a risk factor for preeclampsia? Eur J Obstetric Gynecology Report Biol 2001 Apr; 95 (2): 226-8 [ Links ]
17. Solomon H. Snyder y David S. Bredt. Funciones Biológicas del Oxido Nítrico. Investigación y Ciencia 1992 Julio; 12-20. [ Links ]
18. Walter Alexander. Recomendaciones de la Asociación Americana del Corazón sobre dietas y vitaminas para pacientes con alto nivel de Homocisteína.Cardiology Today, Vol2 N02 Febrero 1999;25. [ Links ]
19. Lena Bennet.Folic Acid and B6 for Herat Health . Health News The New England Journal of Medicine March /April 1998; 3-4. [ Links ]
20.Ueland PM, Refsum H. Plasma Homocysteineine, a risk factor fon vascular disease : plasma levels in health, disease, and drug therapy, J lab Clin Med 1989;114:473-501. [ Links ]
21.Ueland PM,Refsum H, BrTTSTROM l. plasma homocysteine and cardiovascular disease. In : Francis R B Jr,ed. Atherosclerotic cardiovascular disease, hemostasis, and endothelial funtion. New York: Marcel Dekker,1992:183-236. [ Links ]
22.Cohen HJ, Weinstein Wm, Marin –Sorensen M. et al:
Heterogeneous gastric status in food-cobalamin malabsorption: Some patients have normal acid secretion and gastric histology Am J Clin Nutr 66:206,1997 (abstr)
23.Stamler JS,Osborne JA, Jaraki O, Rabbani LE, Mullins M, Singel D, Loscalzo J Adverse Vascular Effects of Homocysteine are modulated by endothelium-derived Relaxing factor and Related Oxide of Nitrogen . J Clin Invest , 1993 :91,308-318. [ Links ]
24.Welch GN,Upchruch GR, Loscalzo J. Homocysteine; Oxidative Stress and Vascular Disease . Hosp Pract 1997 :Jun;81-92. [ Links ]
25.Kraus JP Molecular basis of phenotype expression in homocysteinuria J Inherit Metab Dis 1994:17; 383-390. [ Links ]
26.Erbe RW. Generic aspects of folate metabolism. Advances in Human genetics 1979 293-354 New York Plenu ,1979. [ Links ]
27.Rossenblatt DS. Inherited disorders of folate transport and metabolism. The Metabolic and Molecular Bases of Inherited Disease. New York Mc GrawHill Inc.1995; 3111-28 [ Links ]
28.Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Matthewes RG, Roers GJH; den Heijer M, Kluijtmans LAJ, van den Heuvel LP, Rozen R. A candidate genetic risk factors for vascular disease a common mutation in methylenetetrahydrofolate reductasa. Nature Genetics 1995; 10:111-113 [ Links ]
29.Fonseca V. Guba SC,Fink LM: Hyperhomocysteinemia and the endocrine system: Implications for artherosclerosis and thrombosis. Endocrine Rev 1999, 20: 738-759 30. [ Links ]Tawakol A, Omland T, Gerhard M, y cols: Hyperhomocysteinemia is associlated with impaired endothelium-dependent vasodilation in humans. Circulation 1997, 95: 1119-1121. [ Links ]
31.Jeffey A. Tice, MD , Elizabeth Ross et al Cost-effectiveness of Vitamin Therapy to Lower Plasma Homocysteine Levels for the Prevention of Coronary Heart Disease. Jama 2001:286:936-943. [ Links ]
32.Salazar, L. Inhibidores Naturales de la Coagulación, Anticuerpos Antifosfolipídicos y Factores Genéticos Moleculares en la Enfermedad Trombótica. Tesis de Maestria, Sistema de Estudios de Posgrado, Universidad de Costa Rica.2000: 17-42 [ Links ]
33.MA J, Stamfer MI, Heennekens CH, et a. Methylenetetrahydrofolate reductase polymorphism, plasma folate, homocysteine, and risk of myocardial infarction in US physicians, Circulation 1996: 94: 3074-8 [ Links ]
34.Kang SS, Zhou J, Wong PWK, Kowaslisyn J, Strokosch G. Intermediate homocysteinemia: a thermolabile variant of methylenetetrahydrofolate reductase. Am J.Hum Genet 1988 43:414-421 [ Links ]
35.Kluijtmans LA, Vam dem Heurel LP. Boers GH y cols: Molecular generic analysis in mild hyperhomocysteinemia: a common mutation in the methylenetetrahydrofolate reductase gene is a genetic risk factor for cardiovascular disease. Am J.Hum Genet 1996 58:355-341 [ Links ]
* Servicio de Cardiología. Hospital San Juan de Dios, C.C.S.S., San José, Costa Rica
** Universidad de Costa Rica, lsalazar@cariari.ucr.ac.cr














