Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Pediátrica Costarricense
Print version ISSN 1409-0090
Acta pediátr. costarric vol.18 n.1 San José Jan. 2004
Manejo del dolor en el paciente oncológico
Carlos Rodríguez 1, José Carlos Barrantes 2, Gabriela Jiménez 3, Vladimir Putvinski 4
1 Pediatra Asistente Servicio de Oncología,
2 Jefe Servicio de Oncología,
3 Médico Residente de Pediatria
4 Médico General
Dirección: Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera", Tel: 839-0951, Correo electrónico: carlosro2@hotmail.com
Acta Pediátrica Costarricense 2004, volumen 18, número 1.
"Calmar el dolor siempre, consolar a veces y curar cuando se puede" Hipócrates de Cos, 500 a. C.
El cáncer es una de las principales causas de muerte por enfermedad en los niños de 1 a 14 años. Por cada millón de niños menores de 14 años, aproximadamente 130 se enferman de cáncer cada año. En el curso de su enfermedad, casi todos los niños con cáncer experimentan algún dolor, ya sea producido directamente por la enfermedad, por procedimientos invasivos, tratamientos o aflicción psíquica( 1 ). Aunque existen medios eficaces para aliviarlo, es muy frecuente que el dolor en niños no se reconozca, o que una vez reconocido no se trate de forma adecuada. Se ha reportado carencia de capacitación en pediatras oncólogos en el manejo del dolor( 2 ).
Los niños con cáncer no tienen por qué sufrir dolor sin alivio. El tratamiento eficaz del dolor y los cuidados paliativos están entre las principales prioridades del programa de lucha contra el cáncer de la Organización Mundial de la Salud (OMS), al lado de la prevención primaria, el diagnóstico precoz y el tratamiento del cáncer ( 3 ). El tratamiento del dolor debe comenzar cuando se diagnostica al niño con cáncer y proseguir durante todo el curso de la enfermedad(4). Las terapias con analgésicos y anestésicos son esenciales para controlar el dolor y deben complementarse con los aspectos psicosociales, físicos y de apoyo( 5 ).
Dolor
La Asociación Internacional para el Estudio del Dolor lo define como "una experiencia desagradable sensorial y emocional que se asocia a una lesión actual o potencial de los tejidos o que se describe en función de dicha lesión". El dolor es siempre subjetivo; cada persona aprende a aplicar la palabra a través de experiencias en los primeros años de vida. Es incuestionable que el dolor físico es una sensación desagradable en una o más partes del cuerpo, por lo tanto es también una experiencia emocional. El dolor altera el afecto del paciente, deseo de vivir, relaciones familiares, vida social, sueño, apetito, espiritualidad y habilidad para participar en actividades físicas; ya sea para el cuidado de si mismo o recreación. Cuando no se trata, el dolor puede causar la muerte emocional y espiritual del paciente mucho antes de la muerte biológica ( 6 ).
A menudo en oncología y cuidados paliativos se menciona el dolor asociado con cáncer como un dolor maligno y lo diferencian de los otros tipos de dolor agudo o crónico. Aunque la enfermedad metastásica tiene algunas características únicas, tales como la progresión, síndromes de dolor iatrogénico (ej. dolor neuropático postirradiación) y su potencial de ser letal, se cree que el dolor que sufren los pacientes oncológicos tiene las mismas cualidades que tienen los dolores agudos, crónicos o recurrentes y no debe considerarse como un dolor especial ( 7 ).
Nocicepción consiste en la activación, a través de la energía térmica, mecánica o química, de las terminaciones nerviosas especializadas que traducen la información del daño en los tejidos al sistema nervioso central. Por otra parte, el dolor es una percepción subjetiva que es resultado de transducción, transmisión y modulación de información sensorial filtrada por la composición genética de la persona, su educación y atenuada por el estatus fisiológico actual, respuesta idiosincrásica, las expectativas, el estado de ánimo y el ambiente sociocultural ( 8 ). Por lo tanto, el alivio de dolor no es simple tratamiento del dolor sino tratamiento de una persona con dolor.
Los tipos de dolor en los niños con cáncer se dividen en las siguientes categorías: dolor producido por el propio cáncer, por los tratamientos y procedimientos diagnósticos o terapéuticos invasivos, así como dolor incidental debido a otras causas ( 9 ) (Tabla Nº1).
Alivio del dolor en cáncer infantil
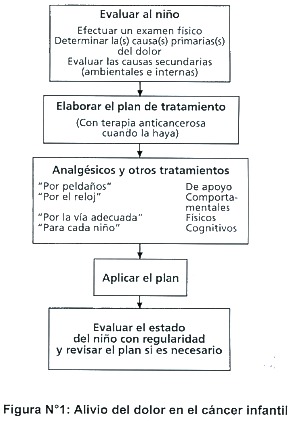
Por su carácter complejo, el dolor del cáncer infantil se debe tratar dentro de un contexto amplio, y para ello suelen ser útiles los conocimientos especializados de diferentes disciplinas. La asistencia completa al cáncer infantil abarca no sólo el tratamiento activo de la enfermedad sino también intervenciones farmacológicas y no farmacológicas orientadas a reducir el dolor y el sufrimiento ( 5 ) (Figura Nº1).
Evaluación del dolor
La evaluación adecuada del dolor constituye la base de su tratamiento eficaz. Las normas básicas de la evaluación del dolor en los niños con cáncer establecidos por OMS( 5 ) son:
EVALUAR. Evaluar siempre el posible dolor del niño con cáncer. Los niños pueden experimentar dolor aunque no sean capaces de expresarlo con palabras.
LOCALIZAR. Considerar el dolor como parte sustancial del examen físico. Dicho examen debería incluir un repaso completo de todas las zonas del cuerpo en busca de posibles puntos dolorosos.
CONTEXTUALlZAR. Considerar el impacto de factores como la familia, la asistencia sanitaria y el ambiente en el dolor del niño.
DOCUMENTAR. Anotar periódicamente la intensidad en el niño. Emplear una escala de dolor que sea sencilla y apropiada tanto para el nivel de desarrollo del niño como para el contexto cultural en el que se aplica.
VALORAR. Valorar la eficacia del tratamiento del dolor a intervalos regulares y modificar el plan de tratamiento según sea necesario hasta que se logre aliviar o minimizar el dolor del niño.
La focalización, cualidad, intensidad y duración del dolor deben verse como importantes signos vitales, ya que los cambios en el dolor de los niños pueden constituir una señal de cambio en el proceso de la enfermedad. Esta valoración debe ser continua, porque el proceso de la enfermedad y los factores que influyen en el dolor varían a lo largo del tiempo. La valoración del dolor se realiza utilizando varios medios, como por ejemplo los autoinformes del dolor por parte del equipo médico y los padres del niño, evaluaciones fisiológicas y la observación directa( 5, 10 ).
Los niños menores de seis años sólo saben describir la magnitud general del dolor que sienten, mientras los de más edad saben también describir otros aspectos como: intensidad, carácter, localización, duración y sus variaciones en el tiempo( 11 )
Medidas conductuales
La observación directa se ha centrado en conductas de vocalizaciones, gestos faciales, respuestas motoras, postura corporal y apariencia. En estos parámetros se basan diferentes escalas que se utilizan para los niños menores de 4 años( 5 ) (Tabla Nº2).
Autoinformes
Las medidas de autoinformes son comunicaciones de la experiencia que se basan en el concepto de percepción del dolor en forma subjetiva. Los niños hacia los 3 años de edad pueden proporcionar medidas de autoinforme utilizando palabras, números, dibujos, etc., para indicar cuánto dolor sienten ( 12 ).
La escala visual analógica (VAS - visual analogue scale) consiste en una línea de 10 cm con anclajes en ambos extremos que representan "nada de dolor" y "el máximo dolor posible". El niño marca en la línea la cantidad del dolor que siente. Para aplicación de esta escala, se requiere que el niño entienda el concepto de proporcionalidad, por lo que los niños de 3 y 4 años pueden tener dificultades en comprender los requisitos de este autoinforme( 12 ). La Escala Analógica Coloreada (Coloured Analogue Scale, CAS) es una de las últimas modificaciones de la VAS, a la que se ha añadido color variable según la intensidad del dolor y se le ha dado forma triangular, recomendándose su aplicación a niños mayores de 5 años. Otras modificaciones de escalas análogas son escalas de descriptores verbales o escalas de valores numéricos( 13 ).
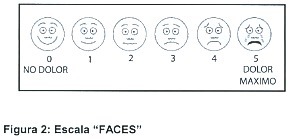
La escala "FACES" (caras) muestra una serie de caras, normalmente dibujadas, ordenadas con una intensidad creciente desde "nada de dolor" hasta "el máximo dolor posible" (Figura 2). Cuando se presenta una escala FACES, se le pide al niño que señale la cara que mejor muestra cuánto dolor está experimentando en ese momento. Beyer desarrolló el Oucher, que se utiliza en niños de 3 a 12 años y representa fotografías de un niño con seis grados progresivos de dolor, que van desde 0 para una cara tranquila, hasta 100 para una cara gritando y en actitud retraída. Se piensa que entienden mejor las escalas FACES que otros instrumentos, ya que no tienen que traducir su experiencia de dolor a un valor numérico, por lo que se han utílizado en niños mayores de 3 años( 14 )
Medidas fisiológicas
Las variables fisiológicas que se han estudiado hasta el momento son: frecuencia cardiaca, tono vagal, frecuencia respiratoria, presión arterial, sudor palmar, saturación de oxígeno, tensión transcutánea de dióxido de carbono y presión intracraneal. Lamentablemente los resultados obtenidos en diversas investigaciones indican que las respuestas fisiológicas no son únicas ni específicas del dolor, por lo que los indicadores fisiológicos deben utilizarse solamente con autoinformes y con medidas conductuales para determinar cuando el niño tiene dolor( 15 ).
Terapia no farmacológica
Las terapias no farmacológicas forman parte integral del tratamiento del dolor en el niño con cáncer, empezando en el momento del diagnóstico y prosiguiendo durante todo el tratamiento( 16,17,18 ). Se pueden clasificar en las categorías de terapias de apoyo, cognitivas, conductuales o físicas( 5 ). (Tabla Nº 3)
Con los métodos de apoyo se pretende fomentar la buena asistencia psicosocial a los niños. Su primer principio es que esa asistencia tiene su foco en la familia. En la mayoría de los casos son los padres quienes mejor conocen a sus hijos, y por lo tanto pueden ser participes en el tratamiento, pero quizá haya que enseñarles a hacer frente al dolor y la ansiedad del niño. En todo el mundo se emplean técnicas de disminución del dolor o remedios tradicionales propios de cada cultura, que reflejan la sabiduría tradicional, los lazos de unión y confianza de la familia y las sanciones sociales de la comunidad. Es importante respetar esas prácticas, determinar su compatibilidad con el tratamiento y no herir los sentimientos de la familia( 20 ).
Con los métodos cognitivos de tratamiento se pretende influir en los pensamientos y la imaginación del niño. Con frecuencia los padres son muy hábiles en el empleo de esos métodos porque conocen las preferencias de sus hijos. Es importante distraer activamente la atención del niño: cuanto más inmerso llegue a estar en una actividad, más distraído estará del dolor. La visualización, por ejemplo, es el proceso mediante el cual el niño se concentra en la imagen mental de una experiencia agradable e interesante en lugar de concentrarse en el dolor. Hipnosis real requiere formación especializada, pero el dolor se puede modificar con palabras de consuelo y aliento dichas de una manera particular ( 19,20 ).
Métodos conductuales incluyen la respiración profunda, la cual es un método sencillo que ayuda al niño a disminuir el dolor y adquirir autocontrol. Enfoca la atención, reduce la tensión muscular, relaja el diafragma y oxigena el cuerpo. Lo mejor para empezar a enseñar esta técnica es pedirle al niño que espire y eche afuera la tensión, o "las cosas malas", con el aire que exhala cada vez. Relajación progresiva, que consiste en tensar y relajar sucesivamente distintos grupos de músculos en posición de decúbito, es una técnica útil para los adolescentes y se puede combinar con respiración profunda y sugestión( 21, 22 ).
El tacto es uno de los métodos físicos de alivio del dolor y es importante para todos los niños, en particular para los niños que no hablan todavía, ya que en gran medida es tocando y palpando como comprenden el mundo. Formas de tacto son acariciar, tomar en brazos y acunar, dar masaje en las manos, la espalda, los pies, la cabeza y el abdomen, así como cambiar los pañales. El hielo envuelto en un paño puede ser útil para aliviar el dolor producido por la enfermedad o inflamación. La estimulación neuroeléctrica transcutánea posiblemente actúa por medio de las fibras nerviosas de gran diámetro, amortiguando la transmisión del dolor a nivel raquídeo. Los niños suelen experimentar la estimulación neuroeléctrica transcutánea como un hormigueo o cosquilleo; no debe llegar a ser dolorosa ( 20, 3 ).
Manejo farmacológico del dolor
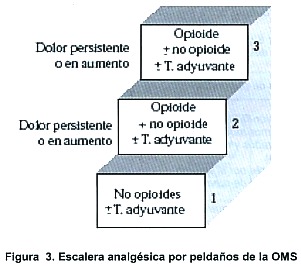
El uso de analgésicos para el manejo del cáncer en niños, se basa en la escalera analgésica de la OMS (Figura 3). La elección depende de la severidad del dolor y puede ser desde acetaminofen hasta opioides. La meta es obtener un balance entre analgesia y efectos secundarios.
I. Dolor leve
1. Acetaminofén
El acetaminofén es uno de los analgésicos no opiodes más comúnmente utilizados en niños( 5 ). Actúa inhibiendo la síntesis de prostanglandinas a nivel central. Una ventaja sobre los antiinflamatorios no esteroideos (AINES) es que no produce gastritis ni alteración a nivel plaquetario. No se ha visto asociado al sindrome de Reye. A niveles terapéuticos no produce daño renal ni hepático(5). Es bien tolerado por recién nacidos y lactantes ( 3 ). La dosis recomendada es de 15 mg/kg cada 4-6 horas con un máximo 90 mg/kg/día en niños mayores y 60mg/kg/día en niños menores. No hay información sobre la seguridad del uso a largo plazo de acetaminofén.
2. AINES
Son útiles en pacientes que tienen una adecuada cantidad y funcionamiento de plaquetas. Se pueden usar solos o en combinación con opioides. Los AINES están contraindicados en pacientes oncológicos con trombocitopenia por el riesgo de sangrado. Son útiles en pacientes con metástasis óseas que no tienen alteración plaquetaria. Se deben utilizar con prudencia en recién nacidos( 5 ). Se puede prescribir el ibuprofeno a 10mg/kg/dosis cada 6-8 horas. Otra opción es el Naproxeno a 5mg/kg/dosis cada 8-12 horas. Aumentando las dosis no se logra más analgesia e incrementa el riesgo de efectos secundarios. No hay datos sobre el uso de inhibidores de Cox-2 en niños con cáncer.
II. Dolor moderado
La codeína es un alcaloide fenantreno derivado de la morfina. Es el opioide de elección para el dolor moderado(5). Por lo general se administra oral unido a medicamentos no opioides como el acetaminofén. No se recomienda la administración parenteral (5). La dosis inicial en mayores de 6 meses es de 0.5 a 1 mg cada 4 horas. En menores de 6 meses se puede utilizar de una cuarta a una tercera parte de esta dosis. Si no hay mejoría del dolor se debe suspender la codeína y utilizar un opioide más potente ya que aumentar las dosis no mejora la analgesia e incrementa los efectos secundarios.
III. Dolor severo
OPIOIDES
Para el dolor severo se utilizan opioides potentes que suelen aliviar las molestias satisfactoriamente en la mayoría de los niños(5). Se pueden usar solos o asociados a otros analgésicos o medicamentos adyuvantes. A diferencia de otros medicamentos, los opioides no tienen dosis límite analgésica, la dosis adecuada es la necesaria para aliviar los síntomas. Utilizarlos por más de siete días crea dependencia y deben disminuirse gradualmente para evitar la abstinencia. Se recomienda disminuir la dosis al 50% por dos días y luego 25% cada dos días hasta llegar a la dosis equivalente vía oral (morfina 0.6 mg/kg en menores de 50 kg y 30 mg/día en mayores de 50 kg).
1. Morfina
Es el opioide más utilizado en niños con cáncer para dolor severo(3,5). El principal metabolito hepático, morfina-6-glucoronide, puede acumularse y dar efectos secundarios en pacientes con insuficiencia renal. Para niños con dolor severo la dosis inicial oral recomendada es de 1.5 a 2mg/kg por día ó 0.15-0.3mg/kg cada cuatro horas ( 3, 5, 24 ). El aclaramiento de morfina es retardado en los primeros 3 meses de vida. La vida media cambia de 10-20 horas en prematuros a 1-2 horas en niños pequeños (3,5). La dosis en lactantes pequeños debe ser reducida a un 25-30% de la dosis usual de niños pequeños. La administración de morfina en lactantes deber ser en un lugar donde se puede observar continuamente por el riesgo de depresión respiratoria.
Si no se puede utilizar la vía oral, la infusión intravenosa produce un alivio continuo iniciando con 0.02-0.03 mg/kg por hora y 0.015 mg/kg por hora en mayores y menores de 3 meses respectivamente. Se pueden utilizar dosis intermitentes de 0.05-0.1 mg/kg cada 2 a 4 horas por las vías subcutánea o intravenosa. Existe una presentación en tabletas de acción prolongada que se administran cada 8-12 horas. Permiten respetar el patrón de sueño. Si se trituran, la morfina se libera inmediatamente por lo que no son útiles en pacientes que no pueden tragarlas. En algunos países cuentan con otras presentaciones que no pierden esta propiedad cuando se abren las cápsulas. La dosis es de 0.6 mg/kg cada 8 horas ó 0.9 mg/kg cada 12 horas.
2. Hidromorfona
Es similar a la morfina en eficacia, farmacocinética y toxicidad, pero se diferencia en que por vía parenteral es seis veces más potente y por vía oral es ocho veces más potente. También esta en presentación subcutánea, intratecal y epidural. Por su alta potencia y ser hidrosoluble puede utilizarse en infusión subcutánea. Cuando la morfina está contraindicada la hidromorfona es una opción ( 3, 5 ).
3. Metadona
Es un opioide sintético con una vida media larga y variable. Por ser lipofílico se absorbe rápido y fácilmente en el tracto gastrointestinal( 25 ). Es más potente por vía oral que parenteral ( 3 ). Varios estudios concuerdan en que es eficaz y bien tolerada por vía oral ( 25 ).Produce una analgesia equivalente a la morfina pero con un efecto más prolongado. La dosis inicial recomendada es de 0.2 mg/kg cada 4 horas cuando sea necesario para evitar el riesgo de sobredosis. Esta última puede suceder por una acumulación lenta del fármaco que produce síntomas a los días de su uso ( 5 ). Por esta razón se debe vigilar de cerca de los pacientes al inicio del tratamiento y cada vez que se incremente la dosis.
La vía preferida es la oral, pero se puede usar vía intravenosa al 50% de la dosis usual oral ( 5 ). En pacientes muy debilitados o con alteración de la función renal ó hepática la dosis inicial es menor. La cantidad administrada puede incrementarse hasta que se consiga el efecto deseado, siempre y cuando no hallan efectos secundarios indeseables.
4. Fentanilo
Es un opioide sintético de más corta duración que la morfina. Se utiliza en bolos para dolor severo por procedimientos invasivos y en infusión para dolor continuo. La dosis para procedimientos breves es de 1-2mcg/kg, 5 minutos antes de procedimiento. Produce menos liberación de histamina que la morfina por que produce menor prurito. A dosis mayores de 3 mcg/kg puede producir rigidez de la caja torácica y problemas ventilatorios.
Existe también el sufentanilo y el alfentanilo, que son sustancias análogas de más corta duración que pueden ser utilizados para procedimientos invasivos cortos. Existen los parches transdérmicos que se utilizan para el dolor crónico en pacientes mayores de 12 años y con un peso mayor a los 50 kg. Este método alcanza niveles terapéuticos en 12-16 horas y la semivida de elíminación es de 21 horas.
Efectos Secundarios
Todos los opioides tienen efectos secundarios similares. Dentro de éstos se mencionan los siguientes:
- Estreñimiento: no resuelve espontáneamente, puede evitarse consumiendo abundantes líquidos, fibra y complementando con un ablandador de las heces.
- Prurito: se pueden utilizar antihistamínicos como la difenhidramina o la hidroxizina, ambas a una dosis de 0.5-1 mg/kg por dosis cada 4-6 horas( 5 ).
-Náuseas y vómito: para ésto se utilizan antieméticos como la metoclopramida (0.10.2 mg/kg intravenosa u oral cada 6 horas) ó una fenotiazida (proclorperazina 0.1-0.2 mg/kg cada 6 horas).
- Depresión respiratoria: si es leve se puede estimular al niño, suspender la dosis siguiente e iniciar al 50 % de la dosis. En casos más severos se debe dar ventilación asistida, oxígeno suplementario y como antagonista el naloxone hasta revertir el efecto. La dosis de naloxone se incrementa de 0.5-2 mcg/kg cada 1-2 minutos phata obtener el efecto deseado ( 5 )
- Confusión: se debe cambiar el medicamento o añadir un neuroléptico como el haloperidol a una dosis de 0.01-1 mg/kg cada 8 horas intravenoso u oral.
- Mioclonías: es un movimiento súbito e involuntario de las extremidades, tronco o cabeza. Es normal al dormirse, pero si se presenta en vigilia y es severo se puede utilizar una benzodiacepina o cambiar el opioide.
- Somnolencia: por lo general desaparece a la semana del tratamiento, de no ser así se pueden utilizar psicoestimulantes como el metilfenidato o la dexanfetamina.
Terapia coadyuvante
1. Antidepresivos
Los antidepresivos tricíclicos aparte de mejorar la depresión pueden ayudar con el dolor. Antes de su inicio se recomienda descartar problemas de la conducción cardiaca( 3 ). Son los fármacos de elección para el dolor neuropático( 5, 26 ), producido por inflamación o lesión las vías nerviosas. Además mejoran el sueño y pueden reforzar la analgesia. Su inicio de acción para el manejo del dolor es más rápido que para la depresión, en la cual el efecto puede tardar en verse hasta un mes ( 26 ). Los efectos secundarios comunes son síntomas anticolinérgicos, como sequedad de boca y somnolencia ( 5 ).
La dosis inicial recomendada es de 0.2-0.5 mg/kg de amitriptilina a la hora de dormir hasta un máximo de 25mg. Se puede incrementar en un 25% cada 2-3 días hasta lograr un efecto antidepresivo si fuera necesario. El sueño mejora en forma inmediata y la analgesia puede verse en 3-5 días aunque puede tardar hasta 2 semanas ( 5 ).
2. Psicoestimulantes
Como se mencionó anteriormente el metilfenidato y la dexanfetamina son útiles para el manejo de la somnolencia producido por los opioides. También potencializan la analgesia producida por éstos( 5 ). Los efectos secundarios incluyen anorexia, insomnio y agitación( 3, 5 ). La dosis inicial es de 0.1 mg/kg por la mañana y al medio día.
3. Corticoesteroides
Son útiles en el dolor óseo, edema cerebral y compresión epidural medular ( 3 ). La dexametasona es la más comúnmente utilizada por su potencia, duración de acción y mínimo efecto mineralocorticoide. La dosis depende de la situación clínica ( 5 ). Mejoran el apetito y ayudan a combatir las náuseas en pacientes terminales ( 26 ). Dentro de los efectos secundarios se menciona el edema, dispepsia e inclusive sangrado digestivo ( 5 ).
4. Anticonvulsivantes
La carbamazapina, la fenitoína y el clonazepam pueden aliviar el dolor neuropático. La primera puede iniciarse a 2 mg/kg cada 12 horas hasta un máximo de 100mg por dosis de inicio, pero puede incrementarse hasta 10-20 mg/kg/día ( 5 ). Los anticonvulsivantes pueden ser muy útiles para el tratamiento del dolor en neuropatías periféricas en "guante" o "media". La Gabapentina alivia el dolor neuropático, es bien tolerada y no produce menos efectos adversos ( 3 )
5. Neurolépticos
Se utilizan para manejar la agitación y la psicosis y para aliviar las náuseas y los vómitos en los niños. Entre sus efectos secundarios están: sequedad de boca, estreñimiento, hipotensión, taquicardia y retención de orina. Aunque poco frecuente pueden producir extrapiramidalismo ( 5 ). Se recomienda iniciar con clorpromazina (0.5 mg/kg, máximo 25mg cada 6-8 horas) (5).
Referencias
1. Himelstein BP, Hilden JM, Boldt AM, Weissman D. Pediatic palliative care. N Engl J Med 2004; 350: 1752- 62. [ Links ]
2. Hilden JM, Emanuel EJ, Fairclough DL, Link MP, Foley KM, Clarridge BC, Schnipper LE, Mayer RJ. Attitudes and practices among pediatric oncologists regarding end-of-life care: results of the 1998 American Society of Clinical Oncology survey. J Clin Oncology 2001: 19(1 ):205-212. [ Links ]
3. Collins J. Palliative care and the child with cancer. Hematol Oncol Clin N Am 2002; 16: 657-670. [ Links ]
4. Howard R. Current status of pain management in children.JAMA;2003; 290(18): 2464-9. [ Links ]
5. Pain relief and palliative care in children with cancer. Geneva: WHO; 1998. [ Links ]
6. Turk DC, Monarch ES, Williams AD. Cancer patients in pain: considerations for assessing the whole persono Hematol Oncol Clin Am 2002; 16: 511-525. [ Links ]
7. Gonzalez GR, Elliot KJ, Portenoy RK, et al. The impact of a comprehensive evaluation in the management of cancer pain. Pain 1991; 47: 141-4. [ Links ]
8. Walco GA, Cassidy RC, Schechter NL. Pain, hurt and harm - the ethics of pain control in infants and children. N Engl J Med 1994; 331: 541-544. [ Links ]
9. Wolfe J, Grier HE, Klar N, Levin SB, et al. Symptoms and suffering at the end of life in children with cancer. N Engl J Med 2000; 242: 326-33. [ Links ]
10. Collins JJ, Devine TD, Dick GS, et al. The measurement of symptoms in young children with cancer: the validation of the Memorial Symptom Assessment Scale in children aged 7-12. J Pain Symptom Manage 2002; 23(1 ):1 0-16. [ Links ]
11. Salas M, Gabaldón O, Mayoral JI, Amayra I. Evaluación de la ansiedad y el dolor asociados a procedimientos médicos dolorosos en oncología pediátrica. An Esp Pediatr 2002; 57(1): 34-44. [ Links ]
12. Huskisson EC. Measurement of pain. Lancet 1974; 2:1127-34. [ Links ]
13. McGrath PA, Seifert CE, Speechley KN, Booth JC, Sitt L, Gibson MC. A new analogue scale for assessing children's pain. Pain 1996; 64: 435-43. [ Links ]
14. Chambers CT, Craig KD. An intrusive impact of anchors in children's faces pain scales. Pain 1998; 78: 27-37. [ Links ]
15. Sweet SD, McGrath PJ. Physiologicals measures of pain. En: Finley GA, McGrath PJ, editors. Measurement of pain in infants and children. Progress in Pain Research and Management. Vol. 10. Seattle, WA: IASP Press, 1998; p.59-81. [ Links ]
16. Wolfe J, Friebert S, Hilden J. Caring for children with advanced cancer: Integrating palliative care. Ped Clin N Amer 2002; 49 (5): 1043-1062. [ Links ]
17. Hutton N. Pediatric palliative care. The time has come. Arch Pediatr Adoles Med 2002; 156: 9-10. [ Links ]
18. Rusy LM &, Weisman SJ. Complementary therapies for acute pediatric pain management. Pediatric Clinics of North America 2000 June;47(3):589-99. [ Links ]
19. Zeltzer, L.K., Bush, J.P., Riveral, A. A psychobiologic approach to pediatric pain: part I. History, physiology and assessment strategies. Current problems in Pediatrics. Vol 27 Number 6. July 1997. [ Links ]
20. Zeltzer, L.K., Bush, J.P., Riveral, A. A psychobiologic approach to pediatric pain: Part II. Prevention and treatment. Current problems in Pediatrics. Volume 27 number 7. August, 1997. [ Links ]
21. McCarthy AM, Cool VA, Hanrahan K. Cognitive behavioral interventions for children during painful procedures: research challenges and program development. J Ped Nursing 1998; 13(1 ):55-63. [ Links ]
22. Chen E, Joseph MH, Zeltzer LK. Behavioral and cognitive interventions in the treatment of pain in children. Pediatr Clin North Am 2000 Jun 47:513-25. [ Links ]
23. Lander J. Fowler-Kerry S. TENS tor children's procedural pain. Pain, 1991, 52:209-216. [ Links ]
24. Hunt, A. Population pharmacokinetics of oral morphine and its glucuronides in children receiving morphine as immediate release liquid or sustained-release tablets for cancer pain. J Ped. 1999: 135. [ Links ]
25. Ripamonti, C. The use of methadone for cancer pain. Hematol Oncol Clin N Am. 2002; 16 (3). [ Links ]
26. Galloway, K. Acute pain in children. Pediatr Clin North Am. 2000; 47 (3). [ Links ]