Introducción
Las microalgas son organismos unicelulares fotosintéticos que utilizan la energía luminosa y el dióxido de carbono para obtener una mayor eficiencia fotosintética, la cual les permite una alta capacidad de producción de biomasa que puede ser destinada a diferentes aplicaciones, como la producción de biocombustibles, purificación de aguas residuales, extracciones de alimentos de alto valor añadido, productos farmacéuticos y como alimento para la acuicultura (1) (2) (3). Nannochloropsis oculata ha sido una de las principales candidatas para la nutrición de especies animales, debido a su alto contenido en lípidos y que además puede ser utilizada en la fabricación de biodiesel (4) (5) (6).
Sin embargo, la producción masiva de esta especie representa una fracción considerable del costo total de operación en los laboratorios, debido a la necesidad de mano de obra calificada, de infraestructura adecuada y que, en su mayoría, corresponden a sistemas abiertos que no permiten mantener las condiciones fisicoquímicas controladas (7) (8).
Una alternativa a los métodos tradicionales de producción de microalgas es la utilización de fotobiorreactores; un sistema cerrado, aislado del medio ambiente sin intercambio de gases y fuentes de contaminación externa, diseñado en material transparente; que consta de un receptor de luz (sistema tubular optimizado) y un sistema de impulsión (burbujeo de aire en un desgasificador plano), cuyo diseño es determinado por el uso final de la biomasa así como el requerimiento de su calidad (9). Su uso ha sido ampliamente reportado en la literatura (10) (11) (12) (13) dada su importancia especialmente para producir biocombustibles.
El siguiente trabajo tiene como objetivo ofrecer ventajas comparativas de un fotobiorreactor tubular helicoidal como una alternativa de optimización en la producción de microalgas para la nutrición de especies marinas, comparado con los sistemas tradicionales de producción en tanques.
Metodología
Sistemas de cultivos microalgales
Fotobiorreactor tubular helicoidal
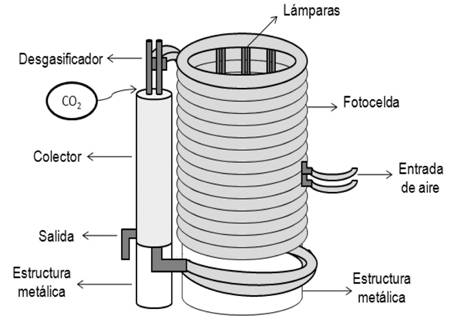
Una fotocelda fue construida usando una manguera semitransparente (100 m de largo, con un volumen aproximado a los 55 litros) enrollada de forma circular en el exterior de una malla metálica cilíndrica (0,67 m de diámetro y 1,90 m de altura). La manguera se colocó inclinada con una pendiente de dos grados (figura 1 ). Por medio de un soplador regenerativo se inyectó aire en la parte media superior de la estructura. El aire excedente más el oxígeno producido por las algas fue liberado a través de un desgasificador colocado en la parte superior de la fotocelda. Para captar el medio de cultivo se utilizó un colector en el cual se vertió el medio de cultivo por gravedad, el cilindro contó con 0,12 m de diámetro y una altura aproximada de 1,25 m; y con un volumen aproximado de 15 L. Por medio de un tanque de 2500 libras y mediante un suave burbujeo, se suministró dióxido de carbono para regular el pH. Finalmente, se equipó con una fuente de luz artificial en la estructura de la malla metálica cilíndrica compuesta por 8 tubos de luz fluorescente de 32W cada uno. El fotobiorreactor, se colocó en el área interna del laboratorio (cepario), el cual está temperado a 27+1° C.
Sistema abierto
Se utilizaron tanques de fibra de vidrio con un volumen de 2 m3 de capacidad y 1,3 m de diámetro; ubicados en una sala externa al cepario y bajo techo cubierto de láminas de policarbonato transparentes, con aireación constante.
Cultivo de microalgas
Nutrientes para los cultivos intermedios y para el fototobiorreactor tubular helicoidal
En la siembra de los cultivos algales intermedios se utilizó una cepa de Nannochloropsis oculata en un sistema escalonado, se inició con volúmenes de 250 mL hasta culminar con volúmenes de 100 L. Para estas etapas se utilizó el medio f/2 de Guillard (14) (composición final por litro de los stock de nutrientes: 90 g NaNO3; 5 g NaH2PO4.2H2O; 27,5 g NH4Cl; 4,36 g EDTA.Na2; 3,150 g FeCl3.6H2O; 0,010 mg CuSO4.5H2O; 0,022 mg ZnSO4.7H2O; 0,010 mg CoCl2.6H2O; 0,180 mg MnCl2.4H2O; 0,006 mg Na2MoO4.2H2O; 1 mL cianocobalamina cristalina (B12); 0,2 g tiamina clorhídrica; 0,001 mg biotina cristalina). Los medios de cultivo se mantuvieron a una salinidad de 31 ppt y fueron producidos en el cepario en el cual la temperatura se mantuvo aproximadamente en 27+1oC.
Nutrientes para sistema abierto común
En el caso del sistema abierto de producción de microalgas se utilizó fertilizantes para cultivos masivos, el cual correspondió a 120 g de nitrato de potasio (NO3K) y 5,5 g de fosfato monoamónico (MAP) por tonelada de agua marina.
Inoculación de algas
El fotobiorreactor tubular helicoidal se inoculó con 30 L de microalga N. oculata a una densidad de 17x106 cel/mL y el sistema abierto con 80 L de microalga a una densidad de 7x106 cel/mL.
Tratamiento de agua de mar
El agua de mar fue filtrada con cartuchos dispuestos en serie, con capacidad de retención de 10, 5 y 1 µm. El agua se desinfectó con hipoclorito de sodio (3%) a razón de 1 mL/L de agua de mar, la que después de 24 horas se eliminaron sus residuos con tiosulfato de sodio (0,06 mg/L).
Medición de parámetros
Para los cultivos microalgales, la salinidad se ajustó a 31 ppt. Además, diariamente se midió el grado de acidez y temperatura con un pHmetro de la marca Hanna Instruments. En el caso del fotobiorreactor, se midió la iluminancia real diariamente con un luxómetro de la marca Aquatic Eco-System.
Determinación de la densidad y biomasa celular
Las densidades celulares se determinaron a diario mediante el recuento de alícuotas con un microscopio óptico binocular Optima, que se fijaron con lugol y posteriormente se contaron utilizando un hematocitómetro con una profundidad de 0,1 mm, expresándolas como número de células por mililitro del cultivo. No se cuantificaron células no pigmentadas o lisadas, consideradas éstas como células muertas. Estos datos fueron utilizados para la confección de curvas de crecimiento. Finalmente, la biomasa celular (g/L) se obtuvo centrifugando tres litros de cultivo de N. oculata de cada réplica en cada sistema, para este proceso se utilizó una centrifuga de la marca Thermo Scientific.
Comparación de costos
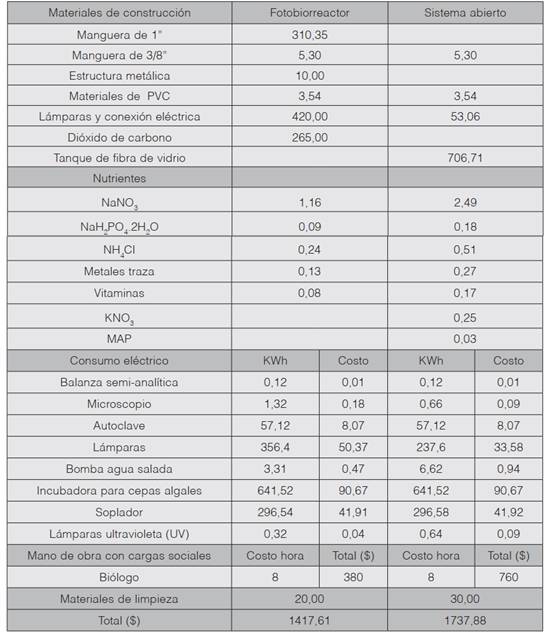
Los rubros que se definieron como parte de los costos para producir 1,1 x 1013 células de Nannochloropsis oculata, correspondieron al consumo eléctrico, mano de obra, materiales para la construcción del fotobiorreactor, tanque de fibra del sistema abierto y los reactivos para la formulación de los medios de cultivo. Los costos abarcaron desde el desarrollo de los cultivos intermedios hasta la siembra de cada uno de los sistemas de producción, lo cual correspondió a un mes aproximadamente.
Diseño experimental y análisis estadístico
Se realizaron tres replicas para cada sistema de producción de microalgas. El análisis estadístico partió de comprobar la homogeneidad de la varianza y la normalidad de los datos (test de Shapiro-Wilks), si los datos son normales y homocedásticos, para un nivel de significancia de 0,05; se procedió a comparar las medias con ANOVA en caso contrario se aplicará la prueba de Kruskal-Wallis. Los datos que se compararon correspondieron a las densidades máximas (cel/mL) y la biomasa celular.
Resultados
Para los cultivos algales producidos en el fotobiorreactor la temperatura fue de 26,89+0,56° C y un pH promedio de 7,77+1,08. En el caso del sistema abierto se obtuvo una temperatura de 29,2+0,45° C y un pH de 9,1+0,3. La sala donde se desarrolló el sistema abierto reportó una iluminancia de 2470+126 Lux. En el caso del fotobiorreactor, al día de la siembra se midió una iluminancia total de 1250+95 Lux y en el día de máxima densidad se reportó 238,33+83 Lux.
En cuanto a las curvas de crecimiento microalgal con el fotobiorreactor tubular (figura 2), la máxima densidad se alcanzó al noveno día con 134x106 +13,52x106 cel/mL, del día 10 al 15 aproximadamente permaneció constante, sin embargo, a partir del día 16 se presentó un descenso rápido en la densidad microalgal. En cuanto al sistema abierto común, se obtuvo que su máxima densidad se obtuvo al día 4,33+0,56 con una densidad máxima promedio de 7,5x106 +0,15x10 6 cel/mL. Los datos de máximas densidades no cumplieron la normalidad y se aplicó un test no paramétrico de Kruskal-Wallis, dando como resultado la existencia de diferencias significativas entre los datos analizados (P<0,05). Con respecto a la biomasa celular, utilizando el fotobiorreactor se obtuvo 0,28 + 0,05 g/L y con el sistema abierto 0,08+0,03 g/L, estos datos al cumplir tanto con la normalidad como con la homocedasticidad de la varianza se le aplicó un ANOVA dando como resultado diferencias significativas entre ambos (P<0,05).
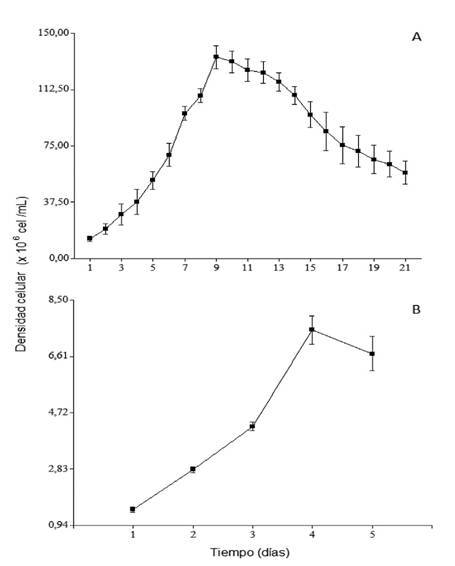
Figura 2 Crecimiento microalgal de Nannochloropsis oculata en un fotobiorreactor tubular helicoidal (A) y en un sistema abierto tradicional (B).
El cuadro 1 muestra la comparación de costos (US$) en la producción de N. oculata con un fotobiorreactor y con un sistema tradicional, siendo porcentualmente más barato con el fotobiorreactor
Cuadro 1 Costos (US$) de la producción de Nannochloropsis oculata con cada uno de los sistemas de producción.
Discusión
El fotobiorreactor tubular helicoidal, ha sido utilizado para la producción de Spirulina platensis (15), de Isochrysis galbana, Skeletonema costatum y Chlorella vulgaris (16) y por el Parque Marino del Pacífico para N. oculata.
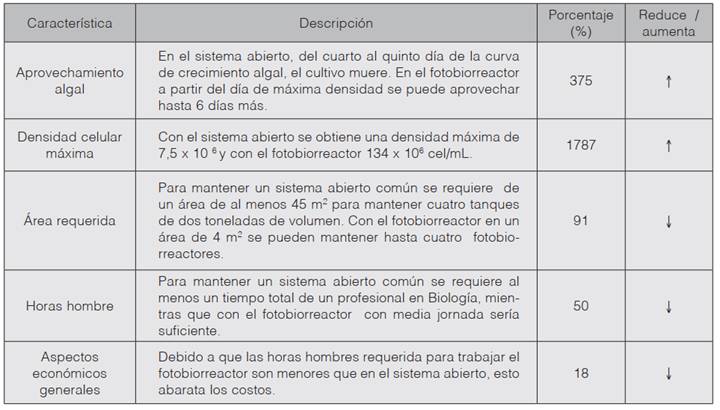
El cuadro 2, muestra variables comparativas entre el fotobiorreactor tubular helicoidal con respecto a un sistema abierto común. El fotobiorreactor tiene la capacidad de aprovechar la biomasa microalgal por más cantidad de días y a mayores densidades (figura 2) y resulta más barata a mediano plazo.
La baja eficiencia en la productividad microalgal obtenida en el sistema abierto en comparación con el fotobiorreactor está relacionada con la mayor proporción de volumen de agua que requiere para su siembra y su bajo aprovechamiento de la intensidad luminosa que incide negativamente en su función fotosintética; así mismo, el sistema de mezclado resulta ineficiente, pues la aireación sencilla en tanques circulares no es el sistema más aconsejable, sino en sistemas tipo “raceway” (17) (18).
Los factores de estrés también afectan la producción en sistemas abiertos, como lo son cambios de temperatura y pH elevados (19) (20) (21). En el caso de la temperatura, el inóculo requerido para la siembra del cultivo masivo se llevó a cabo dentro del cepario donde existe al menos tres grados menos de diferencia con respecto al área externa donde se encuentra el sistema abierto. Este último aspecto, no afectó al cultivo microalgal en el fotobiorreactor pues al ocupar poca área pudo ser ubicado dentro del cepario bajo las mismas condiciones de temperatura que su respectivo inóculo. El pH, en el fotobiorreactor fue regulado, por medio de la aplicación de CO2, a valores cercanos a 7 el cual es el recomendado para N. oculata (22) (23); en el sistema abierto el pH fue notablemente superior debido a que el volumen de agua al ser mayor, la aplicación de CO2 no resulta factible económicamente y según Sánchez-Torres et al. (24) la disponibilidad de CO2 en el agua es el principal limitante en la capacidad de carga en los cultivos algales.
Cuadro 2 Ventajas del uso de un fotobiorreactor tubular helicoidal con respecto a un sistema abierto común en un laboratorio de producción de microalg6566
La densidad celular obtenida en el fotobiorreactor se encuentra en el rango de los 100 millones de células por mL similar a otros estudios (18) (25) (26) (27) (28). Sin embargo, autores como Briassoulis et al. (29) reportan densidades muy superiores de hasta 350 millones de células por mL para Nannochloropsis sp. en un fotobiorreactor tubular helicoidal.
Con respecto a la productividad algal, la mayoría de los reportes en la literatura (30) (31) (32) (33) (34) (35) (36) señala para N. oculata, utilizando varios tipos de fotobiorreactores, valores entre 0,17 a 0,76 g/L/d, en el cual se encuentra el valor obtenido en el presente estudio, no obstante Briassoulis et al. (29) reportó un mayor rango de productividad para esta especie (1,10-3.03 g/L/d). La medición de la productividad algal es relevante, ya que es a partir de ésta que se puede obtener biocombustibles, también se utiliza en la alimentación animal y humana, en la obtención de productos biotecnológicos con uso en medicina, farmacia y/o cosmética (37) (38).
El fotobiorreactor resulta ser una ingeniería menos costosa en comparación a los sistemas abiertos (39) esto debido a que su bioproceso es más eficiente en cuanto a densidad algal, mano de obra y utilización del espacio.
En conclusión, mantener un fotobiorreactor tubular helicoidal en un laboratorio para producción de juveniles de peces, permite un suministro de biomasa algal constante diariamente, lo cual lo hace fácilmente adaptable a los distintos fines comerciales. La tecnología de los fotobiorreactores corresponde a un campo de investigación en el cual aún se hace necesario nuevos aportes científicos en beneficio de la industria en general.