Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.24 n.1-2 San José Jan. 2003
Resumen
Trichosporon beigelii es un hongo que se aísla del suelo y aguas en zonas tropicales y ocasionalmente se encuentra como parte de la flora micótica de piel, uñas y boca. Hasta 1970 la importancia médica de este agente se relegó a una micosis superficial en el pelo, caracterizada por la producción de unas masas blanquecinas, de donde deriva el nombre de "Piedra blanca." Actualmente este agente se relaciona con infecciones sistémicas o localizadas en algunos órganos en pacientes con algún grado de inmunodeficiencia o con cuadros malignos bajo tratamiento, en los cuales se presentan leucopenias importantes. Otros factores predisponentes son el tratamiento con corticosteroides, la implantación de prótesis en válvulas cardiacas, la hemacromatosis y el SIDA.
Se describe el caso de una niña de 3 meses de edad, con un absceso hepático del cual se tomó una biopsia por punción, que mostró lesiones caracterizadas por un infiltrado inflamatorio con predominio de células mononucleares, detritus celulares asociados con masas de micelio septado, artrosporado, blastosporas, algunas gemando y otras formando cadenas de pseudomicelio. Del cultivo de ese material se aisló Trichosporon beigelii.
Histopatológicamente esta micosis se puede confundir con Candida, Aspergillus y Geotrichum. También, las colonias en cultivos jóvenes en agar sangre tienden a confundirse con Candida. En todo caso la identificación de micelio, pseudomicelio, blastosporas y artrosporas orienta al diagnóstico. (Rev Costarric Cienc Med 2003; 24: 63-70)
Palabras clave: Trichosporon beigelii, Piedra blanca, absceso hepático, infección sistémica.
Abstract
Trichosporon beigelii is a fungus isolated from soil and superficial water mainly from tropical countries. Also, it has been associated with human normal flora of ski n and mouth. Until 1970 its medical importance was regarded with "White Piedra" an infection that produces whiteness concretions attached to hair. Nowadays this agent is related with systemic infection with a high mortality, mainly in patients with immunodeficiency, associated HIV, malignant hematology disorders, treatments with cytotoxicity drugs or corticosteroids.
In this paper we described the case of a three years old girl with a hepatic abscess. The histology of the biopsy material showed lesions characterized by inmflamatory infiltrates with predominance of mononuclear cells, cellular detritus and mycelial masses with blastospores, arthroblastospores, and pseudomycelia. A strain of Trichosporon beigelii was isolated from the biopsy tissue.
At histopathologic analysis this micosis could be confounding with Candida, Aspergillus, or Geotrichum. Also, in blood agar the young colonies have a similar aspect of Candida. For those reasons, the observation of mycelia, blastospores, arthroplastospores, and pseudomicelia oriented the diagnosis.
Key words: trichosporon beigelii, White Piedra blanca, hepatic abscess, systemic infections.
Introducción
Por antonomasia los hongos han sido considerados patógenos oportunistas, lo cual se ha hecho aún más patente, entre otros aspectos, con el advenimiento de terapias agresivas anticancerosas, el empleo cada vez más frecuente de drogas inmunosupresoras y citotóxicas, los progresos en medicina que logran prolongar la vida de pacientes con cuadros terminales y la aparición del Síndrome de Inmunodeficiencia Adquirida (SIDA) (1 ). Todas esas condiciones han llevado a un incremento de la población inmunocomprometida, lo que se ha reflejado en la descripción cada vez más frecuente de infecciones severas provocadas por agentes con un potencial de virulencia bajo, que incluso pueden ser parte de la flora normal o simples saprófitos. Los nuevos patógenos suelen denominarse emergentes; o bien, reemergentes cuando se trata de agentes que se consideraban controlados (2 ). En la micología médica esto se refleja en la descripción de infecciones debidas a hongos otrora considerados solo como contaminantes de laboratorio, lo que llevó a una avalancha de descripciones de infecciones severas, a veces fatales, cuya denominación era compleja; pues los nombres se basaban en el género o la especie de tales agentes, lo que provocaba confusiones (1 ). Para facilitar la denominación de las nuevas entidades clínicas asociadas con esos hongos se acuñaron dos términos:
Feohifomicosis e Hialohifomicosis, según se tratase de hongos pigmentados o no, respectivamente. Entre esos agentes emergentes se incluye hongos que anteriormente se asociaban solo con infecciones superficiales e incluso algunas asintomáticas. Uno de esos agentes es Trichosporon beigelii, que antes de 1970 solo se relacionaba con el cuadro clínico de "Piedra blanca"; pero actualmente se incrimina en infecciones sistémicas o localizadas en algunos órganos.( 2 ,3 ).
Trichosporon beigelii
Trichosporon beigelii (sinonimia T cutaneum) fue clasificado en la familia Cryptococcaceae; sin embargo, se le han encontrado características comunes con los miembros de la subdivisión Basidiomycotina, como son la presencia de xilosa en su pared, el hallazgo de que sus septos son doliporos y que presenta antígenos comunes con Filobasidiella neoformans, la fase teleomórfica de Cryptococcus neoformans (4 ). También, se ha sugerido con base en pruebas de hibridación con ADN, que en realidad T beigelii representa un complejo de seis especies (4 ).
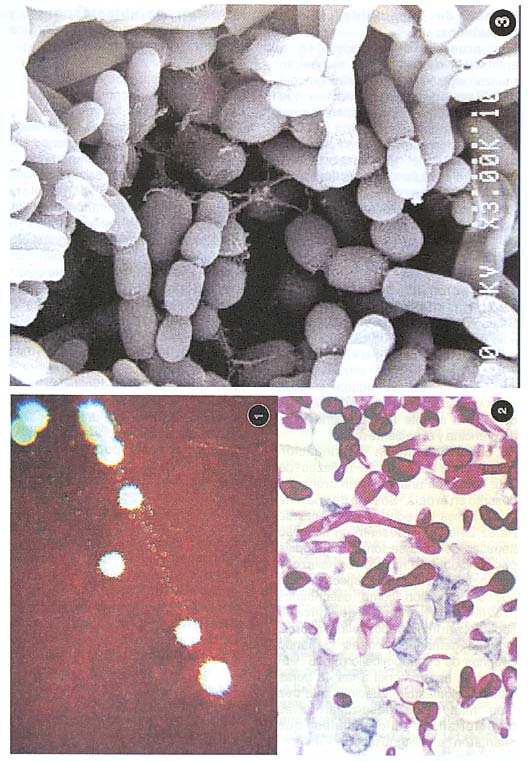
T beigelii es un hongo de crecimiento intermedio; la colonia joven es blanca con el centro ligeramente elevado. Si el aislamiento se hace a partir de sangre o de un tejido inoculado en agar sangre, el aspecto de esas colonias inicialmente hace pensar en Candida (Fig. 1 ). Sin embargo, a medida que envejece la colonia toma una coloración pardusca, que se acentúa en el centro, el cual se eleva más y la superficie de la colonia se torna plegada.
Microscópicamente la superficie de la colonia está cubierta por blastosporas y artroblastosporas, ya que el extremo de las hifas se fragmenta. Por lo tanto, la observación de estos elementos orienta la identificación del agente.
Epidemiología
Este hongo es comúnmente aislado del suelo yaguas en zonas tropicales y ocasionalmente se encuentra como parte de la flora micótica de piel, uñas y boca (5 ). Su aislamiento a partir de piel es más frecuente en genitales y se hace más notable en homosexuales masculinos (6 ).
Hasta 1970 la importancia médica de T beigelii, se relegó a una micosis superficial prácticamente inocua, que afecta las células de la cutícula del tallo del pelo, donde produce masas blanquecinas de consistencia suave, que se mantienen adosadas a los cabellos por medio de apresorios rudimentarios. El aspecto de esas masas inspiró el nombre de "Piedra blanca", con el que se conoce tal afección (7 ).
Trichosporon como patógeno emergente
La primera indicación de una infección sistémica por este hongo correspondió al hallazgo de un caso de absceso cerebral descrito en 1970 (8 ) Y posteriormente su potencial patogénico quedó demostrado en infecciones experimentales en conejos (9 ) y en ratones tratados con drogas inmunosupresoras (10 ) o irradiados (11 ). La descripción de infecciones severas, ya fuesen sistémicas o localizadas en tejidos profundos, especialmente en pacientes inmunocomprometidos lo consolidan como un agente oportunista (12 ).
Una investigación prospectiva en un grupo de 353 pacientes inmunosupresos, a quienes se les hizo cultivos semanales por hongos a partir de muestras de orina, heces y secreciones respiratorias, durante un periodo de 37 meses; mostró que el hongo pudo aislarse de 13 (3,7%) de los pacientes. Pero, solo tres de ellos mostraron signos de infección sistémica; lo que significa que este agente puede colonizar tracto digestivo y respiratorio (13 ).
La descripción de casos esporádicos de fungemias o de infecciones en tejidos profundos, han hecho que se le considere un agente oportunista emergente; aunque poco frecuente, puede afectar a hospederos inmunocomprometidos leucopénicos (14 , 15 ). Uno de los aspectos importantes de estas infecciones es la resistencia a la anfotericina S, o bien, la falta de respuesta terapéutica a este antibiótico, lo que hace que las
infecciones sistémicas por T beigelii presenten una tasa de mortalidad superior al 79% ( 4 ,15 ). Adicionalmente, en la década de 1990 se acumularon datos que asocian a este hongo con cuadros de neumonitis por hipersensibilidad ( 16 ).
Las infecciones en tejidos profundos debidas a T beigelii se asocian con pacientes con algún grado de inmunodeficiencia o a pacientes con cuadros malignos bajo tratamiento, en los cuales se presentan leucopenias importantes. Otros factores predisponentes son el tratamiento con corticosteroides, la implantación de prótesis en válvulas cardíacas, la hemacromatosis y el SIDA ( 15 ).
La infección origina rápidamente un cuadro febril con azotemia, infiltración pulmonar y lesiones dérmicas; la invasión a tejidos puede darse en riñones , pulmones, pieI y su diseminación vía sanguínea le lleva a otros tejidos (15 ). Entre las infecciones localizadas se ha descrito casos de artritis, colangitis, meningitis y hepatitis (17 ).
En los pacientes inmunosupresos, en los cuales el hongo puede originar cuadros sistémicos, se ha hecho un seguimiento con cultivos de sangre, heces, orina y secreciones pulmonares, lo cual justifica que se recomiende tal seguimiento a esos pacientes; aparte de las muestras de sangre que siguen la rutina de un hemocultivo, las otras muestras se inoculan en medio de Sabouraud dextrosa con 100 Ig/ ml de gentamicina; las muestras de orina se inoculan de la misma manera que para un urocultivo bacteriano (13 ,14 ,18 ).
Se sospecha que la principal puerta de entrada al organismo es el tracto digestivo o la vía aerógena, lo cual se correlaciona con el hallazgo de colonización intestinal y pulmonar en ausencia de síntomas (13 , 17 ). Sin embargo se han descrito al menos tres casos asociados con inoculación intradérmica en adictos a drogas endovenosas (19 ,20 ).
Histopatología
Las lesiones se caracterizan por un infiltrado inflamatorio con predominio de células mononucleares, con detritus celulares asociados con el hongo (13 ). En los tejidos necrosados se puede observar micelio, blastosporas, pseudomicelio y artrosporas. El micelio tiende a disponerse en forma radial, pudiendo dejar una zona de necrosis puntual en el centro. Esta observación se facilita si se hacen tinciones con ácido peryodico de Shiff (PAS) o con el método de Grocott (21 ). Alrededor de las hifas se acumula un infiltrado mononuclear, posiblemente compuesto por monocitos y macrófagos y pueden encontrarse células gigantes fagocitando fragmentos de hifas (14 ).
Diagnóstico diferencial:
Si no se presta la atención adecuada a las estructuras del hongo que pueden aparecer en el tejido necrosado, eI caso se puede confundir con Candída, y recordemos que el tratamiento recomendado es diferente (22 , 23 ); más aún, si ambos agentes están presentes, es posible que T beigelii, pase desapercibido (22 ). Por otra parte, al observar zonas necróticas con abundante micelio se podría confundir histológicamente con una aspergilosis, especialmente en tejidos pulmonares (21 ). Por lo tanto, un elemento importante para hacer el diagnóstico histopatológico es la observación de artrosporas; sin embargo, este elemento podría encaminar las sospechas hacia Geotrichum, otro agente oportunista, que también,
presenta artrosporas. Por lo tanto, es importante el hallazgo conjunto de todos los elementos: micelio, blastosporas, pseudomicelio y artrosporas (Fig.2 ).
Si los cultivos se han realizado exclusivamente en agar sangre, se obtendrán colonias que inicialmente son blancas, secas, convexas, que inicialmente muestran una superficie cremosa, lo cual hace que se confundan fácilmente con Candida sp ( Fig. 1 ). Además, si la observación microscópica no se hace meticulosamente la confusión suele ser mayor, pues ambos agentes muestran micelio, blastosporas e incluso pseudomicelio.
El hallazgo adicional de artrosporas orienta el diagnóstico a Trichosporom, lo cual es más evidente en las hifas del borde de la colonia (Fig.3 ).
La identificación final de este agente se puede hacer mediante pruebas de fermentación de carbohidratos, lo cual puede hacerse con sistemas miniaturizados semiautomáticos como el API-20C AUX (BioMerieux).
Prueba de sensibilidad a los antibióticos
Las pruebas de sensibilidad a antimicrobianos en hongos se pueden realizar siguiendo la metodología del ATB-F4ngus de la casa BioMerieux; que consiste en hacer una suspensión del hongo en solución salina a una concentración equivalente a la turbidez del tubo N° 2 del nefelómetro de McFarlane e inocularla en las bandejas que contienen 5-Fluorocitocina, anfotericina ,B, nistatina, miconasol, econasol ketoconasol. EI crecimiento en las diferentes celdillas indica la sensibilidad a estas drogas.
Trichosporon beigelli en infecciones sistémicas en Costa Rica:
Hasta donde sabemos previamente solo se ha descrito un caso (24 ) que consistió en una fungemia en un niño de 7 años de edad, que sufría de una leucemia mielocitica aguda y cuya puerta de entrada fue un catéter venoso central. El agente fue resistente a la anfotericina y el paciente murió.
El caso descrito a continuación corresponde al segundo hallazgo de este hongo en una infección profunda, descrito en el país. Se trató de una niña de 3 meses de edad, proveniente de Pérez Zeledón. Presentó un absceso hepático del cual se tomó una biopsia por punción, que mostró los hallazgos histopatológicos característicos de este tipo de infección como describimos previamente: masas de micelio septado, artrosporado, blastosporas, algunas gemando y otras formando cadenas de pseudomicelio (Fig. 3 ). El cultivo de ese material a las 48 horas mostró colonias blanquecinas que tres días más tarde desarrollaron las características diferenciales que orientaron el diagnóstico a Trichasparan, ya que su aspecto se tornóalgodonoso Y con una coloración pardusca. El aspecto microscópico evidenció la presencia de micelio
Artrosporado, blastosporas y pseudomicelio, caracterizado por una alta sensibilidad a los antimicóticos.
Conclusión
En pacientes con factores de riesgo que le predisponen a infecciones por agentes oportunistas es importante el diagnóstico diferencial de agente, que podría considerarse como flora indígena o como contaminantes del laboratorio. En el presente caso, el hallazgo de elementos diagnósticos que orientaron hacia Trichosporon, tanto en el estudio histopatológico, como en la observación de las colonias aisladas fue un elemento importante; ya que uno de los hongos con los que se puede confundir es Candida sp., y el tratamiento no seria efectivo en una infección sistémica por Trichosporon (25 ). Por lo tanto, la identificación del agente etiológico y su comportamiento de sensibilidad a los antibióticos se tornan aspectos importantes en el tratamiento de este tipo de infecciones.
Referencias
2. Lederberg J. Infectious disease as an involutionary paradigm. Emerg infect Dis 1997;3:417 -423. [ Links ]
3. Ajello L. Hyalohyphomycosis and Phaeohyphomycosis: Two global diseases of public health importance. Eur J Epidemiol 1986; 2:243-251. [ Links ]
4. Sugita T, Akemi N, Shinoda T, Kume H. Taxonomic position of deep seated, mucosal-associated and superficial isolates of Trichosporon cutaneum from trichosporonosis patients. J Clin Microbiol 1995;33;1 368-1370. [ Links ]
5. Marier R, Zakhireh S, Downs J, Wynne S, Hammond GL, Andriole VT. Trichosporon cutaneum endocarditis. Scand J Infect Dis 1978;10:255-256. [ Links ]
6. Kwon-Chung KJ, Senneth JE. Medical Mycology. Lea Febiger, Philadelphia, USA. 1992. I Edición. [ Links ]
7. Rippon JW. Micología Médica 3 ed. Interamericana McGraw Hill. Mexico.1990. [ Links ]
8. Watson KC, Kallichurum S. Srain abscess due to Trichosporon cutaneum. J Med Microbiol 1970; 3:19-23. [ Links ]
9. Taschdjian CL, Kozinn PJ, Toni EF. Opportunistic yeast infections, with special reference to candidiasis. Ann NY Acad Sci 1970; 174: 606624. [ Links ]
10. Hospenthal D, Selay T, Lappin P, Rogers A, Kennedy M. Disseminated trichosporonosis in aneutropenic murine model. Mycopathologia 1993; 122:115-122. [ Links ]
11. Pospisil J, Postupa J, Otcenasek M, Vejbora O. Pathogenicity of Trichosporon capitatum for normal and irradiated mice and the efficacy of miconazole on experimental systemic trichosporosis in mice. Mycoses 1990;33:559-566. [ Links ]
12. Rivera R, Cangir A. Trichosporon beigelii sepsis and leukemia. Cancer 1975; 36:1106-1110. [ Links ]
13. Haupt HM, Merz WG, Seschomer WE, Vaughan WP, Saral R. Colonization and infection with Trichosporon species in the immunosuppressed host.. J Infect Dis 1983; 147: 199-203. [ Links ]
14. Walling DM, Mc Graw DJ, Mertz WG, Karp JE, Hutchins GM. Disseminated infection with Trichosporon beigelii. Rev Infect Dis 1987;9:1013-1019. [ Links ]
15. Walsh T J, Melcher GP, Rinaldi MG, Lecciones J, McGough DA, Kelly P, Lee J, Callender D, Rubin M, Pizzo P A. Trichosporon beigelii, an emergin pathogen resistant to anphotericin S. J Clin Microbiol 28: 1616-1622, 1990. [ Links ]
16. Ando M, Sakata T, Yoshida P, Yamasaki H, Araki S, Onue K, Shinoda T. Serotype related antigen of Trichosporon cutaneum in the induction of Japanese summer-type hypersensitivity pneumonitis: Correlation between serotype of inhalation challenge positive antigen and that of isolates from patients homes. J Allergy Clin Immunol 1990; 85:36-44. [ Links ]
17. Fisher OJ, Christy C, Spafford P, Maniscalco WM, Hardy DI, Graman PS. Neonatal Trichosporon beigelii infection: Report of a cluster of cases in a neonatal intensive care unit. Pediatr Infect Dis 1993; 12: 149-155. [ Links ]
18. Sanford GR, Merz WG, Wingard JR, Charache P, Saral R. The value of fungal surveillance cultures as predictors of systemic fungal infections. J Infect Dis 1980: 142: 503-509. [ Links ]
19. Brahn E, Leonard PA. Trichosporon cutaneum endocarditis: A sequela of intravenous drug abuse. Am J Clin Pathol 1982; 78:792-794. [ Links ]
20. Keay S, Denning OW, Stevens DA. Endocarditis due to Trichosporon cutaneum: In vitro susceptibility of isolates and review. Rev Infect Dis 1991; 13:383-386. [ Links ]
21. Libertin CR, Davies NJ, Halper J, Edson RS, Roberts GD. Invasive disease caused by Trichosporon beigelii. Mayo Clin Proc 1983; 58: 684-686. [ Links ]
22. Hung C, Chang S, Chen Y, Tien H, Hsiek W. Trichosporon beigelii fungemia in patients with acute leukemia: Report of three cases. J Formos Med Assoc 1995; 94: 127-131. [ Links ]
23. Shaw BW Jr, Woods GL. Disseminated Trichosporon beigelii infection after orthotopic liver transplantation. Am J Clin Pathol 1989; 92:119-123. [ Links ]
24. Herrera ML, Moya T, Duarte 1, Bogantes A. Fungemia por Trichosporon beigelii. Reporte del primer caso en Costa Rica. Rev Med Hosp Nal Niños Costa Rica 1995; 30: 27-30. [ Links ]
25. Denning OW, Donnelly JP. HellreigelK P, Ito J, Martino P, van' t Wout JW. Ad HOC Working Group. Antifungal prophylaxis during neutropenia or allogeneic bone marrow transplantation: what is the state of the art? Chemotherapy 1992; 38:43-49
1 . Servicio de Anatomía Patológica, Hospital Nacional de Niños, CCSS, San José, Costa Rica.
2 . Facultad de Microbiología, Universidad de Costa Rica, San José, Costa Rica.
3 . CIEMIC, Universidad de Costa Rica, San José, Costa Rica. Correspondencia: E-mail : hchavarr@cariari.ucr.ac.cr













