Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.18 n.4 San José Dec. 1997
Resumen
Se sometió la cepa ATCC 27853 de Pseudomonas aeruginosa a la acción de sulfato de amikacina y como control se cultivó la bacteria en el medio libre de antibióticos. Se cosecharon las bacterias; se fijaron con una mezcla de glutaraldehido al 2,5%, rojo de rutenio al 0,075% y lisina 50 mM y se procesaron para microscopía electrónica.
Se observaron alteraciones en la pared bacteriana, como separación de sus componentes y la membrana externa apareció más ondulada que en los controles no tratados con el antibiótico; además en el citoplasma de las bacterias tratadas aparecieron zonas claras aparentemente debidas, a retracción del citoplasma. (Rev. Costarricense de Ciencias Médicas, 1997. 18-04:51-58)
Palabras clave
Ultraestructura, Pseudomonas aeruginosa, amikacina, pared celular.
La estreptomycina, introducida en 1994, fue el primer aminoglicósido de una familia de antibióticos que actualmente incluye drogas naturales y semisintéticas. Las primeras son derivadas de Micromonospora spp y llevan el sufijo "micina" (gentamicina, isomicina y netilmicina) o de Streptomyces spp, con el sufijo "mycina" (estreptomycina, neomycina, kanamycina y tobramycina)(1). La amikacina es un derivado semi-sintético de la kanamycina(2, 3) y es la droga más resistente del grupo, sin embargo, es inactiva principalmente por una acetiltransferasa de bacterias Gram-negativas(4).
En general los aminoglicósidos se caracterizan por una acción rápida, un amplio espectro y efectos sinérgicos con antibióticos beta lactámicos, por lo que en los últimos años han constituido el tratamiento de elección contra bacilos Gram negativos y en especial contra las infecciones por Pseudomonas spp(5). Además, inducen una baja de liberación de endotoxinas(6). Estos antibióticos bloquean la síntesis proteica al interactuar con los ribosomas en las etapas de iniciación y elongación de las proteínas; pero para que lleguen al citoplasma de bacterias Gram negativas, deben unirse a lípido A del lipopolisacárido(7), y destruir uniones en la bicapa lipídica, lo que lleva a desestabilizar la membrana externa(8), desorganizándola(7,8), con un consiguiente aumento en la permeabilidad a lisozima y compuestos hidrófobos(7,8) acción que se relaciona con la actividad bactericida y citotóxica de este grupo de antibióticos(9,10).
Como se indicó previamente la amikacina es el antibiótico de elección en el tratamiento de las infecciones por Pseudomonas aeruginosa. Esta característica motivó la búsqueda de alteraciones ultraestructurales en la pared celular de esta bacteria tratada in vitro con sulfato de amikacina.
Material y métodos
Se inocularon 100 µl de una suspensión (ca. 3 x 108 UFC/mL) de Pseudomonas aeruginosa (cepa ATCC 27853) en placas de Müeller Hinton con 32, 16, 8, 4, 2 y 1 µg/mL de sulfato de amikacina (Amikin® , Bristol) y en placas sin el antibiótico. Las colonias obtenidas en los platos se colectaron y fijaron durante 20 minutos a temperatura ambiente con una mezcla de glutaraldehido al 2,5%, rojo de rutenio al 0,075% y lisina 50 mM en amortiguador de cacodilato al 0.1 M (pH =7.0). Luego se fijaron nuevamente durante 100 minutos con una solución de glutaraldehido, rojo de rutenio y cacodilato(11). La suspensión de bacterias fijadas se incluyó en un coágulo de plasma(12), se seccionó en cubos de ca. 1 mm3 y se fijaron nuevamente con glutaraldehido al 2,5% durante 30 minutos, se lavaron con el amortiguador de cacodilato, se fijaron en tetraóxido de osmio, se deshidrataron en una gradiente de etanol (30 a 100%) y se incluyeron en resina Spurr de baja viscosidad para obtener secciones finas (ca. 90 nm de grosor), que se tiñeron con acetato de uranilo y citrato de plomo y se analizaron en microscopio electrónico de transmisión.
Resultados
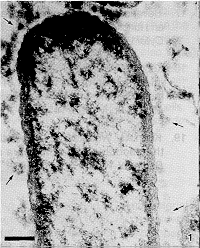
En las muestras control no tratadas con amikacina se aprecia el aspecto normal del citoplasma, la pared bacteriana, incluyendo una buena definición de la membrana externa y de los componentes del glicocalix, que aparece como un material amorfo y electrón denso dispuesto alrededor de las células (Figura 1).
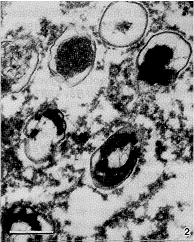
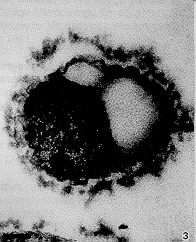
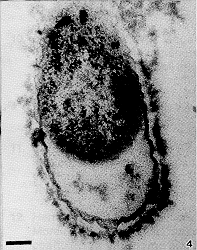
Solo se obtuvieron colonias en las placas con la menor concentración del antibiótico y mostraron alteraciones citoplasmáticas, como la presencia de zonas electrolúcidas, centrales o periféricas; en todo caso no se vislumbra una membrana alrededor de esas zonas claras, por lo que se trata de espacios de plamólisis (Figuras 2 y 4). Algunas células pierden prácticamente todo el citoplasma y en aquellas que aún conservan parte de éste, aparece más denso a los electrones que el citoplasma de los controles sin antibiótico (Figuras 2 y 3). Además, la pared celular aparece con ondulaciones más pronunciadas que las observadas en las muestras control (Figuras 3 y 4) y la membrana externa se hace más evidente, lo cual podría ser debido a separación de los elementos que forman la pared bacteriana.
Discusión
Tradicionalmente se ha considerado a la amikacina como un antibiótico que inhibe la síntesis de proteínas al unirse a la subunidad 30 S del ribosoma bacteriano y producir una lectura errónea en el RNAm(14). Sin embargo, este antibiótico interacciona con los sitios de unión de cationes divalentes en los lipopolisacáridos de Pseudomonas aeruginosa y permeabiliza la membrana externa de este microorganismo, lo que facilita la entrada del antibiótico(7, 8, 14). Es muy posible que al igual que la gentamicina, la amikacina, desplace cationes esenciales dentro de la membrana externa, lo que produciría desestabilidad que podría llevar también a la extracción de constituyentes orgánicos(16, 17). Los mecanismos de interacción entre el antibiótico y los componentes de la membrana externa que promueven su internalización, inducen la desestabilización de esa membrana, haciendo a la célula más susceptible a los cambios hipertónicos del medio extracelular. Esto explica la acción bactericida de este antibiótico y se refleja en alteraciones ultraestructurales como las zonas transparentes a los electrones en el citoplasma, lo que puede deberse a espacios de plasmólisis y a condensación del citoplasma. Esto parece ocurrir en algunos casos, dado el aumento en la electrodensidad observado (Figuras 2 y 4). En otros casos, las bacterias no parecen mostrar alteraciones citoplasmáticas, pero la pared presenta ondulaciones más acentuadas que las observadas en las muestras control; también se observa una aparente separación de las capas de la cubierta bacteriana (Figuras 3 y 4). Este fenómeno podría deberse a la retracción del citoplasma con la consiguiente formación de pliegues de su pared, en la cual tanto la membrana externa como el sáculo de mureina y la membrana citoplasmática se estarían arrugando como respuesta a la retracción del citoplasma, lo cual se ha demostrado en Escherichia coli que sometida a choque osmótico(18), que por la elasticidad de su mureina, es capaz de expanderse o contraerse hasta cuatro veces su área(19). Por lo tanto, la contracción del citoplasma también induciría la contracción de la mureina, lo que haría que el perplasma se expandiera y la membrana externa se corrugara, como se observa en las Figuras 3 y 4, en las que se hacen evidentes los distintos componentes de la envoltura bacteriana. Otra posibilidad que explicaría tales alteraciones y que también ha sido descrita, es la acción de la droga sobre la síntesis de lipoproteínas(17).
En conclusión el tratamiento in vitro de Pseudomonas aeruginosa con dosis subletales de sulfato de amikacina induce alteraciones ultraestructurales tanto en la pared bacteriana como en el citoplasma, cambios que llevarían a la muerte de la bacteria.
Agradecimientos
Al personal de la Unidad de Microscopía Electrónica de la Universidad de Costa Rica y a Patricia Rivera del Laboratorio de Microbiología, Servicio de Patología del Hospital Nacional de Niños y al Dr. Gerardo Mora, del Centro de Investigación en Productos Naturales, de la Universidad de Costa Rica por su colaboración. A la Agencia de Cooperación Internacional del Japón (JICA) y la Vicerrectoría de Investigación de la Universidad de Costa Rica, por su apoyo y financiamiento.
Abstract
The aminoglycosides were introduced with streptomycin en 1944, today this group of antibiotics includes natural and semisynthetic drugs, such as amikacin sulfate, used for treating Pseudomonas aeruginosa infections. The best known action of this antibiotic is the inhibition of bacterial protein synthesis; nevertheless, its bactericidal activity is associated with its interactions and destabilization of the outer membrane.
Pseudomonas aeruginosa (strain ATCC 27853) was treated in vitro with amikacin and as control, the strain was inoculated in culture media without antibiotic. The bacteria were harvested and suspended in cacodilate buffer and fixed with a mixture of 2.5% glutaraldehide, 0.075% ruthenium red, and 50mM lysine, and processed for electron microscopy.
The bacteria treated with the antibiotic showed a wavier outer membrane than the controls and the cell wall of the bacteria exposed to the antibiotic was altered; also, their cytoplasm showed clear zones, like vacuoles, but without membranes and the remaining cytoplasm was more electrondense than the cytoplasm of the untreated control cells.
Key words
Ultrastructure, Pseudomonas aeruginosa, amikacin, cell wall.
Referencias
1. Yao JDC, Moellering RC. Antibacterial Agents, p. 1065-1098. IN: A Balows, Hausler WJ, Herrmann KL, Isenberg HD, Shadomy HJ. (ed). Manual of Clinical Microbiology, 5th ed. American Society for Microbiology, Washington D.C. 1991. [ Links ]
2. Grayson, M. Antibiotics, chemotherapeutics and antibacteria agents for disease control. John Wiley & Sons. Nueva York. 1982, 32-71 p. [ Links ]
3. Ristuccia, AM, Cunha BA. An overview of amikacin. Ther Drug Monit 1995; 7:12-25. [ Links ]
4. kawaguchi H. A new semisinthetic aminoglycoside antibiotic. J Antibiot 1972;25:695. [ Links ]
5. Barriere SL. Aminoglycosides: A reassessment of their therapeutic role. Clin Pharm 1988;7:385-90. [ Links ]
6. Lamp KC, Rybak MJ, McGrath BJ, Summers KK. Influence of antibiotic and E5 monoclonal immunoglobulin M interactiosn on endotoxin release from Escherichia coli and Pseudomona aeruginosa. Antimicrob Agents Chemother 1996;402:247-52. [ Links ]
7. Hancock REW, Won PGW. Compounds which increase the permeability of the Pseudomonas aeruginosa outer membrane. Antimicrob Agents Chemother 1984;26:48-52. [ Links ]
8. Hancock REW, Raffle VJ, Nicas TI. Involvement of the outer membrane in gentamicin and streptomycin uptake and killing in Pseudomonas aeruginosa. Antimicrob Agents Chemother 1981;19:777-85. [ Links ]
9. Xiong Y, Caillon Q, Drugeon J, Potel KM, Baron D. Influence of pH on adaptative resistence of Pseudomona aeruginosa to aminoglycosides and their postantibiotic effects. Antimicrob Agents Chemother 1996; 40:35-39. [ Links ]
10. Rahtmati-bahram A, Magee JT, Jackson SK. Growth temeperature-dependent variation of cell envelope lipids and antibiotic susceptibility in Stenotrophomonas (Xanthomonas) maltophila. J Antimicrobial Chemother 1995; 36:317-26. [ Links ]
11. Jacqes M, Graham L. Improved preservation of bacterial capsule for electron microscopy . J Electron Microsc Tech 1989; 11:167-9. [ Links ]
12. Hernández F.,Coto E, Colmenares A, Moreira L. Aplicación del método de coagulación de plasma al estudio ultraestructural de especímenes biológicos. Rev Biol Trop 1991;39:177-80. [ Links ]
13. Hoffmann HP, Geftic SG, Gelzer J, Heymann H, Adair FW. Ultrastructural alterations associated with the growth of resistant Pseudomonas aeruginosa in the presence of benzalkonium chloride. J Bacteriol 1973;
113:409-16.
14. Chopra I, Ball P. Transport of Antibiotics into bacteria. Adv Microb Physiol 1982; 23:183-99. [ Links ]
15. Taber HW, Mueller PJ, Miller PF, Arrow AS. Bacterial uptake of aminoglycoside antibiotics. Microbiol Rev 1987; 51:439-57. [ Links ]
16. Martin NL, Beveridge TJ. Gentamicin interaction with Pseudomonas aeruginosa cell envelope. Antimicrob Agents Chemother 1986; 29:1079-87. [ Links ]
17. Beveridge TJ. Ultrastructure, chemistry and function of the bacterial wall. Int Rev Cytol 1981;72:229-17. [ Links ]
18. Koch A, Schwarz H. Phase and electron microscopic observations of plasmolysis of the Gram-negative cell wall. Microbiology 1995; 141:3161-70. [ Links ]
19. Koch A L, Woeste SW. The elasticity of the sacculus of Escherichia coli. J Bacteriol. 1992; 174:4811-19. [ Links ]
1. Centro de Información de Medicamentos (CIMED) Facultad de Farmacia, Universidad de Costa Rica, San José, Costa Rica.
2. Facultad de Microbiología, Unidad de Microscopia Electrónica y Centro de Investigación en Enfermedades Tropicales, Universidad de Costa Rica, San José, Costa Rica.
* Trabajo presentado en el XVI Congreso Panamericano de Farmacia.
** Correspondencia.
 |  |
| 
|
la membrana citoplasmática (MC), peptidoglicano (P) y membrana externa (ME). La barra equivale a 0.1µm.
Figura 2. Células tratadas con sulfato de amikacina. Esta muestra cortes transversales de las bacterias, que presentan zonas
electrolúcidas y restos de citoplasma electrodensos.
Barra = 0,25µm.
Figura 3. Muestra detalles de la retracción citoplásmica y alteraciones en la pared celular, que muestra los componentes más
separados y aparece con ondulaciones fuertes.
Barra = 0,1 µm.
Figura 4. Muestra detalles de la retracción citoplásmica y alteraciones en la pared celular, que muestra los componentes más
separados y aparece con ondulaciones fuertes.
Barra = 0,1 µm.













