Introducción
La bioluminiscencia es un proceso bioquímico por el que los seres vivos emiten luz. Los organismos luminiscentes se encuentran ampliamente distribuidos a lo largo del planeta y las bacterias luminiscentes marinas se consideran las más abundantes (Medvedeva, Tyulkova, Kuznetsov, & Rodicheva, 2009). Los factores que afectan la emisión de luz en bacterias resultan más complejos para las de vida libre en el medio marino, ya que los autoinductores responsables de estimular la emisión luminosa rara vez alcanzan la densidad crítica para disparar este fenómeno. En contraste, las que habitan en los órganos luminosos de especies de peces y calamares, tales como el pez Monocentris japonica y el calamar Euprymna scolopes, superan la concentración crítica del inductor con mayor facilidad (Engebrecht & Silverman, 1987). Asimismo, se ha comprobado que algunas de las bacterias luminiscentes dejan de emitir luz cuando se modifica su entorno, lo que sugiere que la luminiscencia no solo está controlada por la densidad celular, y otros factores intrínsecos, sino también por factores ambientales tales como el pH, la temperatura y la salinidad (Kuts & Ismailov, 2009). Otros factores exógenos al medio marino, tales como los xenobióticos, pueden afectar sensiblemente la emisión luminosa de lo que deriva su importancia práctica (Beh, Lim, Asmat, Lee, & Salmijah, 2010).
Dada la sensibilidad de la emisión luminiscente a las condiciones ambientales, las bacterias luminiscentes han sido empleadas en sistemas de monitoreo de la calidad ambiental y en otras aplicaciones (Podgórska, Chêæ, Ulanowska, & Wêgrzyn, 2005; Podgórska & Węgrzyn, 2006). El uso de las bacterias luminiscentes como indicadores de toxicidad se fundamenta en que algunos sistemas bioquímicos y fisiológicos se encuentran altamente conservados durante la evolución y determinados xenobióticos actúan de manera análoga en diversos organismos (Girotti, Bolelli, Ferri, Carpené, & Isani, 2015). Por otro lado, la sensibilidad, reproducibilidad y rapidez, de los ensayos basados en la luminiscencia bacteriana se han recomendado para evaluar la toxicidad de algunos ecosistemas (Parvez, Venkataraman & Mukherji, 2006).
Los géneros más representativos de bacterias luminiscentes son Vibrio, Photobacterium y Shewanella; donde las especies más comunes son: V.harveyi,V. fischeri(actualmente propuesta como Aliivibriofischeri), P.phosphoreum, P. leiognathiyS.hanedai (Martín, Serrano, Santos, Marquina, & Vázquez, 2010). Estos géneros se encuentran ampliamente distribuidos tanto en zonas costeras como en mar abierto (Sáenz & Nevárez, 2010). Lugioyo, Bellota y Moreta (1994) reportaron el primer aislamiento de bacterias luminiscentes en Cuba de aguas de la plataforma noroccidental y aguas oceánicas al sur de la Isla. Posteriormente fue identificada una cepa procedente de aguas costeras como Vibrioharveyi CBM-784 (Delgado et al., 2017).
Como parte de la caracterización fisiológica de las bacterias luminiscentes es imprescindible analizar la composición de los diferentes medios de cultivo por su influencia en el crecimiento y particularmente en la emisión de luz. En el caso del medio LM recomendado por Baumann y Baumann (1981) se refiere que el carbonato de calcio es un inductor de la luminiscencia. La disponibilidad en las condiciones de cultivo de determinados componentes como el carbonato de calcio, el glicerol y las sales de magnesio influyen en la emisión de la luminiscencia de este grupo bacteriano (Baumann & Baumann, 1981; Tabei, Era, Ogawa, & Morita, 2011).
Teniendo en cuenta las ventajas que ofrece el trabajo con bacterias luminiscentes para la evaluación de la calidad ambiental, este estudio tuvo como objetivos caracterizar taxonómicamente dos cepas de bacterias luminiscentes aisladas de aguas de la plataforma cubana. Además, determinar la influencia de diferentes medios de cultivo en su crecimiento y luminiscencia.
Materiales y métodos
Las cepas CBM-976 y CBM-992, depositadas en la Colección de Bacterias Marinas (CBM) del Instituto de Ciencias del Mar (ICIMAR), fueron aisladas de la plataforma noroeste de Cuba (23°10’26” N & 84°06’03” W). El medio empleado para el mantenimiento de estos cultivos fueelLM recomendado para el aislamiento de bacterias luminiscentes(Baumann & Baumann, 1981).
Identificación taxonómica de los aislados: Para la identificación de las cepas CBM-976 y CBM-992 se ensayaron diferentes pruebas morfológicas, bioquímicas y fisiológicas recomendadas por el Bergey’s Manual (De Vos et al., 2009). Se emplearon como referentes para la comparación con los ensayos fisiológicos y bioquímicos la cepa Vibrio harveyi CBM-784 (Delgado et al., 2017) depositada en la CBM y otras ocho bacterias luminiscentes procedentes de la colección de cultivos tipo de Estados Unidos (American Type Culture Collection Catalog) sugeridas por Bagordo et al. (2012). La forma y agrupamiento de las células se determinaron mediante los procedimientos estándar de tinción de Gram. Las pruebas realizadas incluyeron: movilidad; actividad catalasa; oxidasa; emisión de luminiscencia; crecimiento en medio TCBS. Además, en el medio LM se evaluó el crecimiento a diferentes temperaturas (4, 10, 15, 25, 30, 35 y 40 ºC) y la tolerancia al NaCl (0, 1, 3, 6, 8 y 10 %) (Pedersen et al., 1998).
Se determinó la presencia de las actividades correspondientes a reducción de nitratos, metabolismo óxido-fermentativo de la glucosa (O/F), la hidrólisis de orto-nitrofenil-β-D-galactopiranósido (ONPG) y la arginina dihidrolasa (Ramasamy et al., 2014). Se evaluó la producción de H2S a partir de tiosulfato, la reducción de indol, la hidrólisis de esculina y gelatina, la hidrólisis de urea y el uso de citrato, mediante tiras reactivas de API 20 NE (BioMeriux, SA, Francia). Siguiendo los métodos propuestos por Harrigan y McCance (1968) se evaluó la producción de amilasa y lipasa, la reacción de Voges-Proskauer (VP), las actividades lisina (LDC) y ornitina descarboxilasa (ODC). Todas las determinaciones se realizaron con tres repeticiones.
La comparación entre las características fisiológicas de los aislados CBM-976 y CBM-992 y las cepas empleadas como referencia, se realizó mediante un análisis de similitud con el programa estadístico Primer 6.1.6. Los resultados de las pruebas fisiológicas realizadas se codificaron como 1 (presencia/positivo), 0 (ausencia/negativo) y 9 (datos no comparables). Las similitudes se determinaron mediante el coeficiente de similitud de Brays-Curtis de apareamiento simple y la agrupación empleando métodos aglomerativos jerárquicos. Posteriormente, se realizó un dendrograma con el método de agrupamiento por promedio aritmético de grupos pares no ponderados (UPGMA) (Bagordo et al., 2012).
Se realizó una extracción del ADN genómico de las cepas CBM-976 y CBM-992 para el posicionamiento taxonómico mediante abordajes moleculares usando el método fenol/cloroformo según Thompson et al. (2005). La reacción de PCR tiempo final y la secuenciación en dos direcciones de los fragmentos parciales de la subunidad pequeña del ARN ribosomal (16S ARNr), la subunidad beta de la girasa (gyrB) y la uridilato quinasa (pyrH) se desarrollaron según Delgado et al. (2017). Las secuencias obtenidas fueron editadas manualmente con el programa Geneious R9 (Biomatters Ltd, Nueva Zelanda) y se identificaron mediante la herramienta básica de búsqueda de similitud local (BLASTn, por sus siglas en inglés) (Altschul, Gish, Miller, Myers, & Lipman, 1990) de la base de datos NCBI (www.ncbi.nlm.nih.gov/blast) mediante parámetros por defecto. Las secuencias resultantes fueron depositadas en el GenBank (www.ncbi.nlm.nih.gov/genbank).
El análisis de posicionamiento taxonómico entre las secuencias parciales CBM-976, CBM-992 y las obtenidas en la base de datos Genbank (Apéndice digital 1) se realizó mediante una topología filogenética multilocus de las regiones 16S ARNr, gyrB y pyrH. Primeramente, se elaboraron matrices de secuencias por cada gen y se alinearon con el programa en línea MAFFT 7.0 (http://mafft.cbrc.jp/alignment/server), con el método de refinamiento iterativo (G-INS-i) y el parámetro 20 PAM / k = 2 (Katoh, Rozewicki, & Yamada, 2017). Por otro lado, se utilizó el programa Gblocks (Castresana, 2000) para seleccionar bloques conservados mediante parámetros menos estrictos de selección de bloques. Para determinar el mejor modelo de sustitución nucleotídica, las matrices individuales se analizaron con jModelTest 2.1.10 (Darriba, Taboada, Doallo, & Posada, 2012) con la estrategia de selección mediante el criterio de información de Akaike (AIC) y un 95 % de intervalo de confianza. El árbol de posicionamiento taxonómico se elaboró mediante el algoritmo de máxima verosimilitud (ML) con el programa raxmlGUI versión 1.3 (Silvestro & Michalak, 2012) con el modelo reversible en tiempo general (GTR-GAMMA+I) y un soporte de los nodos derivado del método Bootstrap (2000 réplicas). Los árboles fueron visualizados y editados con el programa FigTree 1.4 (Rambaut, 2009). Posteriormente, se garantizó que no existieran topologías en conflicto entre los árboles obtenidos individualmente y se procedió a concatenar las matrices alineadas de cada uno de los genes mediante el programa SequenceMatrix v1.7.8 (Vaidya, Lohman, & Meier, 2011) para obtener una topología multigénica consenso mediante el método de ML.
Influencia de la composición del medio de cultivo sobre el crecimiento yla luminiscencia: Se cultivaron las cepas en cuatro medios recomendados para bacterias luminiscentes marinas: (1) Boss: 30 g NaCl, 1 g glicerol, 10 g peptona bacteriológica, 3 g extracto de carne (Klein, Walczak, Krasnowska, Blaszczak, & Lipińska, 1995); (2) Chalk: 30 g NaCl, 5 g peptona, 3 g extracto de levadura, 5 g CaCO3, 15 g glicerol, 1 000 ml agua destilada (Shanware, Thakre & Pande, 2013); (3) LM: 0.3 % (v/v) de glicerol, 5 g extracto de levadura, 5 g triptona, 1 g CaCO3, 75 % agua de mar y 25 % agua destilada (Baumann & Baumann, 1981) y (4) ZoBell: 5 g peptona bacteriológica, 1 g extracto de levadura, 0.1 g FePO4.H2O, 75 % agua de mar y 25 % agua destilada (Oppenheimer & ZoBell, 1952), para seleccionar la variante de mayor crecimiento y emisión de la luminiscencia.
Los cultivos se incubaron en zaranda orbital (Infors HT Ecotron®) a 160 r·min-1 y 28 ± 1 °C; a valores iniciales de pH y salinidad de 7.0 y 3.5 %, respectivamente (Ramahian & Chandramohan, 1994). El crecimiento bacteriano se determinó mediante la medición de la DO a 620 nm en un espectrofotómetro Genesys® 10UV. En paralelo, se midió la luminiscencia en un espectrofluorímetro Shimadzu® RF-5301pc en el cual la fuente de luz de excitación se fijó en 0 nm para evitar la interferencia de luz de la lámpara. Las mediciones se realizaron cada dos horas por un período de 8 h.
Los valores de máxima emisión luminiscente se calcularon a partir de la integración de los espectros de emisión obtenidos entre 400 y 600 nm, mediante los programas Fluorescence Spectroscopy, Optima 2.20R2 y Origin 8.0, fueron expresados como ual·ml-1 (unidades arbitrarias de luz por ml). La velocidad específica de crecimiento (µ) se calculó en la fase exponencial mediante el modelo de crecimiento no restringido para caracterizar los aislados en los medios de cultivo empleados (Gódia & López, 1998). Para comparar la velocidad específica de crecimiento de los aislados y la luminiscencia, una vez que se verificó el cumplimiento de la distribución normal de los datos según Kolmogorov Smirnov y la homogeneidad de varianza por el método de Bartlett, se realizó el análisis de varianza de clasificación simple y la prueba de comparación de medias de rangos múltiples de Duncan (Lerch, 1977) en la cual las diferencias entre las medias se distinguen por diferentes letras. Los resultados fueron procesados con el paquete estadístico Spss v.21.0. Todas las determinaciones se realizaron por triplicado y los resultados se expresaron en términos de la media ± desviación estándar (DS).
Resultados
Identificación taxonómica de los aislados: Los aislados de las cepas CBM-976 y CBM-992 presentaron características de cultivo muy similares, con colonias amarillo claro, brillantes, translúcidas, redondas y con bordes regulares. Además, emitieron una luz azul-verdosa que se aprecia a simple vista al colocar estas placas en la oscuridad. Por otra parte, la observación microscópica de los cultivos reveló la presencia de bacilos Gram negativos y móviles.
Los resultados de las pruebas bioquímicas y fisiológicas realizadas a los cultivos aparecen en el apéndice digital (Apéndice digital 2). Las cepas bacterianas evaluadas presentaron, al igual que la cepa de referencia V. harveyi ATCC 14126, respiración aeróbica facultativa y produjeron enzimas con actividad gelatinolítica, lisina carboxilasa, lipasa frente a Tween 80, caseinasa y amilasa. Los dos cultivos fueron capaces de reducir nitrato y crecieron entre 15 y 40 °C, pero no a 4 °C. Sin embargo, las cepas no produjeron indol ni ornitina carboxilasa, características que las diferencian de la cepa V. harveyi ATCC 14126 empleada como referencia. Además, ambas cepas (CBM-976 y CBM-992) presentaron cambios de coloración de verde azulado a amarillo en el medio selectivo y diferencial para Vibrio (TCBS).
El dendrograma correspondiente a la clasificación numérica, a través de la cual se compararon las características fisiológicas de los aislados como caracteres independientes, evidenció el mayor porcentaje de similitud entre los aislados de cepas CBM-976 y CBM-992 (96.9 %). Asimismo, pudo apreciarse un 100 % de similitud entre CBM-992 y Vibrio harveyi CBM-784 (Delgado et al., 2017). Por su parte, el conjunto de las cepas CBM-976, CBM-992 y Vibrio harveyi CBM-784 (Delgado et al., 2017) mostraron un 84.4 % de similitud con respecto a la cepa de referencia V. harveyi ATCC 14126 (Apéndice digital 3). A través de la identificación basada en las características fisiológicas y bioquímicas se concluyó que las cepas CBM-976 y CBM-992 pertenecen a la especie Vibrio harveyi.
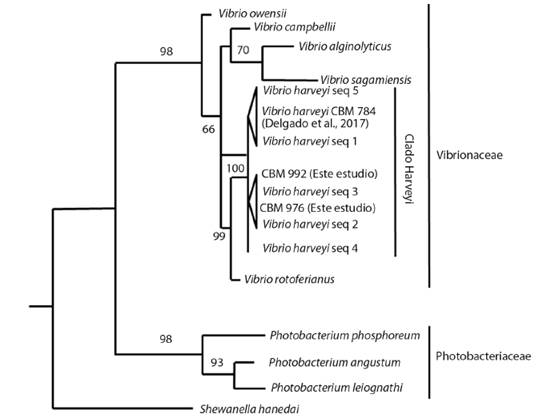
Fig. 1. Fig. 1 Árbol de posicionamiento taxonómico de bacterias luminiscentes mediante máxima verosimilitud (ML) y basado en secuencias parciales de la subunidad pequeña del ARN ribosomal (16S ARNr), subunidad beta de la girasa (gyrB) y del gen uridilato quinasa (pyrH) en una topología concatenada. Las cepas de este estudio se definen como CBM-976 y CBM-992. El número en las ramas indica el valor de soporte boostrap (porcentaje derivado de 2 000 repeticiones). Shewanella hanedai se estableció como grupo externo. Taxonomic positioning tree of luminescent bacteria by maximum likelihood (ML) and based on partial sequences of the ribosomal RNA (16S rRNA) small subunit, beta subunit of gyrB and the uridylate kinase gene (pyrH) in a concatenated topology. The strains in this study are defined as CBM-976 and CBM-992. The number in branches indicates the boostrap support value (percentage derived from 2 000 replicates). Shewanella hanedai was set as an external group.
Mediante el análisis de posicionamiento taxonómico multigénico y concatenado, empleando los genes ARNr 16S, gyrB y pyrH, se confirmó la identidad de los aislados CBM-976 y CBM-992 como Vibrio harveyi. Se observó que los aislados de este estudio se agrupan como bacterias del género Vibrio con un soporte del nodo de un 98 %. Las cepas CBM-976 y CBM-992 se posicionaron en el clado Harveyi (100 %) y compartieron su posición taxonómica con el aislado de Vibrio rotiferianus con un soporte del nodo del 99 %. Por otro lado, la familia Photobacteriaceae, reveló una separación evidente entre los cultivos identificados dentro del grupo Vibrio (Fig. 1). Las secuencias obtenidas en este estudio fueron depositadas en la base de datos del GenBank con los números de acceso correspondientes para cada gen (MT269308 y MT269307, secuencias parciales del gen 16S de 1400pb; MT274009 y MT274008, secuencias del gen gyrB de 539 pb; MT274011 y MT274010 secuencias del gen de pyrH de 585 pb).
Influencia de diferentes medios de cultivo sobre el crecimiento y la luminiscencia de las cepas CBM-976 y CBM-992. La selección de los medios que favorecen el crecimiento y la luminiscencia de los aislados se realizó a partir del análisis del crecimiento microbiano y el comportamiento de la emisión de luminiscencia en el tiempo para cada uno de los medios de cultivos evaluados (Boss, Chalk, LM y ZoBell) (Fig. 2). En general, para las dos cepas y los cuatro medios de cultivo, el patrón de crecimiento fue similar, no se observó la fase de latencia y la fase exponencial se prolongó aproximadamente durante 6 h (Fig. 2A y 2B).
Al analizar los valores de velocidad específica de crecimiento (μ) para ambas cepas en cada uno de los medios de cultivo ensayados, se demostró que para el cultivo CBM-976 no existen diferencias significativas entre ellos (P > 0.05). Mientras que para la cepa CBM-992, la μ en el medio Chalk fue menor y significativamente diferente con relación a medios de cultivo Boss, LM y ZoBell (Apéndice digital 4).
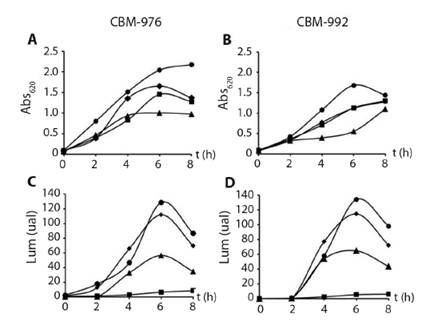
Fig. 2. Fig. 2 Influencia del medio de cultivo en el crecimiento (A: CBM-976 y B: CBM-992) y la luminiscencia (C: CBM-976 y D: CBM-992) de los aislados cultivados a 28 ± 2 °C, pH 7 y 160 r·min-1 (medios de cultivo: ■ Boss, ▲ Chalk, ♦ LM y ● ZoBell). Influence of culture medium on growth (A: CBM-976 and B: CBM-992) and luminescence (C: CBM-976 and D: CBM-992) of isolates grown at 28 ± 2 °C, pH 7 and 160 r-min-1 (culture media: ■ Boss, ▲ Chalk, ♦ LM and ● ZoBell).
Las emisiones máximas de luz para los medios LM, Chalk y ZoBell se produjeron a las 6 h de cultivo, y resultaron significativamente superiores al final de la fase exponencial e inicio de la fase estacionaria en los medios LM y ZoBell, tanto para CBM-976 como para CBM-992 (Fig. 2C y 2D).
Los espectros de emisión obtenidos para todas las condiciones evaluadas presentaron máximos de luminiscencia a 476 ± 5 y a 483 ± 3 nm para CBM-976 y CBM-992, respectivamente. En ambos cultivos los mayores valores de luminiscencia se obtuvieron en los medios LM y ZoBell y fueron significativamente diferentes a la emisión de luz encontrada en los medios Boss y Chalk. La luminiscencia máxima en LM y Zobell resultó aproximadamente el doble con respecto a la de Chalk y aproximadamente 25 veces superior a la alcanzada en Boss (Apéndice digital 4).
Discusión
Los resultados confirman que la combinación de métodos para la identificación de bacterias es lo más adecuado. Por un lado, los métodos tradicionales de identificación de bacterias aun siendo menos sensibles, son ampliamente utilizados ya que brindan información sobre la morfología y la actividad de las cepas en cuestión (Fang et al., 2019). Por otro la práctica recomienda complementar los resultados de la caracterización fisiológica y bioquímica con los análisis filogenéticos de secuencias multilocus para la identificación de bacterias luminiscentes (Ast & Dunlap, 2005;Thompson, et al., 2005; Delgado et al., 2017).
Los abordajes moleculares realizados en este estudio muestran que los aislados se posicionan de manera robusta con el nodo que agrupa a los Vibrio harveyi obtenidos de ambientes u organismos acuáticos; en tanto discrimina a especies relacionadas tales como V. campbellii, V. owensii, V. sagamiensis, V. alginolyticus, pero no a V. rotiferianus, de manera similar a los hallazgos de Ke et. al. (2017) que fueron obtenidos mediante un análisis de genómica comparativa del clado Harveyi, demostrando una alta diversidad genética intra-clado.
Sin embargo, en términos fenotípicos, las cepas CBM-976 y CBM-992 presentaron algunas características diferentes a la cepa V. harveyi ATCC 14126; tales como no producir indol ni mostrar actividad ornitina descarboxilasa. Aun cuando las cepas pertenecen a la misma especie, las condiciones ambientales y adaptación en los ecosistemas de procedencia influyen en el metabolismo bacteriano lo que posiblemente contribuya a la aparición de variaciones fenotípicas. Esta variabilidad pudiera atribuirse a la amplia distribución geográfica de las bacterias luminiscentes que condiciona su necesidad adaptativa, así un elevado número de aislados son provenientes de zonas templadas (Bagordo et al., 2012; Dunlap, 2014), en tanto otras han sido obtenidos de zonas tropicales (Martín et al., 2010; Delgado et al., 2017; Rojas-Alfaro, Umaña-Castro, Rojas-Campos, & Vargas-Montero, 2020).
Las variaciones detectadas en la identificación de especies pertenecientes al grupo Harveyi (V. harveyi, V. rotiferianus, V. campbellii, V. owensii, y V. jasicida)(Cano-Gómez, Høj, Owens, Baillie, & Andreakis, 2015), mediante herramientas bioquímicas y genéticas, se evidencia en la heterogeneidad fenotípica del grupo (Alsina & Blanch, 1994). La variabilidad en las características bioquímicas de V. harveyi también podría estar relacionada con la transferencia de genes que ocurre, tanto dentro de la misma especie, como entre diferentes géneros bacterianos (Lal & Ransangan, 2013). Una prueba de ello es la transferencia horizontal de genes lux que tiene lugar de Vibrios luminiscentes (V. harveyi) a no luminiscentes (V. vulnificus y V. chagasii) (Urbanczyk, Ogura, & Hayashi, 2014). En esta dirección, se ha comprobado que este grupo contiene elementos genéticos móviles (Cano-Gómez, Høj, Owens, & Andreakis, 2011) y ocurren importantes eventos de recombinación entre las diferentes especies (Urbanczyk et al., 2014), lo que contribuye a la adquisición de nuevas características fenotípicas.
Algunos estudios basados en la caracterización fenotípica de bacterias luminiscentes informan a V. harveyi, V. fischeri y P. leiognathi como especies frecuentemente encontradas en aguas costeras templadas y tropicales (Chiu, Chou, Jean, & Shieh, 2007). En Cuba, han sido descritas especies de Photobacterium phosphoreum, V. harveyi y V. splendidus en las aguas oceánicas al sur de la Isla, mientras en las aguas de la plataforma noroccidental fueron aisladas las especies P. leiognathi (Lugioyo, 2003) y V. harveyi (Delgado et al., 2017).
En los estudios de fisiología bacteriana uno de los aspectos iniciales a tener en cuenta es la selección del medio de cultivo. En particular, para las bacterias luminiscentes se han descritodiversosmedios de cultivocon el fin de evaluarelcrecimientoy la emisióndeluz(Baumann & Baumann, 1981; Ramahian & Chandramohan, 1994; Danyluk, Uchman, Konieczny, & Bilska, 2007).
En los medios de cultivo Chalk, LM y ZoBell, las máximas intensidades de luz de las cepas CBM-976 y CBM-992 se obtuvieron durante el final de la fase exponencial e inicio de la fase estacionaria y son consistentes con lo informado en otras investigaciones (Meighen, 1993; Ramahian & Chandramohan, 1994; Soto & Gutierrez, 2009). Coincidentemente, Krieg y Holt (1984) encontraron que la máxima luminiscencia se obtuvo en el inicio de la fase estacionaria del crecimiento y luego disminuyó rápidamente. Otros estudios han demostrado que cuando se alcanza cierto nivel de luminiscencia la síntesis de la enzima finaliza y comienza la inactivación de esta (Soto & Gutierrez, 2009).
Los máximos de luminiscencia de las cepas CBM-976 y CBM-992 (476 ± 5 y 483 ± 3 nm, respectivamente) se presentaron en las longitudes de onda referidas para bacterias luminiscentes marinas (470-490 nm) (Makiguchi et al., 1979; Dunlap, 2014). Específicamente, en cepas de V. harveyi aisladas del Mar Arábigo presentaron los máximos de luminiscencia en el rango entre 466-474 nm (Ramahian & Chandramohan, 1994).
La emisión de luz en las condiciones experimentales para las dos cepas resultó superior en los medios de cultivo ZoBell y LM. Ambos medios incluyen en su composición un 75 % de agua de mar, que aporta micronutrientes que pudieran estar involucrados como cofactores en el proceso de emisión de luz. En contraste, los medios Boss y Chalk se preparan con agua destilada y 3 % de NaCl, por lo que carecen de otros microelementos. El fenómeno de inducción de la luminiscencia requiere que los medios de cultivo contengan Na+, Ca2+, Cl+, HCO3 -, K+, Mg2+ y S2- (Tabei et al., 2011; Tabei, Era, Ogawa, & Morita, 2012). En particular, el Na+ garantiza en Vibrio fisheri funciones celulares generales tales como la estabilización de actividades de la membrana celular y garantiza la motilidad del flagelo. Asimismo, este ion participa en la cadena respiratoria dependiente de Na+ presente en bacterias marinas muy relacionada con el fenómeno de la luminiscencia (Tabei et al., 2011, Tabei et al., 2012). Por otra parte, el medio LM contiene 1 g·L-1 deCaCO3, un inductor de la luminiscencia y activador de la respiración dependiente de Na+ (Baumann & Baumann, 1981; Tabei et al., 2012). especies luminiscentes como Photobacterium phosphoreum, se ha demostrado que el K+ contribuye a la expresión de genes involucrados en el fenómeno de bioluminiscencia (Watanabe, Inaba, & Hastings, 1991). En el medio Chalk, la menor emisión de luz pudiera atribuirse, tanto a la ausencia de micronutrientes como a una alta concentración de glicerol (10 g·L-1), con respecto al medio LM (3 g·L-1). Resultados similares se obtuvieron para una cepa de Vibrio rotiferianus aislada de la playa Dui, India, donde en los medios de cultivo Chalk y Boss los niveles de luminiscencia fueron menores que en LM (Shanware et al., 2013).
En esta investigación se corroboró que la combinación de las características fisiológicas y bioquímicas, así como las técnicas basadas en la biología molecular resultaron adecuadas para ubicar la posición taxonómica de las cepas CBM-976 y CBM-992 aisladas de aguas marinas cubanas como Vibrio harveyi. Además, se lograron seleccionar los medios LM y ZoBell como los más adecuados paraelcrecimientoy emisión de la luminiscencia en ambas cepas. A partir de la selección de los medios de cultivos LM y ZoBell se continuarán los estudios de optimización de las condiciones de crecimiento y luminiscencia para las cepas CBM-976 y CBM-992, imprescindibles para el diseño y desarrollo de métodos sencillos y rápidos destinados a la detección de contaminantes en ecosistemas marinos.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

