Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.59 n.4 San José Dec. 2011
Jesylén Castillo1,2, Nora Eslava2 & Leo Walter González2
1. Escuela de Ciencias Aplicadas del Mar. Universidad de Oriente, Núcleo Nueva Esparta, Venezuela; jesylencastillo31@gmail.com2. Área de Biología y Recursos Pesqueros, Instituto de Investigaciones Científicas, Universidad de Oriente, Núcleo Nueva Esparta, Venezuela; neslava20@yahoo.es, lwgc25@gmail.com
Dirección para correspondencia
Abstract
Dana Swimming crab growth Callinectes danae (Decapoda: Portunidae) from Margarita Island, Venezuela. Callinectes danae is a common species captured with crab traps in nearby areas of coastal lagoons in Margarita Island. Although its considerable economic importance as a fishery resource, few studies have been done on population dynamics and its fishery potential in local coastal environments to support decision making in fishery administration. We present growth pattern details of Callinectes danae to better estimate its population size and exploitation feasibility. For this, we analyzed a total of 3 623 specimens that were Wonthly captured in crab pots by artisanal fishermen in Las Marites lagoon, from October 2007 to September 2008. The length-weight ratio was determined, and growth parameters estimated from both length and weight curves of the von Bertalanffy model. The general sex ratio showed no significant difference between males and females (χ2=0.04, p>0.05). However, values of slopes b between males and females were significantly different (ts=2.75, p<0.05), as well as intercepts a (ts=2.44, p<0.05). Thus, the length-weight ratio was determined separately: W=7.48e-5*L2.98 for males and W=1.21e-4*L2.87 for females, indicating a negative allometric growth in both sexes. Growth parameters were established as: L∞=134.80mm, W∞=166.04g and k=0.86/yr for males; L∞=122.35mm, W∞=118.45g and k=0.63/yr for females. Lifespan was estimated at 3.05 years for males and 4.24 years for females. We concluded that Callinectes danae is a species with short lifespan and moderately rapid growth. The coefficient of variation values (CV), of the phi-prime growth performance index (Ø’), showed a different growth pattern compared to those obtained in other regions. We propose that a management strategy will be the periodical review of the minimum capture size for fishing area, after the great variability found in growth parameters. Rev. Biol. Trop. 59 (4): 1525-1535. Epub 2011 December 01.
Key words: growth, dana swimcrab, Callinectes danae, Portunidae, Margarita Island, Venezuela.
Resumen
Palabras clave: crecimiento, cangrejo, Callinectes danae, Portunidae, Isla Margarita, Venezuela.
En la dinámica de poblaciones sometidas a explotación, el conocimiento y caracterización del crecimiento individual es de suma importancia pues este proceso, junto con la supervivencia, determina la magnitud de la disponibilidad del recurso. En este sentido, es evidente que al obtener un conocimiento detallado sobre el patrón de crecimiento de una especie se lograrán estimaciones más precisas sobre el tamaño de la población y su disponibilidad para la explotación, o por lo menos con márgenes de variabilidad conocidos (Arreguin et al. 1991). Se puede definir el crecimiento de manera cuantitativa de varias formas, entre ellos se encuentra el modelo de von Bertalanffy. Aunque la fisiología de los crustáceos es muy diferente a la de los peces, el crecimiento, en la mayoría, se adecua al modelo de crecimiento de von Bertalanffy (Musick & Frazer 1999).
Callinectes danae Smith, 1869 constituye, indudablemente, un recurso de considerable importancia económica entre los crustáceos comestibles; sin embargo, pocos estudios han sido publicados sobre la biología, ecología y potencialidad pesquera en ambientes costeros de Venezuela que amerita información de índole periódica de los parámetros de crecimiento indispensables en la evaluación y toma de decisiones en la administración pesquera. Por tal razón, se decidió realizar esta investigación con el fin de contribuir al conocimiento de la dinámica poblacional de este recurso para su mejor aprovechamiento de manera sustentable de la flota artesanal de La Isleta, la cual está ubicada en el municipio García, en la costa sur de la Isla de Margarita, su costa presenta alternados acantilados y playas que registran una intensa actividad pesquera, y el mar circundante está caracterizado por un sistema de corrientes que mantiene en constante renovación la masa de agua (Lárez 2004).
Materiales y métodos
Se realizaron muestreos mensuales desde octubre 2007 hasta septiembre 2008 y se analizó un total de 3 623 ejemplares de C. danae en La Isleta, durante la actividad de pesca de la flota artesanal (96 embarcaciones) que opera en áreas cercanas a la Laguna de Las Marites (10°53’25’’ N - 63°55’33’’ W). Del total, 10 embarcaciones de 7m de eslora con motor fuera de borda realizaron faenas tres veces al día, desde las 7am hasta las 12pm, utilizando cada una 45 nasas cangrejeras rectangulares (40-45cm de largo, 30-35cm de ancho y 30-40cm de altura), unidas a través de una cuerda (enyugue de nasas) a una distancia de 10 brazadas entre nasas.
Para analizar diferencias significativas respecto a la proporción sexual ♂:♀ se aplicó la prueba Chi-cuadrado (Zar 1996) (α=0.05, χ2=3.841) con correcciσn de Yates para continuidad (Steel & Torrie 1985).
Relación longitud-peso: Se determinó la relación talla-peso mediante la ecuación propuesta por Ricker (1975): P=a*Lb; donde P es el peso total en g, L es el ancho del caparazón en mm, a es la intersección con el eje de las ordenadas y b es la pendiente de la curva. Las constantes a y b fueron estimadas por el método de los mínimos cuadrados, previa linearización de los datos mediante una transformación logarítmica (Ricker 1973). Se determinó la existencia de diferencias significativas entre los coeficientes de machos y hembras (a y b), y se probó la hipótesis del crecimiento isométrico (Ricker 1975) mediante una prueba t student (Walpole & Myers 1989) con un nivel de significación de α=0.05.
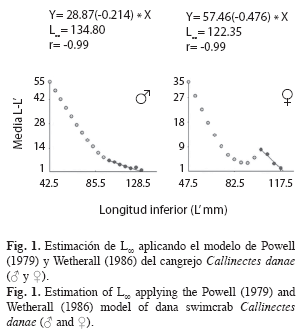
Parámetros de crecimiento: La estimación del crecimiento se basó en el análisis de la distribución de frecuencia de longitudes (anchos del caparazón). Para ello se uso el software FiSAT (Gayanilo et al. 1996). En primer lugar, se estimó una longitud asintótica (L∞) aplicando el método de Powell (1979) y Wetherall (1986), que permitió determinar el coeficiente de crecimiento (k) a través de la rutina ELEFAN I. En segundo lugar, se calculó el to de acuerdo a la fórmula anotada por Pauly (1979): Log10(-to)=-0.3922-0.2752*Log10L∞- 1.038*Log10k; donde to es la edad teórica en que el organismo tiene talla cero, L∞ es el ancho del caparazón asintótico o ancho promedio máximo y k es el coeficiente de crecimiento o coeficiente de curvatura. Para el cálculo de la longevidad se utilizó la ecuación de Taylor (1958): A0.95=to+2.996/k; donde A0.95 es la edad límite o tiempo requerido para alcanzar el 95% del ancho del caparazón máximo promedio (L∞). El peso asintótico se estimó mediante la fórmula anotada por Csirke (1980): P∞=a*L∞ b; donde P∞ es el peso asintótico o peso máximo promedio.
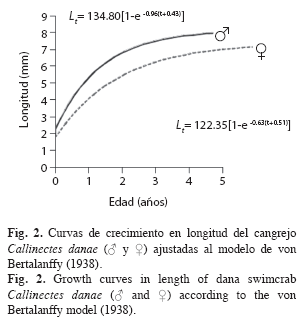
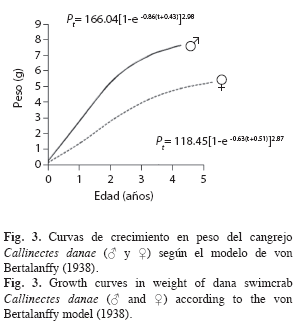
Una vez ajustados L∞, P∞, k y to, tanto en machos como en hembras, se determinaron las curvas de crecimiento en longitud y en peso adecuadas al modelo de von Bertalanffy (1938), según las siguientes ecuaciones: Lt=L∞[1-e–k(t-to)]; Pt= P∞[1-e–k(t-to)]b. Las curvas de crecimiento, de longitud (ancho del caparazón) para ambos sexos, fueron comparadas a través de un análisis de varianza de doble vía con un nivel de significación de 0.05 (Sokal & Rohlf 1969). Los parámetros de crecimiento estimados de C. danae, fueron comparados con resultados obtenidos por otros investigadores en diferentes regiones, mediante el índice phi prima (Ø’) de Munro & Pauly (1983): Ø’=Log10k+2Log10L∞ y el criterio de Sparre & Venema (1995) quienes establecen que el coeficiente de variación (CV) no debe exceder del 4% para poder asumir que los resultados son estadísticamente similares.
Resultados
Los machos mostraron longitudes (anchos del caparazón) entre 48 y 130mm (media 97.20±11.25mm) y pesos que oscilaron entre 7 y 135g (media 64.85±20.69g). Por otra parte, las hembras presentaron longitudes de 54 a 121mm (media 82.96±7.35mm) y pesos que oscilaron entre 11 y 109g (media 39.36±9.85g) (Cuadro 1). La proporción sexual de machos y hembras se desvió de la igualdad a lo largo de todo el período de muestreo; sin embargo, para la totalidad del período de estudio la proporción sexual global fue 1:1 (χ2=0.04, p>0.05) (Cuadro 2).
Relación longitud-peso: Los valores de la pendiente b entre machos y hembras presentaron diferencias significativas (ts=2.75, p<0.05) igualmente las intersecciones a (ts=2.44, p<0.05); razón por la cual la relación longitudpeso se estableció por separado, quedando en los machos: P=7.48e-5*L2.98 y en las hembras: P=1.21e-4*L2.87.
Parámetros de crecimiento: La longitud asintótica estimada fue L∞=134.80mm para machos y L∞=122.35mm para hembras (Fig. 1); el coeficiente de crecimiento fue k=0.86/año en machos y k=0.63/año en hembras; la edad teórica to=-0.43años en machos y to=-0.51años en hembras. La longevidad o edad límite (A0.95) calculada fue de 3.05 años para machos y 4.24 años para hembras.
La comparación de las curvas de crecimiento en longitud (ancho del caparazón) y peso por sexo, a partir del análisis de varianza, demostró que hay diferencia estadísticamente significativa entre machos y hembras tanto en las curvas de longitud (FS=1128.36, p<0.05), como en las de peso (FS=115.06, p<0.05); lo que conllevó a establecer las curvas de crecimiento por sexo separado ajustadas al modelo de von Bertalanffy. Las curvas de crecimiento en longitud de machos y hembras describieron curvas de tipo exponencial; se observó un rápido crecimiento en el primer año de vida, para luego disminuir a medida que alcanzaba la longitud asintótica (Fig. 2).
El peso asintótico (P∞) fue obtenido usando las constantes a y b de la relación talla-peso y las longitudes asintóticas (L∞) estimadas. Los valores obtenidos fueron: P∞=166.04g en machos y P∞=118.45g en hembras, los cuales fueron reemplazados en la ecuación de crecimiento en peso. Las curvas de crecimiento en peso evidenciaron una curva tipo sigmoidea, donde se observó un crecimiento lento en el primer año de vida, luego se aceleró y posteriormente se produjo una inflexión hasta acercarse a su peso máximo (Fig. 3).
El coeficiente de variación obtenido tanto en machos (CV=9%) como en hembras (CV=12%), permitió establecer que hay diferencia en el patrón de crecimiento de la especie C. danae (Cuadro 3).
Discusión
Relación longitud-peso: El valor de b, para machos (b=2.98) y hembras (b=2.87), indicó un crecimiento alométrico negativo, lo cual significa que, a medida que los individuos crecen se modifican sus proporciones corporales, siendo, en este caso, menos pesados para la longitud que se tiene. Dicho resultado coincide con lo reportado por Pereira-Barros & Travassos (1975) (b=2.65) y Branco & Thives (1991) (b=2.89) para hembras de C. danae. Estudios de crecimiento en hembras de C. bellicosus (Molina-Ocampo 2001) y C. bocourti (Costa et al. 1980), mostraron un crecimiento alométrico negativo. Molina-Ocampo (2001), anotó que este tipo de crecimiento es debido a las bajas tasas de alimentación y mayor gasto energético en la temporada reproductiva. Un crecimiento isométrico (b=3) indica que, a medida que crecen mantienen sus proporciones corporales, como señala Baptista et al. (2005) para la misma especie. De la misma manera, Nevárez et al. (2003) y Hernández & Arreola (2007), observaron crecimiento isométrico en C. arcuatus y C. bellicosus; expresando, estos últimos investigadores, que los machos del género Callinectes, eventualmente pueden tener un sesgo hacia el crecimiento alométrico, debido a la presencia de hembras en la temporada reproductiva.
La relación longitud-peso mostró que los machos alcanzan mayores tallas y pesos que las hembras. Esto en los braquiuros, parece ser una generalidad asociada con el proceso reproductivo debido a que la hembras detienen su crecimiento para destinar gran parte de la energía a la reproducción, mientras que los machos continúan creciendo aún después de alcanzar la madurez sexual; y la cópula se realiza cuando la hembra está mudada por lo que el macho que la toma debe tener mayor tamaño para protegerla de depredadores; mientras que se regenera el exoesqueleto (Sastry 1983). El mayor peso de los machos, también, puede ser explicado por la diferencia en el tamaño de los apéndices quelados, los cuales son más robustos en los machos. Pereira-Barros & Travassos (1975) y Costa et al. (1980), estudiando el crecimiento de C. danae y C. bocourti, indican que ocurre dimorfismo sexual, en cuanto al peso, los machos son más pesados que las hembras. Este factor conllevaría a considerar que los resultados obtenidos en la presente investigación corroboran las características biológicas de la especie.
Parámetros de crecimiento: Las longitudes asintóticas (L∞) estimadas de C. danae en este estudio fueron diferentes a las encontradas por Williams (1974) en la costa este de los Estados Unidos (♂=140mm; ♀=120mm), Branco & Masunari (1992) en Florianópolis, Brasil (♂=140mm; ♀=133mm) y Keunecke et al. (2008) en Río de Janeiro, Brasil (♂=120mm, ♀=111mm). Igualmente, difieren de las presentadas por Rosas & Navarrete (2008) para Callinectes sapidus de la Bahía de Chetumal, México (♂-♀=231.50mm) y Ferreira & D’Incao (2008) para la misma especie en la Laguna Los Patos, Brasil (♂=162.71mm; ♀=157.78mm). En tal sentido, se puede considerar que las diferencias son debidas, posiblemente, a las zonas geográficas, a la aplicación de métodos distintos en la determinación de edad y crecimiento, y a la disparidad en el diseño de muestreo (González 2005). El índice de curvatura (k) estimado para ambos sexos, indica un crecimiento moderadamente rápido, similar a lo señalado por Branco & Masunari (1992) (♂=0.69/año, ♀=0.65/año), pero difiere con lo reportado por Keunecke et al. (2008) (1.8/año para ambos sexos). Este índice es útil para caracterizar la vulnerabilidad potencial de las poblaciones a una mortalidad excesiva (Musick & Frazer 1999).
La curva de crecimiento en longitud del tipo exponencial suele ser muy rápido al principio, cuando el organismo es muy joven, pero se va haciendo más lento a medida que aumenta la edad, y a medida que éste alcanza el tamaño o la longitud máxima promedio que cada individuo puede alcanzar. No obstante, el crecimiento en peso sigue un patrón diferente, ya que describe una curva del tipo sigmoideo; debido, probablemente, a que en las etapas tempranas de vida parte de la energía es destinada a la maduración de las gónadas (Csirke 1980).
El alto valor del coeficiente de variación del índice de phi prima (Ø’) por sexo, indica diferencia en los patrones de crecimiento de Callinectes danae, esto podría deberse a características de hábitat, estimaciones a partir de distintos métodos de análisis de datos, tamaño de la muestra, modalidad de captura y selectividad de los artes de pesca (Rosas & Navarrete 2008). Sin embargo, Pauly & Munro (1984) anotaron que dentro de una familia, los valores de (Ø’) están normalmente distribuidos y, que en las especie de una misma familia sus valores son similares.
Agradecimientos
Expresamos nuestro más sincero agradecimiento a los pescadores de la comunidad de La Isleta, Orangel Antón, Juancho, Moncho y Alexis por su apoyo logístico en la obtención de las muestras biológicas. A Francisco Guevara por su apoyo en el laboratorio de Biología Pesquera del IIC-UDONE. A Clark Casler por las aclaratorias sobre el recurso.
Referencias
Arreguín, F., J.A. Sánchez & O. Defeo. 1991. Análisis del crecimiento de la almeja amarilla (Mesodesma mactroides) de la costa uruguaya en base a datos de composición por longitudes. Frente Marítimo 9: 75-81. [ Links ]
Baptista, C., M. Pinheiro, A. Blankesteiyn & C. Borzone. 2005. Biologia populacional e reproductiva de Callinectes danae Smith (Decapoda: Portunidae) no Balneário Shangrí-lá, Pontal do Paraná, Paraná, Brasil. Rev. Bras. Zool. 22: 446-453. [ Links ]
Von Bertalanffy, L. 1938. A quantitative theory of organic growth. Hum. Biol. 10: 181-213. [ Links ]
Bond, G. & L. Backup. 1983. O cultivo de Macrobrachium borellii (Nobili, 1896) e de Macrobrachium potiuna (Müller, 1880) em laboratório (Crustacea, Decapoda, Palaemonidae). Rev. Bras. Biol. 43: 177-190. [ Links ]
Branco, J. & S. Masunari. 1992. Crescimento de Callinectes danae (Decapoda: Portunidae) da lagoa da Conceiçao, Florianápolis, Santa Catarina, Brasil. Rev. Bras. Zool. 9: 53-66. [ Links ]
Branco, J. & S. Masunari. 2000. Reproductive ecology of the blue crab Callinectes danae Smith 1869, in the Conceição Lagoon system, Santa Catarina Isle, Brazil. Rev. Bras. Biol. 60: 17-27. [ Links ]
Branco, J. & A. Thives. 1991. Relação peso/ largura, fator de condição e tamanho de primeira maturação de Callinectes danae Smith 1869 (Crustacea: Decapoda) no Manguezal do Itacorubi, SC, Brasil. Arq. Biol. Tecnol. 34: 415-424. [ Links ]
Costa, F.J.C.B., I.V. Nascimento & M.F.P. Sa. 1980. Estudo biométrico do siri gurjaú, Callinectes bocourti A. Milne Edwards, 1879, da Lagoa Menguaba. Bol. Núcl. Ests. Cis. Mar., Maceió. 2: 5-9. [ Links ]
Csirke, J. 1980. Introducción a la dinámica de poblaciones de peces. FAO, Documento Técnico de Pesca 192. Roma, Italia. [ Links ]
Ferreira, L.S. & F. D’Incao. 2008. Crescimento de Callinectes sapidus (Crustacea, Decapoda, Portunidae) no estuário da laguna dos Patos, Rio Grande do Sul, Brasil. Iheringia. Ser. Zool. Porto Alegre 98: 70-77. [ Links ]
Gayanilo, F., P. Sparre & D. Pauly. 1996. Stock assessment tools users manual. FAO, 8. Roma, Italia. [ Links ]
González, L.W. 2005. Análisis de la pesquería artesanal de la sardina Sardinella aurita, Valenciennes, 1847 (Pisces: Clupeidae) de la región nororiental de Venezuela. Bol. Inst. Oceanogr. Venez. 24: 111-128. [ Links ]
Hendrickx, M. 1995. Cangrejos. Guía FAO para la identificación de especies para los fines de pesca. FAO, Roma, Italia. [ Links ]
Hernández, L. & J. Arreola. 2007. Estructura de tallas y crecimiento de los cangrejos Callinectes arcuatus y C. bellicosus (Decapoda: Portunidae) en la laguna costera Las Guásimas, México. Rev. Biol. Trop. 55: 226-233. [ Links ]
Hill, R., M. Wyse & M. Anderson. 2006. Fisiología animal. Panamericana, Caracas. [ Links ]
Keunecke, K., F. D’Incao, F. Moreira, D. Silva & J. Verani. 2008. Idade e crescimento de Callinectes danae e C. ornatus (Crustacea: Decapoda) na Baía de Guanabara, Rio de Janeiro, Brasil. Iheringia. Ser. Zool. Porto Alegre 98: 231-235. [ Links ]
Lárez, D. 2004. Variación de la estructura comunitaria del fitoplancton en el área pesquera Porlamar-La Isleta, Isla de Margarita, Venezuela; en el período febrerojulio 2002. Tesis de Licenciatura, Universidad de Oriente, Boca de Río, Venezuela. [ Links ]
Molina-Ocampo, R. 2001. Jaiba del Estado de Sonora Callinectes bellicosus, p. 329-248. In Sustentabilidad y pesca responsable en México. Evaluación y manejo. INP/SEMARNAP, Sonora, México. [ Links ]
Munro, J. & D. Pauly. 1983. A simple method for comparing growth of fishes and invertebrates. Fishbyte 1: 5-6. [ Links ]
Musick, J. & N. Frazer. 1999. Planificación del manejo para especies longevas. Contribución Nº 2353 del Virginia Institute of Marine Science: 61-67. [ Links ]
Nevárez, M., J. López, C. Cervantes, E. Miranda, R. Morales & M. Anguiano. 2003. Evaluación biológica y pesquera de las jaibas Callinectes bellicosus y Callinectes arcuatus (Brachyura: Decapoda: Portunidae) en las bahía de Guásimas y Lobos, Sonora, México, p. 143-151. In M.E. Hendrickx (ed.). Contribuciones al estudio de los crustáceos del Pacífico Este 3. Instituto de Ciencias del Mar y Limnología, UNAM, México. [ Links ]
Pauly, D. 1979. Theory and management of tropical multispecies stocks: a review with emphasis on the Southeast Asian demersal fisheries. ICLARM Studies and Review, Manila, Philippines. [ Links ]
Pauly, D. & J.L. Munro. 1984. Once more on the comparison of growth in fish and invertebrates. Fishbyte 2: 21. [ Links ]
Pereira-Barros, J.B. & I. Travassos. 1975. Informes sobre a pesca e biologia do siri tinga (Callinectes danae) e guajaú (Callinectes bocourti), na Lagoa Mundaú, Maceió, Alagoas. Superintendência do Desenvolvimento do Nordeste, Departamento de Recursos Pesqueiros, Recife, Brasil. 9. [ Links ]
Pope, J., A. Margetts, J. Hamley & E. Akyüz. 1983. Manual de métodos para la evaluación de las poblaciones de peces. Parte 3. Selectividad del arte de pesca. FAO, Documento Técnico de Pesca 41, Roma, Italia. [ Links ]
Powell, D. 1979. Estimation of mortality and growth parameters for the length frequency of a catch. Report procès-V Réunion Conseil International pour L’Exploitation de la Mer. 175: 167-169. [ Links ]
Ricker, W. 1973. Linear regressions in fishery research. J. Fish. Res. Board. Can. 30: 409-434. [ Links ]
Ricker, W. 1975. Computation and interpretation of biological statistics of fish populations. Bull. Fish. Res. Board. Can. 191: 382. [ Links ]
Rosas, C. & A. Navarrete. 2008. Parámetros poblacionales de la jaiba azul Callinectes sapidus (Rathbunae, 1896) en la Bahía de Chetumal, Quintan Roo, México. Rev. Biol. Mar. Oceanog. 43: 247-253. [ Links ]
Sastry, A. 1983. Ecological aspects of reproduction, p. 179-270. In D.E. Bliss (ed.). The biology of Crustaceae. Academic, Nueva York, EEUU. [ Links ]
Silva, D., D. Silva & M. Negreiros. 2004. Somatic growth of the mudflat fiddler crab Uca rapax (Smith, 1870) (Brachyura: Ocypodidae) from two subtropical mangroves in Brazil. Universidad y Ciencia 20: 15-22. [ Links ]
Sokal, R. & F. Rohlf. 1969. Biometry. W.H. Freeman and Co., San Francisco, EEUU. [ Links ]
Sparre, P. & S. Venema. 1995. Introducción a la evaluación de los recursos pesqueros tropicales. Parte 1. FAO, Documento Técnico de Pesca 306: Revisión 1. Valparaíso, Chile. [ Links ]
Steel, R. & J. Torrie. 1985. Bioestadística: Principios y procedimientos. Mc. Graw-Hill, Latinoamericana S.A., Bogotá, Colombia. [ Links ]
Taylor, C. 1958. Cod growth and temperature. Journal of Conseil International pour L´Exploitation de la Mer. 23: 366-370. [ Links ]
Van Engel, W. 1958. The blue crab and its fishery in Chesapeake Bay. Reproduction, early development, growth migration. Commer. Fish. Rev. 24: 6-17. [ Links ]
Villasmil, L. 1994. Aspectos taxonómicos y biológicospesqueros del recurso cangrejo del género Callinectes, Stimpson, 1880 (Crustacea: Portunidae) en el Lago de Maracaibo, Venezuela. Tesis de Maestría, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Villasmil, L. & J. Mendoza. 2001. Las pesquería del cangrejo Callinectes sapidus (Decapoda:Brachyura) en el Lago de Maracaibo, Venezuela. Interciencia 26: 301-306. [ Links ]
Walpole, R. & R. Myers. 1989. Probabilidad y estadística para ingenieros. Interamericana, México. [ Links ]
Wetherall, J. 1986. A new method for estimating growth and mortality parameters from length-frequency data. Fishbyte 4: 12-14. [ Links ]
Williams, A. 1974. Shrimp lobster and crabs of the Atlantic coast of the Eastern Unites States, Maine to Florida. Smithsonian Institution, Washington D.C., EEUU. [ Links ]
Zar, J. 1996. Biostatistical analysis. Prentice Hall, Nueva Jersey, EEUU. [ Links ]
Nora Eslava & Leo Walter González. Área de Biología y Recursos Pesqueros, Instituto de Investigaciones Científicas, Universidad de Oriente, Núcleo Nueva Esparta, Venezuela; neslava20@yahoo.es, lwgc25@gmail.com
Recibido 03-IX-2010. Corregido 09-III-2011. Aceptado 08-IV-2011.