Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.59 n.2 San José Jun. 2011
Abundancia relativa y uso de microhábitat de la rana Geobatrachus walkeri (Anura: Strabomantidae) en dos hábitats en Sierra Nevada de Santa Marta, Colombia
Vera Martínez Baños1, Vanesa Pacheco Florez1 & Martha P. Ramírez-Pinilla2
1.Universidad del Magdalena, Santa Marta, Colombia; tatianam86@gmail.com, vanesasofi@gmail.com
2.Laboratorio de Biología Reproductiva de Vertebrados, Universidad Industrial de Santander, Bucaramanga, Colombia; mpramir@gmail.com, mpramir@uis.edu.co
Dirección para correspondencia.
Abstract
Relative abundance and microhabitat use by the frog Geobatrachus walkeri (Anura:Strabomantidae) in two habitats of Sierra Nevada de Santa Marta, Colombia. Geobatrachus walkeri belongs to a monotypic frog genus endemic to the San Lorenzo area, Sierra Nevada de Santa Marta, Colombia. This species has been categorized as endangered because of its small distribution area and the decline in the extent and quality of its habitat. It inhabits two forest types with different composition and structure, the native secondary forest and a pine plantation (dominated by Pinus patula). To compare the relative abundance and microhabitat use of this species in these habitat types, 30 quadrants/environment were distributed randomly. The individual number, microhabitat use and other aspects of its natural history were registered using visual encounter surveys in both sites, including non-sampled areas in the quadrants. The relative abundance of frogs was significantly different between habitats and among seasons. The highest abundance of G. walkeri relative to the total area was found in the pine plantation, being 2.3 times higher than in the natural forest. More frogs were significantly found during the rainy season; nevertheless, active individuals were also found during the dry season. Significant differences were found in the microhabitat use with respect to the forest type and season. The most frequently microhabitat used in the two forest types was the pine leaf-litter; besides, in the native forest, the microhabitat occupied more frequently presented medium and large size stones. Geobatrachus walkeri is a successful species in pine plantations, associated permanently to its leaf-litter environment where it seems to develop its entire life cycle. The clear modifications in the soils and water, derived from the introduction of the pine plantation in this area, seem not to have negatively affected the conservation and successful maintenance of this species. Rev. Biol. Trop. 59 (2): 907-920. Epub 2011 June 01.
Key words: leaf-litter anurans, amphibian conservation, pine plantations, native tropical forests, Sierra Nevada de Santa Marta.
Resumen
La rana Geobatrachus walkeri pertenece a un género monotípico y endémico del área de San Lorenzo, Sierra Nevada de Santa Marta, Colombia. La especie habita en el bosque secundario natural y en una plantación de pino (dominada por Pinus patula). Para comparar la abundancia relativa y el uso del microhábitat en estos dos hábitat y durante los períodos de máxima y mínima precipitación, se distribuyeron aleatoriamente 30 cuadrantes en cada bosque sobre los que se registraron el número de individuos y los microhábitats ocupados. Además se reconocieron otros aspectos de la historia natural mediante muestreo por encuentros casuales (VES), se incluye en los dos hábitats áreas no muestreadas por los cuadrantes. La mayor abundancia de ranas se obtuvo en la plantación de pino y durante la época de lluvias. El microhábitat más usado fue la hojarasca de pino. Geobatrachus walkeri es una especie exitosa en las plantaciones de pino, asociada permanentemente a su hojarasca en donde parece desarrollar todo su ciclo de vida. Las claras modificaciones derivadas de la introducción de las plantaciones de pino en el suelo y el agua, parecen no haber afectado la supervivencia y mantenimiento exitoso de esta especie categorizada como en peligro de extinción.
Palabras clave: anuros de hojarasca, conservación de anfibios, plantaciones de pino, bosques nativos tropicales, Sierra Nevada de Santa Marta.
Entre los lugares más destacados del Neotrópico por su biodiversidad y endemismo se encuentra la Sierra Nevada de Santa Marta (SNSM), localizada en el norte de Colombia. Éste es un macizo fisiográficamente aislado que por sus características geográficas, climáticas y geomorfológicas constituye un mosaico complejo que comprende casi todas las zonas de vida del Neotrópico, desde matorrales espinosos semi-desérticos, manglares, bosques tropicales secos y húmedos, bosques montañosos y páramos, hasta las nieves perpetuas (Strewe & Navarro 2004). La SNSM es una de las regiones ecológicas más diversas del mundo, presenta elementos comunes de las regiones que la rodean y elementos propios y por el efecto de aislamiento concentra un alto grado de endemismo de flora y fauna (Strewe 2008). Los anfibios son el grupo con mayor representación de endemismo en la SNSM; comprenden 2 órdenes, 7 familias, 8 géneros, 20 especies, de las cuales 19 son endémicas, pertenecientes a los géneros Bolitoglossa (1 sp. B. savagei), Geobatrachus (1 sp. G. walkeri), Pristimantis (8 spp., P. carmelitae, P. cristinae, P. delicatus, P. insignitus, P. megalops, P. ruthveni, P. sanctamartae y P. tayrona), Ikakogi (1 sp., Ikakogi tayrona), Colostethus (1 spp., C. ruthveni), Cryptobatrachus (2 spp., C. boulengeri y C. ruthveni) y Atelopus (5 sp., A. arsyecue, A. carrikeri, A. laetissimus, A. nahumae y A. walkeri) (Frost 2010).
Una de las zonas al interior del macizo que ha sido más estudiada con respecto a su fauna de anfibios es la Cuchilla de San Lorenzo (Ruthven 1915, 1922, Ruiz-Carranza & Hernández 1978, Ardila-Robayo 1979, Granda et al. 2008, Carvajalino et al. 2008), la cual es además considerada como uno de los últimos lugares que proporciona hábitats significativos para especies de fauna y flora en peligro de extinción (American Bird Conservancy 2006). Sin embargo, varias hectáreas de bosque nativo de esta área han sido taladas para el uso de la tierra en prácticas agrícolas. Para su reforestación en los años 70´s, el entonces INDERENA (Instituto Nacional de los Recursos Naturales Renovables y del Ambiente) autorizó la siembra de plántulas de pino, acacias y eucalipto para la producción de materia prima para la industria de papel y madera (Gómez-Torres 2005). A este panorama se suma que en algunas áreas aledañas el bosque nativo ha sido reemplazado por cultivos y potreros para cría de ganado, lo que ha contribuido con la destrucción continua de la vegetación nativa y de esta forma amenazando el hábitat de especies nativas y endémicas de flora y fauna (Strewe & Navarro 2003). Aunque, la zona está bajo la jurisdicción y protección de entidades ambientales (CORPAMAG y Parques Nacionales Naturales), y a pesar de ser considerada como reserva natural, se sigue presentando pérdida y degradación de hábitat.
Geobatrachus walkeri es una rana perteneciente a un género monotípico endémico del sector de San Lorenzo en la SNSM. El género ha sido incluido en familias como Brachycephalidae, Dendrobatidae, Microhylidae, Leptodactylidae (Ardila-Robayo 1979) y finalmente reubicado de manera provisional dentro de la familia Strabomantidae y subfamilia Strabomantinae debido a su semejanza con el género Pristimantis (Hedges et al. 2008). Después de su descripción original, la especie fue estudiada ampliamente por Ardila-Robayo (1979). Este trabajo taxonómico redescribió el género y se incluye información morfológica, (osteología, miología) y genética, para concluir que G. walkeri debía ser incluida dentro de la familia Leptodactylidae.
El trabajo de Ardila-Robayo (1979) incluyó además algunas observaciones de su historia natural. El hábitat G. walkeri es el bosque subtropical y tropical húmedo montano, sus hábitos son nocturnos y diurnos, su microhábitat está limitado a troncos y piedras bajo los cuales deposita sus huevos, los cuales presentan desarrollo directo (Ardila-Robayo 1979). La distribución de la especie se limita al norteoeste de la SNSM, sin embargo puede estar distribuida más ampliamente de lo que indican los actuales registros (Ardila-Robayo 1979, Ramírez-Pinilla et al. 2004). Esta sugerencia fue recientemente confirmada con la ampliación de distribución altitudinal para la especie en 700m y se observa por primera vez en el ecosistema páramo (Rueda-Solano & Vargas- Salinas 2010). Actualmente, esta especie se encuentra categorizada en la lista roja UICN (Ramírez-Pinilla et al. 2004, UICN 2009) como en peligro (EN B1 ab(iii)) a causa de: 1) su área de distribución es menor a 5 000km2, 2) sus poblaciones se encuentran establecidas en menos de cinco localidades, 3) disminución en la calidad y extensión de su hábitat. Sin embargo, no se han realizado para G. walkeri estudios suficientes de su biología básica e historia natural que permitan establecer su estado de conservación actual y ofrecer medidas eficaces de conservación.
Dado que uno de los factores fundamentales que puede estar afectando la supervivencia de esta especie es la continua degradación de su hábitat, el presente trabajo pretende, además de establecer su estado de conservación actual en el área, determinar la abundancia relativa y uso de microhábitat de Geobatrachus walkeri entre dos tipos de hábitats con diferente composición y estructura: un bosque nativo (bosque secundario en recuperación) y una plantación de pino cuya especie predominante es Pinus patula. Así mismo, tanto la abundancia relativa de individuos como el uso del microhábitat pueden a su vez estar relacionados con las estaciones climáticas determinadas por la precipitación (estaciones de lluvia y sequía), entonces, se evaluaron ambas variables de manera comparativa en cada estación. La modificación del hábitat para las poblaciones residentes puede producir condiciones ambientales diferentes que pueden reflejarse en cambios demográficos o morfológicos en los individuos que habitan estos ambientes. Por lo tanto, se evaluaron también y de manera comparativa las condiciones físicas de los microhábitats ocupados y el tamaño corporal de las ranas en ambos ambientes.
Materiales y métodos
Área de estudio: El sector de San Lorenzo en el flanco nor-occidental de la Sierra Nevada de Santa Marta, departamento del Magdalena, Colombia, se encuentra entre los 2 300 y 3 500m de altitud (Fig. 1). Los componentes florísticos del área corresponden a una zona de vida de bosque muy húmedo montano bajo (bmh-MB) siguiendo a Espinal y Montenegro (1963). La precipitación media anual es de 2 622mm., y la temperatura media anual de 13.6ºC. Esta área registra un régimen de precipitación unimodal y presenta el periodo seco entre los meses de diciembre a marzo y el periodo lluvioso de abril a noviembre (Granda & Del Portillo 2007). La topografía es predominantemente escarpada, con algunas pendientes que pueden superar los 70 grados. Esta zona posee una alta humedad relativa (90%) debido a que funciona como frente de condensación, ya que esta directamente expuesta a los vientos provenientes del mar Caribe (Proaves 2009).
La cuchilla de San Lorenzo se caracteriza por poseer bosques premontanos y montanos que corresponde a selvas higrofíticas y subhigrofíticas de piso isomesotérmico e isomicrotérmico con nieblas frecuentes y cobertura densa; además cuenta con una quebrada muy inclinada, con dosel cerrado, con vegetación dominante de las familias Melastomataceae, Mirtaceae, Ericaceae y Rubiaceae y abundancia de plantas epífitas principalmente de la familia Bromeliaceae. Entre siete y ocho especies introducidas son además encontradas, ellas son: Pinus patula (pino pátula o candelabro), Cupressus lusitanica (ciprés), Acacia melanoxylon (acacia negra), Pinus cf. taeda, Pinus sp. (pinos), Fraxinus americanus (urapán) y Eucaliptus sp. (Eucalipto) (Cuadrado-Peña 2005).
El estudio se llevó a cabo en dos tipos de zonas presentes en área entre los 2000 y 2 500m de altitud: 1) la plantación de pino, es el área de bosque plantado en el que el elemento exótico dominante es el pino pátula (Pinus patula) y donde no se observa sotobosque ni vegetación herbácea. Presenta parches bien definidos. 2) El bosque nativo secundario, el bosque se caracteriza por ser ombrófilo, tropical, montano y con muy poca intervención. Este bosque posee un dosel continuo con árboles siempre verdes de 15 a 20m de altura. El sotobosque del área está poco expuesto a la incidencia de la luz y presenta visibilidad horizontal escasa (<15m) debido fundamentalmente a la alta densidad de árboles por unidad de área (Cuadrado-Peña 2005).
Las zonas estudiadas son continuas entre sí y puede notarse un área donde se encuentra vegetación propia de los dos bosques. Ambas se ven interrumpidas ocasionalmente por pequeños parches donde se establece actividad antrópica como extracción de madera en la plantación de pino, paso de la carretera principal y caminos secundarios que recorren toda el área y otras actividades de bajo impacto para el bosque secundario.
Muestreo de anfibios: La obtención de datos se realizó por medio de dos estrategias de muestreo, que son las siguientes: muestreo por cuadrantes y VES (búsqueda por encuentro casual) (Crump & Scott 1994). Cada salida al sitio de muestreo tuvo una duración de cinco días, de los cuales tres de ellos fueron utilizados para el muestreo por cuadrantes y dos para el VES.
Con el objetivo de obtener datos cualitativos, observaciones generales de historia natural, y realizar búsqueda de individuos en lugares en los cuales es imposible realizar cuadrantes debido a lo escarpado del terreno, se optó por ejecutar búsqueda por encuentro casual durante dos horas en el día y dos horas en la noche durante dos días en cada salida a campo. El VES consiste en caminatas aleatorias que permite abarcar gran cantidad de microhábitats, y puede ser empleado de manera efectiva para especies que viven en hábitats fácilmente identificables tales como troncos o zonas riparias o que permanecen en el piso (Crump & Scott 1994, Toft 1982).
Abundancia relativa: Para obtener la abundancia relativa de la población en los dos hábitats se llevó a cabo muestreo por cuadrantes. Para cada ambiente se hicieron pre-muestreos (Mayo y Julio 2008) durante los cuales se eligieron puntos aleatorios en todo el área y se establecieron 30 cuadrantes (4x4m); se identificaron los cuadrantes y la secuencia aleatorizada del muestreo aleatorio simple de acuerdo con Jaeger & Inger (1994).
Ahora bien, se realizaron 4 salidas en total al sitio de muestreo. Con el fin de establecer diferencias de abundancia de ranas entre los dos periodos climáticos, 2 de los muestreos se hicieron durante los meses de octubre y noviembre de 2008, cuando se presentan las mayores precipitaciones en la zona, y dos en diciembre de 2008 y enero de 2009, que constituyen los meses de sequía.
Entonces, se eligieron seis unidades por hábitat en cada una de las cuatro salidas, para un total de 48 cuadrantes efectivamente muestreados de los 60 elegidos en total para toda el área. Cada muestreo tuvo una intensidad de trabajo de 4 horas diurnas y 4 nocturnas, con un esfuerzo de muestreo horas/hombre de 16 horas diarias. Por lo tanto, se rotaron las horas de muestreo con el fin de realizar turnos que cubrieran la mayor parte del día y la noche en los días de cada salida, para así poder establecer posibles picos de actividad diaria.
La búsqueda y cuantificación de los individuos se hizo hasta examinar todos los posibles microhábitats donde encontrar las ranas en cada cuadrante, durante dos horas como máximo y 40 minutos como mínimo por cada cuadrante. Asi bien, se analizaron un total de cuatro cuadrantes por día, dos por cada jornada (diurna/nocturna) 6 por cada tipo de bosque, 12 cuadrantes por salida. Además, se registraron todos los individuos avistados en cada cuadrante. Todos los ejemplares capturados se liberaron en el mismo lugar luego de ser medidos y fotografiados.
La abundancia relativa (AR) se calculó como el número de individuos detectados en cada cuadrante por tiempo de muestreo: AR=Total de individuos/horas muestreo. Para determinar si la abundancia de G. walkeri es diferente entre los tipos de ambientes (i.e. bosque nativo y plantación de pino) y estaciones climáticas evaluadas (i.e. lluvioso y seco), se realizó un ANOVA a dos vías para comparar los promedios de la abundancia relativa de los cuadrantes en cada ambiente y realizados en cada estación.
Uso de microhábitat: A cada animal observado se le registró el tipo de microhábitat en que se encontraba al momento del avistamiento con el objeto de determinar su uso de acuerdo con la metodología descrita por Inger (1994), Vargas & Castro (1999) y García et al. (2005). En cada cuadrante se buscó exhaustivamente los individuos; a cada individuo encontrado se le registraron los datos de posición vertical, substrato, hora de captura y actividad (canto, amplexus, reposo, etc.), longitud rostro cloaca (medida en mm con un calibrador Vernier con 0.02mm de precisión, LRC) y sexo. Así mismo, en cada cuadrante se registraron los datos de cobertura vegetal y características físicas del ambiente como humedad relativa del suelo y del aire y temperatura ambiente.
Para determinar el uso de microhábitat de G. walkeri se elaboró una tabla de contingencia donde se consignó el número de individuos encontrados para cada microhábitat en cada tipo de ambiente por cada periodo climático. Esta tabla incluyó tanto los datos de los cuadrantes como los datos de las búsquedas por encuentro casual. Con esta tabla se realizó un análisis de Chi Cuadrado (X2) para determinar si el uso de los distintos microhábitats por G. walkeri es diferente en cada tipo de ambiente y en cada periodo climático. Con esta tabla de contingencia además se realizó un análisis de modelos Log-Lineales para determinar si el uso de los distintos microhábitats por G. walkeri depende del tipo de hábitat y estación climática. En el análisis Log-Lineal se consideraron los siguientes estadísticos: cociente de verosimilitud (Likelihood-Ratio Chi Square) y Criterio Bayesiano de Información (BIC).
Tamaño corporal: Con el fin de determinar si el tamaño promedio del cuerpo (LRC) de G. walkeri es diferente entre los tipos de ambientes y estaciones climáticas evaluados, se realizó un ANOVA de dos vías.
Condiciones ambientales en los dos hábitats: La cobertura vegetal fue calculada a través del análisis de fotografías tomadas en cada cuadrante, todas las fotografías fueron tomadas de día incluso las de aquellos cuadrantes muestreados de noche. Las fotografías fueron analizadas con Whinphot versión 5.0 para obtener la cobertura final en cada cuadrante según la metodología descrita por Klingenböck et al. (2000). Los datos de temperatura y humedad relativa se obtuvieron con un termohigrómetro portátil HI 856, estos registros se obtuvieron con el fin de determinar si existen diferencias significativas del microambiente que puedan determinar el uso de microhábitat y de manera comparativa en dos lugares con diferente composición vegetal y en las diferentes estaciones climáticas. Para determinar si la profundidad de hojarasca, la cobertura vegetal, la temperatura y la humedad relativa es diferente entre los tipos de ambientes (i.e. bosque nativo y plantación de pino) y periodos climáticos evaluados (i.e. lluvioso y seco), se emplearon pruebas de Kruskal-Wallis.
Antes de los análisis, se determinó la normalidad de los datos y la homogeneidad de varianzas mediante las pruebas de Shapiro- Wilks y Bartlett, respectivamente. Luego de las pruebas de ANOVA paramétricas o no paramétricas se utilizaron pruebas a posteriori de Tukey o Nemenyi, respectivamente, para determinar los grupos en los que habría diferencias significativas. Todos los análisis estadísticos siguen a Zar (1999) y el valor de significancia P se estableció en 0.05.
Resultados
Durante la búsqueda por encuentro casual, en la plantación de pino fue común escuchar coros conformados por varios individuos de día y de noche; estos se silencian ante un estimulo externo como la luz o el ruido de origen antrópico. Nunca se escucharon cantar mientras se manipulaban. En el bosque nativo los coros eran escasos con respeto al escuchado en la plantación de pino. En octubre y noviembre, meses de lluvias, se escucharon cantar durante todas las jornadas de muestreo mientras que en diciembre y enero, meses secos, sólo se escucharon hasta tres individuos por jornada y en algunas jornadas no se escucharon cantando. El canto consiste de silbidos cortos y agudos de dos a cinco o seis notas, con un tiempo intermedio variable de 1 a 13 minutos entre cada secuencia de notas.
Al manipularse las ranas adoptaban una actitud inmóvil, rara vez intentaron escapar y se vio torpeza al saltar pero cierta agilidad al trepar; en las instancias en que se observó desplazamiento las ranas se movieron con una especie de marcha descrita en Ardila-Robayo (1979). Se encontraron ranas tanto juveniles como adultos; todas presentaron a simple vista un aspecto sano, sin malformaciones aparentes y una buena condición general (Fig. 2).
Abundancia relativa: En total se realizaron 126 observaciones de Geobatrachus walkeri en el bosque nativo y 248 en la plantación de pino. El mayor número de individuos se observó durante la época lluviosa con 224 individuos. La abundancia relativa promedio calculada para Geobatrachus walkeri en el área de estudio y en ambas épocas climáticas fue de 4.36 individuos registrados durante 2h por 2 personas por cada cuadrante. Al analizar los datos obtenidos para cada ambiente se encontraron diferencias marcadas en cuanto a la abundancia relativa de la especie, la plantación de pino siempre mostró una mayor abundancia durante ambas estaciones. Entonces, se encontraron 2.3 veces más individuos en la plantación (6.26) que en el bosque nativo (2.7, Fig. 3). Las diferencias en la abundancia relativa de G. walkeri entre ambos ambientes son significativas, siendo mayor en la plantación de pino que en el bosque nativo (F=14.29, p=0.0005). Ni las estaciones ni su interacción con los tipos de vegetación en los dos ambientes afectaron significativamente la abundancia de G. walkeri (F=0.52, p=0.47 y F=1.18, p=0.28, respectivamente).
Uso de microhábitat: Los microhábitats usados por Geobatrachus walkeri estuvieron siempre ligados al suelo (entre la hojarasca, bajo piedras o bajo troncos caídos), no se observaron individuos sobre la vegetación por encima del suelo ni dentro del bosque, ni cerca de los cursos de agua. En la plantación de pino se observaron entre la hojarasca refugios bien definidos, que consisten en pequeños huecos circulares de unos 3 a 4 centímetros de diámetro cuyas paredes se forman por la misma hojarasca compactada. Casi siempre se encontró un individuo de G. walkeri por refugio (Fig. 4a), pero en algunas ocasiones se encontraron dos y hasta tres animales (Fig. 4b). En uno de estos refugios durante el mes de Octubre (época de lluvias) se encontró una postura de G. walkeri, cerca de la cual no se observó ningún individuo adulto y por lo tanto ningún indicio de cuidado parental. La postura se reconoció como de la especie porque ocupaba uno de los refugios característicos ocupados por los adultos y al compararse con la descripción de la postura dada por Ardila-Robayo (1979). La postura formaba una masa compacta constituida por 23 huevos de color amarillento opaco con un tamaño aproximado de 3.3 mm de diámetro, cubiertas con una capa gelatinosa y translúcida. La hojarasca del refugio donde se encontró la postura tenía una profundidad de 12 cm y la temperatura ambiente era de 15.5 grados centígrados, la cobertura vegetal para este cuadrante fue de 77% y la humedad relativa del suelo de 93%.
De las 168 ranas encontradas en la hojarasca de pino, 17 fueron observadas enterradas parcialmente en los suelos blandos por debajo de la hojarasca de pino, mostrando habilidad para cavar y esconderse, de estas 9 ranas se observaron cavando activamente intentando escapar y ocultarse entre la tierra.
A pesar de que este aspecto no fue objetivo de este trabajo, se observó que en el bosque nativo es mayor diversidad de ranas, reptiles y artrópodos asociados a la hojarasca, ocupando frecuentemente microhábitats que podrían ser usados por G. walkeri. Sin embargo, en ningún caso se observaron individuos de otras especies de ranas u otros animales diferentes a artrópodos de menor tamaño ocupando simultáneamente el mismo microhábitat de G. walkeri en ninguno de los hábitats. Se encontró a Pristimantis sanctamartae y Pristimantis megalops que usaban posibles michohábitats de G. walkeri, 4 especimenes sobre hojarasca de pino y 9 en el bosque nativo; 8 debajo de piedras medianas a grandes (Pmg) y una bajo troncos.
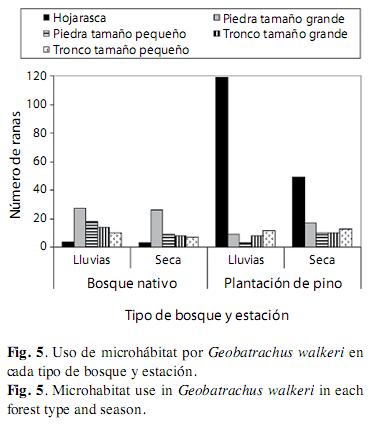
La disponibilidad de mirohábitats en los dos ambientes evaluados indudablemente no es la misma porque tienen características estructurales diferentes relacionadas con el tipo de vegetación dentro del mismo lugar geográfico; a pesar de ello, la variable disponibilidad de microhábitats no se cuantificó. Sin embargo, dentro de los dos ambientes evaluados, Geobatrachus walkeri usa de manera diferencial y significativa los diferentes microhábitats que se evaluaron (X2=180.25, gl=4, p<0.0001). El microhábitat más usado fue la hojarasca de pino durante el periodo lluvioso (119 individuos observados) y el de menor uso fue bajo piedras pequeñas en la plantación de pino y en el periodo lluvioso para toda el área en ambas épocas (Fig. 5). El uso de microhábitats por G. walkeri es significativamente diferente entre tipos de ambientes (X2=161.12, gl=10, p<0.0001) y entre estaciones (X2=40.21, gl=10, p=0.0002). En la plantación de pino el microhábitat más usado fue la hojarasca mientras que en el bosque nativo la hojarasca fue el microhábitat menos usado. En el bosque nativo el microhábitat más usado fue bajo piedras. La hojarasca fue el microhábitat de mayor uso durante el periodo lluvioso, seguido de las piedras. Durante el periodo seco, las piedras y la hojarasca fueron igualmente usadas. El espacio bajo los troncos es el microhábitat menos usado en ambas estaciones.
El análisis Log-Lineal comprueba los resultados obtenidos anteriormente para el uso de microhábitat de G. walkeri, y demuestra la independencia de las variables (Cuadro 1). El modelo log-lineal más parsimonioso que se ajustó en la tabla de contingencia fue: el microhábitat está asociado con el tipo de bosque, la estación es independiente. El Cociente de Verosimilitud con un valor p=0.001 y para el valor del Criterio Bayesiano de Información = -25.49. Los modelos que muestran una relación de asociación entre el microhábitat y el tipo de ambiente y el microhábitat y la estación son aproximadamente igual de parsimoniosos con y sin dependencia entre el bosque y la estacionalidad de las lluvias, con un p>0.05. Por lo tanto, se puede concluir que: 1) G. walkeri presenta un uso diferencial de los distintos microhábitats; 2) El uso de cada microhábitat por G. walkeri depende del tipo de ambiente; 3) El uso de cada microhábitat por G. walkeri depende de la estacionalidad de lluvias en la plantación de pinos; 4) La estacionalidad de lluvias, por si sola, no afecta el uso de los distintos microhábitats por G. walkeri.
Tamaño corporal: Aún cuando no hay diferencias en el tamaño corporal de las ranas entre los tipos de hábitats (F=0.01, p=0.94), el tamaño corporal de G. walkeri cambia significativamente entre las estaciones (F=4.01, p=0.046), así como la interacción entre el tipo de hábitat y la estación de lluvias (F=11.83, p=0.006). Los cambios significativos en la LRC ocurren en las ranas del bosque nativo, mientras que en la plantación de pino, el efecto de la estación es no significativo. En el bosque nativo, durante el periodo de lluvias, la LRC promedio de G. walkeri (media±desviación estándar, 15.6±0.9mm) es mayor que la LRC promedio de toda el área de estudio en ambas épocas (14.06±0.88mm); así mismo, durante el periodo seco, la LRC promedio (12±.2mm) es menor que la LCR promedio de toda el área de estudio en ambas estaciones. En la plantación de pino, la LRC de G. walkeri es en las dos estaciones (14.32±0.7mm) siempre cercana a la LRC promedio de toda el área de estudio.
Condiciones ambientales en los dos hábitats: Al comparar las condiciones ambientales que ofrecen a las ranas los dos hábitats durante las estaciones de lluvias y seca, se encontraron diferencias significativas entre los dos diferentes hábitats para las variables profundidad de hojarasca (H=5.69, p=0.017), cobertura vegetal (H=27.06, p<0.0001) y humedad relativa del suelo (H=69.21, p<0.0001). La plantación de pino tiene significativamente hojarasca más profunda (66.85cm, rango de variación 18.6cm vs. 36.66cm, rango de variación 28cm), menor cobertura vegetal (79%, rango de variación 36% vs. 86%, rango de variación 15%) y mayor humedad relativa del suelo (85.5%, rango de variación 13% vs. 80%, rango de variación 9%) que el bosque nativo. Estas tres variables (profundidad de hojarasca, cobertura vegetal y humedad relativa del suelo) sin embargo, no fueron significativamente diferentes entre las estaciones en ninguno de los dos hábitats. Para la temperatura ambiente no se encontraron diferencias significativas entre los hábitats (14.5°C en bosque nativo, 14.4°C en plantación de pinos) pero si se encontraron diferencias significativas entre estaciones (H=15.78, p<0.0001, 15.55°C en la estación de lluvias, variación 3.8°C vs. 13.95°C en la estación seca, variación 2.8°C).
Discusión
La plantación de pino en periodo de lluvias es el lugar y momento donde se observa mayor abundancia de Geobatrachus walkeri cuando se considera el total de muestreos realizados en el área. El bosque nativo muestra un estado de conservación aceptable, con más cuerpos de agua, con la vegetación propia del lugar (más diversa y con diferentes estratos), dosel cerrado, y con hojarasca profunda y húmeda, permitiendo el establecimiento y desarrollo de G. walkeri así como otras especies de anuros propios de la zona con desarrollo directo (Pristimantis sanctamartae y Pristimantis megalops). Sin embargo, no es en este bosque donde se encontró el mayor número de individuos de la especie. Geobatrachus walkeri parece haberse adaptado exitosamente a la plantación de pino, relativamente nuevo en la zona.
Este hecho puede deberse a las características especificas del microambiente que la hojarasca de pino puede proporcionar. La capa de hojarasca en la plantación de pinos es significativamente más profunda y la humedad relativa del suelo mayor que en el bosque nativo, y muestra que la abundancia de ranas tiene una relación positiva con estas variables. La cobertura vegetal es uno de los parámetros más importantes que determinan la distribución de anuros, aunque ésta es significativamente menor para la plantación de pinos, no parece limitar la permanencia de la especie en este bosque. Del otro lado, en el bosque nativo, los individuos de G. walkeri se observaron mayoritariamente bajo piedras de tamaño mediano a grande y no bajo la hojarasca. La diferencia en la composición de la hojarasca tanto física y química entre los dos tipos de bosque podría estar produciendo estos resultados.
La relación de la abundancia relativa de ranas y uso de microhábitat con respecto de la cobertura vegetal y espesor de la hojarasca, ha sido demostrada en ranas del género Pristimatis en bosques nativos (Toucher et al. 1997). No conocemos estudios similares en especies de Pristimantis u otras especies cercanas del Neotrópico, donde el bosque a estudiar sea una plantación de pinos de manera que pudiera hacerse una comparación como en este caso. Para G. walkeri se demostró una relación positiva entre la abundancia y la profundidad de la hojarasca y su humedad relativa, características que son significativamente mayores en la plantación de pino. Por lo tanto, la presencia y características propias de la hojarasca de pino por si solas parecen ser suficientes para el establecimiento exitoso de la especie en este ambiente. Aunque las poblaciones de anuros terrestres se encuentran muy ligadas al bosque (Marsh & Pearman 1997), estas dependen de la disponibilidad de microhábitats aptos para establecerse (Urbina-Cardona 2002).
Aunque, no fue cuantificada ni era el objetivo de este trabajo, la diversidad y abundancia de otros organismos de hojarasca es mucho mayor en la hojarasca del bosque nativo que en la hojarasca de pino. En un trabajo previo, Camero & Chamorro (1999) encontraron que el bosque nativo propicia una mayor actividad de la macrofauna del suelo y mantiene una mayor diversidad, mientras que la plantación de pinos muestra mayores densidades poblacionales, pero tiene menor diversidad de especies y grupos taxonómicos. Se puede sugerir que G. walkeri puede encontrar en la hojarasca de la plantación de pino un microhábitat donde puede dominar como especie, escapar a posibles depredadores, y encontrar mayor cantidad y densidad de presas. Sin embargo, es importante hacer un estudio comparado de los factores biológicos asociados a la hojarasca de los dos tipos de bosque que permiten el éxito de G. walkeri en este particular microhábitat de la plantación de pinos.
Estudios en otras especies han demostrado que existen picos de abundancia de algunas ranas durante la época seca cuando existe mayor abundancia de artrópodos (Allmon 1991); sin embargo, la mayor parte de los estudios han registrado que la anurofauna es mucho más abundante durante la estación húmeda cuando es poco probable desecación, las presas son abundantes, y ocurren los eventos reproductivos (Vonesh 2001). Es probable que algunos de estos eventos estén asociados con la mayor abundancia de G. walkeri durante la estación de lluvias, sin embargo, aunque encontramos una relación directa entre la estación de lluvias y la abundancia relativa de las ranas, se necesita estudiar la biología trófica y reproductiva de la especie para establecer los factores biológicos que están determinando esta relación.
La hojarasca de pino fue el único microhábitat donde se encontró una postura de Geobatrachus walkeri, lo cual no indica que este sea el único lugar donde se este dando la reproducción de la especie, pero si demuestra que las ranas están desarrollando todo su ciclo de vida en este microhábitat. Las posturas anteriormente registradas a este estudio fueron encontrados bajo piedras, en terreno pedregoso, con cobertura de Pennisetum cladestinium, en los meses de abril y mayo (Ardila-Robayo 1979). Esta cobertura es un tipo de pasto que por su alta tasa de crecimiento tiende a producir mucho “fieltro o colchón” lo cual se asemeja físicamente a las características de la hojarasca de la plantación de pino lo que podría sugerir la preferencia de G. walkeri para ubicar sus posturas en este tipo de microhábitat. Más de la mitad de las ranas andinas presentan una reproducción terrestre que los independiza de cuerpos de agua y los liga al hábitat de bosque (Kattan & Álvarez-López 1996); estas ranas depositan huevos con desarrollo directo en el suelo del bosque (Duellman 1999). Esta característica explica el éxito de G. walkeri en los bosques de pino y de otras especies del género Pristimantis en ambientes de bosques montañosos con pocas corrientes de agua.
Geobatrachus walkeri por ser una especie con huevos de desarrollo directo posee ventajas para explotar nuevos ambientes pero así mismo puede exponer los huevos a la deshidratación, que dependen de la ubicación de las posturas en el bosque como ha sido observado para especies de Pristimantis (Tocher et al. 1997). Aunque los rodales de pino modifican la acidez en el suelo y el agua, estos efectos parecen no dañar el desarrollo de los huevos de G. walkeri ni tampoco afectar a los individuos adultos. Sin embargo, queda pendiente por estudiar la tasa de eclosión exitosa de los huevos de manera comparativa entre ambos hábitats.
Al observarse individuos de todos los tamaños durante todo el estudio se puede inferir que la reproducción no es estacional. El mayor tamaño corporal durante la época lluviosa puede indicar que en esta época los individuos mayores de la población alcanzan tamaños óptimos reproductivos. Así mismo, el hallazgo de posturas y la observación de coros activos durante la estación de lluvias sugieren que aunque la reproducción puede ser continua durante el año, habría un pico reproductivo durante la estación de lluvias, como ha sido encontrado para otras especies de ranas neotropicales de desarrollo directo (Crump 1974, Donnelly 1999, Watling & Donnelly 2002).
El tamaño corporal de los individuos de las poblaciones también puede ser alterado debido a la modificación del hábitat, pudiendo ser menor en las áreas disturbadas ya que puede haber una restricción en la disponibilidad o la calidad de la dieta que resulta en individuos mas pequeños, o verse afectado por cambios en los procesos de desarrollo y crecimiento que usualmente promueven un crecimiento simétrico entre los individuos (Delgado-Acevedo & Restrepo 2008). Para nuestro caso, el tamaño corporal no fue significativamente diferente entre los dos hábitats estudiados, y las diferencias encontradas respondieron a la variable época climática (mayor tamaño durante la estación de lluvias), lo que sugiere que en relación con la dieta no habría diferencias significativas en la energía obtenida a partir de las presas entre los dos hábitats que pueda invertirse diferencialmente en crecimiento. Sería importante realizar estudios comparativos de la disponibilidad de presas (incluyendo diversidad y abundancia) y dieta efectiva de las ranas en ambos tipos de hábitats.
El ente corporativo de carácter público encargado de administrar el medio ambiente y propender por el desarrollo sostenible del área de estudio (CORPOMAG) está considerando la autorización para la erradicación de los pinos y la restauración con flora nativa de la Sierra, con el apoyo de la Fundación ProAves (CORPAMAG 2007). Es imperativa la realización un estudio más profundo de la biología e interacciones de las comunidades de especies nativas que se han establecido en las plantaciones de pinos, y en particular de especies endémicas y tan particulares a nivel evolutivo como G. walkeri. Igualmente, se debe considerar que las plantaciones de pino o cualquier plantación que contemple componentes ambientales similares, y favorables a esta especie cuya distribución es tan reducida, pueden servir como sitios de mantenimiento de algunas de sus poblaciones permitiendo la coexistencia de la especie con ciertas actividades productivas. Estudios realizados por Lemckert et al. (2005) afirman que conservando corredores de bosque nativo entre las plantaciones de pino es posible mantener la mayoría de poblaciones de ranas que viven en este bosque.
Agradecimientos
Nuestro agradecimiento a la Dirección de programa de Biología y a la Universidad del Magdalena, el Señor Jorge Torregrosa nos abrió desinteresadamente las puertas de su casa en el área de estudio. Dagoberto Venera, Hernán Granda, Víctor Hugo Serrano y Juan Pablo Ramírez por sus aportes y comentarios al documento; Adolfo del Portillo, Carlos José Villa de León, Oferny Sierra, colaboraron en algunas de las fases del trabajo de campo. La Unidad Administrativa Especial del Sistema de Parques Nacionales-Sierra Nevada de Santa Marta y CORPAMAG otorgaron los permisos de investigación. A.M.C. Ardila-Robayo y dos revisores anónimos hicieron valiosos aportes al manuscrito.
Referencias
Allmon, W. 1991. A plot study of forest floor litter frogs, central Amazon, Brazil. J. Trop. Ecol. 7: 503-522. [ Links ]
American Bird Conservancy. 2006. Crucial Site for Endangered Frogs and Birds Saved. Conservation Partners Join Forces to Protect Mountain Habitat Slated for Development. Washington, D.C. (Consultado: 10 Septiembre 2009, www.abcbirds.org/newsandreports/releases/060403.html). [ Links ]
Ardila-Robayo, M.C. 1979. Status Sistemático del Genero Geobatrachus Ruthven 1915 (Amphibia: Anura). Caldasia 12: 383-496. [ Links ]
Camero, R.E. & C. Chamorro. 1999. La fauna edáfica en bosques y plantaciones de coníferas de la estación San Lorenzo-Sierra Nevada de Santa Marta. ActaBiol. Col. 4: 35-45. [ Links ]
Carvajalino-Fernández, J.M., B. Cuadrado-Peña & M.P. Ramírez-Pinilla. 2008. Registros adicionales de Atelopus nahumae y Atelopus laetissimus para la Sierra Nevada de Santa Marta, Colombia. Actual. Biol. 30: 97-103. [ Links ]
CORPAMAG. 2007. Primer informe de avance de gestión. Informe técnico de gestión. Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Dirección de Planeación, Información y Coordinación Regional, Bogota, D.C., Colombia. [ Links ]
Crump, M.L. 1974. Reproductive strategies in a tropical anuran community. Univ. of Kansas Mus. of Nat. Hist., Misc. Publ. 61: 1-68. [ Links ]
Crump, M.L. & N.J. Scott. 1994. Standard Techniques for inventory and monitoring, p. 77-171. In R.W. Heyer, M.A. Donnelly, R.W. Mcdiarmid, L.A. Hayek & M.S. Foster (eds.). Measuring and monitoring biological diversity. Standard Methods for amphibians. The Smithsonian Institution, Washington, D. C., EEUU. [ Links ]
Cuadrado-Peña, B.J. 2005. Estructura y composición florística del bosque ripario de la cuenca del río Gaira. Tesis de pregrado, Universidad del Magdalena, Colombia. [ Links ]
Delgado-Acevedo, J. & C. Restrepo. 2008. The contribution of habitat loss to changes in body size, allometry, and bilateral asymmetry in two Eleutherodactylus frogs from Puerto Rico. Conservat. Biol. 22: 773-782. [ Links ]
Donnelly, M.A. 1999. Reproductive phenology of Eleutherodactylus bransfordii in Northeastern Costa Rica. J. Herpetol. 33: 624-631. [ Links ]
Duellman, W.E. 1999. Patterns of distribution of amphibians. A global perspective. The Johns Hopkins University, Baltimore, EEUU. [ Links ]
Espinal, L.S. & E. Montenegro.1963. Formaciones vegetales de Colombia. Instituto Geográfico Agustin Codazzi, Bogotá, Colombia. [ Links ]
Frost, D.R. 2010. Amphibian Species of the World: an Online Reference. Version 5.3. American Museum of Natural History, Nueva York, EEUU (Consultado: Abril 2010, http://research.amnh.org/herpetology/amphibia/). [ Links ]
García, R.J., F. Castro & H. Cardenas. 2005. Relación entre la distribución de anuros y variables del hábitat en el sector la Romelia, Parque Nacional Natural Munchique (Cauca, Colombia). Caldasia 27: 299-310. [ Links ]
Gómez-Torres, M. 2005. Política fiscal para la gestión ambiental Colombia. Serie Medio Ambiente y Desarrollo. División de Desarrollo Sostenible y Asentamientos Humanos. Naciones Unidas CEPALDeutsche Gesellschaft für Technische Zusam, Santiago, Chile. [ Links ]
Granda, H. & A. Del Portillo. 2007. Evaluación Poblacional de Atelopus laetissimus y Atelopus nahumae (Anura: Bufonidae) del sector San Lorenzo Sierra Nevada de Santa Marta. Tesis de Pregrado, Universidad del Magdalena, Colombia. [ Links ]
Granda, H., A. Del Portillo & J.M. Renjifo. 2008. Uso de hábitat en Atelopus laetissimus (Anura: Bufonidae) en una localidad de la Sierra Nevada de Santa Marta, Colombia. Herpetotropicos 4: 87-93. [ Links ]
Hedges, S.B., W.E. Duellman & M.P. Heinicke. 2008. New World direct-developing frogs (Anura: Terrarana): Molecular phylogeny, classification, biogeography, and conservation. Zootaxa 1737: 1-182. [ Links ]
Inger, R.F. 1994. Distribution of Microhabitat, p. 60-66. In R.W. Heyer, M.A. Donnelly, R.W. Mcdiarmid, L.A. Hayek & M.S. Foster (eds.). Measuring and monitoring biological diversity standard methods for amphibians. Smithsonian Institution, Washington, D.C., EEUU. [ Links ]
Jaeger, R.G & Inger R.F. 1994. Quadrant sampling, p. 97-102. In R.W. Heyer, M.A. Donnelly, R.W. Mcdiarmid, L.A. Hayek & M.S. Foster (eds). Measuring and monitoring biological diversity standard methods for amphibians. Smithsonian Institution, Washington, D.C., EEUU. [ Links ]
Kattan, G.H. & H. Alvarez-López. 1996. Preservation and management of biodiversity in fragmented landscapes in the Colombian Andes, p. 3-18. In J. Schelhas & R. Greenberg (eds.). Forest patches in tropical landscapes. Island, Washington D.C., EEUU. [ Links ]
Klingenböck, A., K. Osterwalder & R. Shine. 2000. Habitat use and thermal biology of the “land mullet” Egernia major, a large scincid lizard from remnant rain forest in south eastern Australia. Copeia 2000: 931-939. [ Links ]
Lemckert, F. 2005. Native vegetation corridors in exotic pine plantations provide long-term habitat for frogs. Ecol. Manag. Restor. 6: 132-134. [ Links ]
Marsh, D.M. & P.B. Pearman. 1997. Effects of habitat fragmentation on the abundance of two species of Leptodactylid frogs in an Andean montane forest. Conservat. Biol. 11: 1323-1328. [ Links ]
Proaves. 2009. Restauración en la Sierra Nevada de Santa Marta. (Consultado: 10 septiembre 2009, www.proaves.org/article.php?id_article=589). [ Links ]
Ramírez-Pinilla, M.P., M. Osorno-Muñoz, J.V. Rueda, A. Amézquita & M.C. Ardila-Robayo. 2004. Geobatrachus walkeri. IUCN 2009. IUCN Red List of Threatened Species. Version 2009.1. (Consultado: 16 September 2009, www.iucnredlist.org). [ Links ]
Rueda-Solano, L.A. & F. Vargas-Salinas. 2010. Amphibia, Anura, Strabomantidae, Geobatrachus walker (Ruthven, 1915): Altitudinal extension and new habitat, Colombia. Check List. 6: 454-455. [ Links ]
Ruiz-Carranza, P.M. & J.I. Hernández. 1978. Una nueva especie Colombiana de Atelopus (Amphibia: Bufonidae). Caldasia 12: 181-197. [ Links ]
Ruthven, A. 1915. Descriptions of a new tailless amphibian of the family Dendrobatidae. Occ. Pap. Mus. Zool. Univ. Michigan 20: 1-3. [ Links ]
Ruthven, A. 1922. The Amphibians and reptiles of Sierra Nevada de Santa Marta. Misc. Publ. Mus. Zool. Univ. Michigan 8:1-94. [ Links ]
Strewe, R. 2008. Efectos de calentamiento global sobre los paramos de la Sierra Nevada de Santa Marta, Colombia. Rev. Enl. Empr.-UAN. 10: 14-15. [ Links ]
Strewe, R. & C. Navarro 2003. New distributional records and conservation importance of the San Salvador Valley, Sierra Nevada de Santa Marta, Northern Colombia. Ornitología Colombiana 1: 29-41. [ Links ]
Strewe R. & C. Navarro 2004. New and noteworthy records of birds from the Sierra Nevada de Santa Marta region, north-eastern Colombia. Bull. B.O.C. 124: 38-51. [ Links ]
Tocher, M.D., C. Gascon & B. Zimmerman 1997. Fragmentation effects on a central Amazonian frog community. A ten years study, p. 124-137. In W. Laurance & R. Bierregaard (eds). Tropical forest remnants. Universidad de Chicago, Chicago, EEUU. [ Links ]
Toft, C.A. 1982. Community structure of litter anurans in a tropical forest, Makokou, Gabon: A preliminary analysis in the minor dry season. Revue D’Ecologie Terre Vie. 31: 223-232. [ Links ]
Urbina Cardona, J. & J. Pérez-Torres 2002. Dinámica y preferencias de microhábitat en dos especies del género Eleutherodactylus (Anura: Leptodactylidae) de bosque andino, p. 278-288. In C.A. Jaramillo, C.A. Castaño-Uribe, F.A. Hincapié, J.V. Rodríguez & C.L. Durán (eds.). Memorias del Congreso Mundial de Páramos. Gente Nueva, Bogotá, Colombia. [ Links ]
Vargas, F. & H. Castro. 1999. Distribución y preferencias de microhabitat en anuros (Amphibia) en bosque maduro y áreas perturbadas en Anchicayá, Pacífico Colombiano. Caldasia 21: 95-109. [ Links ]
UICN. 2009. The IUCN Red List of Threatened Species. (Consultado: 10 de Septiembre 2009, www.iucnredlist.org/). [ Links ]
Vonesh, J. 2001. Patterns of Richness and Abundance in a Tropical African Leaf-litter Herpetofauna. Biotropica 33: 502-510. [ Links ]
Watling, J. & M.D. Donnelly. 2002. Seasonal patterns of reproduction and abundance of leaf litter frogs in a Central American rainforest. J. Zool. 258: 269-276. [ Links ]
Zar, H.H. 1999. Biostatistical Analysis. Prentice Hall, Englewood Cliffs, Nueva Jersey, EEUU. [ Links ]
Correspondencia: Vera Martínez Baños & Vanesa Pacheco Florez. Universidad del Magdalena, Santa Marta, Colombia; tatianam86@gmail.com, vanesasofi@gmail.com
Martha P. Ramírez-Pinilla. Laboratorio de Biología Reproductiva de Vertebrados, Universidad Industrial de Santander, Bucaramanga, Colombia; mpramir@gmail.com, mpramir@uis.edu.co
Recibido 18-V-2010. Corregido 04-XII-2010. Aceptado 12-I-2011.