Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 suppl.1 San José Nov. 2009
Efectos de la cópula y el tamaño del macho sobre el comportamiento de ovipostura en la mosca estercolera Archisepsis diversiformis (Diptera: Sepsidae)
Martha Lucía Baena Hurtado
Departamento de Biología Evolutiva, Instituto de Ecología, A.C., Apartado Postal 63, Xalapa 91000 Veracruz, México; marthalucia.baena@gmail.com
Abstract: Effects of copulation and male size on the oviposition behavior of the manure fly Archisepsis diversiformis (Diptera: Sepsidae). I evaluated the effect of copulation as a stimulation factor for oviposition of Archisepsis diversiformis by using two different age groups of females. In addition, I tested the effect of copulation on female longevity and progeny sex ratio, taking into account female and male size, and oocyte development in relation to female age. A delay in copulation leads to a delay in oviposition. Females of both age groups started to oviposit between four and five days after copulation. The number of eggs that were laid during the first ten days after copulation, the average number of ovipositions (number of eggs laid per day) during the females life, and the average time between ovipositions were all similar. I found further evidence for the effect of copulation on oviposition: when females copulate, they oviposited faster than virgin females. In addition, these females laid a lower number of eggs after the age of 13 days, while females of the same age (that have copulated before, when they were two or six days old) laid a higher number of eggs (an average of 75 eggs). Oocytes in virgin females became larger with age; 57 % of the variation in the number of eggs laid by females depends on females longevity. As in other studies, female size had an effect on the total number of eggs laid. However, male size significantly affected the oviposition rate (total number of eggs/female longevity). Females tended to have a higher oviposition rate after copulating with larger males. These data suggest that for this fly species, sexual selection through female choice might be occurring. Rev. Biol. Trop. 57 (Suppl. 1): 239-250. Epub 2009 November 30.
Key words: oviposition rates, Archisepsis diversiformis, female choice, development of oocytes, size and longevity of female,
En hembras de muchos insectos existen factores externos e internos que influyen en la maduración de sus huevos. Los factores externos incluyen: temperatura (Adams & Mulla 1968, Fletcher et al. 1978, Robinson & Zurlini 1979), fotoperíodo (Tzanakakis & Koveos 1986), dieta (Pappas & Fraenkel 1977, Webster & Stoffolano 1978, Agui et al. 1985), exposición a los sitios potenciales de oviposición (Koveos & Tzanakakis 1990, Alonso-Pimentel et al. 1998, Papaj 2000) e interactiones sociales (Craddock & Boake 1992, McDonald & Borden 1995). Igualmente, el estímulo físico provisto por el acto de los apareamientos puede en sí mismo alterar el comportamiento de la hembra (Saunders & Dodd 1972, Davidescole et al. 1993, Clutton-Brock & Langley 1997). Estos factores externos pueden actuar en la liberación de
En muchos insectos, las hembras vírgenes colocan menos huevos que las no vírgenes (Leopold 1976, Guillot 1988, Miller et al. 1994, Chapman 1998). Los cambios en el comportamiento y fisiología entre estos dos tipos de hembras, tienen sentido desde un punto de visto evolutivo. Altas tasas de producción de huevos podrían empezar solamente una vez el apareamiento ha ocurrido y el esperma ha sido recibido para evitar la producción de huevos estériles, la cual puede ser energéticamente costosa (Chapman et al. 1998). Durante la cópula, los machos adicionan sustancias a los eyaculados que en la hembra estimulan el crecimiento de los ovocitos y la postura de huevos (Leopold 1976, Park et al. 1998). Las sustancias secretadas por el tracto reproductivo del macho, como las glándulas accesorias (Chen et al. 1988, Herndon & Wolfner 1997) y el ducto eyaculatorio (Riemann et al. 1967, Morrison et al. 1992) han sido llamadas, sustancias de inhibición del reapareamiento (o RIS, del inglés Remating Inhibiting Substances) y sustancias que facilitan la fecundidad (FES, del inglés Fecundity Enhancing Substances) respectivamente (Gillot 1988). Estas pasan a la pared del tracto receptivo de la hembra y entran a la hemolinfa, donde ellas ejercen su efecto (Wolfner 1997). La actividad de estas sustancias ha sido demostrada en varios órdenes de insectos, pero solamente pocos RIS y FES han sido químicamente caracterizados (Miller et al. 1994). El cuadro más completo viene de Drosophila melanogaster (Kubli 1996, Wolfner 1997). En esta especie un componente del fluído de las glándulas accesorias afecta la producción de huevos: la proteína del fluído accesorio Acp 26Aa (Herndon & Wolfner 1995). Otro caso es el de Leptinotarsa decemlineata (Coleoptera: Chrysomelidae), donde Smid (1997) describió la estructura del peptido designado como Led-MAGP (Leptinotarsa decimlineata Male Accesory Gland Peptide), la cual acelera el crecimiento de los ovocitos en las hembras. Las sustancias RIS y FES también han sido detectadas en otras especies de Drosophila (Monsma et al. 1990, Wolfner 1997, Xue & Noll 2000, Chapman 2001) y en otras especies de Diptera como Musca domestica, Delia antigua y Culex tarsalis (Gwadz 1972, Miller et al. 1994). Aunque aislar los peptidos de estas especies ha sido difícil debido a la fuerte tendencia que tienen de agregarse a otras proteínas (Smid 1997), recientemente se han caracterizado hasta el 90 % de las secresiones en D. melanogaster (Wolfner 2002).
Elevar la tasa reproductiva de la hembra por acción de la sustancia FES es una ventaja para el macho, pero al mismo tiempo puede implicar costos a la hembra. Esto puede dar origen a un conflicto sexual entre machos y hembras: el macho, más que la hembra, prefiere que un mayor número de huevos se produzca, al costo de disminuir la longevidad y éxito reproductivo de la hembra debido a las sustancias tóxicas de las glándulas accesorias del macho (Chapman et al. 1995, 1998). Este tipo de conflicto sexual (Trivers 1972, Parker 1979, West-Eberhard 1984, Rice & Holland 1997), incluye acciones que tienen el potencial de beneficiar al macho y perjudicar a la hembra. Evaluar los beneficios además de los costos del apareamiento, es importante para entender la evolución del conflicto sexual.
Ningún estudio ha investigado la influencia de la cópula en la estimulación de las oviposturas en hembras de la familia Sepsidae, así como su efecto en la longevidad y el desarrollo de ovocitos. La estrategia de apareamiento que presentan varias especies de esta familia es poco usual. Las hembras oviponen sobre el estiércol o carroña (Pont 1979) con un macho montado sobre su espalda. La cópula con ese macho solamente ocurre después que la hembra ha colocado los huevos fertilizados de sus apareamientos anteriores (Parker
En este estudio probé si la cópula y/o sustancias que se transfieren durante ella tiene un efecto en la estimulación de la ovipostura y longevidad en hembras de A. diversiformis, de dos diferentes edades. Si este es el caso, la predicción es que en estas dos edades, el patrón de oviposturas será similar. Además, se analizó la respuesta de la producción de huevos de la hembra según el tamaño del macho con el cual copuló y el desarrollo de ovocitos según la edad de la misma. Los hallazgos sugieren la posibilidad que la relación tasa de ovipostura y tamaño del macho aceptado, se explique bajo selección sexual por elección femenina precópula. Las hembras tuvieron una mayor tasa de oviposturas con machos más grandes.
Materiales y métodos
Obtención de hembras y machos vírgenes: Moscas adultas y estiércol de vaca se recolectaron, en potreros ubicados en las afueras de la ciudad de San José, Costa Rica. El estiércol se colectó fresco y se sometía a congelación con el fin de matar otros insectos y ácaros.
En el laboratorio se estableció una colonia de moscas en una jaula de cedazo (
Las cajas con estiércol que se retiraban, se colocaron dentro de cajas de plástico para criar las moscas (
Estimulación de la ovipostura y longevidad de la hembra: Para determinar el efecto de la cópula y el tamaño del macho en las oviposturas se escogió una hembra virgen de cada edad (dos y seis días) y se colocó en una caja petri vacía con dos tamaños diferentes de macho. Esto se replicó 33 veces (18 para hembras de dos días y 15 para las de seis). Cuando una hembra aceptaba un macho en cópula, con un cronómetro se registraba la duración de la misma y a partir de los cinco minutos de haber empezado la cópula, el macho no aceptado por la hembra, se retiró con un aspirador bucal cuidadosamente para no interrumpir a la pareja en cópula y se sacrificó en un frasco con alcohol al 70 %. Cuando la cópula finalizó, la hembra se trasladó a una caja de ovipostura plástica (
El estiércol de cada cajas de oviposturas (donde las hembras se alimentaron y ovipositaron) se retiró diariamente y se reponía por uno fresco, miel y agua. Este se revisó bajo un estereoscopio para contar el número de huevos cada día, los cuales se reconocían porque contrastan con la superficie del estiércol por su color blanco y el largo filamento, el cual es dos a tres veces el tamaño del huevo (Meier 1995). Las larvas en el estiércol se reconocieron por la presencia de pequeños cráteres, al parecer formados cuando colocaban la punta del abdomen hacia arriba. Las cajas de oviposturas se revisaron diariamente para contar los huevos y para llevar un registro de la longevidad de la hembra. Después de contar los huevos, cada caja se colocó en cajas de emergencia de adultos para contar la proporción de descendencia emergida, la cual indicaba el éxito de fertilización.
La fecundidad era expresada de tres maneras: 1- como el número total de huevos puestos después de la cópula y durante toda la vida de una hembra, 2- como postura (número o grupo de huevos puestos en una sesión de ovipostura. Una sesión era realizada cada dos o tres días) y 3- como tasa de ovipostura (total de huevos puestos durante la vida de una hembra, dividido por los días de vida después de la cópula).
Desarrollo de los ovocitos según la edad de hembras vírgenes: Con el fin de determinar si los ovocitos maduraban con la edad, se examinó su desarrollo en diferentes edades de hembras vírgenes. Las hembras recién nacidas (obtenidas de la misma forma mencionada anteriomente), se separaron de los machos y se colocaron en nuevas cajas de plástico (
Los datos sobre las oviposturas en las dos edades de hembra presentaron una distribución de tipo no paramétrico. El modelo de regresión lineal simple se ajustó para examinar la relación entre tamaño de los ovocitos y edad de hembras vírgenes. El de regresión múltiple para analizar la relación entre el número total de huevos puestos por la hembra sobre la duración de la cópula y tamaño del cuerpo de ambos sexos.
Resultados
Estimulación de la ovipostura y longevidad de la hembra: El número de oviposturas diarias y la duración de vida de A. diversiformis, se observó en 18 hembras que copularon una sola vez a los dos días de nacidas y en 15 hembras a los seis días de nacidas.
La predicción en cuanto al estímulo de la cópula en las dos edades de la hembra fue confirmada, ya que hubo una sincronización en los comportamientos de ovipostura en las hembras. Los resultados demostraron que: no hubo diferencias significativas entre hembras que copularon a los dos y seis días de nacidas en cuanto al número de días que vivieron después de la cópula (Hembras de dos días=36.64 +11.18 días. Mín.=22. Máx.=54 días, n=18. Hembras de 6 días=28.28 +11.86 días. Mín.=13. Máx.=51 días, n=15; P=0.080 Mann-Whitney). Entre estas hembras tampoco hubo diferencias significativas en el tiempo empleado en las oviposturas (las hembras de dos días colocaron huevos en promedio hasta los 32.89 +11.52 días de edad (Mín.=14. Máx.=51 días, n=18 y las de 6 hasta los 24.73 +11.76 días. Mín.=7. Máx.=9 días, n=15; P=0.062. Mann-Whitney).
Las primeras oviposturas de hembras que copularon a los dos y seis días de edad empezaron a edades diferentes de la hembra, pero en tiempos similares después de la cópula; las de dos días en promedio empezaron a los 7.1 días de edad y las de seis a los 10.5 días de edad (t=1.15, g.l=31. P=0.26. Prueba de t para muestras independientes). Ninguna hembra ovipuso durante los dos primeros días después de haber copulado con un macho. Solamente tres (16.6 %) hembras de dos días y dos (13.3 %) de seis días empezaron a oviponer a partir del tercer día de haber copulado con un macho.
El número de huevos puestos durante los diez primeros días después de la cópula, no difirió significativamente entre los dos grupos de edades de la hembras (t=0.47, g.l=18. P=0.63. Prueba de t para muestras independientes).
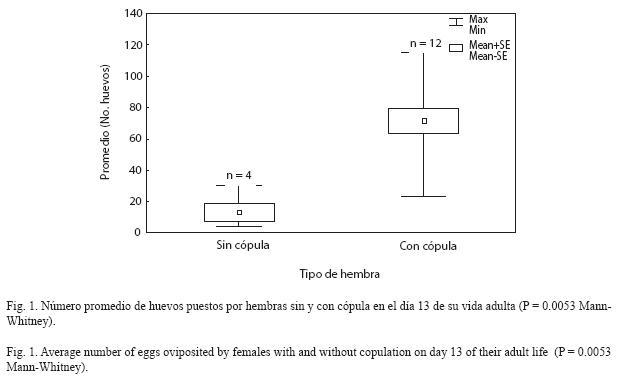
Consistente con nuestra predicción, la cópula estimuló no solamente la producción de mayor número de huevos, sino que además estimuló la ovipostura en sí, ya que las hembras vírgenes ovipositaron huevos no fértiles solamente a partir de los 13 días de edad, mientras que las hembras no vírgenes ovipositaron entre cinco y seis días después de la cópula. A los 13 días, el 36 % de las hembras no vírgenes (con cópula) colocaron un número promedio de huevos mayor que las vírgenes (Figura 1).
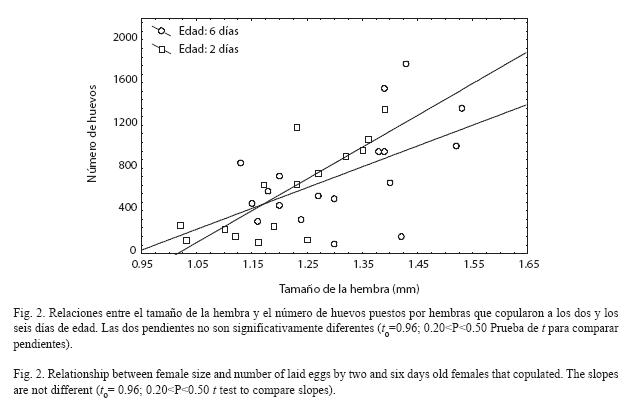
El 23 % de la variación en el número de huevos de las hembras de dos días fue explicado por su tamaño corporal (F1,16=6.24; P=0.023. Regresión lineal simple) y en hembras de seis días, fue del 60 % (F1,13=21.95; P=0.0004. Regresión lineal simple). Las pendientes de las dos edades no difirieron estadísticamente (Figura 2). Por otro lado, el número promedio de posturas en toda la vida de una hembra que copuló a los dos días, era un poco más alto pero no difirió estadísticamente al de hembras que copularon a los seis días (t=1.65, g.l=31. P=0.11. Prueba de t para muestras independientes). El tiempo promedio entre posturas fue de 2.5 y 2.36 días en las dos edades respectivamente (t=0.76, g.l=335. P=0.45. Prueba de t para muestras independientes).
No hubo diferencias significativas entre hembras que copularon a los dos y seis días, en cuanto al número total de huevos puestos durante toda su vida (Promedio hembra dos días=737 huevos. Mediana=623. Mín.=87, Máx.=1772, n=18. Promedio (seís días)=587.5 huevos. Mediana=642. Mín.=104. Máx.=1349, n=15; P=0.38. Mann-Whitney). Tampoco hubo diferencias significativas entre hembras que copularon a estas dos edades, en cuanto al número de moscas adultas emergidas (Mediana hembra dos días=238 adultos. Mín.=39, Máx.=507, n=18. Para seís días=173 adultos. Mín.=4. Máx.=503, n=15; P=0.25. Mann-Whitney). El éxito de fertilización fue del 32.5 % en hembras que copularon a los dos días (los adultos emergieron de 13237 huevos) y del 35 % en hembras que copularon a los seis días (adultos emergidos de 8812 huevos).
Utilizando un análisis de regresión múltiple y eliminando los términos no significativos, se encontró que el el 44 % de la variación en el número total de huevos puestos por la hembra se explica por el tamaño de la misma (F2,30=13.873; P=0.00010), mientras que la duración de la cópula y el tamaño del macho no tuvieron efectos significativos. Con la tasa de oviposturas (Nº. total de huevos/duración de la vida de la hembra) además de un efecto significativo del tamaño de la hembra (F2,30=9.76; P=0.00019), también hubo un efecto significativo del tamaño del macho (F2,30=9.76; P=0.011). Estos dos factores explicaron el 35 % de la variación en el número de huevos puestos durante toda la vida de la hembra. La duración de la cópula no tuvo efecto sobre la tasa de oviposturas (F2,30=9.76; P=0.53).
Las hembras con un tamaño corporal mayor al promedio vivieron más tiempo (r2=0.27. F1,31=12.79; P=0.0011, n=33. Regresión Lineal Simple). El 57 % de la variación en el número de huevos de la hembra depende de su longevidad (F1,31=43.95; P=0.00001, n=33. Regresión Lineal Simple). El 34 % de la variación en la duración de la vida de la hembra fue explicado únicamente por el tamaño de la misma (F1,31=19.6; P<0.00011). Ni el tamaño del macho (F1,31=19.6; P<0.60), ni la duración de la cópula (F1,31=19.6; P<0.60. Regresión Múltiple paso a paso hacia adelante) tuvieron un efecto significativo sobre la longevidad de la hembra.
No hubo diferencias significativas entre hembras que copularon a los dos y seis días de edad, en cuanto a la relación macho/hembra en hijos (Mediana Hembra de dos días=0.98. Mín.=0.6, Máx.=1.25, n=18. De seis días=0.92. Mín.=0.50. Máx.=1.37, n=16; P=0.33. Mann-Whitney).
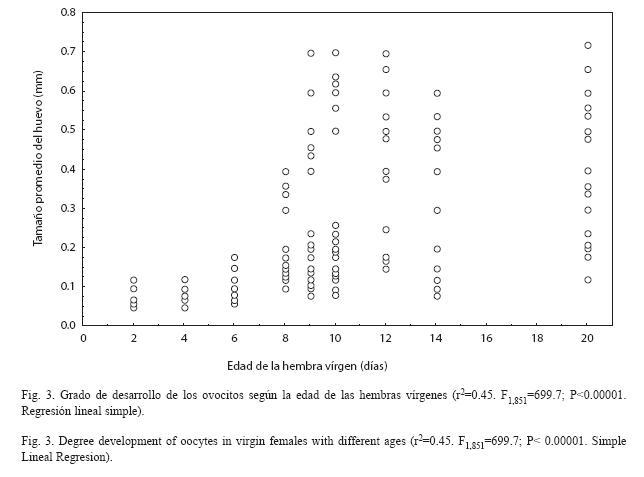
Desarrollo de los ovocitos según la edad de la hembra: Se encontró que los ovocitos en las hembras vírgenes crecieron con la edad. El 45 % de la variación del tamaño depende de la edad de la misma (Figura 3). No se encontró que el grado de desarrollo de los ovocitos dependiera del tamaño de la hembra (r2=0.00034. F1,95=0.032; P=0.85. Regresión Lineal Simple).
Discusión
Varias evidencias encontradas en este estudio indicaron que la cópula en moscas de A. diversiformis estimuló la ovipostura. Las hembras que copularon a los dos y seis días de edad, empezaron a oviponer después de la cópula en tiempos similares. Por otro lado, durante los primeros diez días después de la cópula las hembras más jóvenes colocaron un número de huevos y un número de posturas similar al de hembras de mayor edad. En este estudio la manipulación de la edad fue importante porque la sincronización en los patrones de oviposturas en hembras que copularon a diferentes edades demostró que en esta especie, la cópula y/o las sustancias que se transfieren durante ella, pueden ser factores importantes en la estimulación de las oviposturas en esta especie. En otros grupos de insectos (Guillot 1988) y en Diptera particularmente, Chapman et al. (1998) reportaron que en 38 de 64 especies, la cópula incrementa la producción de huevos en la hembra. Estos resultados sin embargo, no consideran la diferencia entre efecto de la cópula y edad de la hembra, los cuales podrían estar confundidos.
Otra evidencia de la estimulación de la cópula en la ovipostura de la hembra de A. diversiformis fue que las hembras vírgenes pusieron huevos en número muy reducido y solo a partir de los 13 días de nacidas, mientras que hembras con cópula y de la misma edad de las vírgenes colocaron mucho más huevos (Fig. 1). La cópula también incrementó la producción de huevos en Sepsis Cynipsea, en comparación al de hembras vírgenes (Blanckenhorn et al. 2002, Teuschl & Blanckenhorn 2007). Pero en Saltella sphondylli (Martin & Hosken 2004) este no es el caso, porque las hembras vírgenes no colocaron ningún huevo a pesar que incluyeron experimentos con y sin la posibilidad de que las hembras los pusieran. Sin embargo, en otras especies de Diptera como en Coelopa frigida (Pitafi 1990) y en varias especies de Drosophila, Xue & Noll (2000) encontraron que las hembras vírgenes colocaron en promedio cuatro huevos por día comparado con 43 huevos colocados por hembras con cópula y, concluyen que el esperma y los productos de la glándula seminal son factores que estimulan la oviposición en estas especies de mosca.
Los resultados de este estudio resaltan otro aspecto interesante y es que en A. diversiformis, la estimulación por parte del macho sobre la ovipostura y maduración de los huevos en la hembra no parece absoluta. Al parecer las hembras también pueden coordinar las oviposturas porque los ovocitos en las hembras vírgenes crecieron con la edad. Además, estas hembras presentaron cierta flexibilidad en cuanto al grado de desarrollo de sus ovocitos, pues dentro de cada edad, algunas hembras no desarrollaron sus ovocitos mientras que otras si lo hicieron. El significado de esta flexibilidad no es del todo claro. Una probable explicación puede ser que el alimento obtenido en el laboratorio pudo haber contribuído al desarrollo de los ovocitos, pues se sabe que las hembras para reproducirse exitosamente deben coordinar la alimentación, el apareamiento y hasta los sitios para oviponer (Wheeler 1996, Lachmann & Papaj 2001, Kaspi et al. 2002). Respecto a los nutrientes, estos son necesarios para soportar el desarrollo embrionario, así que el tiempo en la produccion y maduración de huevos a menudo está relacionado con el tiempo de alimentación (Wheeler 1996). Por ejemplo, en S. cynipsea y muchas otras especies de Sepsidae, las hembras vírgenes necesitan proteína para producir huevos. Ellas tienen que visitar e ingerir el estiércol fresco antes de iniciar la postura de huevos (Schulz 1999, Teuschl & Blanckenhorn 2007). En este estudio las hembras de A. diversiformis en condiciones de laboratorio se alimentaron de excremento, miel y agua. Probablemente las buenas condiciones alimenticias influyeron en la maduracion de los ovocitos y por eso el análisis sobre el tamaño de la hembra en si mismo, no explicó el desarrollo de los huevos en las hembras vírgenes.
El número promedio de posturas que las hembras de dos y seis días hacen durante toda su vida y el tiempo promedio entre éstas, fue similar para las hembras de ambas edades después de haber copulado. Este último patrón concuerda con el de otras especies de moscas. Las hembras de C. frigida (Butlin & Day 1985) colocan una postura de huevos cada dos o tres días y en S. cynipsea, Schulz (1999) encontró que las hembras necesitan aproximadamente dos días para colocar una nueva postura de huevos; en A. diversiformis el tiempo promedio entre posturas era de 2.5 +1.63 días. Por otro lado, el éxito de fertilización entre hembras de las dos edades fue similar (32.5 % y 35 % respectivamente) pero contrasta con el de S. cynipsea donde el éxito de fertilizacion varió entre el 40 y 90 % en hembras de tres a cuatro días de edad (Teuschl & Blanckenhorn 2007).
En A. diversiformis el número de huevos puestos por la hembra incrementó según su propio tamaño. Esto mismo ha sido demostrado en S. cynipsea (Blanckenhorn et al. 1999, 2002), en algunas familias de Diptera como Scatophagidae (Parker 1970, Borgia 1981, Parker et al. 1999), en Coelopidae (Butlin & Day 1985) y en muchos otros grupos de insectos (Thornhill & Alcock 1983, Honêk 1993). Sin embargo, el incremento de la fecundidad de la hembra de A. diversiformis por efecto del tamaño del macho con el cual copuló, no ha sido investigado experimentalmente en ninguna otra especie de Sepsidae. Este incremento probablemente ha evolucionado bajo selección sexual por elección femenina pre-copulatoria. La tendencia de la hembra de A. diversiformis fue colocar la mayor tasa de huevos (Nº. de huevos/duración de vida de la hembra) después de copular con un macho grande. Por otro lado, dado que el tamaño de la hembra también influyó en la cantidad total de huevos puestos y en la tasa de oviposturas, es posible que los machos grandes también estén escogiendo a las hembras grandes a través de apareamientos asortativos, bajo la hipótesis de elección de pareja por tamaño de ambos sexos (Crespi 1989). Quizá la hembra obtiene otros beneficios directos al aparearse con este tamaño de macho. Por un lado, este pudo proporcionar más alimento ya que los machos de mayor tamaño transfieren espermatóforos más grandes y ellas pueden degradarlo hasta desaparecer completamente en un lapso máximo de 25 horas (L. Rodríguez, en prep.). Los machos grandes se podrían beneficiar al inducir a la hembra a colocar el mayor número de huevos, de esta forma sus probabilidades de una mayor paternidad aumentarían con la descendencia de esa hembra. Por otro lado, las hembras que favorecen a machos grandes, además de poner más huevos, podrían tener ventajas en producir hijos que provean los mayores espermatóforos a sus compañeras.
La longevidad en hembras de A. diversiformis parece estar influenciada más por su propio tamaño que por el tamaño del macho y/o la duración de la cópula. En esta especie no se observó que el macho impusiera costos a la hembra, en terminos de reducir su longevidad. Al contrario, la longevidad parece conferir ventajas a la hembra en cuanto a mayores oportunidades de tener mayor número de huevos, pues las más longevas colocaron en promedio 931 huevos durante toda su vida, mientras que las que vivieron menos tiempo colocaron 327 huevos en promedio. En S. sphondylli, tampoco se encontró que la cópula (fuera una o seis) influyera significativamente sobre la longevidad de la hembra (Martin & Hosken 2004). Los resultados en estas dos especies de Sepsidae contrastan con los de S. cynipsea, donde al parecer hay altos costos del apareamiento en términos de incrementar la mortalidad inmediatamente después de la primera cópula (Blanckenhorn et al. 2002, Hosken et al. 2003, Martin & Hosken 2003). En A. Diversiformis, las evidencias demostraron que los machos lograron incrementar la fecundidad de la hembra sin ocasionar el costo de reducir su supervivencia. Este podría ser un caso donde no se presenta el conflicto sexual entre machos y hembras.
En conclusión, la cópula y/o la transferencia del eyaculado incrementan la ovipostura en hembras de A. diversiformis, aunque estas pueden ejercer cierto control sobre el desarrollo de sus huevos. Se necesitan más estudios para determinar la sustancia específica y/o el comportamiento de cópula responsable del control de la ovipostura. El tamaño de la hembra y del macho tuvieron efectos positivos en la longevidad y producción de progenie, lo cual podría resultar en una selección direccional hacia individuos de mayor tamaño. En A. diversiformis las hembras no parecen sufrir un costo al aparearse en términos de longevidad, lo cual podría indicar que en esta especie no existe un conflicto sexual en términos de aceptar una cópula.
Agradecimientos
Agradezco especialmente a William G. Eberhard por apoyarme en el desarrollo de las ideas de este capítulo de mi tesis de maestría (Programa de Posgrado en Biología, Universidad de Costa Rica) y por supuesto por sus valiosos comentarios. A Federico Escobar S. por su importante asesoría estadística y apoyo financiero en Costa Rica.
Resumen
Se evaluó el efecto de la cópula como factor estimulante de la oviposición en Archisepsis diversiformis utilizando hembras de dos edades, y en la longevidad de la hembra y en la proporción sexual de la progenie, tomando en cuenta el tamaño de hembra y macho, y el desarrollo de los ovocitos en relación a la edad de la hembra. Se demostró que una demora en copular indujo una demora en oviponer. También hubo similitud en el número de huevos puestos en los diez primeros días después de la cópula, en el número promedio de posturas (grupo de huevos puestos por día) durante toda la vida de una hembra, y en el tiempo promedio transcurrido entre posturas. Otra evidencia del efecto de la cópula en la ovipostura, fue que las hembras que copularon ovipositaron más rápido que las vírgenes. Además, éstas colocaron un número muy bajo (en promedio 14) de huevos a partir de los 13 días de edad, mientras que hembras de esta misma edad (que previamente habían copulado a los dos o seis días de edad) colocaron un mayor número (en promedio 75) de huevos. Como en otros estudios, el tamaño de la hembra tuvo un efecto significativo sobre el número total de huevos puestos. Sin embargo, el tamaño del macho afectó significativamente la tasa (Nº total de huevos/duración de la vida de la hembra) de ovipostura. Estos datos sugieren la posibilidad de que la selección sexual por elección femenina actúe en hembras de esta especie de mosca.
Palabras clave: tasas de oviposición, Archisepsis diversiformis, elección femenina, desarrollo de ovocitos, tamaño y longevidad femenina, Costa Rica.
Recibido 09-X-2007. Corregido 06-X-2008. Aceptado 18-XI-2008.
Referencias
Adams, T.S. & M.S. Mulla. 1968 The reproductive biology of Hippelatus collusor. III. Effect of temperature on oogenesis. Ann. Entom. Soc. Amer. 61: 368-372. [ Links ]
Alonso-Pimentel, H., J.B. Korer, C. Nufio & D.R. Papaj. 1998. Role of colour and shape stimuli in host-enhanced oogenesis in the walnut fly, Rhagoletis juglandis. Physiol. Entom. 23: 97-104.
Blanckenhorn, W.U., C. Morf, C. Mühlhaüser & T. Reusch. 1999. Spatiotemporal variation in selection on body size in the dung fly Sepsis cynipsea. J. Evol. Biol.
12: 563-576.
Blanckenhorn, W.U., D.J. Hosken, O.Y. Martin, C. Reim, Y. Teuschl & P.I. Ward. 2002. The cost of copulating in the dung fly Sepsis cynipsea. Behav. Ecol. 13: 353-358. [ Links ]
Borgia, G. 1981. Mate selection in the fly Scatophaga stercolaria: female choice in a male-controlled system. Anim. Behav. 29: 71-80. [ Links ]
Bownes, M. 1989. The roles of juvenile hormone, ecdysone and the ovary in the control of Drosophila Vitellogenesis. J. Insect Physiol. 35: 409-413. [ Links ]
Butlin, R.K. & T.H. Day. 1985. Adult size, longevity and fecundity in the seaweed fly, Coelopa frigida. Heredity 54: 107-110. [ Links ]
Chapman, T., L.F. Liddle, J.M. Kalb, M.F. Wolfner &
Chapman, T., T. Miyatake, H.K. Smith & L. Partridge. 1998. Interactions of mating, egg productions and death rates in females of the Mediterranean fruit fly, Ceratitis capitata. Proc. R. Soc. London., Ser. B: Biol. Sci. 265(1408): 1879-1894. [ Links ]
Chapman, T. 2001. Seminal fluid-mediated fitness traits in Drosophila. Heredity 87: 511-521. [ Links ]
Chen, P.S., E. Stumm-Zollinger, T. Aigaki, J. Balmer, M. Bienz & P. Bohlen.
Clutton-Brock, T & P. Langley. 1997. Persistent courtship reduce male and female longevity in captive
tsetse flies Glossina morsitans morsitan Westwood (Diptera:Glossinidae). Behav. Ecol. 8: 392-395.
Craddock, E.M & C.R.B, Boake. 1992. Onset of vitellogenesis in female Drosophila silvestris is accelerated in the presence of sexually mature males. J. Insect Physiol. 38: 643-650. [ Links ]
Crespi, B.J. 1989. Causes of assortative mating in arthropods. Anim. Behav. 38:980-1000. [ Links ]
Daviescole, J., H.G. Morgan, M. Chaudhury & G.P. Kaaya. 1993. Some aspects of sexual receptivity and refractory behaviour in female Glossina morsitans Westwood. Insec Sci. Applic. 14: 723-727. [ Links ]
Eberhard, W.G. 2000. Behaviour and reproductive status of Microsepsis eberhardi flies away from oviposition sites (Diptera, Sepsidae). Ann. Entom. Soc. Ame. 93: 966-971. [ Links ]
Fletcher, B.S., S. Pappas, E. Kapatos. 1978. Changes in the ovaries of olive flies Dacus oleae (Gmelin) during the summer, and their relationship to temperature, humidity and fruit availability. Ecol. Entom. 3: 99-107. [ Links ]
Gilbert, L.I. 1976. The Juvenile Hormones. Plenum, Nueva York, EEUU. [ Links ]
Guillot, C. 1988. Accessory sex glands in Arthropoda-Insecta. p. 319-
Reproductive biology of invertebrates. III. John Wiley & Sons.
Gwadz, R.W. 1972. Neuro-hormonal regulation of sexual receptivity in female Aedes aegypti. J. Insect Physiol.
18: 259-266.
Herndon, L.A. & M.F. Wolfner.
Honêk, A. 1993. Intraspecific variation in body size and fecundity in insects: A general relationship. Oikos
66: 483-492.
Hosken, D.J., O.Y. Martin, J. Born & F. Huber. 2003. Sexual conflict in Sepsis cynipsea: female reluctance, fertility and mate choice. J. Evol. Biol. 16: 485-490. [ Links ]
Kaspi, R., S. Mossinson, T. Drezner, B. Kamensky & B. Yuval. 2002. Effects of larval diet on development rates and reproductive maturation of male and female Mediterranean fruit flies. Physiol. Entom. 27: 29-38. [ Links ]
Koveos, D.S. & M.E. Tzanakakis. 1990 Effect of the presence of olive fruit on ovarian maturation in the olive fruit fly, Dacus oleae, under laboratory conditions. Entom. Experim. Appl. 55: 161-168. [ Links ]
Kubli, E. 1996. The Drosophila sex-peptide: A peptide pheromone involved in reproduction. Adv. Dev. Biochem. 4: 99-128. [ Links ]
Lachmann, A.D. & D.R. Papaj. 2001. Effect of host stimuli on ovariole development in the walnut fly, Rhagoletis juglandis (Diptera, Tephritidae). Physiol. Entom. 26: 38-48. [ Links ]
Leopold, R.A. 1976. The role of male accesory glands in insect reproduction. Ann. Rev. Entom. 21: 199-221. [ Links ]
Martin, O.Y. & D.J. Hosken. 2004. Copulation reduces male but not female longevity in Saltella sphondylli (Diptera: Sepsidae). J. Evol. Biol. 17: 357-362. [ Links ]
McDonald, R.S. & J.H. Borden. 1995. The relationship of age and ovarian development to mating of Delia antiqua (Diptera: Anthomyiidae). Physiol. Entom.
Meier, R.
Miller, J.R., J.L. Spencer, A.J. Lentz, E.D. Walker & J.F. Leykam. 1994. Sex-peptides: potentially important and useful regulators of insect reproduction. p. 292
Morrison, P.E., K. Venkatesh & B. Thompson. 1992. The role of male accessory gland substance on female reproduction with some observations of spermatogenesis in the stable fly. J. Insect Physiol. 28: 607-614. [ Links ]
Oberhauser, K.S. 1997. Fecundity, lifespan and egg mass in buttterflies: effects of male-derived nutrients and female size. Funct. Ecol. 11: 166-175. [ Links ]
Papaj, D.R. 2000. Ovarian dynamics and host use. Annu. Rev. Entom. 45: 423-448. [ Links ]
Pappas, C. & G. Fraenkel. 1977. Nutritional aspects of oogenesis in the flies Phormia
Park, Y.I., S.B. Ramaswamy & A. Srinivasan. 1998. Spermatophore formation and regulation of egg maturation and oviposition in female Heliothis by the male.
Parker, G.A. 1970. The reproductive behaviour and the nature of sexual selection in Scatophaga stercolaria
L. (Diptera: Scatophagidae) II. The fertilization rate and the spatial and temporal relationships of each sex around the site of mating and oviposition. J. Anim. Ecol. 39: 205-228.
Parker, G.A. 1972a. Reproductive behaviour of Sepsis cynipsea (L.) (Diptera: Sepsidae). I. A preliminary analysis of the reproductive strategy and its associated behaviour patterns. Behavior 41: 172-206. [ Links ]
Parker, G.A. 1972b. Reproductive behaviour of of Sepsis cynipsea (L.) (Diptera: Sepsidae). II. The significance of the precopulatory passive phase and migration. Behavior 41: 242-250. [ Links ]
Parker, G.A. 1979. Sexual selection and sexual conflict. p. 123-166. In: M. S. Blum & N.A. Blum (eds.). Sexual selection and reproductive competition in insects. Academic, Nueva York, EEUU. [ Links ]
Parker, G.A., L.W. Simmons, P. Stockley, D.M. McChristie & E.L. Charnov. 1999. Optimal copula duration in yellow dung flies: effects of female size and egg content. Anim. Behav. 57: 795-805. [ Links ]
Pitafi, K.D., R. Simpson, J.J. Stephen & T.H. Day. 1990. Adult size and mate choice in seaweed flies. Heredity
65: 191-197.
Pont, A.C. 1979. Sepsidae. Diptera Cyclorrhapha, Acalyptrata. p. 1-
Rice, W.R. y B. Holland. 1997. The enemies within: intergenomic conflict, interlocus contest evolution (ICE) and the intraspecific Red Queen. Behav. Ecol. Sociobiol. 41: 1-10. [ Links ]
Riemann, J.G., D.J. Moen & B.J. Thorson. 1967. Female monogamy and its control in house fly. J. Insect Physiol. 13: 407-418. [ Links ]
Robinson, A.S. & G. Zurlini. 1979. The response of two strains of Hylema antiqua (Diptera: Anthomyiidae) to a constant and alternating temperature regime.
Saunders, D.S. & C.W.H. Dodd. 1972. Mating, insemination, and ovulation in the tsetse fly, Glossina morsitans. J. Insect Physiol. 18: 187-198. [ Links ]
Schulz, K.S. 1999. The evolution of mating systems in black scavenger flies (Diptera: Sepsidae). Ph. D. thesis,
Smid, H.M. 1997. Chemical mate guarding and oviposition stimulation in insects: a model mechanism alternative
to the Drosophila Sex-Peptide paradigm. Proc. Kon. Ned. Akad. v. Wetensch. 100(1-2): 269-278.
Teuschl, Y. & W.U. Blanckenhorn. 2007. The reluctant fly: what makes Sepsis cynipsea females willing to copulate? Anim. Behav. 73: 85-97. [ Links ]
Thornhill, R. 1983. Cryptic female choice and its implications in the scorpionfly Harpobittacus nigriceps. Amer. Nat. 122: 765-788. [ Links ]
Thornhill, R. & J. Alcock. 1983. The evolution of insect mating systems.
Trivers, R.L. 1972. Parental investment and sexual selection. p. 136-179. In: B. Campbell (ed). Sexual selection and the descent of man. Aldine, Chicago, EEUU. [ Links ]
Tzanakakis
79: 15-18.
Ward, P.I. 1983. The effects of size on the mating behaviour of the dung fly Sepsis cynipsea. Behav. Ecol. Socio.
13: 75-80.
Ward, P., H. Hemmi & T. Röösli. 1992. Sexual conflict in the dung fly Sepsis cynipsea. Func. Ecol. 6: 649
Webster, R.P. & J.G. Stoffolano. 1978. The influence of diet on the maturation of the reproductive system of the apple maggot, Rhagoletis pomonella. Ann. Entom. Soc. Am.71: 844-849. [ Links ]
West-Eberhard, M.J. 1984. Sexual selection, competitive communication and species-specific signals in insects. p. 283-324. In: T. Lewis (ed). Insect communication. Academic, Nueva York, EEUU. [ Links ]
Wheeler, D. 1996. The role of nourishment in oogenesis. Ann. Rev. Entom. 41: 407-431. [ Links ]
Wolfner, M.F. 1997. Tokens of love: functions and regulation of Drosophila male accessory gland products. Ins.
Biochem. Molec. Biol. 27: 179-192.
Wolfner, M.F. 2002. The gifts that keep on giving: physiological functions and evolutionary dynamics of male seminal proteins in Drosophila. Heredity 88: 85-93. [ Links ]
Xue, L. & M. Noll. 2000. Drosophila female sexual behavior induced by sterile males showing copulation complementation. Proc. Natl. Acad. Science. 97 (7): 3272-3275. [ Links ]