Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.50 n.3-4 San José Dec. 2002
Abstract
The abundance, population structure, and growth of the Pen-shell Atrina maura in the Corralero-Alotengo tropical lagoon system in Oaxaca, Mexico, were studied from February to September of 1997. An abundance analysis showed significant temporal and spatial differences (Kruskal-Wallis, p< 0.001). Two spatial groups of abundance were found in the area, one from the mouth of the lagoon system to the middle of the Penshell bank, and the other between the middle of the Pen-shell bank and the head of the system. Three temporal periods of abundance were found (February-April-May; July-August; March-June-September). The distribution of population size showed that benthic recruitment of A. maura occurred from February to July. Length frequency of A. maura is commonly wide-ranging; nevertheless, in this study Pen-shell organisms with a valve length of 15 cm were frequently found. The growth rate length was 3.7 cm/month during the dry season (February to May), and 3.5 cm/month during the rainy season (June to September). Sex ratio was maintained at 1: 1 from February to May, but males were dominant from June to August, and the minimum length for reproduction was registered at 10 cm valve length.
Key words
abundance, population structure, growth, Pen-sheli, Atrina maura, tropical coastal lagoon.
En México, los miembros de la familia Pinnidae son conocidos comúnmente como callos de hacha, viven generalmente en bahías y lagunas costeras con fondos constituidos de arena fina y limo-arcilla, a profundidades que van de 0.5 a 15 m. Este molusco, dominante en la comunidad bentónica de los sitios donde habita, forma densos bancos de tamaño y persistencia variable. En el Pacífico mexicano, los Pinnidae están representados principalmente por las especies Pinna rugosa y Atrina maura (Keen 1971 , Holguín 1988 , Skoglund 1991 ), las cuales han recibido paulatinamente mayor atención, debido a las características del músculo abductor posterior, el cual tiene una elevada demanda en el mercado regional y nacional.
En la provincia biogeográfica del Pacífico mexicano, las poblaciones silvestres de A. mau ra (Sowerby 1835) han sido objeto de un reducido número de investigaciones, enfocadas principalmente al conocimiento del ciclo reproductivo. Así Aguilar (1964) y Soria (1989) al estudiar el ciclo reproductivo de esta especie mediante cortes histológicos encontraron que, los individuos alcanzan la madurez sexual a los 16 cm de longitud valvar, con presencia de organismos sexualmente maduros todo el año, y dos picos reproductivos; el primero de noviembre a enero y el segundo, de abril a junio. De la misma manera, Angel (2000) encontró dos períodos reproductivos importantes; uno que va de octubre a noviembre y otro, de abril a julio.
En cuanto a la estructura de la población, Soria (1989) reporta que la talla mínima registrada fue de 6 cm y la máxima de 22.6 cm, con una longitud promedio general de 14.2 cm. Asimismo, indica que existe reclutamiento en los meses de enero, julio y agosto, aunque menciona la posibilidad de que éste sea constante debido a que encontró individuos maduros todo el año. En relación a la proporción entre machos y hembras, señala que en los meses de enero, abril, agosto, noviembre y diciembre fue de 1: 1.29 y en los meses restantes del año de 1: 1. Por su parte, Angel (2000) encuentra que la proporción 1: 1 entre machos y hembras, sólo fue significativamente diferente en el mes de noviembre.
A nivel de laboratorio, se han realizado diversos esfuerzos encaminados a lograr la producción de juveniles de A. maura (Robles et al. 1996 , Serrano 1997 ), sin embargo los resultados aunque alentadores no son suficientemente consistentes para establecer estrategias de repoblación o cultivo masivo a corto plazo.
Así, mientras que por un lado se redoblan esfuerzos para desarrollar biotecnologías que permitan cultivar esta especie, las poblaciones silvestres están siendo impactadas por la presión pesquera y por fenómenos naturales. Tal es el caso de la población de A. maura de la laguna costera Corralero-Alotengo, que fue fuertemente diezmada después de que el área donde habita recibió, entre otras cosas, grandes volúmenes de agua dulce como resultado de las intensas lluvias provocadas por el paso de los huracanes "Paulina" y "Rick", en octubre y noviembre de 1997. De forma que en este trabajo se analiza la abundancia, estructura poblacional y crecimiento en talla de A. maura dentro del sistema lagunar Corralero-Alotengo, Oaxaca, México, antes de que sucedieran estas alteraciones naturales.
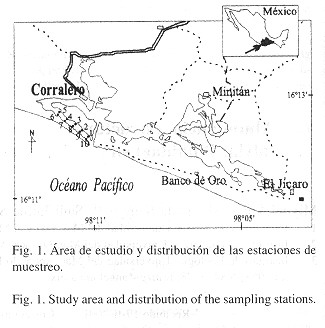
Área de estudio: El sistema lagunar Corralero-Alotengo (Fig. 1 ) se encuentra ubicado entre los 16º 11' y 16º 13' N y entre los 98º 11' y 98º 05' O, cuenta con una extensión de 3 158 ha (Contreras 1993) rodeadas por manglar y otras especies halófitas. Es un sistema sumamente ramificado, con canales y lagunas de diferente extensión y profundidad. Según Lankford (1977) , pertenece a la categoría III-A, caracterizada por presentar depresiones inundadas en las márgenes internas del borde continental, al que rodean superficies terrígenas protegidas del mar por una barra arenosa originada por olas y corrientes.
De acuerdo con la clasificación climática de Köppen, modificada por García (1981) , se encuentra dentro de la región Awol que corresponde a un clima tropical subhúmedo con régimen de lluvias en verano. La temperatura media anual es de 28.7ºC con una oscilación térmica de 3.4ºC. El mes de mayo es el más cálido, con temperatura media de 30ºC y enero el menos cálido, con 25.6ºC ( Anónimo ). La precipitación anual fluctúa entre 736.6 y 1 514.7 mm. La temporada de lluvias normalmente inicia a mediados de mayo y finaliza a principios de noviembre, periodo en el que se precipita el 97% del total anual. En la década de los años 90, el mes con mayor precipitación fue septiembre, seguido de agosto y julio (Anónimo ).
Materiales y métodos
Mensualmente, de febrero a septiembre de 1997, mediante buceo autónomo se recolectaron muestras de callo de hacha, para evaluar la abundancia, estructura poblacional y crecimiento de A. maura en diez estaciones distribuidas uniformemente dentro de un banco situado en las proximidades de la bocabarra que conecta al sistema lagunar Corralero-Alotengo con el mar adyacente (Fig. 1 ). El muestreo fue aleatorio simple con dos repeticiones, y consistió en lanzar al azar tres cuadrantes de un metro cuadrado en cada estación, contando los ejemplares existentes dentro de cada uno de ellos. Asimismo, de uno de los cuadrantes (seleccionado al azar) se recolectaron todos los organismos presentes para practicarles diferentes biometrías, entre ellas, la longitud valvar que se midió con una regla (± 0.1 cm) para analizar el crecimiento en talla de los individuos que componen la población.
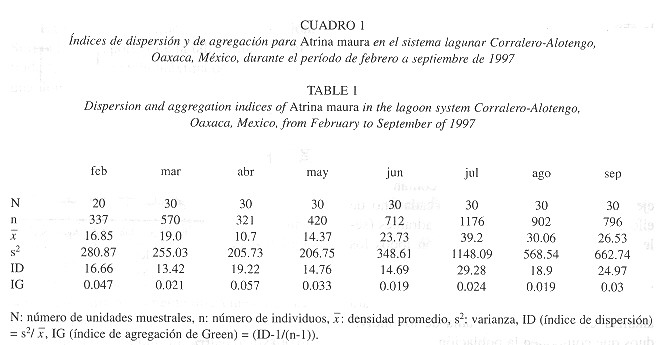
Los patrones espaciales de abundancia, se analizaron con base en las distribuciones de frecuencias estadísticas, de donde se calculó el índice de dispersión (ID = s 2/ x) y el índice de agregación de Green (IG = ID-1/(n-1) (Ludwig y Reynolds 1988 ). Además, con el fin de ver si existían diferencias significativas entre las estaciones y entre los meses de muestreo, se aplicó la prueba de rangos de Kruskal-Wallis (Zar 1996 ).
El crecimiento en talla fue inferido de la progresión modal de las frecuencias de longitud valvar, aplicando de forma combinada los métodos de: Bhattacharya (1967) , máxima verosimilitud (Gayanilo et al. 1996 ) y la unión de medias, para construir curvas de crecimiento ( Pauly 1983 , Sparre y Venema 1992 ). Siguiendo el criterio de Pauly (1983) , se analiza la curva de crecimiento que vincula un mayor numero de valores modales.
Resultados
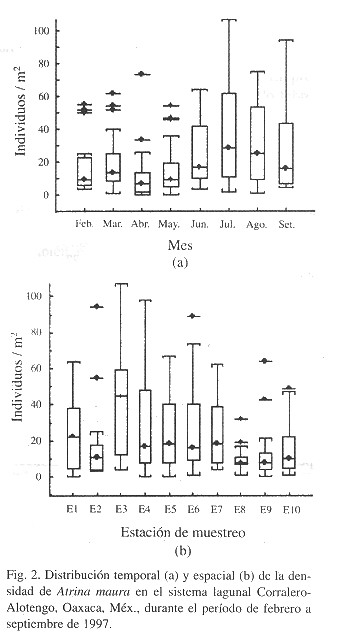
Durante el período de febrero a mayo las densidades fueron menores que de junio a septiembre, pero en éste último se incremento la varianza (Fig. 2a ). La ausencia total de individuos en las unidades muéstrales sucedió en los meses de abril y mayo, en las estaciones uno, cuatro, cinco y nueve, y la máxima presencia (109 ind/m2) se registró en el mes de julio, en la estación tres (Fig. 2a, b ). En general, las estaciones ocho y nueve presentaron las densidades más bajas y la menor varianza, y las estaciones tres y cuatro las densidades más altas y la mayor varianza (Fig. 2b ).
Los valores del ID y del IG ( Cuadro 1 ) indican que los individuos que conforman el banco de callo de hacha, en el canal del sistema Corralero-Alotengo, tienden a estar más dispersos de julio a septiembre (ID = 29.325.0) que de marzo a mayo (ID = 13.4-14.8) y por tanto, la intensidad de agregación es mayor en el periodo de secas (IG = 0.05-0.06) que en la época de lluvias (IG = 0.02-0.03), lo que permite inferir que la competencia intraespecífica por espacio y alimento es mayor antes de la temporada de lluvias.
De acuerdo con la prueba de rangos de Kruskal-Wallis aplicada a la densidad, existen diferencias altamente significativas entre las estaciones (p< 0.0001) y entre los meses de muestreo (p< 0.0017). El ordenamiento por pares de medianas (
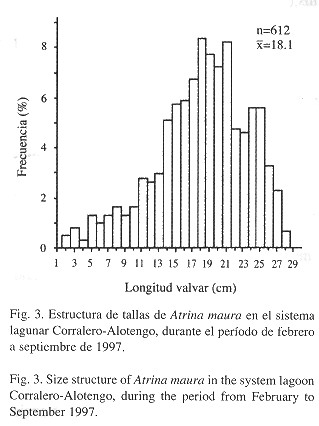
La estructura de tallas ( Fig. 3 ) indica que la población de A. maura está constituida principalmente por individuos de longitud valvar mayor a 15 cm (77.69%), donde dominan dos grupos de individuos con tallas de 17.6 a 21.5 cm y de 23.6 a 25.5 cm. La longitud valvar máxima incluyó organismos de la clase 27.6-28.5 cm, siendo el promedio general 18.13 cm. Por otro lado, la estructura mensual de tallas (Fig. 4 ) permite observar la presencia de reclutamiento a la población bentónica (individuos con talla menor o igual a 6 cm) de febrero a julio, y su ausencia, en los meses de agosto y septiembre.
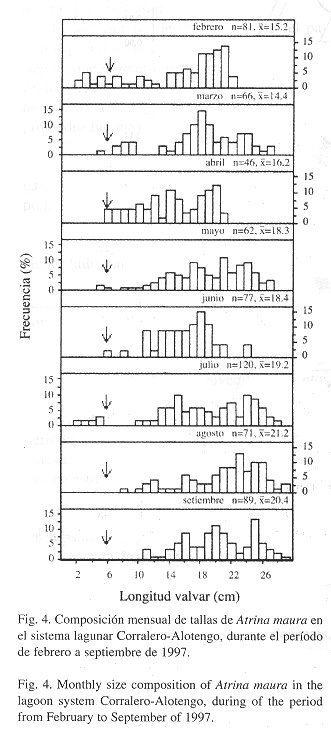
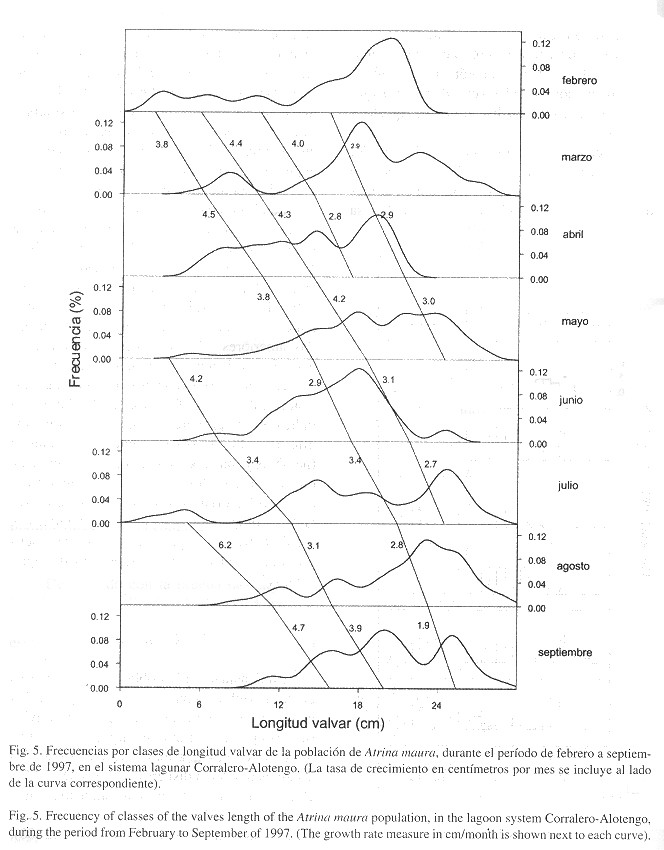
En cuanto al crecimiento en talla ( Fig. 5 ), la clase 1.6-2.5 cm, detectada en febrero, se desplaza hasta la clase 24.6-25.5 cm en el mes de septiembre, de donde se deduce que la tasa de crecimiento es de 3.3 cm/mes, con una velocidad de 4.0 cm/mes en individuos con tallas entre 1.6 y 14.5 cm, y de 2.7 cm/mes en individuos con tallas entre 14.6 y 25.5 cm. En promedio se estimó que durante el período febrero-mayo (época de secas), A. maura presentó un crecimiento de 3.7 cm/mes, mientras que en el período junio-septiembre (temporada de lluvias) el crecimiento fue de 3.5 cm/mes.
La observación macroscópica de la condición de la gónada permitió detectar madurez sexual a partir de 10 cm de longitud valvar. También, reveló la existencia de madurez gonádica continua en la población de organismos entre 13.5 y 21.5 cm de longitud, y una marcada estacionalidad en individuos con tallas superiores a 22 cm, los cuales reactivan la gametogénesis a partir del mes de mayo.
La prueba exacta de proporciones mediante intervalos de confianza al 95% (Zar 1996 ) indica que la proporción entre organismos indiferenciados y sexualmente diferenciados (hembras y machos) en marzo, julio y septiembre es 1: 1 y en los otros meses de muestreo, dominan los organismos diferenciados. Entretanto, la proporción entre machos y hembras es 1: 1 de febrero a mayo y en septiembre, mientras que en el periodo junio-agosto dominan los machos.
Discusión
La densidad de la población en los meses de secas (febrero-mayo) es menor que en los meses correspondientes a la época de lluvias (junio-septiembre); sin embargo, en este último período, hay una mayor varianza y los individuos tienden a dispersarse más (ID =14.7 a 29.3; Cuadro 1 ) (Fig. 2a ). Esta situación puede estar asociada a los hábitos reproductivos de la especie, la cual, de acuerdo con Angel (2000) , presenta dos picos de reproducción; el primero de mayor intensidad, de abril a julio y el segundo de octubre a noviembre, aunque este último, considerando lo reportado por Aguilar (1964) y Soria (1989) , probablemente se prolongue hasta enero.
Si la hipótesis anterior se toma como válida, entonces las diferencias encontradas entre los meses de secas y lluvias (prueba de rangos Kruskal-Wallis p< 0.0001) tienen correspondencia, ya que al existir un mayor número de individuos en desove, se esperaría que el reclutamiento a la población también fuera más intenso y por lo tanto, las densidades tenderían a incrementarse y fluctuar en relación al reclutamiento de nuevos individuos a la población bentónica. En cuanto a la dispersión de los individuos dentro del banco, ésta podría estar relacionada con la extracción, ya que el callo de hacha es un recurso bajo explotación pesquera, pero también estarían relacionadas con las condiciones hidrodinámicas y fisicoquímicas imperantes en el fondo ( Butler y Brewster 1979 , Butler y Keough 1981 , Wu 1983 ), así como a la geomorfología del canal donde está asentada la población.
Lo anterior puede constatarse con el patrón espacial de la densidad (Fig. 2b ), el cual sugiere que A. maura tiende a concentrarse del centro hacia la parte más interna del banco (estaciones 3 a 7, Fig. 1 ) donde la profundidad promedio fue mayor (5 m en pleamar), el tipo de sedimento ligeramente más fino (arenas medias a finas), y el porcentaje de materia orgánica levemente mayor (2%) (Sandoval, en prep.). Asimismo, dos rasgos geomorfológicos sobresalientes son el diámetro y la curvatura del canal, lo que seguramente propicia condiciones hidrodinámicas particularmente favorables, de tal forma que las larvas de A. maura analizadas por Hernández (2000) , no son transportadas más allá del canal que comunica al sistema lagunar con el mar adyacente y consecuentemente, en esta zona existe un mayor asentamiento y fijación de juveniles al bentos lagunar.
La presencia de casos atípicos durante el periodo febrero-mayo puede ser una evidencia más del efecto de la pesquería en el recurso, ya que en estos meses se realizaron actividades de extracción. Aquí habría que considerar el método empleado por los pescadores para extraer a los organismos, que al ser buceo libre, propicia que la presión de pesca sea dirigida hacia las zonas más someras y por esta causa, posiblemente se hayan detectado valores de densidad atípicos, en las estaciones menos profundas.
Se ha señalado que en las zonas tropicales, un gran número de las especies de moluscos bivalvos estudiadas, se reproducen durante todo el año, con uno o dos picos de mayor intensidad anual (Baqueiro et al. 1992 , Baqueiro et al. 1997 ). Este parece ser el comportamiento reproductivo de la especie bajo estudio, puesto que el análisis de la estructura mensual de la población (Fig. 4 ) sugiere que A. maura presenta al menos dos máximos reproductivos; el primero, detectado en febrero y el segundo, de mayo a julio. En el primer caso y de acuerdo con estudios de la misma especie en el área de estudio (Angel 2000 ) o en otras regiones de la costa del Pacífico mexicano ( Aguilar 1964 , Soria 1989 ), probablemente se trata del período de reproducción invernal, que se presenta de noviembre a febrero.
En cuanto a la reproducción continua, basados en el reclutamiento a la población, no se tiene la suficiente evidencia para confirmarla, ya que en el período de estudio, dos meses no presentan reclutamiento (agosto y septiembre), aunque hay evidencia de organismos sexualmente activos, lo cual concuerda con lo reportado por Angel (2000) . A lo anterior, debemos sumar que los Pinnidae con tallas menores a 6 cm de longitud valvar, presentan un ligero desplazamiento vertical dentro del bentos, lo que conlleva a considerar la posibilidad de no haber detectado estos organismos y subestimar el reclutamiento.
Asimismo nuestros resultados sugieren que, A. maura activa la producción de gametas y se diferencia sexualmente por primera vez a partir de los 10 cm de longitud valvar, lo que difiere con lo reportado por Soria (1989) quien detectó madurez sexual en organismos con tallas de 16 cm. En cuanto a la proporción sexual entre machos y hembras, Soria (1989) y Angel (2000) , reportan una dominancia de hembras durante la mayor parte del año, aunque para el primer autor (prueba Z, = 0.05), la proporción 1: 1, sólo fue significativamente diferente en los meses de enero, abril, agosto y diciembre, y para el segundo (prueba X2 ,
= 0.05) la diferencia solo fue significativa en el mes de noviembre.
Estos resultados no son consistentes con los obtenidos aquí, ya que los machos dominan ligeramente sobre las hembras la mayor parte del tiempo, y la hipótesis estadística de la proporción 1: 1 sólo se cumple para el período de febrero a mayo y durante el mes de septiembre. Estas discrepancias probablemente estén influidas por la diferencia en el tamaño de muestra utilizado en este estudio y el de Soria (1989) y Angel (2000) , quienes analizaron un promedio de 15 organismos, lo cual representa aproximadamente el 25% del tamaño de muestra empleado en el presente trabajo.
El crecimiento de los Pinnidae ha sido inferido por diversos autores con base en la frecuencia de tallas ( Butler y Brewster 1979 , Wu 1983 , Cendejas et al. 1985 , Arizpe y Félix 1987 , Soria 1989 , Arizpe 1995 ), reportando distintas velocidades de crecimiento para las diferentes especies. En nuestro caso, el crecimiento estimado para A. maura (23.8 cm en ocho meses) en el primer año de vida es mayor a los 20 cm reportados por Soria (1989) para la misma especie en las costas de Michoacán, México.
Esta diferencia posiblemente se debe a las características ambientales de los sitios de estudio, pues, mientras que la población analizada por Soria se localiza en la desembocadura de un río, la aquí estudiada se encuentra en las cercanías de la bocabarra de un sistema lagunar, cuyos aportes fluviales son tan escasos, que la salinidad del agua donde está asentada la población presenta valores típicamente marinos durante todo el año ( Ahumada y Ruiz 2000 ).
Lo anterior, presupone una mayor estabilidad ambiental, la cual se refleja en un mayor crecimiento de la especie. Esta hipótesis parece razonable si consideramos la diferencia encontrada en la velocidad de crecimiento entre los meses de secas (3.7 cm/mes) y los de lluvias (3.5 cm/mes).
De acuerdo con nuestros resultados, organismos con tallas menores a 24 cm de longitud valvar corresponden a individuos en el primer año de vida y aquellos con longitudes mayores, al segundo año. Estructura de tallas coherente, si consideramos que la conexión del sistema lagunar y el mar adyacente se restableció dos años antes del presente estudio y a partir de ella, se presentaron las primeras fijaciones y dio inició el reclutamiento de los Pinnidae a la población bentónica del interior del Sistema.
Agradecimientos
Se agradece especialmente a Octaviano Hernández, Heladio Spindola, Darío, Adrián y Máximo Mayren, así como a la comunidad de Corralero, Oaxaca, la ayuda y cooperación durante el trabajo de campo. Asimismo, agradecemos a la Universidad del Mar el apoyo para la realización del presente estudio.
Resumen
Mensualmente, de febrero a septiembre de 1997, mediante muestreo aleatorio simple con dos repeticiones, se estudió la abundancia, estructura poblacional y crecimiento del molusco bivalvo Atrina maura en diez estaciones distribuidas de manera uniforme, en un banco natural localizado dentro del sistema lagunar Corralero-Alotengo, Oaxaca, México. El análisis de la abundancia reveló diferencias estadísticas, altamente significativas entre las estaciones y entre los meses de muestreo (Kruskal-Wallis, p< 0.001). De acuerdo con el arreglo espacial de abundancia, se diferencian dos grandes grupos, uno de la boca a la región media del banco de A. maura y otro, de la mitad del banco hacia el interior del sistema lagunar. Temporalmente, se reconocieron tres períodos de abundancia; febrero-abril-mayo, julio-agosto, y marzo-junio-septiembre. La distribución de tallas, indica que A. maura se recluta al bentos de febrero a julio. Asimismo, aún cuando se encontró un amplio intervalo de tallas, dominan los organismos con longitud valvar mayor o igual a 15 cm (77.69%). Se estimó un crecimiento en talla de 3.7 cm/mes durante el periodo de secas (febrero a mayo) y de 3.5 cm/mes durante la temporada de lluvias (junio a septiembre). De febrero a mayo la proporción sexual fue 1:1, la dominancia de machos fue evidente en el período de junio a septiembre, y se detectó madurez gonadal a partir de 10 cm de longitud valvar.
Referencias
Aguilar, F. 1964. Contribución al estudio histológico de las gónadas de Atrina maura Sowerby, 1835 (Mollusca: Pinnidae). Tesis de Licenciatura en Biología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, D. F., México. 27 p. [ Links ]
Ahumada, M.A. & N. Ruiz. 2000. Condiciones hidrológicas del sistema lagunar Corralero-Alotengo, Oaxaca, México. Memorias del XII Congreso Nacional de Oceanografía. Instituto Nacional de la Pesca, Huatulco, Oaxaca, México. 290 p. [ Links ]
Angel, C. 2000. Ciclo reproductivo de Atrina maura (Sowerby 1835) (Bivalvia: Pinnidae) en el sistema lagunar Corralero-Alotengo, Oaxaca, México. Tesis de Licenciatura en Biología Marina, Universidad del Mar, Puerto Angel, Oaxaca, México. 56 p. [ Links ]
Anónimo. Comisión Nacional del Agua: Base de datos de la estación hidrométrica el Tomatal, Oaxaca. Gerencia Regional Pacífico Sur, Sub-Gerencia Regional Técnica. Oaxaca, Oax., México. [ Links ]
Arizpe, O. & R. Félix. 1987. Crecimiento de Pinna rugosa (Sowerby, 1835) en la Bahía de La Paz, México. An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. México. 13: 167-172. [ Links ]
Arizpe, O. 1995. Mortality, growth and somatic secondary production of the bivalve, Pinna rugosa (Sowerby), in suspended and bottom culture in Bahia de La Paz, Mexico. Aquaculture Res. 26: 843-853. [ Links ]
Baqueiro, E., A. Avilés, J. Masso, M. Muciño, P. Rogers & A. Velez. 1992. Manual de métodos de muestreo y evaluación de poblaciones de moluscos y otros recursos bentónicos. Instituto Nacional de la Pesca. Secretaría de Pesca, México. 73 p. [ Links ]
Baqueiro, E., D. Aldana & O. Gorosepe. 1997. Patrones en la biología poblacional de moluscos comerciales en México. Memorias del III Congreso Latinoamericano de Malacología y VI Reunión Nacional de Malacología y Conquiliología. CICESE. Ensenada, B.C. México. 280 p. [ Links ]
Bhattacharya, C.G. 1967. A simple method of resolution of a distribution into Gaussian components. Biometries 23: 115-135. [ Links ]
Butler, A.J. & EJ. Brewster. 1979. Size distribution and grow of the fan-shell Pinna bicolor Gmelin (Mollusca: Eulamellibranchia) in South Australia. Aust J. Mar. Freshwater Res. 30: 25-39. [ Links ]
Butler, A.J. & M.J. Keough. 1981. Distribution of Pinna bicolor Gmelin (Mollusca: Bivalvia) in South Australia, with observations on recruitment. Trans. R. Soc. S. Aust. 105: 29-39. [ Links ]
Cendejas, M., M. Carvallo & L. Juárez. 1985. Experimental spat collection and early growth of the Pen Shell, Pinna rugosa (Pelecypoda: Pinnidae) from the Gulf of California. Aquaculture 48: 331-336. [ Links ]
Contreras, E 1993. Ecosistemas Costeros Mexicanos. Universidad Autónoma Metropolitana Unidad Iztapalapa. D. E, México. pp. 22-34. [ Links ]
García, E. 1981. Modificaciones al sistema de clasificación climática de Kbppen. EGM, México. 252 p. [ Links ]
Gayanilo, Jr., P. SparTe & P. Pauly. 1996. Fisat user's manual. FAO, UN, Roma. 126 p.
Hernández, O. 2000. Distribución y abundancia de larvas de callo de hacha (Bivalvia: Pinnidae) en el sistema lagunar Corralero-Alotengo, Oaxaca. Tesis de Licenciatura en Biología Marina, Universidad del Mar, Puerto Angel, Oaxaca, México. 41 p. [ Links ]
Holguín, H. 1988. Moluscos de la franja Costera del estado de Oaxaca. Centro Interdisciplinario de Ciencias Marinas. La Paz, B.C.S., México. 44 p. [ Links ]
Keen, M. 197 1. Sea shells of Tropical West America. Stanford Univ. Stanford, Calif., U.S.A. 2064 p. [ Links ]
Lankford, R. 1977. Coastal Lagoons of Mexico. Their origin and classification. pp. 182-215. In Wiley (ed.). Estuarine Processes. Nueva York. [ Links ]
Ludwig, J.A. & J.F. Reynolds. 1988. Statistical ecology, a primer on methods and computing. Wiley, Nueva York. 337 p. [ Links ]
Pauly, D. 1983. Algunos métodos simples para la evaluación de recursos pesquemos. Documento Técnico de Pesca No 234. FAO, UN, Roma. 292 p. [ Links ]
Robles, M., S.J. Serrano & F.J. Hoyos. 1996. Cultivo de larvas y producción de semilla de callo de hacha (Atrina maura, Sowerby, 1835) (Mollusca: Pinnidae) en el CREMES de Bahía de Kino, Sonora, Méx. (0-024). XI Simp. Int. Biol. Mar., La Paz, B.C.S., México. [ Links ]
Serrano, S. 1997. Crecimiento y desarrollo de larvas de callo de hacha (Atrina maura, Sowerby, 1835) en cultivo. Memorias del III Congreso Latinoamericano de Malacología y VI Reunión Nacional de Malacología y Conquiliología. CICESE. Ensenada, B.C. México. pp. 39-41. [ Links ]
Sparre, P. & S. Venema. 1992. Introduction to tropical fish stock assessment. Fisheries Technical Paper No 30611. FAO, UN, Roma. 361 p. [ Links ]
Soria, E. 1989. Aspectos poblacionales y datos preliminares para la evaluación del callo de hacha Atrina maura (Sowerby, 1835) en la desembocadura del río Balsas de Lázaro Cárdenas, Michoacán, México. Tesis de Licenciatura en Biología, Escuela de Biología, Universidad Michoacana de San Nicolás de Hidalgo, Michoacán, México. 27 p. [ Links ]
Skoglund, C. 1991. Additions to the Panamie Province Bivalvia (Mollusca) Literature. 1971 to 1990. The Festinus 22 (Suppl. 2): 1990. Festinus. Vol. XII. U.S.A. 23 p. [ Links ]
Wu, S. 1983. Some aspects of the ecology of Pinna atropurpurea Sowerby (Bivalvia: Pinnidae), with a note on the commensal pontoniine shrimp Anchistus custos (Forskal), pp. 421-432. In B. Morton & D. Dudgeon (eds.). Proc. Sec. lnt. Workshop on the Matacofauna of Hong Kong and Southern China, Hong Kong. [ Links ]
Zar, H. 1996. Biostatistical Analysis. Prentice Hall, Nueva Jersey. 918 p. [ Links ]
1 . Instituto de Recursos, Universidad del Mar, Oaxaca, México; ahumada@angel.umar.mx
2 . Instituto de Industrias, Universidad del Mar, Oaxaca, México; sserrano@angel.umar.mx
3 . Instituto de Ecología, Universidad del Mar, Apartado Postal 47. C. P. 70902. Puerto Angel, Oaxaca, México. Tel. y fax (958) 5 84 30 78; nruizg@angel.umar.mx














