Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.49 n.3-4 San José Dec. 2001
en refugios artificiales en Quintana Roo, México
Adrián Cervantes-Martínez y Angélica Ramírez-González
El Colegio de la Frontera Sur (ECOSUR), Carretera Chetumal-Bacalar Km 2, Zona Industrial No. 2, C.P. 77049, A.P. 424. Chetumal Quintana Roo, México. Corel: Fax + 52 (983) 21666, corel: adrian@ecosur-qroo.mx, aramirez@ecosur-qroo.mx.
Recibido: 18-I-2000 Corregido: 13-X-2000 Aceptado: 25-II-2001
Abstract
In Florida and Cuba the stone crab Menippe mercenaria (Say, 1818) is under strong fishing-pressure; nevertheless in the Mexican Caribbean it is considered as sub-utilized and poorly known resource. Artificial shelters ("condominios cubanos") were used to study relative abundance, age structure, claw length-carapace amplitude relation, and population in three seasons and four sectors at Bahia Ascension, Quintana Roo, Mexico. The abundance varied according to the sector and sampling season: population was higher in the south and during the north wind ("Nortes") season (January to March). The carapace amplitude was directly proportional to claw length (r2 = 0.83, 0.97 and 0.89; p< 0.05 in females, males and total, respectively). The results sugest that specimens with 37.5 and 67.5 mm of carapace amplitude are the most limited regarding refuge availability in the Bay.
Key words: Caribbean, stone crab, artificial shelter, bay, occupancy.
En las costas de Florida y Cuba, el cangrejo moro Menippe mercenaria (Say, 1818) ha soportado intensas presiones de pesca (Ehrhardt et al. 1990, Sosa-Cordero et al. 1993). En el Caribe Mexicano es considerado como un recurso subexplotado; incluso su pesca se considera como incidental y para autoconsumo (Sosa-Cordero et al. 1993, Basurto & Zárate 1994). Una de las zonas del Caribe Mexicano con gran importancia pesquera es la Bahía de la Ascensión, localizada dentro de la reserva de la biósfera Sian Kaan en Quintana Roo, México (Basurto & Zárate 1994), caracterizada por el dominio de las "casitas cubanas" para la pesca sustentable de la langosta Panulirus argus (Latreille, 1804) (Seijo 1993). En esta bahía el cangrejo se pesca con nasas campechanas y tailandesas, en otras partes del estado se utiliza gancho y arpón (Sosa-Cordero et al. 1993). En la bahía de la Ascensión, el cangrejo moro se encuentra principalmente en sustrato arenoso, tanto sobre manchones de pasto marino como fuera de ellos (Basurto & Zárate 1994). Existen diversos estudios en cuanto a la biología y ecología de M. mercenaria (Wilber 1995, Beck 1997). En algunos se recomiendan tallas mínimas y máximos de captura para la Bahía de la Ascensión (Basurto & Zárate 1994); incluso se ha establecido que M. mercenaria puede ser un recurso pesquero alternativo a P. argus en dicha Bahía (Basurto et al. 1991). Sin embargo todavía existen ciertas lagunas no resueltas en cuanto a la ecología y procesos de reclutamiento del cangrejo moro (Ehrhardt et al. 1990, Sosa-Cordero et al. 1993). El conocimiento de la abundancia, estructura de tallas y patrones espacio-temporales, determinados a partir del reclutamiento de organismos usando estructuras artificiales, pueden ser útiles para la evaluación del cangrejo moro como un recurso alternativo en la Bahía y pueden informar acerca de qué clase de tamaño es la más limitada de refugio en el sistema, ya que la teoría predice que el tamaño de clase de cangrejo atraído en las más altas densidades por los refugios artificiales es la clase más limitada de refugio (Beck 1995). Por lo tanto el presente estudio pretende determinar la abundancia relativa y tallas de M. mercenaria en diferentes zonas de la bahía de la Ascensión en tres temporadas de muestreo usando refugios artificiales, así como determinar la relación entre el ancho del carapacho con respecto a la longitud de la quela del organismo.
Materiales y métodos
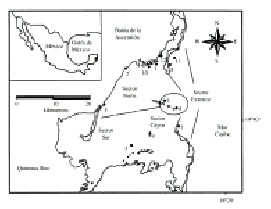
La Bahía de la Ascensión se localiza en la costa central del Estado de Quintana Roo (19°35-19°45 N y 87°30-87°45 W), con una superficie de 740 km2; está rodeada por manglares con algunos cayos en la parte centro y sur, con barreras coralinas que protegen a la bahía de la acción del oleaje (Briones-Fourzan & Gutiérrez-Carbonell 1992) y con profundidades de 1 a 6 m (Gutiérrez-Carbonell et al. 1992). En la parte intermedia presenta praderas de Thalassia testudinum Banks & Sol. Ex K. D. Koenig, mientras que hacia la parte interior son más abundantes las algas verdes y rojas. El tipo de sustrato es muy diverso, con arenas blandas no consolidadas en la parte media de la bahía, piedras calizas y bancos de coral fuera de ella (Briones-Fourzan & Gutiérrez-Carbonell 1992, Gutiérrez-Carbonell et al. 1992, Revilla et al. 1994).
Se realizaron muestreos mensuales de enero a septiembre de 1999, abarcando las temporadas: nortes (enero a marzo), secas (abril a junio) y lluvias (julio a septiembre) (Camarena-Luhrs et al. 1993). Se identificaron 12 estaciones de forma azarosa (Fig. 1) sobre el fondo dominado por pastos y macroalgas identificados con anterioridad en la bahía (Revilla et al. 1994). En cada estación se colocaron dos "condominios cubanos", que consisten en estructuras construídas con 16 bloques de concreto de 40 x 20 x 10 cm; cada bloque tiene tres aberturas rectangulares de 4.5 x 10 cm. Estas estructuras han sido utilizadas para estudiar la colonización por langosta espinosa y peces (de León et al. 1991, Lozano-Alvarez et al. 1994, González & Aguilar 1996). Se consideraron cuatro sectores en la bahía: Norte, Sur, Cayos y Exterior (Fig. 1), de acuerdo a las diferencias en el tipo de sedimento predominante (Revilla et al. 1994). Para determinar el reclutamiento, los organismos se extrajeron de los condominios y se liberaron aproximadamente a 1 km de distancia cada vez que se realizaba la recolecta. Ésta se realizó con una red de mano por buceo libre, evitando dañar a los organismos. Todos los individuos fueron contados, sexados y medidos: amplitud de carapacho (AC) y longitud de quela (LQ) con un vernier, posteriormente fueron liberados vivos. Para determinar la variación de la abundancia de organismos a través del tiempo, se calculó mensualmente la abundancia relativa en individuos/sector e individuos/estación. También se determinó la cantidad de organismos observados por zona (abundancia total). Con los datos de AC se obtuvo la estructura de tallas macho-hembra por temporada y total (individuos medidos en las tres temporadas de muestreo). Se aplicó una correlación lineal de Pearson para evaluar la relación entre la LQ y el AC.
Fig. 1. Location of the study area, sampling stations and sectors of Bahía Ascension.
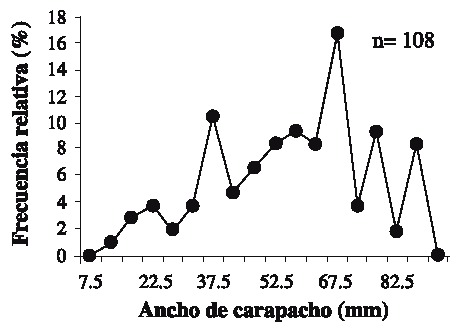
Fig. 2. Frequency distribution of the sizes of the crab during the whole sampling season (n = 108 individuals).
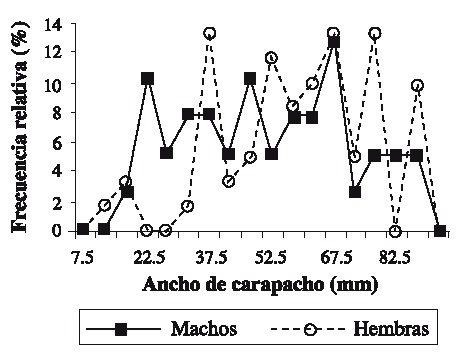
Fig. 3. Frequency distribution of the sizes in the three sampling seasons of females (n = 58) and males (n = 36).
Resultados
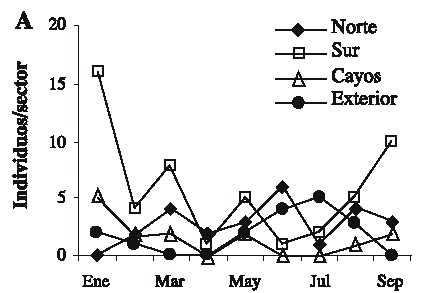
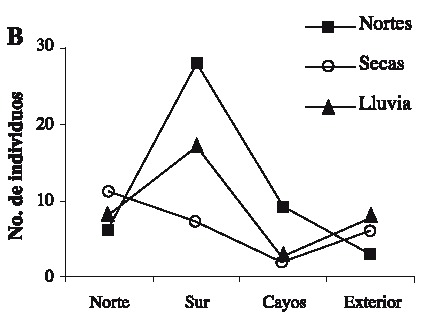
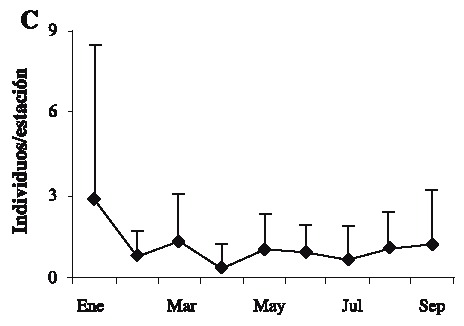
Se capturaron 108 individuos con una talla mínima de 12.1 mm AC y máxima de 89.5 mm AC. La talla promedio fue de 57.01 ± 19.02 mm AC. Las tallas más frecuentemente encontradas fueron 37.5 y 67.5 (Fig. 2). Las hembras presentaron las tallas más grandes (Fig. 3) . El sector sur presentó las mayores abundancias relativas (Fig. 4 A) y totales (Fig. 4 B) en todo el período de muestreo. Aparentemente en la temporada de nortes se encontró la mayor abundancia relativa (Fig. 4 C). La distribución de los cangrejos se da en parches, ya que en el 60-70% de los refugios no reclutó ningún organismo (Fig. 5). No fue posible determinar el sexo de 14 individuos; en los 94 restantes se encontró una proporción hembra: macho de 1.6: 1 considerando todas las temporadas de muestreo (Fig. 6). Se observaron diez hembras con masa ovígera; el 50% de éstas se recolectaron en secas, el 30% en lluvias y el 20% en nortes. La hembra ovígera más pequeña presentó una talla de 55 mm AC. La correlación entre AC y LQ fue alta en hembras r2 = 0.83, LQ = 2.69 + 0.692 AC (n = 43); machos r2 = 0.97, LQ = -7.352 + 0.962 AC (n = 32); y en hembras+machos r2 = 0.89, AC = -1.075 +0.783 LQ (n = 79) a una p < 0.05, observándose un crecimiento proporcional entre ambas estructuras. Debido a que carecían de quela al momento del muestreo, no fue posible determinar la correlación AC-LQ en 29 individuos.
Fig. 4. Variaciones en la abundancia del cangrejo moro: (A) abundancia relativa por sector/mes,
(B) abundancia absoluta por sector/temporada y (C) abundancia relativa mensual.
Fig. 4. Variations in the abundance of the stone crab: (A) relative abundance per sector/month,
(B) absolute abundance per sector/season, and (C) monthly relative abundance.
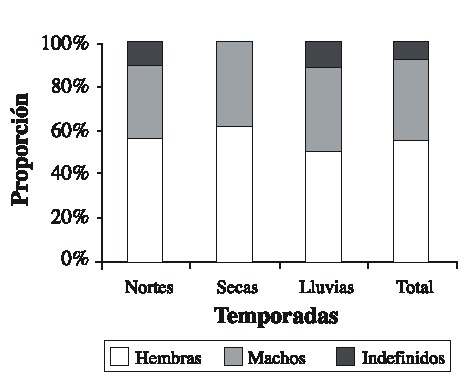
Fig. 5. Abundance of the crabs in the artificial refuges (n = 72) during the three sampling seasons.
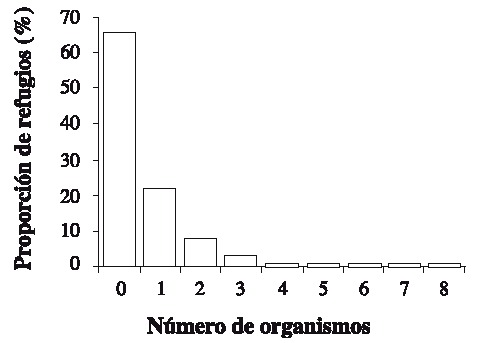
Fig. 6. Proportion of female-male and individuals with indefinite sex per season.
Discusión
Aunque se capturaron 11 individuos con AC > 80 mm, el refugio utilizado en este estudio principalmente reclutó organismos juveniles, ya que la talla de adultos y de captura se establece en 80 mm de AC en machos y 90 mm en hembras (Ross & Pérez 1981, Basurto & Zárate 1994). Los resultados muestran que las clases de talla más limitadas de refugio en Bahía Ascención son las que se encuentran entre los 37.5 y 67.5 mm AC, debido a que estas se encontraron con mayor frecuencia; en contraste Beck (1995) encontró que en Florida las tallas más limitadas de refugio se encontraban entre los 75-100 mm de AC con un área de refugio similar a la utilizada aquí (45 cm2). Los resultados sugieren que la abundancia relativa más elevada se encontró en la temporada de nortes, probablemente debido a que el mal tiempo impide la actividad pesquera produciendo un incremento en la cantidad de organismos que ingresan y permanecen en la bahía (Basurto & Zárate 1994). Sin embargo es notable que los valores de desviación estándar son altos a lo largo del muestreo, esto es característico en poblaciones que se distribuyen en parches (Legendre & Legendre 1998), comunes en los ambientes marinos (Connaughey & Conquest 1992) y en este caso particular es importante señalar que los refugios de las estaciones 10 y 11 (Fig. 1) no reclutaron organismos en ninguna temporada. También se encontraron diferencias de abundancia relativa y total entre sectores de la bahía: en comparación con los demás, el sector sur presentó el mayor reclutamiento de organismos a lo largo del estudio. Por lo tanto y de acuerdo a Basurto & Zárate (1994) dicho sector es de los más productivos en la bahía. Son necesarios estudios posteriores para determinar los factores relacionados con las diferencias en distribución y abundancias encontradas; probablemente las zonas de sedimentación en combinación con las arenoso-fangosas y los parches coralinos característicos de los fondos en el sur de la bahía (Revilla et al. 1994) proporcionan mejor calidad en el hábitat, permitiendo mayores abundancias. Sin embargo, el reclutamiento de organismos pequeños indica que en general el hábitat es estructuralmente poco complejo (Beck 1997). En las tres temporadas la abundancia de hembras fue mayor que la de los machos; Basurto & Zarate (1994) reportaron lo contrario para la bahía en poblaciones adultas, con una proporción hembra-macho igual a 1: 3.6; sin embargo, en un estudio realizado por Alvarez & Briquets (1983) para el golfo de Batabanó (Cuba), se encontró una dominancia de las hembras sobre los machos. Probablemente el tipo y arte de muestreo pueden influir en la selectividad de los sexos. Se encontró un 12.9 % de individuos con sexo indeterminado, aunque este porcentaje se agregue a los machos, la proporción de hembras permanece mayor. La presencia de hembras con masa ovígera coincide con la prolongada época reproductiva de la especie que se extiende de febrero a octubre; el porcentaje más alto de hembras ovígeras encontrado, coincide con la época de clímax reproductivo (Basurto & Zárate 1994). Aunque es común encontrar hembras ovígeras de tallas pequeñas (Ross & Pérez 1981), se considera que la cantidad de huevos que producen no es de consideración; por lo tanto se ha establecido a los 60 mm de AC como primera talla de madurez sexual (Basurto & Zárate 1994). A pesar de que el tamaño del refugio pudo albergar hembras con la talla de madurez, sólo el 51.7% del total de hembras lo presentó. Las correlaciones significativas entre AC y LQ indican crecimiento proporcional entre ambas medidas (King 1995). Con las características de los condominios usados en el presente estudio, fueron escasos los organismos reclutados con talla mínima legal de 80 mm AC (10.18%). Por lo tanto, la mayoría de individuos capturados no pueden ser considerados de talla explotable según lo propuesto por Basurto & Zárate (1994) para Bahía Ascención, Alvarez & Briquets (1983) para Cuba y Beck (1997) para Florida. Sin embargo los "condominios cubanos" usados aquí pueden ayudar a la protección de juveniles, los cuales aparecen como los más limitados de refugio en el sistema analizado.
Agradecimientos
El financiamiento del presente trabajo fue aportado por la Comisión Nacional para el Conocimiento y Aprovechamiento de la Biodiversidad (CONABIO Ref. L218). Eloy Sosa Cordero, Minerva Arce Ibarra, Martha A. Gutiérrez Aguirre y cuatro revisores anónimos realizaron valiosos comentarios que mejoraron el contenido del manuscrito. Gaspar Poot López y Angela Nah Chan apoyaron en el trabajo de campo.
Resumen
En Florida y Cuba el cangrejo moro Menippe mercenaria (Say, 1818) se encuentra sometido a fuertes presiones de pesca; sin embargo en el Caribe Mexicano se considera como un recurso subexplotado. Debido a que existen pocas evaluaciones del cangrejo como un recurso alternativo en la región, se emplearon hábitats artificiales ("condominios cubanos"), considerando tres temporadas de muestreo y cuatro sectores con el propósito de conocer la abundancia relativa, estructura de tallas, relación entre la longitud de quela-ancho del carapacho y aspectos poblacionales de estos organismos en la Bahía de la Ascensión, Quintana Roo, México. La abundancia varió de acuerdo a la estación y temporada de muestreo: el sector sur de la bahía y la temporada de nortes (enero a marzo) presentaron la mayor abundancia relativa. La amplitud del carapacho fue directamente proporcional a la longitud de la quela (r2 = 0.83, 0.97 y 0.89, p< 0.05 en hembras, machos y global respectivamente). Los resultados sugieren que los especímenes de 37.5 y 67.5 mm de amplitud de carapacho son los más limitados de refugio en la Bahía.
Referencias
Alvarez, I. & V. Briquets. 1983. Resultados de los estudios de morfometría y regeneración del cangrejo moro (Menippe mercenaria) en el Golfo de Batabanó, Cuba. Rev. Cub. Inv. Pesq. 8: 64-77. [ Links ]
Basurto, O.M., B.E. Zárate & F. Pérez. 1991. El cangrejo moro, un recurso potencial en Sian Kaan. Sian Kaan J. 8: 3-4. [ Links ]
Basurto, O.M. & B.E. Zárate. 1994. Algunas recomendaciones de manejo del cangrejo moro, Menippe mercenaria (Say, 1818) en la Bahía de la Ascensión, Q. Roo. Sian Kaan J. 2: 35-41. [ Links ]
Beck, W.M. 1995. Size-especific shelter limitation in stone crabs: a test of the demographic bottleneck hypothesis. Ecology 76: 968-980. [ Links ]
Beck, W.M. 1997. A test of the generality of the effects of shelter bottlenecks in four stone crab populations. Ecology 78: 2487-2503. [ Links ]
Briones-Fourzan, P. & D. Gutiérrez-Carbonell. 1992. Postlarval recruitment of the spiny lobster, Panulirus argus (Latreille 1804), in Bahía de la Ascensión, Q. R. Proc. Gulf Caribb. Fish. Inst. 41: 492-509. [ Links ]
Camarena-Luhrs, T., L. Cobá-Cetina, A. Aguilar-Pereira & W. Aguilar-Dávila. 1993. Distribución y abundancia de juveniles de langosta (Panulirus argus) y su reclutamiento a la pesquería en la Bahía de la Ascensión, Quintana Roo. Consejo Nacional de Ciencia y Tecnología y Centro de Investigaciones de Quintana Roo, Chetumal, México. 39 p. [ Links ]
Connaughey, M. & L.L. Conquest. 1992. Trawl survey estimation using a comparative aproach based on log-normal theory. Fish. Bull. 91: 107-118. [ Links ]
de León, M.E., R. Cruz, E. Díaz, R. Brito, R. Puga & J. del Castillo. 1991. Distribución y estacionalidad de Panulirus argus en la Plataforma Cubana. Rev. Inv. Mar. 12: 117-124. [ Links ]
Ehrhardt, N. M., D. J. Die & V. Restrepo. 1990. Abundance and impact of fishing on stone crab (Menippe mercenaria) population in Everglades National Park Florida. Bull. Mar. Sci. 446: 311-323. [ Links ]
González, S.G & B. C. Aguilar. 1996. Asociaciones de peces en refugios artificiales experimentales. Rev. Invest. Mar. 17: 29-36. [ Links ]
Gutiérrez-Carbonell, D., J. Simmon-Díaz & P. Briones-Fourzan. 1992. A simple collector of the spiny lobster Panulirus argus Proc. Gulf Caribb. Fish. Inst. 41: 516-527. [ Links ]
King, M. 1995. Fishieres biology assessment and management. Fishing News Books, Inglaterra. 850 p. [ Links ]
Legendre, P. & L. Legendre. 1998. Numerical Ecology. Elsevier, Amsterdam, Holanda. 853 p. [ Links ]
Lozano-Alvarez, E., P. Briones-Fourzan & F. Negrete-Soto. 1994. An evaluation of concrete block structures as shelter for juvenile caribbean spiny lobsters, Panulirus argus. Bull. Mar. Sc. 55: 351-362. [ Links ]
Revilla, U.N., L.T. Camarena, P. A. Aguilar & W. Aguilar. 1994. Tipos de fondos de un sector de Bahía Ascensión, Quintana Roo, México, aplicando métodos de teledetección. Sian Kaan J. 2: 35-41. [ Links ]
Ross, R.M. & D. Pérez. 1981. La pesca del cangrejo moro del combinado pesquero industrial de Batabanó, Cuba. Rev. Cub. Inv. Pesq. 4: 1-52. [ Links ]
Seijo, J. C. 1993. Individual transferable grounds in a community managed artisanal fishery. Mar. Res. Econ. 8: 78-81. [ Links ]
Sosa-Cordero E., A. Medina-Quej, A. Ramírez-González, M. Domínguez-Viveros & W. Aguilar-Dávila. 1993. Invertebrados Marinos Explotados en Quintana Roo, p. 709-734. In S. I. Salazar-Vallejo & N. E. González (eds.). Biodiversidad Marina y Costera. Comisión Nacional para el Conocimiento y Aprovechamiento de la Biodiversidad y Centro de Investigaciones de Quintana Roo, Chetumal, México. [ Links ]
Wilber, H.D. 1995. Claw regeneration among North Florida stone crabs (genus Menippe) and its implications to the Southwest Florida fishery. Bull. Mar. Sci. 56: 296-302. [ Links ]