Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.48 n.4 San José Dec. 2000
del Archipiélago de San Andrés y Providencia (Caribe sur occidental)
Luz Stella Mejía1 y Jaime Garzón-Ferreira1
Recibido: 5-VII-99. Corregido: 7-II-00. Aceptado: 16-VI-00
Abstract
In 1994 and 1995, 131 visual censuses of reef fishes were made using the stationary sampling method in Courtown, Albuquerque, Serrana and Roncador, four atolls of the Archipelago of San Andrés and Old Providence in the Southwestern Caribbean. Fish species and their abundances were recorded in four geomorphologic zones: lagoon, windward barrier reef, windward terrace and forereef terrace. A total of 98 species were censused; the most abundant were Chromis cyanea (14%), Clepticus parra (14%) and Stegastes partitus (10%). The most abundant families were Pomacentridae (37%), Labridae (28%) and Scaridae (10%). Analysis of similarities showed that differences between zones were greater than differences between atolls, but lagoon and forereef terrace were not significantly different. Cluster and ordination analysis confirmed these results; in addition, the ordination analysis placed the groups according to depth and wave-exposure gradients, suggesting that these two physical variables were responsibles for the clustering. Differences in equitability and species richness appear also due to these variables. Inverse analysis showed in each group few characteristic species, then the differences between zones were due specially to dominance of some species. The dominant trophic categories were planktivorous and herbivorous that were significantly different between zones. In shallow zones (shallow lagoonal patch reefs) and high wave-exposed zones (winward barrier reef) dominated herbivorous fishes, while in deeper zones (terraces and deep lagoonal patch reefs) planktivorous were more abundant.
Key words
Reef fishes, Caribbean atolls, community structure, Colombia, Southwestern Caribbean.
Introducción
El interés por la ecología de peces de arrecifes coralinos se ha incrementado significativamente en las últimas dos décadas, en especial el estudio de aquellos aspectos que determinan la estructura de la comunidad. En los arrecifes de coral la abundancia y diversidad de los peces son afectadas por la zonación coralina (Alevizon et al. 1985), pues en cada una de las zonas la composición del sustrato y el crecimiento coralino diferencial resultan en una disponibilidad diferente de refugio y alimento. Además, los factores físicos que determinan esta zonación, como la profundidad y el grado de exposición al oleaje (Graus y Macintyre 1989) pueden controlar en gran parte la composición y diversidad de las especies de peces en un área (Williams 1991, McGehee 1994 y Meekan et al. 1995).
En el archipiélago de San Andrés y Providencia se han realizado muy pocos estudios sobre fauna íctica, todos ellos a nivel taxonómico. Para las islas está la información proporcionada por el crucero Catherwood-Chaplin West Indies Expedition (Fowler 1950), los estudios realizados por Barriga et al. (1969) en San Andrés y Garzón y Acero (1983) en Providencia. En los atolones de este estudio sólo se conocen los resultados de la Fifth George Vanderbilt Expedition llevada a cabo en 1941 (Fowler 1944) y los trabajos de Victoria y Gómez (1984) y Gómez y Victoria (1986).
Debido al origen común y a la ubicación oceánica de los atolones, es de esperarse que su fauna íctica sea muy semejante entre sí, tal como ha sido observado respecto a la estructura de sus comunidades de la biota arrecifal sésil (Díaz-Pulido y Díaz 1997, Sánchez et al. 1997), y que esté determinada más por la zonación arrecifal que por las diferencias geográficas, ya que se sabe que la estructura de la comunidad íctica está muy influenciada por las características del sustrato (Alevizon et al. 1985). En el presente estudio se pretende caracterizar espacialmente (por zonas) las comunidades ícticas arrecifales en términos de su abundancia, composición y diversidad, así como definir si las diferencias geomorfológicas y ecológicas tienen mayor influencia sobre la estructura de la comunidad íctica que las diferencias geográficas.
Materiales y Métodos
Área de estudio: El archipiélago colombiano de San Andrés y Providencia se localiza en el Caribe suroccidental y está conformado por dos islas oceánicas relativamente grandes y numerosos atolones, bancos, cayos y pequeñas islas. Se escogieron cuatro atolones para el estudio estos son: Courtown, Albuquerque, Roncador y Serrana. Son atolones verdaderos debido a su base volcánica y a su zonación arrecifal, la cual es muy similar en los cuatro atolones, siendo fuertemente determinada por las olas que provienen del noreste (Díaz et al. 1996).
Los atolones se caracterizan por presentar un arrecife periférico de barlovento a manera de barrera, que se extiende por todo el margen N, E y SE donde el oleaje es muy fuerte. Hacia sotavento se encuentra un arrecife periférico poco desarrollado. Una y otra formación encierran una laguna arrecifal en la cual se presentan numerosos parches coralinos a profundidad variable, desde la superficie hasta los 18 m aproximadamente. Hacia el lado exterior de barlovento presentan una terraza prearrecifal, la cual desciende en un ángulo de 6 a 9 grados, hasta los 24 - 30 m. Por debajo de los 18 m hay gran diversidad de algas, corales hemisféricos y gorgonáceos. Hacia el margen noroeste y suroeste, y hasta una profundidad de unos 18 m, se encuentra la terraza de sotavento. La diversidad coralina aumenta paulatinamente allí con la profundidad y el borde del talud presenta corales hemisféricos dispersos, esponjas, gorgonáceos y antipatarios (Díaz et al. 1996).
Trabajo de campo: Para realizar el trabajo, se realizaron dos cruceros a bordo del B/I ANCONdel Instituto de Investigaciones Marinas y Costera INVEMAR, a los cuatro atolones seleccionados. En cada atolón se observó la ictiofauna en cuatro zonas: arrecife periférico de barlovento, laguna, terraza prearrecifal de sotavento y terraza de barlovento. Del arrecife periférico no se obtuvieron datos para todos los atolones debido a las difíciles condiciones en este ambiente. Se utilizó el método de muestreo estacionario desarrollado por Bohnsack y Bannerot (1986), el cual consistió en censar las especies vistas dentro de un cilindro imaginario, de altura igual a la columna de agua y de 5 m de radio durante 5 minutos (el radio en el método original era de 7.5 m). Posteriormente se contabilizó el número de individuos por especie. No se tuvieron en cuenta especies que por su tamaño reducido, sus hábitos crípticos o pelágicos, no son valoradas óptimamente con el método de censo visual. En cada estación se realizaron dos censos, los cuales se combinaron en una sola muestra. En total se obtuvieron 71 muestras (dos censos por muestra).
Análisis de la información: Las abundancias absolutas (número de individuos/78.5 m2) se transformaron (raíz cuadrada) y se obtuvo la matriz de similaridad utilizando el índice de Bray Curtis (Clarke y Warwick 1994). Se realizó un análisis de similaridad (ANOSIM) entre las cuatro zonas geomorfológicas (Clarke y Warwick 1994). Este análisis multivariado define si hay diferencias significativas entre las zonas, en términos de abundancia de especies. Para el análisis de clasificación se construyó un dendrograma con la técnica del ligamiento promedio no ponderado (Field et al. 1982). En el análisis de ordenación se aplicó la técnica de escalamiento multidimensional no métrico (NMDS) (Ludwig y Reynolds 1988) en términos de abundancia íctica por estaciones y se graficaron los resultados en dos dimensiones. Se realizó un ANOVA por rangos de Kruskal-Wallis entre las profundidades de las cuatro zonas y la prueba por pares no paramétrica de Mann-Whitney (Underwood, 1981). Los grupos de estaciones formados en la clasificación se analizaron cualitativamente y se realizó un análisis inverso (Kaandorp 1986) con el fin de detectar cuáles especies fueron las responsables del agrupamiento de las estaciones. Las especies con abundancia promedio total menor de 1.0% y frecuencia menor del 70% fueron extraídas de la lista; las especies seleccionadas para realizar el análisis inverso corresponden al 91.3% de la abundancia total.
Se calculó para cada una de las zonas la riqueza de especies promedio (Nº de especies/m2), la densidad de individuos promedio (Nº de ind./m2), la diversidad de Shannon (H), el número 1 de Hill (N1) y el índice de equitatividad (E5 o Hill 21) (Ludwig y Reynolds 1988). Se efectuó un ANOVA paramétrico a cada uno de los índices y las pruebas a posteriori por pares de Tukey (Underwood 1981).
Estructura trófica: Para cada una de las zonas definidas por el dendrograma se efectuó una categorización trófica de los peces teniendo en cuenta la clasificación de Bouchon-Navaro et al. (1992) y la presencia de alimento predominante en la dieta: (1) Herbívoros: más de un 80% de algas; (2) omnívoros: invertebrados y al menos 10% de algas; (3) planctófagos: plancton; (4) carnívoros de primer orden: invertebrados bentónicos; (5) carnívoros de segundo orden: invertebrados bentónicos y al menos 10% de peces; (6) piscívoros: más del 80% de su dieta está compuesta por peces. La ubicación de las especies en las anteriores categorías se basó en información tomada de la literatura (Hiatt y Strasburg 1960, Randall 1967 y Bouchon-Navaro et al. 1992). Se realizó un análisis de varianza (ANOVA) entre zonas con las abundancias de las categorías tróficas y la correspondiente prueba de Tukey a posteriori entre cada par de zonas (Underwood 1981).
Resultados
Composición íctica general: En total se encontraron 98 especies representantes de 50 géneros y 25 familias (Mejía et al. 1998). Las cinco familias más abundantes fueron Pomacentridae (promedio: 0.9 ind/m2, 37%), Labridae (0.7 ind/m2, 28%), Scaridae (0.3 ind/m2, 10%), Acanthuridae (0.2 ind/m2, 6%) y Grammatidae (0.1 ind/m2, 5%). La familia Serranidae, a pesar de poseer el mayor número de especies (17 especies, 15%), tuvo una abundancia relativa de solo 2.0%. Las cinco especies más abundantes fueron Chromis cyanea (0.37 ind/m2, 14.4%), Clepticus parra (0.36 ind/m2, 14.1%), Thalassoma bifasciatum (0.26 ind/m2, 10.3%), Stegastes partitus (0.23 ind/m2, 8.9%) y Gramma loreto (0.14 ind/m2, 5.6%).
Análisis de similaridad (ANOSIM): El test de Anosim realizado a priori confirmó que hay diferencias altamente significativas en términos de composición y abundancia íctica entre las zonas (p<0.001%) y que estas diferencias fueron mayores que las posibles diferencias geográficas entre los atolones, excepto para la laguna y la terraza de sotavento. Entre estas dos zonas no hubo diferencias significativas, de modo que las diferencias internas pueden ser muy grandes (p = 0.075).
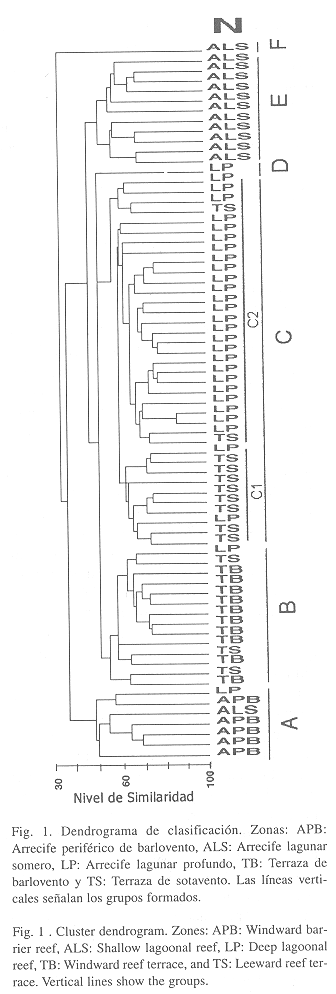
Clasificación de las estaciones: El resultado del análisis de clasificación reitera los resultados del ANOSIM. En general las estaciones se agruparon según la zona geomorfológica a la cual pertenecen (Fig. 1). Los grupos formados a un nivel de similaridad entre 30 y 60 fueron seis. El grupo A correspondió en su mayoría a estaciones del arrecife periférico de barlovento (APB). El grupo B correspondió a la terraza de barlovento (TB) y algunas estaciones de la terraza de sotavento. Las estaciones más profundas de la laguna (LP) se separaron de las someras (ALS) y se unieron en un solo grupo (C) con las estaciones de la terraza de sotavento (TS), aunque internamente se separaron con cierta consistencia en subgrupos (C1 y C2). El grupo D correspondió a una sola estación de arrecife lagunar profundo (LP). En el grupo E quedaron incluidas las estaciones de arrecifes lagunares someros (ALS) y por último, una estación del arrecife lagunar somero se separó de todas las demás y formó un grupo aparte (F). No se observó ningún patrón de similaridad entre las estaciones con relación a la ubicación geográfica.
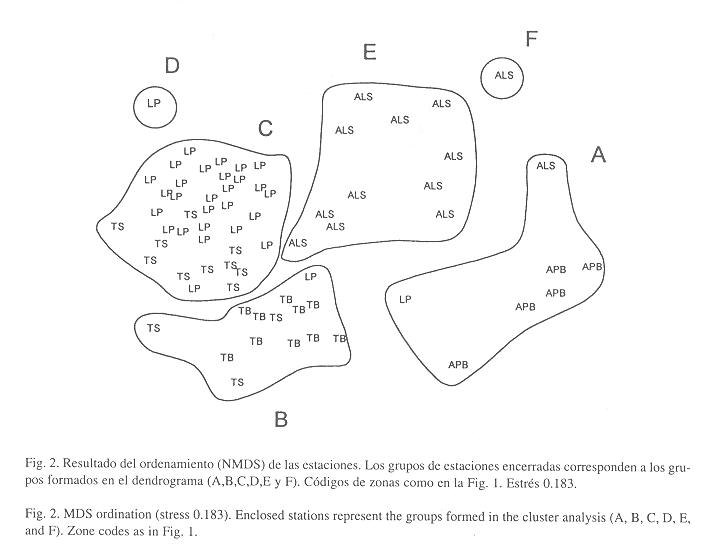
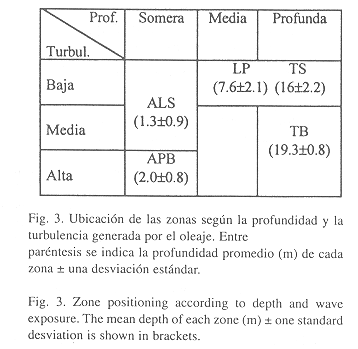
Ordenación de las estaciones: El análisis de ordenación confirma en general los resultados de la clasificación; además, puede verse claramente cómo los grupos se ordenan según su grado de exposición al oleaje y la profundidad (Fig. 2). Los grupos A, E y F correspondientes a estaciones someras, quedaron agrupados al lado derecho de la Fig., mientras que las estaciones de zonas más profundas (grupos B, C y D) se concentraron al lado izquierdo. Por otra parte, las estaciones con poca exposición al oleaje (grupos C, D, E, y F) se ubicaron en la parte superior, mientras que los grupos A y B quedaron en la parte inferior. Para poder observar con claridad la magnitud de estas variables (profundidad y grado de exposición al oleaje), se han esquematizado de una forma cualitativa en la Fig. 3. El ANOVA entre las profundidades de las cinco zonas determinó que hay diferencias significativas entre éstas (p<0.05), siendo todas las zonas significativamente diferentes entre sí, de manera que la unión entre TS y LP no es por similaridad entre las profundidades sino probablemente es debido al bajo grado de exposición al oleaje de ambas zonas.
Especies características de cada zona: Es probable que las estaciones que forman los grupos D y F hayan quedado separadas por efectos del muestreo y no por una diferencia real en su estructura. Teniendo en cuenta que se trata de grupos con una sola muestra, sin réplica, no se podría probar la diferencia estadísticamente, y al recalcular las abundancias promedio y relativizarlas con respecto a los otros grupos, se sobreestimarían las abundancias de las especies. Por estas razones se decidió eliminarlas y realizar el análisis inverso con los cuatro grupos restantes A, B, C y E. Estos grupos corresponden en general, a las zonas geomorfológicas de los complejos arrecifales. En cada zona hubo pocas especies características. El 23% de las especies se encontraron ampliamente distribuidas entre las cuatro zonas, si tenemos en cuenta el 90% de su abundancia (parte inferior del recuadro superior, Fig. 4), otro tanto no fueron características de un grupo jerárquico del dendrograma en particular (23%) (parte superior). En el grupo A (APB) se observaron dos especies características (al nivel del 70%), Kyphosus sectatrix y Microspathodon chrysurus con una frecuencia mayor del 70%. En el grupo B (TB) sólo hubo una especie característica (70%): Stegastes partitus. En el grupo C (LP-TS) se encontraron dos especies características (nivel 70%, frecuencia mayor al 70%) Gramma loreto y S. planifrons. El grupo E (ALS) no tuvo especies características propias. Las especies Chromis cyanea, Clepticus parra y Balistes vetula fueron características de la unión de los grupos BC (TB y LP-TS). El grupo BCE conformado por las zonas TB, LP-TS y ALS, tuvo seis especies características; se destacaron por su abundancia las especies Scarus spp (S. croicensis y S. taeniopterus en su fase no terminal), Halichoeres garnoti, Sparisoma spp (juveniles del género Sparisoma) y S. aurofrenatum.
Aunque los grupos jerárquicos del dendrograma no muestran proximidad entre las zonas de poca profundidad (ALS y APB), dentro de sus especies características sí pudo verse (así como en la ordenación), ya que entre las especies que no pertenecen a un grupo determinado del dendrograma se observó que Stegastes spp (S. dorsopunicans y S. diencaeus), Acanthurus coeruleus, A. bahianus y Halichoeres maculipinna fueron características al nivel del 70%, de ALS y APB (recuadro superior, Fig. 4). Si bien en el dendrograma se unieron TB, LP-TS y ALS formando un grupo, algunas de sus especies características al nivel del 90% son más abundantes en dos de las zonas excluyendo a la otra, siendo de esta manera características de éstas al nivel de 70%, por su diferencia en profundidad o grado de exposición al oleaje; Scarus spp. y Sparisoma spp. son características (70 %) de las zonas ALS y LP-TS (baja exposición al oleaje, profundidad baja y media), mientras que H. garnoti es característica (70%) de TB y LP-TS (zonas más profundas) (Fig. 4).
Especies dominantes por zona: Las diferencias entre las zonas fueron importantes en términos de dominancia. Para todas las zonas, la especie Thalassoma bifasciatum estuvo dentro de las cinco especies dominantes, siendo más abundante en las zonas someras (APB, 17% y ALS, 22%) que en las profundas (LP-TS, 7% y TB, 9%). Otras dos especies que dominaron en zonas someras, sin importar el grado de exposición al oleaje, fueron A. coeruleus (APB, 15% y ALS, 9%) y Stegastes spp. (APB, 11% y ALS, 15%). En la zona expuesta (APB) fueron muy abundantes además Chromis multilineata (8%) y K. sectatrix (6%); mientras que en la zona protegida (ALS) fueron abundantes Scarus spp. (9%) y C. cyanea (6%). Esta última especie, junto con C. parra, fueron muy abundantes en las zonas más profundas (LP-TS, 18% y 20% respectivamente y TB, 17% y 14%). En LP-TS (zonas protegidas) fueron abundantes también Gramma loreto (10%) y S. planifrons (9%), mientras que en TB (zona expuesta) lo fueron S. partitus (26%) y Melichthys niger (5%).
Densidad, riqueza, diversidad y equitatividad: El grupo de estaciones más diverso fue LP-TS (H = 2.46, N1 = 12.2 especies) (Cuadro 1), el cual también presentó la mayor riqueza de especies (0.44 spp/m2), aunque su equitatividad fue baja (0.56), comparada con el arrecife periférico de barlovento (0.68) y el arrecife lagunar somero (0.62). La mayor densidad de individuos se encontró en la terraza de barlovento (2.99 ind/m2), seguida de la terraza de sotavento (2.57 ind/m2). Se puede observar que la riqueza de especies y la densidad tienden a aumentar con la profundidad, mientras que la equitatividad disminuye en el mismo sentido, aunque los resultados del análisis de varianza entre las zonas muestran en general que no hay diferencias significativas, en términos de densidad de individuos (p=0.5), diversidad de Shannon (p=0.2) y N1 (p=0.3). La equitatividad y la riqueza de especies fueron las únicas que mostraron diferencias significativas (p=0.03 y p=0.0001 respectivamente), siendo diferentes el APB de LP-TS para el caso de la equitatividad y las estaciones someras (APB y ALS) de las profundas (TB y LP-TS) en términos de riqueza de especies.
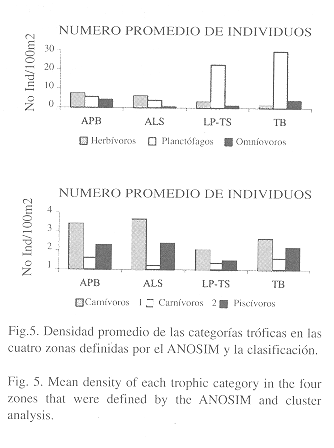
Estructura trófica: Las categorías tróficas dominantes (en términos de abundancia de individuos) en las cuatro zonas fueron planctófagos (51%), herbívoros (24%) y omnívoros (11%). En la Fig. 5 se puede observar una disminución gradual de herbívoros con la profundidad, mientras que los planctófagos aumentan en el mismo sentido. Los omnívoros son abundantes en las zonas más expuestas al oleaje (APB seguido de TB), mientras que en las zonas protegidas o moderadamente expuestas (LP-TS y ALS) son escasos.
El análisis de varianza mostró que existen diferencias significativas entre las zonas con respecto a su estructura trófica. Las zonas someras (APB y ALS) presentan diferencias significativas en la abundancia de herbívoros (p<0.0001) y planctófagos (p<0.0001), en relación con las profundas (LP-TS y TB). Los omnívoros se diferencian entre las zonas de barlovento expuestas al oleaje (APB y TB) y sotavento o protegidas (ALS y LP-TS) (p<0.0001). Los carnívoros de primer orden muestran diferencias significativas (p=0.003) solamente en relación con la profundidad al interior de las lagunas (ALS y LP-TS). Los carnívoros de segundo orden son significativamente diferentes entre las zonas TB y LP-TS, y ALS y LP-TS (p = 0.004), mientras que los piscívoros no presentan diferencias (p = 0.51).
Discusión
Estructura de la comunidad: En los cuatro atolones estudiados se censaron 98 especies. Este número es comparable con la riqueza íctica de diversos arrecifes del Caribe menos aislados, donde se ha encontrado un número similar de especies (Jones y Thompson, 1978, Gladfelter et al. 1980, Bohnsack y Bannerot 1986). La fauna íctica es típica de ambientes arrecifales insulares, con ausencia de especies y familias propias de ambientes con influencia continental (p. ej. Elopidae, Centropomidae) (Mejía et al. 1998).
Las familias más abundantes fueron Pomacentridae, Labridae, Scaridae, Grammatidae y Acanthuridae. Las tres primeras se encuentran dentro de las cinco familias más abundantes en los arrecifes del Caribe (Jones y Thompson 1978, Gladfelter et al. 1980, Phillips y Pérez-Cruet 1984), incluyendo los de la costa continental de Colombia (Torres et al. 1992, Torres 1993, Solano et al. 1995). La familia Acanthuridae es también muy abundante, estando por lo general dentro de las diez familias dominantes (Jones y Thompson 1978, Gladfelter et al. 1980, Phillips y Pérez-Cruet 1984, Alevizon et al. 1985), mientras que la familia Grammatidae (Grammidae) no ha sido registrada dentro de las típicamente dominantes en los arrecifes del Caribe, aunque generalmente se ha encontrado que es importante. En años anteriores, las familias Serranidae y Haemulidae aparecían como dominantes en el Caribe (Jones y Thompson 1978, Gladfelter et al. 1980, Phillips y Pérez-Cruet 1984), pero en los atolones fueron relativamente escasas. Es probable que debido a la sobreexplotación pesquera, actualmente se haya reducido la abundancia de estas familias como en otras áreas arrecifales (Roberts 1995). Los serránidos son especialmente vulnerables ya que son hermafroditas protogínicos, y la población de machos disminuye considerablemente bajo una alta presión pesquera (Koslow et al. 1988).
Las cinco especies dominantes en los cayos y bancos estudiados fueron C. cyanea, C. parra, T. bifasciatum, S. partitus y G. loreto. Estas especies son comunes en los arrecifes del Caribe, pero el orden de abundancia no es tan determinado como sucede con las familias. Por lo general, en trabajos anteriores se encontró que dominan algunas de ellas, pero no siempre las mismas (Jones y Thompson 1978, Gladfelter et al. 1980, Phillips y Pérez-Cruet 1984). La especie Gramma loreto es común y abundante en arrecifes someros del Caribe (Freeman y Alevizon 1983, Asoh y Yoshikawa 1996), aunque raras veces se encuentra dentro de las cinco especies más abundantes. Está más restringida a ciertas áreas de condiciones típicamente tropicales, por lo cual no se encuentra en áreas subtropicales como la Florida (Freeman y Alevizon 1983), ni de surgencia como Santa Marta en la costa Caribe de Colombia (Garzón y Acero 1986). Las larvas de G. loreto provienen de huevos bentónicos y al eclosionar poseen un pequeño saco de yema y mandíbulas y ojos bien desarrollados (Asoh y Yoshikawa 1996), lo que lleva a pensar que su etapa planctónica es muy corta o tal vez no existe. Esta condición, sumada al hecho de que las lagunas de los atolones pueden ser sistemas cerrados para algunas larvas de peces (Leis 1994), hacen pensar sobre la posibilidad de que los reclutas provengan de la misma población adulta de la laguna donde la especie ha encontrado condiciones propicias para prosperar hasta llegar a ser una especie dominante.
Se encontraron especies características para tres de las zonas identificadas en el dendrograma, así como al nivel de unión de dos o más zonas. Además, se pudo observar la afinidad en términos de especies características, entre zonas con profundidad o grado de exposición al oleaje semejantes. En general se pudo comprobar que hay diferencias en las preferencias de la mayoría de especies, lo cual hace que su abundancia no se distribuya homogéneamente entre las diferentes zonas, sino que se concentre en una o varias de éstas, haciendo que sean diferentes. El 54% de especies fueron características de un grupo; del 23% que no caracteriza una zona, pero que tampoco se distribuye de manera homogénea, más de la mitad tienden a agruparse en zonas con semejanza en las condiciones ambientales. Esto concuerda con lo observado en Bahamas por Alevizon et al. (1985), quienes encontraron que las especies se distribuían de manera diferencial en el arrecife, con relación a la zonación coralina. El factor que parece influir en mayor proporción ya sea de manera directa o indirecta, es el grado de exposición al oleaje y en segundo término, la profundidad tal como encontró McGehee (1994) en La Parguera, Puerto Rico.
La diversidad (Shannon) no presentó diferencias significativas entre las zonas estudiadas. Varió de 2.26 a 2.46, valores comparables con los encontrados en otras zonas del Caribe (Alevizon et al. 1985). La diversidad expresada como números de Hill (N1) en un arrecife de Curaçao varió de 4.3 a 10.2 especies, mientras que en Bonaire fue más baja (entre 3.0 a 5.5 especies) (Luckhurst y Luckhurst 1978). En los atolones la diversidad de Hill varió de 10.3 a 12.2 especies, con lo cual se puede decir que la diversidad íctica de los cayos y bancos estudiados es similar a la encontrada en otros arrecifes insulares y continentales del Caribe.
Tal como se ha encontrado anteriormente en otros trabajos, la composición y abundancia de la fauna íctica difiere entre las zonas geomorfológicas del arrecife (Russ 1984, Alevizon et al.1985). En este trabajo se comprobó la hipótesis de que había diferencias entre cuatro grandes zonas geomorfológicas (arrecife periférico de barlovento, arrecifes lagunares, terraza de sotavento y terraza de barlovento) en términos de composición y abundancia íctica y en relación con un gradiente de exposición al oleaje y profundidad. Estas diferencias fueron mayores que las posibles diferencias geográficas entre los atolones.
Categorización trófica: Los peces planctófagos mostraron una distribución diferencial entre las zonas, siendo muy abundante en las terrazas y el arrecife lagunar profundo y muy escasos en las zonas someras. Es muy probable que este hecho se deba a la disponibilidad de alimento, ya que el plancton se distribuye de una manera desigual en el arrecife (Emery 1968). En aguas someras, el plancton es escaso durante el día, cuando busca las aguas más profundas; además como es obvio, no se encuentra en zonas con elevada exposición al oleaje debido a la alta turbulencia (Hobson y Chess 1978). Adicionalmente, el plancton es más abundante antes de pasar por el arrecife que después (Glynn 1973), de manera que en las zonas de barlovento es más abundante que en zonas protegidas. Así, los planctófagos son más abundantes en aguas profundas, y se agregan en sitios en contacto con aguas oceánicas y donde las corrientes son más fuertes (Hamner et al. 1988, Hobson 1991).
Los herbívoros fueron los segundos en importancia en los atolones. Su mayor abundancia se encontró en las zonas someras y con alto grado de exposición al oleaje, disminuyendo con la profundidad. La más baja densidad se encontró en la terraza de barlovento. Además, las especies características del arrecife periférico de barlovento fueron M. chrysurus y K. sectatrix, ambas herbívoras; las especies Stegastes spp, A. coeruleus, A. bahianus y S. viride son características del arrecife periférico de barlovento y del arrecife lagunar somero, indicando la preferencia de algunos herbívoros por las zonas de poca profundidad. Se ha observado un patrón semejante en otros arrecifes del Caribe y de otras áreas tropicales (Russ 1984, Hay 1991, Meekan 1995).
En las zonas de mayor exposición al oleaje hay una alta presión por herbivoría, lo que hace que dominen sobre todo las algas costrosas que son las más resistentes y las filamentosas (Hay 1991), que son altamente susceptibles al herbivorismo y muy apetitosas (Littler et al. 1983), pero de crecimiento rápido (Hay 1991) y alta productividad (Littler et al. 1983); este patrón de distribución algal fue encontrado también en los atolones (Díaz-Pulido 1995, Díaz-Pulido y Díaz 1997). Debido al alto grado de irradiación y al estímulo ejercido por los herbívoros en las zonas someras, las algas filamentosas poseen una alta capacidad de carga trófica para los pastoreadores, convirtiendo estos sistemas en uno de los más productivos (Hay 1991). El caso contrario se daría en las zonas profundas, donde la disminución en la intensidad lumínica puede hacer que las algas sean menos productivas (Hay 1991) y, por ende, que los herbívoros eviten estas zonas.
Los estudios sobre distribución y ecología de categorías tróficas menores son escasos. Se ha encontrado que los carnívoros en general son más abundantes en los arrecifes protegidos que en los expuestos. (Jones et al. 1991, Williams 1991, Letourneur 1996) lo que sugiere una relación negativa entre la abundancia de carnívoros y el grado de exposición al oleaje. Esta relación no se observó en los atolones, ya que los carnívoros sólo mostraron diferencias significativas entre las zonas protegidas. Los carnívoros de segundo orden mostraron diferencias significativas entre LP-TS y TB y entre LP-TS y ALS, siendo más abundantes en las zonas expuestas que en las protegidas; los piscívoros fueron poco abundantes en general y no mostraron diferencias significativas entre las zonas. Los omnívoros fueron significativamente diferentes entre las zonas protegidas y expuestas, mostrando una relación positiva con el grado de exposición al oleaje, ya que son más abundantes en las zonas de barlovento que en las de sotavento. Este patrón es semejante al de los herbívoros, indicando quizás un componente algal alto en sus dietas.
Factores determinísticos y estocásticos: Aparentemente en condiciones extremas de exposición al oleaje y profundidad, los patrones de distribución y dominancia de ciertas especies adaptadas a vivir en estos ambientes son más predecibles, mientras que en condiciones intermedias, los factores aleatorios podrían jugar un papel más importante. La composición íctica en las zonas y la densidad de las especies menos abundantes también parecen estar más relacionadas con factores estocásticos. En sitios profundos y en contacto con corrientes oceánicas se espera encontrar gran abundancia de planctófagos gregarios como C. parra y C. cyanea. Así mismo, en áreas someras se puede esperar la alta abundancia de especies herbívoras como Kyphosus spp. Acanthurus spp, Scarus spp., y Stegastes spp. En áreas intermedias, la dominancia de las categorías tróficas no es tan marcada, encontrándose herbívoros, planctófagos y omnívoros, en mayor o menor grado, de modo que las especies dominantes no son tan predecibles y pueden encontrarse especies comunes a los dos ambientes extremos.
Las especies que tienen un patrón de distribución determinado pueden tener un ámbito estrecho de dominancia o por el contrario, estar distribuidas ampliamente por varias zonas. Como ejemplo del primer caso podría mencionarse la familia Pomacentridae, ya que sus especies se distribuyen de manera diferencial entre las zonas (Emery 1973). En aguas someras de los atolones dominaron S. dorsopunicans y S. diencaeus (Stegastes spp.), mientras que en aguas relativamente profundas pero protegidas de la acción del oleaje, fue muy abundante S. planifrons; las tres especies son territoriales y herbívoras (sensu lato). En zonas profundas, fueron muy abundantes las especies planctófagas S. partitus, C. cyanea y C. multilineata; la primera es territorial, así que a pesar de estar en un sitio con menor complejidad del sustrato que sus congéneres, es probable que la ventaja de la situación estratégica con respecto a su alimento en combinación con la competencia por espacio y su tamaño reducido, haya llevado a esta especie a vivir en este ambiente (ver Waldner y Robertson 1980). C. multilineata fue muy abundante en el APB; esta especie también forma cardúmenes numerosos en zonas someras hacia barlovento (Emery 1973). Otras especies se distribuyen por todo el arrecife, aparentemente sin verse afectadas por ningún factor ambiental, como es el caso de Thalassoma bifasciatum, que se encuentra entre las cinco especies dominantes en todas las zonas. Según Tupper y Hunte (1994) esta especie no mostró diferencias de reclutamiento cuando se comparó entre arrecifes naturales y artificiales sugiriendo que es generalista.
Podría decirse que en el caso de los atolones estudiados hay factores determinísticos, como las variables ambientales imperantes (especialmente las asociadas con el grado de exposición al oleaje y la profundidad) que hacen que la estructura de la comunidad se diferencie entre las grandes zonas geomorfológicas, y factores aleatorios por los cuales la comunidad varía dentro de cada zona. Como respuesta adaptativa al hábitat, la comunidad íctica varía entre las zonas según su necesidad de refugio y alimento y su capacidad de resistir la alta turbulencia. La presencia y dominancia de ciertas especies en un hábitat es predecible (p. ej. los pomacéntridos), así como la distribución de las categorías tróficas dominantes (herbívoros y planctófagos) y la dominancia de ciertas especies en condiciones extremas. Pero en condiciones intermedias la dominancia de las especies podría ser producto de otros factores menos determinados como el reclutamiento (p.ej. la especie G. loreto). Por otro lado, los parámetros de la comunidad íctica (diversidad, riqueza, equitatividad) y la distribución y abundancia de la mayoría de especies menos abundantes no parecen ser muy predecibles, sugiriendo que dependen más del reclutamiento y la mortalidad. Tal variación puede deberse al componente aleatorio de los procesos que afectan la estructura de la comunidad (Sale 1991).
Agradecimientos
Esta investigación fue posible gracias a la valiosa ayuda de nuestros colegas Juan M. Díaz, Sven Zea, Guillermo Díaz y Juan A. Sánchez, y de la tripulación del B/I Ancón. Financiada por INVEMAR y COLCIENCIAS (Proyecto 2105-09-023-93). Este artículo contiene parte de la tesis M.Sc. del primer autor, presentada a la Universidad Nacional de Colombia y financiada parcialmente por la Fundación para la Promoción de la Investigación y la Tecnología del Banco de La República. No. de Contribución 639 del Instituto de Investigaciones Marinas y Costeras INVEMAR. No. de Contribución 170 del posgrado en Biología-Biología Marina de la Universidad Nacional de Colombia, Facultad de Ciencias.
Resumen
En 1994 y 1995 se realizaron 131 censos visuales, utilizando el método de muestreo estacionario en Albuquerque Cays, Courtown Cays, Banco Roncador y Banco Serrana, atolones del Archipiélago de San Andrés y Providencia en el Caribe suroccidental. Se determinó la composición y abundancia íctica en cuatro zonas geomorfológicas: laguna, arrecife periférico de barlovento, terraza de barlovento y terraza de sotavento. En total se censaron 98 especies, de las cuales las más abundantes fueron Chromis cyanea (14%), Clepticus parra (14%) y Stegastes partitus (10%). Las familias dominantes fueron Pomacentridae (37%), Labridae (28%) y Scaridae (10%). El análisis de similaridad entre las zonas mostró que las diferencias entre éstas fueron mayores que las posibles diferencias geográficas entre los atolones, excepto para la laguna y la terraza de sotavento, las cuales no tuvieron diferencias significativas. Los resultados de la clasificación y ordenación confirmaron lo anterior, además en la ordenación los grupos de estaciones quedaron ubicados según un gradiente de profundidad y grado de exposición al oleaje, insinuando que estas dos variables físicas fueron las responsables del agrupamiento de las estaciones. Las diferencias en términos de equitatividad y riqueza de especies parecen ser debidas a las mismas variables. El análisis inverso dio como resultado que en cada grupo hubo pocas especies características, por ende las diferencias entre las zonas parecen ser más debidas a la dominancia de ciertas especies. Las categorías tróficas dominantes fueron planctófagos y herbívoros, los cuales fueron significativamente diferentes entre las zonas. En las someras (arrecife lagunar somero) y con alta exposición al oleaje (arrecife periférico de barlovento) predominaron los herbívoros, mientras que en las profundas (terrazas y arrecifes lagunares profundos) los más abundantes fueron los planctófagos.
Referencias
Alevizon, W.S., R. Richardson, P. Pitts & G. Serviss. 1985. Coral zonation and patterns of community structure in Bahamian reef fishes. Bull. Mar. Sci. 36: 304-318. [ Links ]
Asoh, K. & T. Yoshikawa. 1996. Nesting behavior, male parental care, and embryonic development in the Fairy Basslet, Gramma loreto. Copeia 1996: 1-8. [ Links ]
Barriga, E., J. Hernández, I. Jaramillo, R. Jaramillo, L.E. Mora, P. Pinto y P.M. Ruiz. 1969. La isla de San Andrés: Contribución al conocimiento de su ecología, flora, fauna y pesca. Inst. Cienc. Nat. Dir. Divulg. Cultural. Univ. Nacional. Bogotá. 152 p. [ Links ]
Bohnsack, J.A. & S.P. Bannerot. 1986. A stationary visual census technique for quantitatively assessing community structure of coral reef fishes. NOAA Technical Report NMFS 41: 1-15. [ Links ]
Bouchon-Navaro, Y., C. Bouchon & M. Louis. 1992. L'ichtyofaune des herbiers de phanérogames marines de la Baie de Fort-de-France (Martinique, Antilles Françaises). Cybium 16: 307-330. [ Links ]
Clarke, K.R. & R.M. Warwick 1994. Change in marine communities: an approach to statistical analysis and interpretation. Natural Environmental Research Council, Plymouth Marine Laboratory, Inglaterra. 144 p. [ Links ]
Díaz, J.M., G. Díaz-Pulido, J. Garzón-Ferreira, J. Geister, J. Sánchez & S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano. I. Complejos Arrecifales Oceánicos. Invemar Ser. Publ. Esp. 2: 83 p. [ Links ]
Díaz-Pulido, G. 1995. Comunidades macroalgales de los atolones Albuquerque y Courtown (Bolívar), Caribe suroccidental, Colombia, y relación con la estructura arrecifal. Tesis de Grado, Facultad Biología Marina, Universidad Jorge Tadeo Lozano, Bogotá. 110 p. [ Links ]
Díaz-Pulido, G. & J.M. Díaz. 1997. Algal assemblages in lagoonal reefs of Caribbean oceanic atolls. Proc. 8 th Int. Coral Reef Symposium, Panamá 1: 827-832. [ Links ]
Emery, A.R. 1968. Preliminary observations on coral reef plankton. Limnol. Oceanogr., 13:293-303. [ Links ]
Emery, A.R. 1973. Comparative ecology and functional osteology of fourteen species of damselfish (Pisces: Pomacentridae) at Alligator Reef, Florida Keys. Bull. Mar. Sci. 23: 649-770. [ Links ]
Field, J.G., K.R. Clarke & R.M. Warwick. 1982. A practical strategy for analysing multispecies distribution patterns. Mar. Ecol. Prog. Ser. 8: 37-52. [ Links ]
Fowler, H.W. 1944. Results of the Fifth Vanderbilt Expedition (1941). The fishes. Acad. Nat. Sci. Phila., Monogr. 6:57-529. [ Links ]
Fowler, H.W. 1950. Results of the Catherwood-Chaplin West Indies Expedition, 1948. Part III, The fishes. Proc. Acad. Nat. Sci. Phila. 102:69-93. [ Links ]
Freeman, S. & W. Alevizon. 1983. Aspects of territorial behavior and habitat distribution of the fairy basslet Gramma loreto. Copeia 1983: 829-832. [ Links ]
Garzón, J. y A. Acero. 1983. Notas sobre la pesca y los peces comerciales de la Isla de Providencia (Colombia), incluyendo nuevos registros para el Caribe occidental. Car. J. Sci. 19: 9-19. [ Links ]
Garzón, J. & A. Acero. 1986. Peces de las Islas del Rosario y de San Bernardo (Colombia). III. Comparación con otras regiones del Atlántico Oeste Tropical. An. Inst. Inv. Mar. Punta de Betín 15-16: 67-77. [ Links ]
Gladfelter, W.B., J.C. Ogden & E.H. Gladfelter. 1980. Similarity and diversity among coral reef fish communities: A comparison between tropical western Atlantic (Virgin Islands) and tropical central Pacific (Marshall Islands) patch reefs. Ecology 61: 1156-1168. [ Links ]
Glynn, P.W. 1973. Ecology of a Caribbean coral reef. The Porites reef-flat biotope: Part II. Plankton community with evidence for depletion. Mar. Biol. 22: 1-21. [ Links ]
Gómez, D.P. y P. Victoria. 1986. Peces de la Isla de San Andrés y noreste de la Isla de Providencia (Mar Caribe de Colombia): Inventario en arrecifes coralinos, praderas marinas y aguas costeras. Bol. Ecotrópica 13:41-85. [ Links ]
Graus, R.R. & I.G. Macintyre. 1989. The zonation patterns of Caribbean coral reefs as controlled by wave and light energy input, bathymetric setting and reef morphology: computer simulation experiments. Coral Reefs 8: 9-18. [ Links ]
Hamner, W.M., M.S. Jones, J.H. Carleton, I.R. Hauri & D.McB. Williams. 1988. Zooplankton, planktivorous fish, and water currents on a windward reef face: Great Barrier Reef, Australia. Bull. Mar. Sci. 42: 459-479. [ Links ]
Hay, M.E. 1991. Fish-seaweed interactions on coral reefs: effects of herbivorous fishes and adaptations of their prey. Capítulo 5: 96-119. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press. San Diego. 754 p. [ Links ]
Hiatt, R.W. & D.W. Strasburg. 1960. Ecological relationships of the fish fauna on coral reefs of the Marshall Islands. Ecol. Monogr. 30: 65-156. [ Links ]
Hobson, E.S. 1991. Trophic relationships of fishes specialized to feed on zooplankters above coral reefs. Capítulo 4: 69-95. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press. San Diego. 754 p. [ Links ]
Hobson, E.S. & J.R. Chess. 1978. Trophic relationships among fishes and plankton in the lagoon at Enewetak Atoll, Marshall Islands. Fish. Bull. 76: 133-153. [ Links ]
Jones, G.P., D.J. Ferrell & P.F. Sale. 1991. Fish predation and its impact on the invertebrates of coral reefs and adjacent sediments. Capítulo 7: 156-182. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press. San Diego. 754 p. [ Links ]
Jones, R.S. & M.J. Thompson. 1978. Comparison of Florida reef fish assemblages using a rapid visual technique. Bull. Mar. Sci. 28: 159-172. [ Links ]
Kaandorp, J.A. 1986. Rocky substrate communities of the infralittoral fringe of the Boulonnais coast, NW France: a quantitative survey. Mar. Biol. 92: 255-265. [ Links ]
Koslow, J.A., F. Hanley & R. Wicklund. 1988. Effects of fishing on reef fish communities at Pedro Bank and Port Royal cays, Jamaica. Mar. Ecol. Prog. Ser. 43: 201-212. [ Links ]
Leis, J.M. 1994. Coral sea atoll lagoons: closed nurseries for the larvae of a few coral reef fishes. Bull. Mar. Sci. 54: 206-227. [ Links ]
Letourneur, Y. 1996. Dynamics of fish communities on Reunion fringing reefs, Indian Ocean. I. Patterns of spatial distribution. J. Exp. Mar. Biol. Ecol. 195: 1-30. [ Links ]
Littler, M.M., D.S. Littler & P.R. Taylor. 1983. Evolutionary strategies in a tropical barrier reef system: functional-form groups of marine macroalgae. J. Phycol. 19: 229-237. [ Links ]
Luckhurst, B.E. & K. Luckhurst. 1978. Analysis of the influence of the substrate variables on coral reef fish communities. Mar. Biol. 49: 317-323. [ Links ]
Ludwig, J.A. & J.F. Reynolds. 1988. Statistical ecology: a primer on methods and computing. John Wiley and Sons. Nueva York. 337 p. [ Links ]
McGehee, M.A. 1994. Correspondence between assemblages of coral reef fishes and gradients of water motion, depth and substrate size off Puerto Rico. Mar. Ecol. Prog. Ser. 105: 243-255. [ Links ]
Meekan, M.G., A.D.L. Steven & M.J.Fortin. 1995. Spatial patterns in the distribution of damselfishes on a fringing coral reef. Coral Reefs 14: 151-161. [ Links ]
Mejía, L.S., J. Garzón-Ferreira & A. Acero. 1998. Peces observados en los complejos arrecifales de los cayos de Courtown, Albuquerque, Serrana y Roncador, Caribe occidental, Colombia.Bol. Ecotrópica 32:25-42. [ Links ]
Phillips, P.C. & M.K. Pérez-Cruet. 1984. A comparative survey of reef fishes in Caribbean and Pacific Costa Rica. Rev. Biol. Trop. 32: 95-102. [ Links ]
Randall, J.E. 1967. Food habits of reef fishes of the West Indies. Stud. Trop. Oceanogr. Miami 5: 665-847. [ Links ]
Roberts, C. 1995. Effects of fishing on the ecosystem structure of coral reefs. Cons. Biol. 9: 988-995. [ Links ]
Russ, G.R. 1984. Distribution and abundance of herbivorous grazing fishes in the central Great Barrier Reef. I. Levels of variability across the entire continental shelf. Mar. Ecol. Prog. Ser. 20: 23-34. [ Links ]
Sale, P.F. 1991. Reef fish communities: open nonequilibrial systems. Capítulo 19:564-598. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press, San Diego, California. 754 p. [ Links ]
Sánchez, J.A., J.M. Díaz & S. Zea.1997. Gorgonian communities in two contrasting environments on oceanic atolls of the southwestern Caribbean. Bull. Mar. Sci. 61: 453-465. [ Links ]
Solano, O.D., A. Guzmán, G. Navas & T. Camargo. 1995. Caracterización rápida de comunidades ícticas y coralinas (Isla Barú, Caribe colombiano). Bol. Ecotrópica 29: 21-40. [ Links ]
Torres, D.F. 1993. Abundancia y diversidad de 26 familias de peces arrecifales del costado oeste del Caribe colombiano. Tesis de Grado. Facultad de Biología Marina, Universidad Jorge Tadeo Lozano, Cartagena. 118 p. [ Links ]
Torres, D.F., E.A. Rodríguez, L.S. Mejía & C.A. Buitrago. 1992. Las comunidades del bajo arrecifal profundo Imelda, Isla Barú, Caribe colombiano: VII. Evaluación preliminar de la ictiofauna. Mem. VIII Sem. Nac. Cienc. Tecnol. Mar. 350-361. [ Links ]
Tupper, M. & W. Hunte. 1994. Recruitment dynamics of coral reef fishes in Barbados. Mar. Ecol. Prog. Ser. 108: 225-235. [ Links ]
Underwood, A.J. 1981. Techniques of analysis of variance in experimental marine biology and ecology. Oceanogr. Mar. Biol. Ann. Rev. 19:513-605. [ Links ]
Victoria, P. y D.P. Gómez. 1984. Nuevos registros de peces para la Isla de San Andrés (Mar Caribe de Colombia). An. Inst. Inv. Mar. Punta de Betín 14:115-132. [ Links ]
Waldner, R.E. & D.R. Robertson. 1980. Patterns of habitat partitioning by eigth species of territorial Caribbean damselfishes (Pisces: Pomacentridae). Bull. Mar. Sci. 30: 171-186. [ Links ]
Williams, D.McB. 1991. Patterns and processes in the distribution of coral reef fishes. Capítulo 16: 437-474. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press, San Diego. 754 p. [ Links ]
1 Instituto de Investigaciones Marinas y Costeras INVEMAR, A.A. 1016 Santa Marta, Colombia.